Блокаторы миостатина
Содержание
Вакцина от Pharmacom Labs
С 2007 года и по настоящее время было проведено несколько исследований[1][2], показавших, что введение инородного свиного миостатина мышам вызывало иммунную реакцию с выработкой антител к миостатину. Таким образом, ученые предложили вместо введения более дорогостоящих антител, вводить рекомбинантный миостатин как вакцину, и таким образом, побуждать свой иммунитет связывать и блокировать как чужеродный, так и собственный миостатин. ![]() Исследования вакцины проводились только на лабораторных грызунах.
Исследования вакцины проводились только на лабораторных грызунах.
Подробнее с механизмом действия и получением вакцины можно ознакомиться в статье.
23 мая 2016 Pharmacom Labs объявили в своей ветке на международном ресурсе MESO-Rx о выпуске собственной вакцины под названием Pharmacom GEN M. Представитель компании не раскрыл подробностей производства, однако очевидно, что для изготовления применялся плазмидный вектор с геном животного миостатина, с последующим внедрением в бактерии Escherichia coli, которые размножаются и в процессе жизнедеятельности начинают продуцировать миостатин. Также представитель Pharmacom Labs в шутку сказал, что вакцина уже испытана на русских медведях. А если кто-то встретит в лесу такого медведя с заблокированным миостатином и сделает с ним селфи, то Фармаком предоставит бесплатный курс на год[3]. 9 июля представитель Фармаком сообщил, что вакцина продолжает тестироваться на русских атлетах.[4] В настоящее время из побочных эффектов сообщалось только о повышении температуры до 37,5-38°C в первые дни после инъекции.
С июня 2016 года запущена активная реклама вакцины на российских спортивных ресурсах.
С июня также добавлен новый продукт GEN M2, с описанием:
- «Если в первой версии вакцины блокатора миостатина мы заставляли организм вырабатывать блокатор миостатина, то в новой версии мы заставляем огранизм вырабатывать еще и собственный соматропин. В чем плюс рядом с обычным гормоном роста? Ну вы просто подумайте, обычный гормон вы вкалываете и через 2-3 часа его уровень в крови снова на том уровне, что и был до инъекции. То есть, это вечные волны. Ваш же соматропин вырабатывается постепенно в течении всех двух месяцев, давая намного лучше результат.»
О механизме действия GEN M2 также ничего не сообщается.
Блокаторы миостатина (подробное описание)
Читайте основную статью: миостатин
Блокаторы миостатина подавляют действие миостатина, специфического белка, ответственного за регуляцию и ограничение роста мышечной ткани. Это приводит к тому, что мышцы будут оставаться "накачанными", как будто спортсмен ежедневно продолжает ходить в тренажерный зал, хотя на самом деле он давно прекратил занятия.
В течение последних десятилетий поиски путей восстановления и увеличения мышечной массы велись не только с помощью низкомолекулярных анаболических и антикатаболических препаратов, а также ДД, но и на уровне поиска генов, ответственных за гомеостаз мышечной ткани. Объектом для обнаружения таких генов были, в частности, породы мясного скота с фенотипом так называемой удвоенной мышечной массы (породы бельгийская голубая и piedmontese) (рис. 3.9).
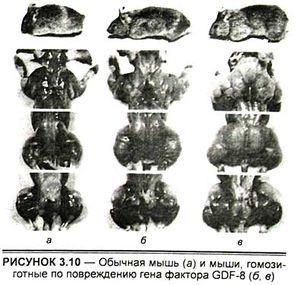
Переломным в этих поисках стал 1997 г. Первоначальный успех был достигнут с помощью генной инженерии (так называемый метод генного нокаута). В лаборатории профессора Си-Джин Ли в университете им. Джона Хопкинса (Балтимор, США) были выведены мыши, гомозиготные по повреждению гена фактора GDF-8 (Growth and Differentiation Factor 8, или фактор роста и дифференцировки N8) (рис. 3.10). У этих мышей в результате эксперимента произошло значительное (2—3-кратное) увеличение всех скелетных мышц. При этом увеличились как число мышечных волокон (гиперплазия), так и их толщина (гипертрофия). Полученные мыши были вполне жизнеспособны и давали потомство.
В результате этих экспериментов было доказано, что белок GDF-8 является отрицательным регулятором роста скелетных мышц. Поэтому он получил название миостатин, а животные с таким дефектом — миостатин-ноль мыши.
После этого открытия в том же 1997 г. в нескольких лабораториях клонировали и установили последовательность гена миостатина у крупного рогатого скота пород бельгийская голубая и piedmontese. Было обнаружено, что у этих животных имеются мутации в гене миостатина (различные в каждой из пород), которые тем или иным образом приводят к отсутствию функционально активного миостатина. В отличие от мышей с поврежденным геном миостатина у этих пород происходит только гиперплазия мышечной ткани без гипертрофии. Хотя применительно к этому мясному скоту используют термин "фенотип удвоенной мышечной массы", суммарное увеличение всех мышц составляет не более 40 % по сравнению с другими мясными породами, но и это, безусловно, неоценимо для мясного животноводства.
Способность миостатина ограничивать рост мышечной массы сразу привлекла к нему внимание как к потенциальной мишени для терапевтического вмешательства при дегенеративных заболеваниях, травмах и других патологиях мышечной системы, а также — для применения в спортивной медицине и спорте.
Было установлено, что миостатин по своей структуре относится к белкам типа TGF-beta (Transforming Growth Factor-beta, трансформируюший фактор роста-бета), которые представляют собой секретируемые факторы, необходимые как в ходе эмбриогенеза, так и во взрослом состоянии для тканевого гомеостаза.
Миостатин имеет общие структурные свойства с другими белками семейства TGF-beta:
- гидрофобное ядро в районе N-концевой части молекулы, которое служит как секреторный сигнал;
- консервативный блок из четырех аминокислот в С-концевой половине молекулы, являющийся сигналом для процессинга (протеолитического расщепления в процессе образования активного белка из предшественника большей длины);
- девять остатков цистеина в С-концевой части молекулы, необходимых для образования функционально активной вторичной структуры. После процессинга С-концевой домен, который становится функционально активным миостатином, остается нековалентно связанным с N-концевой частью молекулы, которую в данном случае называют пропептидом;
- миостатин, как и другие белки типа TGF-beta, секретируется в виде неактивного комплекса с пропептидом.
Процесс экспрессии миостатина, возможно, регулируется белком Titin-cap, так как установлено, что синтез этого белка уменьшает выход миостатина из клеток. Секретированный в виде комплекса с пропептидом миостатин неактивен, поскольку не может связываться со своим рецептором. Для проявления активности миостатин должен быть отделен от пропептида. Активация миостатина осуществляется в результате расщепления пропептида протеазами типа катепсина D.
Считается, что основная масса синтезированного миостатина проявляет свое действие аутокринным и паракринным образом, т. е. миостатин действует внутри синтезировавшей его клетки и в ближайшем окружении. Но недавно в экспериментах in vivo доказана возможность проявления его активности эндокринным образом, т. е. системное воздействие локально синтезированного миостатина на все мышечные группы.
Для проявления своего действия миостатин должен связаться с соответствующим ему рецептором. Показано, что миостатин взаимодействует с рецепторами активина ActRIIB. Мыши с измененными рецепторами ActRIIB, неспособными при связывании миостатина передавать сигнал внутрь клетки, также обладают увеличенной мускулатурой, как и миостатин-ноль мыши.
В эмбриогенезе экспрессия гена миостатина начинается в прогениторных клетках миогенной линии и продолжается во взрослых аксиальных и параксиальных мышцах. При этом уровень синтеза миостатина различен в разных скелетных мышцах.
Последующие исследования обнаружили экспрессию гена миостатина в ряде других тканей. Показано, что миостатин находится в кардиомиоцитах и волокнах Пуркине в сердце, синтез мРНК миостатина обнаружен в молочных железах и адипоцитах.
Можно предполагать, что половые различия в количестве секретируемого миостатина, наряду с другими факторами, влияют на половой диморфизм в развитии скелетной мускулатуры. При одинаковом уровне синтеза мРНК миостатина, т. е. уровне экспрессии гена миостатина, уровень секретированного миостатина выше у женщин, чем у мужчин.
Поскольку начавшаяся в эмбриогенезе экспрессия гена миостатина продолжается в постнатальных мышцах и мышцах взрослого организма, то миостатин, по-видимому, играет существенную роль на всех стадиях миогенеза и в тканевом гомеостазе скелетной мускулатуры во взрослом состоянии при воздействии различных функциональных стимулов, включая обездвиживание.
Активация генов MyoD и Myf5 дает начало миогенной линии клеток, прогениторные клетки (клетки-предшественники) дают начало миобластам. Активация гена миогенина стимулирует миобласты к делению (пролиферации) и последующей дифференцировке. Миостатин, активируя ген р21 и синтез Smad-белков, ограничивает (или останавливает) пролиферацию миобластов. Миобласты, прекратившие деление, переходят к стадии морфогенеза, т. е. к закладке предшественников мышечных волокон — myotubes. Взаимодействуя друг с другом, они выстраиваются в цепочки и сливаются в вытянутые многоядерные клетки (синцитии). После слияния начинаются дифференцировка мембран, биохимическая и цитоплазматическая дифференцировка, в результате чего возникают окончательно сформированные зрелые мышечные волокна.
Зрелые мышечные волокна являются продуктом конечной дифференцировки, т. е., ни они сами, как структура в целом, ни клеточные ядра внутри волокон не могут делиться и рост и регенерация мышц осуществляются благодаря npoлиферации клеток-сателлитов. Клетки-сателлиты имеют размеры, близкие к размерам клеточных ядер мышечных волокон и, как и эти ядра, находятся на периферии мышечных волокон. Только электронная микроскопия позволила установить, что они физически отделены от зрелых мышечных волокон и находятся между сарколеммой и базальной мембраной.
В мышечных волокнах количество цитоплазмы, приходящееся на одно ядро, находится в определенных достаточно узких пределах (миону-клеарный домен). Увеличение размеров волокна (гипертрофия) достигается благодаря слиянию пролиферирующих клеток-сателлитов с волокном, так что размеры мионуклеарного домена остаются в тех же пределах, что и до гипертрофии. Стимулом для деления (пролиферации) клеток-сателлитов у взрослых организмов является прежде всего травма, в том числе на уровне отдельного мышечного волокна. Выходя из состояния покоя, клетки-сателлиты начинают экспрессировать миогенные маркеры, т. е. активируются гены, характерные для миобластов. В процессе регенерации поврежденных скелетных мышц клетки-сателлиты сливаются с существующими мышечными волокнами (гипертрофия) или между собой, создавая новые волокна (гиперплазия).
Определяя долю клеток-сателлитов в мышечной ткани, удобнее сопоставлять миофибриллы и клетки-сателлиты по числу ядер, поскольку мышечные волокна многоядерны. Во взрослом состоянии ядра клеток-сателлитов составляют 2—7 % общего числа ядер в различных мышцах. При рождении ядра клеток-сателлитов составляют около 30 % общего числа ядер в мышцах нижних конечностей. Эти неонатальные клетки-сателлиты пролиферируют и сливаются с растущими мышечными волокнами, привнося в них дополнительные ядра в ходе постнатального роста скелетных мышц.
В ответ на миотравму клетки-сателлиты активируются и пролиферируют. Часть клеток после деления возвращается в состояние покоя (для восстановления пула клеток-сателлитов). Основная часть клеток в результате хемотаксиса мигрирует к поврежденным участкам и в зависимости от степени повреждения или сливается с поврежденным мышечным волокном или клетки-сателлиты сливаются друг с другом, образуя новые волокна. Ядра недавно слившихся клеток-сателлитов находятся в центре волокон. По мере восстановления внутриклеточных структур волокна они мигрируют к периферии.
Таким образом, клетки-сателлиты обеспечивают поддержание функционального состояния скелетных мышц взрослого организма. Они необходимы для восстановления поврежденных мышечных волокон и являются источником дополнительных ядер при гипертрофии мышц в результате тренировочных занятий. Гипертрофия и(или) гиперплазия скелетных мышц у животных с отсутствием функционально активного миостатина доказывает, что миостатин влияет на пролиферацию клеток-сателлитов, поскольку постнатальный рост мышц и увеличение числа ядер в мышечных волокнах в процессе развития до взрослого состояния происходит за счет пролиферации клеток-сателлитов.
При активации клеток-сателлитов (выход из состояния покоя) в них начинают работать гены, характерные для миобластов и, таким образом, клетки-сателлиты становятся миобластами. Степень пролиферации клеток-сателлитов во взрослых мышцах также ограничивается миостатином, как и пролиферация миобластов в эмбриогенезе. Показано, что и белок TGF-beta ингибирует пролиферацию клеток-сателлитов в культуре.
Роль миостатина в гомеостазе зрелых мышечных волокон в полной мере пока не выяснена, но имеется ряд работ по исследованию уровня синтеза как мРНК миостатина, так и самого миостатина в мышцах во взрослом состоянии на животных моделях и у человека при различных физиологических состояниях.
Так, системная сверхэкспрессия миостатина у мышей в течение двух недель приводит к потере свыше 30 % общей массы тела и 50 % мышечной массы, т. е. картина практически идентичная синдрому кахексии у человека. Установлено, что миостатин может действовать эндокринным образом. Введение ингибиторов миостатина пропептида или фоллистатина значительно замедляет потерю мышечной массы при повышенном уровне миостатина.
Также важно отметить, что наряду с потерей мышечной массы происходит практически полная потеря подкожного жира, что также согласуется с данными о влиянии миостатина на дифференцировку адипоцитов.
У людей разных возрастных категорий уровень миостатина в сыворотке крови наиболее высок у мужчин и женщин старше 72 лет и коррелирует со степенью саркопении. У мужчин и женщин среднего возраста уровень миостатина в сыворотке в свою очередь выше по сравнению с молодыми людьми. Индексы чистой массы тела и мышечной массы тела обратно пропорционально коррелируют с сывороточным миостатином во всех возрастных категориях. Эти данные позволяют рассматривать миостатин не просто как биомаркер возрастной саркопении, но как супрессор мышечной массы.
Внутримышечная и сывороточная концентрации миостатина увеличены у больных СПИДом в стадии, когда наблюдается потеря мышечной массы. При этом концентрация миостатина обратно пропорционально коррелирует с индексом чистой массы тела. Эти результаты показывают, что миостатин вносит вклад в потерю мышечной массы при СПИДе, а также о том, что блокаторы миостатина могут быть полезны в медицине.
В прямых экспериментах на крысах выявлено, что потеря мышечной массы, происходящая при космическом полете, связана с увеличением уровня миостатина в скелетных мышцах (2—5-кратное в различных мышцах к 17-му дню полета). Эти результаты показывают, что миостатин один из основных элементов в многофакторной патофизиологии происходящей в условиях космического полета мышечной атрофии.
В наземных исследованиях с участием людей установлено, что к 25-му дню неподвижного режима (в качестве модели космического полета) уровень миостатина повышается на 12 %.
Иммобилизация мышц у мышей приводит к увеличению концентрации мРНК миостатина (экспрессии гена миостатина) в обездвиженных мускулах уже через 24 ч эксперимента, хотя потеря мышечной массы начинается лишь после третьего дня. Наиболее неожиданный результат, полученный в этих экспериментах, состоял в том, что синтез миостатина значительно различался в мышцах, содержащих различные изоформы (варианты) тяжелой цепи миозина. При иммобилизации синтез миостатина значительно возрастал в быстросокращающихся мышечных волокнах, которые атрофировались к седьмому дню на 17 %, в то время как m. soleus, в которой синтез миостатина не обнаруживался, атрофировалась к тому же дню на 42 %. М. soleus состоит только из волокон типов I и Па, тогда как m. gastrocnemius и т. plantaris представляют собой типы IId/х и IIЬ, хотя и содержат типы I и На. Единственно приемлемое объяснение этого феномена — воздействие миостатина, синтезированного m. gastrocnemius и га. plantaris, на m. soleus, т. е. эндокринное воздействие.
Другое объяснение состоит в том, что синтез миостатина коррелирует с типом волокон, т. е. синтез миостатина при иммобилизации мышц у мышей коррелирует с изоформой тяжелой цепи миозина IIb.
На модели мышечной дистрофии Дюшена (мыши линии mdx) показано, что блокаторы миостатина (путем внутрибрюшинных инъекций антител к миостатину) в течение трех месяцев приводит к увеличению мышечной массы, размеров и силы мышц. Гибриды мышей линии mdx с миостатин-ноль мышами имеют значительно лучшее состояние мускулатуры, чем исходные мыши линии mdx. Нормализация состояния мышц у мышей линии mdx путем блокады миостатина или скрещивания с миостатин-ноль мышами открывает новые возможности для лечения патологий, сопровождающихся потерей мышечной массы.
Более сорока лет назад было высказано предположение о существовании тканеспецифических ингибиторов — кейлонов (chalones), которые, синтезируясь данной тканью, ингибируют ее рост и, таким образом, поддерживают адекватную массу этой ткани. Это предположение впоследствии подтвердилось в случае скелетной мускулатуры.
Очевидно, что применение блокаторов миостатина повлечет за собой революционные изменения в медицине и спорте и, возможно, будет широко использоваться в терапевтических целях. С 2008 г. применение ингибиторов миостатина в спорте запрещено.
Читайте также
Источники
- ↑ Zhang T. et al. Oral administration of myostatin-specific whole recombinant yeast Saccharomyces cerevisiae vaccine increases body weight and muscle composition in mice //Vaccine. – 2011. – Т. 29. – №. 46. – С. 8412-8416.
- ↑ Tang L. et al. Myostatin DNA vaccine increases skeletal muscle mass and endurance in mice //Muscle & nerve. – 2007. – Т. 36. – №. 3. – С. 342-348.
- ↑ https://thinksteroids.com/community/threads/pharmacom-labs-officials-and-our-basicstero-com-store.134363986/page-516#post-1610785
- ↑ https://thinksteroids.com/community/threads/pharmacom-labs-officials-and-our-basicstero-com-store.134363986/page-551#post-1642963