Гипертрофия мышц — различия между версиями
Nico (обсуждение | вклад) (→Влияние инсулина, аминокислот и физических упражнений на гипертрофию) |
Ars (обсуждение | вклад) (→Механизмы гипертрофии скелетных мышц) |
||
| Строка 7: | Строка 7: | ||
Таким образом, приспособительный процесс скелетных мышц к тренировочным нагрузкам можно рассматривать как совокупность согласованных локальных и периферических событий, ключевыми [[Рост мышц|регуляторными сигналами]] к которым являются гормональные, механические, метаболические и нервные факторы. Изменения в скорости синтеза [[Анаболические гормоны|гормонов]] и [[Механический фактор роста|ростовых факторов]], а также содержание их [[Андрогенные рецепторы|рецепторов]] являются важными факторами регуляции приспособительного процесса, позволяющего скелетным мышцам удовлетворить физиологические потребности различных [[Виды физических нагрузок|видов двигательной активности]]. | Таким образом, приспособительный процесс скелетных мышц к тренировочным нагрузкам можно рассматривать как совокупность согласованных локальных и периферических событий, ключевыми [[Рост мышц|регуляторными сигналами]] к которым являются гормональные, механические, метаболические и нервные факторы. Изменения в скорости синтеза [[Анаболические гормоны|гормонов]] и [[Механический фактор роста|ростовых факторов]], а также содержание их [[Андрогенные рецепторы|рецепторов]] являются важными факторами регуляции приспособительного процесса, позволяющего скелетным мышцам удовлетворить физиологические потребности различных [[Виды физических нагрузок|видов двигательной активности]]. | ||
| + | |||
| + | == Факторы гипетрофии == | ||
=== Синтез сократительных белков === | === Синтез сократительных белков === | ||
Версия 21:54, 12 октября 2016
Источник:
Эндокриная система, спорт и двигательная активность.
Перевод с англ./под ред. У.Дж. Кремера и А.Д. Рогола. - Э64
Издательство: Олимп. литература, 2008 год.
Содержание
Механизмы гипертрофии скелетных мышц
Гипертрофия - это увеличение мышечных клеток в объеме, возникающее как приспособительная реакция на возрастающую нагрузку.
Гипертрофия обуславливает скорость сокращения скелетной мышцы, количество создаваемой при сокращении силы, а также способность противостоять утомлению, — все это важные показатели, имеющие непосредственное отношение к спортивным показателям. Благодаря высокой лабильности различных характеристик мышечной ткани, таких, как размер и состав фибрилл[1], а также степень капилляризации ткани, скелетные мышцы способны быстро приспосабливаться к изменениям, возникающим в ходе тренировочного процесса. В то же время характер адаптации скелетных мышц к силовым упражнениям и упражнениям на выносливость будет отличаться, что свидетельствует о существовании различных систем реагирования на нагрузку.
Таким образом, приспособительный процесс скелетных мышц к тренировочным нагрузкам можно рассматривать как совокупность согласованных локальных и периферических событий, ключевыми регуляторными сигналами к которым являются гормональные, механические, метаболические и нервные факторы. Изменения в скорости синтеза гормонов и ростовых факторов, а также содержание их рецепторов являются важными факторами регуляции приспособительного процесса, позволяющего скелетным мышцам удовлетворить физиологические потребности различных видов двигательной активности.
Факторы гипетрофии
Синтез сократительных белков
Усиление синтеза сократительных белков является безоговорочным условием увеличения размера мышечных клеток в ответ на тренировочную нагрузку. В процессе роста скелетных мышц изменяется не только интенсивность синтеза белка, но и скорость его деградации[2]. У человека усиление синтеза белка выше уровня покоя происходит очень быстро, в течение 1 — 4 ч после завершения разового тренировочного занятия[3]. В начале мышечной гипертрофии усиление синтеза белка коррелирует с ростом активности РНК [4]. Передача мРНК облегчается теми факторами, активность которых, как известно, регулируется путем их фосфорилирования[5]. Параллельно с этими изменениями после тренировочного занятия происходит усиление транспорта аминокислот в мышцы, подвергавшиеся нагрузке. С теоретической точки зрения это увеличивает доступность аминокислот для белкового синтеза[6].
Рибонуклеиновая кислота (РНК)
Ряд данных свидетельствует о том, что после этого первоначального этапа необходимым условием продолжения гипертрофии мышц является увеличение уровня РНК(в отличие от увеличения активности РНК, происходившего вначале). Здесь возросшее количество мРНК может быть обусловлено либо усилением генной транскрипции в клеточных ядрах, либо увеличением количества ядер. Мышечные волокна взрослого человека содержат сотни ядер и каждое ядро осуществляет синтез белка в каком-то ограниченном объеме цитоплазмы, получившем название "ядерный компонент”[7]. Важно отметить, что хотя ядра мышечной клетки прошли митоз, они способны обеспечивать увеличение фибрилл лишь до определенного предела, после которого становится необходимым привлечение новых ядер. Это предположение подтверждается результатами исследований человека и животных, демонстрирующими, что гипертрофия скелетных мышечных волокон сопровождается значительным увеличением количества ядер[8]. У хорошо тренированных людей, например у тяжеловесов, количество ядер в гипертрофированной фибрилле скелетной мышцы больше, чем у лиц, ведущих малоподвижный образ жизни. Установлено существование линейной зависимости между количеством ядер и площадью поперечного сечения миофибриллы[9]. Появление новых ядер в увеличившейся миофибрилле играет роль в поддержании постоянного ядерно-цитоплазматического соотношения, т. е. стабильного размера ядерного компонента. О появлении новых ядер в гипертрофирующихся миофибриллах сообщалось для лиц разного возраста[10].
Гиперплазия (клетки-сателлиты)
Наряду с гипертрофией (увеличением объема клеток) под влиянием физических тренировок наблюдается процесс гиперплазии - рост числа волокон за счет деления клеток-сателлитов. Именно гиперплазия обеспечивает развитие мышечной памяти.
Клетки-сателлиты или спутниковые клетки
Функции спутниковых клеток это облегчение роста, обеспечение жизнедеятельности и восстановление поврежденной скелетной (не сердечной) мышечной ткани Эти клетки называются клетками-сателлитами, потому что расположены на наружной поверхности мышечных волокон, между сарколеммой и базальной пластинкой (верхний слой базальной мембраны) мышечного волокна. Спутниковые клетки имеют одно ядро, занимающее большую часть их объема. Обычно эти клетки находятся в состоянии покоя, но они активируются, когда мышечные волокна получают любую травму, например, от силовых тренировок. Спутниковые клетки затем размножаются и дочерние клетки притягиваются к поврежденному участку мышц. Затем они сливаются с существующим мышечным волокном, жертвуя свои ядра, которые помогают регенерировать мышечные волокна. Важно подчеркнуть, что этот процесс не создает новые скелетные мышечные волокна (у людей), но увеличивает размер и количество сократительных белков (актина и миозина) в пределах мышечного волокна. Этот период активации сателлитных клеток и пролиферации длится до 48 часов после травмы или после сессии силовых тренировок[11].
Влияние андрогенных анаболических стероидов
Результаты исследований, проведенных на животных, показали, что использование андрогенных анаболических стероидов сопровождается значительным увеличением размера мышц и мышечной силы[12]. Применение тестостерона в концентрациях, превышающих физиологические, у мужчин с различным уровнем физической подготовленности на протяжении 10 недель сопровождалось существенным увеличением мышечной силы и поперечного сечения четырехглавой мышцы бедра[13]. Известно, что андрогенные анаболические стероиды увеличивают интенсивность синтеза белка и способствуют росту мышц как in vivo, так и in vitro[14]. У человека прием анаболических стероидов на протяжении длительного времени усиливает степень гипертрофии мышечных волокон у хорошотренированных тяжелоатлетов[15]. Скелетные мышцы тяжелоатлетов, принимавших анаболические стероиды, характеризуются экстремально большим размером мышечных волокон и большим количеством ядер в мышечных клетках[16]. Подобную картину наблюдали на животных моделях, в частности, было обнаружено, что андрогенные анаболические стероиды опосредуют свое миотрофное воздействие путем увеличения количества ядер в мышечных волокнах и увеличения количества мышечных волокон[17]. Таким образом, анаболические стероиды способствуют увеличению количества ядер с целью обеспечения белкового синтеза в чрезвычайно гипертрофированных мышечных волокнах[18]. Основным механизмом, посредством которого андрогенные анаболические стероиды индуцируют мышечную гипертрофию, является активация и индукция пролиферации миосателлитоцитов, которые впоследствии сливаются с уже существующими мышечными волокнами или между собой, формируя новые мышечные волокна. С таким выводом согласуются результаты иммуногистохимической локализации рецепторов андрогенов в культивируемых клетках-спутниках, демонстрирующие возможность непосредственного воздействия анаболических стероидов на миосателлитоциты[19].
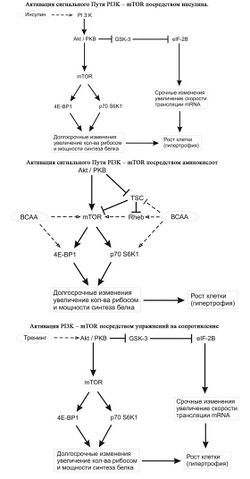
Влияние инсулина, аминокислот и физических упражнений на гипертрофию
Инсулин, аминокислоты и упражнения на сопротивление - все эти факторы приводят к усилению синтеза белка в скелетных мышцах[20]. Несмотря на то, что инсулин, аминокислоты и упражнения по отдельности активируют несколько путей передачи сигнала в скелетных мышцах, один путь, PI3K – mTOR (фосфатидилинозитол-3-киназа – мишень рапамицина млекопитающих), является целью для всех трех. Активация пути передачи сигнала PI3K – mTOR имеет в результате и срочный (от нескольких минут до нескольких часов) и пролонгированный (от часов до нескольких дней) эффект регуляции синтеза белка через модуляцию нескольких этапов, включающих инициацию трансляции мРНК и, как следствие, биосинтез на рибосомах. Общей конечной точкой в передаче сигналов от каждого из стимулов является протеинкиназа mTOR. Ингибирование mTOR рапамицином или посредством генетических методов (к примеру, через РНК-интерференции в культивированных клетках) предотвращает увеличение синтеза белка, вызванные любым из трех обозначенных стимулов. Более того, рапамицин резко ослаблял гипертрофию, наблюдаемую в модели синергетической абляция при упражнениях на сопротивление. По факту, в обоих типах клеток – и в культивированных, и у животных in vivo ингибирование mTOR приводило к уменьшенному фенотипу клеток. В целом, имеющиеся данные строго обозначают центральную роль mTOR в контроле клеточного роста. Теперь, когда важность роли mTOR в процессе гипертрофии была идентифицирована, будущие исследования должны в ближайшее время предоставить более детальную информацию относительно механизмов, с помощью которых аминокислоты и физические упражнения способствуют продвижению сигналлинга через эту киназу. Кроме того, изучение находящихся после mTOR реакций, активируемых ей, и приводящих к экспрессии генов также должно быть адресовано к последующим исследованиям. Вместе такие исследования, направленные как на сигналлинг на входе mTOR, так и на выходе приведут к лучшему пониманию, как инсулин, аминокислоты и упражнения на сопротивления увеличивают белковый синтез и гипертрофию в скелетных мышцах.
Прочие анаболические агенты
- Гормон роста
- Инсулин
- Механический фактор роста
- Факторы роста фибробластов
- Инсулиноподобные факторы роста и их рецепторы
Читайте также
- Рост мышц
- Типы мышечных волокон
- Креатин
- Фармакологическое сопровождение спортивной деятельности
- Анаболическое окно
Источники
- ↑ Примечание: фибриллы, миофибриллы, мышечные волокна и мышечные клетки - это синонимы.
- ↑ Goldbeig et al., 1975
- ↑ Wong, Booth, 1990; Chcsley ct al., 1992; Biolo ct al., 1995; Philips ct al., 1997
- ↑ Laurent et al., 1978; Wong, Booth, 1990
- ↑ Frederickson, Sonebcig, 1993; Wada ct al., 1996
- ↑ Biolo et al., 1997
- ↑ Cheek, 1985; Hall, Ralston, 1989; Allen ct al., 1999
- ↑ Goldberg et al., 1975; Cabric, James, 1983; Winchester, Gonyea, 1992; Allen et al., 1995; Kadi, 2000
- ↑ Kadi et al., 1999а; Kadi, 2000
- ↑ Hikida et al., 1998; Kadi, Tomcll, 2000
- ↑ Hawke, T.J., and D. J. Garry. Myogenic satellite cells: physiology to molecular biology. Journal of Applied Physiology. 91: 534-551, 2001.
- ↑ Egginton, 1987; Salmons, 1992
- ↑ Basin et al., 1996
- ↑ Powers, Florini, 1975; Rogozkin, 1979
- ↑ Kadi et al., 1999b
- ↑ Kadi et al., 1999b
- ↑ Galavazi, Szirmai, 1971; Sassoon, Kelley, 1986; Joubcrt, Tobin, 1989; Joubert, Tobin, 1995
- ↑ Kadi et al., 1999b
- ↑ Doumit et al., 1996
- ↑ Douglas R. Bolster, Leonard S. Jefferson and Scot R. Kimball. Regulation of protein synthesis associated with skeletal muscle hypertrophy by insulin-, amino acid- and exercise-induced signaling. Department of Cellular and Molecular Physiology, The Pennsylvania State University College of Medicine, PO Box 850, Hershey, PA 17033, USA