Грелин
Содержание
- 1 Грелин
- 2 Роль грелина в регуляции сердечно-сосудистой системы
- 3 Роль грелина в развитии ожирения, инсулинорезистентности и сахарного диабета 2 типа
- 4 Действие инсулина и глюкозы на грелиновую секрецию
- 5 Влияние грелина на метаболизм глюкозы и инсулина
- 6 Влияние грелина на жировую ткань
- 7 Действие грелина на иммунную систему.
- 8 Терапевтический потенциал системы грелин-O-ацетилтрансферазы (GOAT)/грелин по борьбе с ожирением и инсулинорезистентностью
- 9 Источники
Грелин
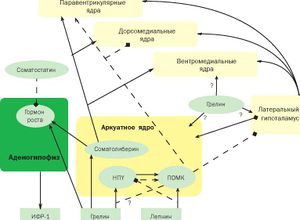
Грелин («ghre-» переводится как рост) - липофильный гормон, секретируемый клетками слизистой оболочки желудка и тонкого кишечника и стимулирующий потребление пищи. Гормон способствует выделению гормона роста, регулирует аппетит, влияет на углеводный и липидный обмены. Кроме того, он оказывает кардиопротекторный эффект при ишемии, усиливает вазодилатацию и регулирует артериальное давление[1].
Грелин идентифецирован в 1999 году благодаря своей способности увеличивать секрецию гормона роста из гипофиза. Концентрация грелина повышается в период голодания и с потерей веса. Предварительные отчеты показывают что у людей с синдромом Прадера - Вилли уровень грелина выше на голодный желудок и отсутствует нормальное снижение гормона после приема пищи [2].
На основе грелина созданы различные производные пептиды, которые нашли широкое применение в бодибилдинге. Среди них:
В последующем было установлено, что грелин оказывает целый ряд кардинальных эффектов на гомеостаз:
1) усиление чувства голода и стимулирование потребления пищи;
2) координация моторики желудка и двенадцатиперстной кишки;
3) подавление активности репродуктивной системы;
4) регуляция циклов сон-бодрствование и поведенческих реакций;
5) моделирование эндокринной и экзокринной функции поджелудочной железы;
6) кардиопротективное действие;
7) антипролиферативное действие в неопластических клетках;
8) участие в реакциях иммунитета;
9) стимуляция секреции пролактина, АКТГ, антидиуретического гормона.
В настоящее время общепризнанна важнейшая роль грелина как индикатора дефицита энергии. Гормон преимущественно секретируется адипоцитами белой жировой ткани, кроме того, источниками его синтеза являются плацента, эпителий грудных желез, скелетная мускулатура и слизистая желудка. К настоящему времени установлено, что грелин сигнализирует о голодании, тем самым способствуя увеличению приема пищи и, соответственно, массы тела, т. е. является орексигенным гормоном. Реципрокные взаимоотношения лептина и грелина проявляются на уровне нейронов гипоталамуса, имеющих специфические рецепторы к каждому из этих пептидов.
Гиперсекреция грелина вызывает развитие ожирения. Однако с развитием тучности уровень гормона в крови снижается и возникает стойкая гипогрелинемия. У пациентов с ожирением в отличие от лиц с нормальной массой тела после еды уровень грелина не снижается. В этом заключается одна из причин того, что у больных с ожирением не возникает чувства сытости после приема пищи; это служит причиной полифагии у тучных людей.[3]
В крови и желудке присутствуют две формы грелина: активная — связанная с октановой кислотой, и неактивная дезацилированная форма. Дезацилированный грелин, присутствующий в сыворотке в значительно больших количествах, чем ацилированная форма, по всей видимости, лишен каких бы то ни было эндокринных эффектов. Тем не менее, он обладает некоторой кардиопротективной и антипролиферативной активностью, возможно, за счет связывания с особыми подтипами рецептора секретагогов гормона роста.
![]() Грелин на сегодняшний момент — единственный гормон, который оказывает свое орексигенное действие и при периферическом введении.
Грелин на сегодняшний момент — единственный гормон, который оказывает свое орексигенное действие и при периферическом введении.
У человека уровень грелина повышается непосредственно перед приемом пищи и быстро снижается после еды, таким образом, грелин является индикатором краткосрочного энергетического баланса и сигналом для инициации приема пищи. Концентрация грелина снижается при ожирении и, напротив, увеличивается при кахексии. Необходимо отметить, что у тучных больных постпрандиальное снижение содержания грелина отсрочено по времени, что вносит определенный вклад в развитие ожирения. Ежедневное подкожное введение грелина приводит к увеличению массы тела, причем отмечается значительный прирост жировой ткани без каких-либо изменений «тощей» (мышечной) массы тела. В условиях эксперимента инъекции грелина не только стимулируют прием пищи, но и увеличивают его продолжительность. [4]
Роль грелина в регуляции сердечно-сосудистой системы
Наличие грелиновых рецепторов в миокарде и сосудистой стенке предполагает существование регуляторного влияния грелина на сердечно-сосудистую систему. Так, в экспериментах было установлено, что грелин улучшает сократимость миокарда при патологических состояниях, уменьшает размер инфаркта и нивелирует ослабление сокращения функции левого желудочка на фоне реперфузионной ишемии [5]. Внутривенные или подкожные инъекции грелина увеличивают сердечный выброс, улучшают сократимость миокарда и вызывают значительное снижение среднего артериального давления без изменения сердечного ритма у здоровых людей[6].
Грелин улучшает функции и снижает ремоделирование левого желудочка у больных с хронической сердечной недостаточностью. Кроме того, грелин снижает системное сосудистое сопротивление и увеличивает сердечный выброс и сердечный индекс у пациентов с хронической сердечной недостаточностью. Замечено, что лечение грелином в течение трех недель увеличивает массу тела, мышечную массу и силу сокращения сердечной мышцы[7]. Эти результаты предполагают, что гре-лин может нивелировать атрофию мышц у пациентов с хронической сердечной недостаточностью. Он также, по-видимому, может эффективно применяться при лечении тяжелых катаболических состояний, характеризующихся потерей веса и мышечной массы и устойчивых к длительному лечению пищевыми добавками.
Отмечена отрицательная корреляция между уровнем плазменного грелина и кровяным давлением, что может свидетельствовать о том, что грелин подавляет симпатическую активность и снижает артериальное давление, влияя на центральную нервную систему[8]. Эта гипотеза подтверждается исследованиями, показывающими, что грелин значительно уменьшает уровень плазменного норадреналина[9]. Было выявлено снижение периферического сопротивления на фоне внутривенного введения грелина в супрафизиологической дозе[10]. Возможно, снижение артериального давления обусловлено прямым действием грелина на эндотелий или гладкомышечные элементы сосудистой стенки[11]. Существует предположение, что грелин нормализует эндотелиальную дисфункцию у больных с метаболическим синдромом путем увеличения биодоступности оксида азота (NO) [60]. Молекулярный механизм действия грелина на сосуды заключается в стимуляции выработки NO с использованием сигнального пути, опосредуемого СГС^Ы, PI-3 киназы, AKT и eNOS[12].
Тесауро М. и соавт.[13] изучили влияние грелина на баланс между NO и эндотелином-1, сосудосуживающим пептидом, вырабатываемым сосудистыми эндотелиальными клетками у лиц с ожирением и метаболическим синдромом. В отсутствие грелина, сосудорасширяющий ответ на введение антагониста рецептора эндотелина-BQ-123 был выше у больных с метаболическим синдромом по сравнению с контролем, тогда как введение ингибитора NO-синтазы вызывало менее выраженную вазоконстрикцию у пациентов по сравнению со здоровыми людьми. Таким образом, у пациентов с метаболическим синдромом грелин способствует поддержанию баланса между сосудосуживающим (эн-дотелин 1) и сосудорасширяющим (NO) соединениями. При этом его влияние может затрагивать как центральные, так и периферические сосуды.
Многочисленные исследования показали, что грелин обладает кардиопротекторным действием, которое заключается в подавлении клеточного апоптоза в сердечнососудистой системе. Грелин, по-видимому, способен предотвращать апоптоз кардиомиоцитов путем подавления арабинозид цитозининового индуктора апоптоза (AraC)[14]. Кроме того, введение грелина предотвращает первичный апоптоз в кардиомиоцитах за счет стимуляции синтеза антител к анти-ФАС агонистам. Известно, что грелин стимулирует фосфорилирование тирозина и активирует ERK-1/2 и Akt в кардиомиоцитах и эндотелиальных клетках. Активация этих двух путей также вовлечена в антиапоптотический эффект грелина. Грелин может модулировать внутриклеточный энергетический баланс, стимулируя 5'-AMP активированную протеинкиназу (AMPK), выполняющую центральную роль в регулировании энергетического обмена в клетках, особенно в анаэробных условиях[15]. Влияние грелина на активность AMPK может иметь важное значение в механизме кардиопротекции при повреждениях постишемической реперфузии [16].
Роль грелина в развитии ожирения, инсулинорезистентности и сахарного диабета 2 типа
Показано, что концентрация грелина снижается при различных метаболических патологиях, включая ожирение, СД2[17]. Экспериментальные данные позволили доказать важную роль грелина в регуляции функций желудочно-кишечного тракта. Центральный и периферический пулы диацилгрелина значительно снижают потребление пищи и уменьшают опорожнение желудка у мышей. У крыс диацилгрелин снижает двигательную активность антрального отдела[18]. Кроме того, диацилгрелин участвует в гипоталамической регуляции пищевого поведения[19].
Было высказано предположение, что на изменение уровня грелина в связи с приемом пищи влияют два обстоятельства. Во-первых, интенсивность постпран-диального снижения уровня грелина пропорциональна времени, в течение которого человек чувствует себя голодным, а во-вторых, как следствие пониженного уровня грелина, скорость опорожнения желудка не уменьшается, и в результате чувство сытости не возникает[20]. Без чувства сытости тучные люди едят больше, чем им нужно, и, следовательно, это приводит к увеличению массы тела[21].
Уровень плазменного грелина регулируется питанием и метаболическими факторами. На самом деле, он увеличивается на фоне ограничения питания (недостаточное питание, анорексия и кахексия) и уменьшается на фоне приема пищи и переедания. Эти данные согласуются с результатами исследований, показывающих снижение циркулирующего грелина у больных с ожирением и метаболическим синдромом[22]. Поэтому закономерно, что циркулирующие уровни грелина увеличиваются у тучных людей, когда они теряют вес[23].
Хотя все формы ожирения у человека характеризуются чрезмерно низким уровнем грелина, единственным исключением является синдром Прадера-Вилли. Это комплексное генетическое заболевание, характеризующееся задержкой умственного развития, гиперфагией, невысоким ростом, связанным с дефицитом гормона роста, и мышечной гипотонией[24]. У этих больных чрезмерный аппетит вызывает прогрессивное ожирение, которое необычно сочетается с высоким уровнем грелина в том же диапазоне, как и у пациентов с нервной анорексией.
В недавнем исследовании предположено, что на продукцию грелина влияет уровень липидов, а не фактор приема пищи в ответ на голод[25]. Было показано, что выработка грелина ингибируется не растяжением желудка, а внутривенным введением глюкозы [64]. В отличие от вышеописанного эффекта, инфузия липидов не изменяет уровень грелина, в то время как при оральном применении жиров наблюдается снижение уровня грелина, хотя не в той степени, как в ответ на введение глюкозы[26]. Кроме того, было показано, что грелин вызывает увеличение уровня глюкозы, и этот эффект может быть связан с активацией гликогенолиза и глюконеоге-неза в печени[27].
Существуют различия в тощаковой и постпранди-альной концентрации грелина как у здоровых людей с нормальной массой тела, так и у людей с избыточной массой тела. Уровень постпрандиального грелина снижается пропорционально калорийности еды у людей с нормальным весом[28], но не у тучных людей[29], у которых рацион питания не в состоянии снизить уровень грелина. Показано, что общее количество грелина плазмы и его неацелированной формы ниже у тучных пациентов с метаболическим синдромом по сравнению с соответствующими показателями у лиц с нормальным весом[30]. В основном, это объясняется повышением ИМТ и появлением компонентов метаболического синдрома в ответ на развитие ожирения. Среди тучных пациентов плазменные уровни грелина ниже у инсулинрезистентных лиц по сравнению с инсулинчув-ствительными лицами[31]. У пациентов с избыточным весом и ожирением отношение AG/UAG ниже у инсу-линчувствительных по сравнению с таковым у инсулин-резистентных[32].
Пациенты с синдромом поликистоза яичников (СПКЯ), сопровождающимся ожирением и метаболическими изменениями[33], имеют более низкий уровень грелина по сравнению с пациентами, имеющими нормальный ИМТ[34].
Положительная корреляция наблюдается между уровнем плазменного грелина и концентрацией липопротеинов высокой плотности (ЛПВП)[35].
Действие инсулина и глюкозы на грелиновую секрецию
Клинические исследования показали, что инсулин, а также оральное и внутривенное введение глюкозы могут подавлять секрецию грелина у здоровых лиц с нормальным и избыточным весом[36]. Уровни инсулина и HOMA-IR отрицательно коррелируют с уровнями общего и неацелированного (UAG) грелина, в то время как с уровнем ацелированного грелина (АГ), напротив, наблюдаются положительные корреляции [37]. Физиологическое увеличение уровня инсулина может играть ключевую роль в регулировании постпранди-альной концентрации грелина в плазме. Показано, что индуцированное приемом пищи снижение грелина отсутствует в случае тяжелого дефицита инсулина [38]. Увеличение инсулина после орального или внутривенного введения глюкозы усиливает тормозное влияние глюкозы на концентрацию грелина. Однако до сих пор неясно, инсулин или глюкоза оказывает прямой ингибирующий эффект на секрецию грелина [38]. Снижение уровня грелина после пероральной нагрузки глюкозой зависит от пола, степени ожирения и уровня резистентности к инсулину. Концентрация грелина выше у женщин, чем у мужчин [25].
Влияние грелина на метаболизм глюкозы и инсулина
Существует точка зрения, что не только инсулин и глюкоза влияют на выработку грелина, но и наоборот — грелин может участвовать в регуляции метаболизма глюкозы и инсулина. Было показано, что AG отвечает за повышение чувствительности к инсулину, а UAG имеет противоположный эффект [81]. Однако в других исследованиях было показано, что введение грелина нарушает метаболизм инсулина и глюкозы, что приводит к росту концентрации глюкозы и снижению уровня инсулина [7]. Именно AG способен снижать инсулин и, как следствие этого, вызывать рост уровня глюкозы [21]. Было высказано предположение, что UAG лишен каких-либо эндокринных эффектов, но в состоянии противодействовать последствиям воздействия AG на секрецию инсулина. Был показан стимулирующий эффект UAG на секрецию инсулина в клетках поджелудочной железы [24]. Относительное превышение AG по сравнению с UAG наблюдается при инсулинорезистентности [3]. Возможно, соотношение UAG/AG может быть диагностическим критерием развития метаболического синдрома. Гипергликемический эффект грелина может быть опосредован через активацию катехоламин-индуцированного [44]. Интересно, что AG стимулирует глюконеогенез в гепатоцитах, тогда как UAG оказывает тормозной эффект на этот процесс [21].
Показано, что грелин может модулировать секрецию инсулина непосредственно в поджелудочной железе [1]. Он способен подавлять секрецию инсулина в изолированных островках in vitro [50], грелин способствует выживанию клеток INS-1E (в-клетки типа INS-1E), и человеческих островков Лангерганса. Грелин предотвращает апоптоз в-клеток островка Лангерганса и способствует их росту. В эксперименте было показано, что грелин подавляет действие инсулина, направленное на снижение эндогенной продукции глюкозы, но усиливает действие инсулина на распределение глюкозы [24].
Точные механизмы, посредством которых инсулин регулирует секрецию грелина, пока не описаны. Тем не менее, можно сделать заключение, что гиперин-сулинемия по принципу обратной связи подавляет секрецию грелина.
Влияние грелина на жировую ткань
Грелин, по-видимому, способствует липогенезу и аккумуляции энергии в жировой ткани [52]. Длительное введение грелина приводит к увеличению массы жировой ткани у грызунов и человека. Грелин (AG и UAG) стимулирует накопление липидов в висцеральной жировой ткани и повышает экспрессию генов PPARg, SREBP1, ацетил-КоА карбоксилазы, липопротеинлипазы, пе-рилипина в дифференцирующихся адипоцитах [35] и стимулирует липогенез. Такое введение подавляло высвобождение норадреналина в бурой жировой ткани, усиливало поглощение глюкозы и триглицеридов, а также оказывало антиапоптический эффект на адипоциты [62]. Кроме того, грелин снижает экспрессию разобщающих молекул и, таким образом, оказывает «энергосберегающее» воздействие на жировую ткань. Грелин стимулирует дифференцировку преадипоцитов и подавляет липолиз in vitro [11]. Показано также, что он усиливает липогенез в костном мозге [62].
Действие грелина на иммунную систему.
Противовоспалительное действие грелина
Учитывая широкое распространение грелиновых рецепторов в клетках иммунной системы, была высказана гипотеза, что грелин обладает иммунорегуляторными свойствами. Согласно опубликованным данным, грелин обладает мощным противовоспалительным действием. В частности, он способен снижать в иммунокомпетентных клетках экспрессию провоспалительных цитокинов (IL-1p, IL-6 и TNF-а). Интересно, что увеличение экспрессии грелина и его рецепторов наблюдается в Т-лимфоцитах после их активации [15].
Грелиновые агонисты способны снижать продукцию IL-6 и тормозить развитие воспаления суставов у крыс [23]. Значительное уменьшение циркулирующих провоспалительных цитокинов было отмечено у крыс в результате введения грелина при хронической патологии почек [13]. Грелин ингибирует экспрессию NF-kB в эндотелиальных клетках, а также подавляет продукцию ими провоспалительных цитокинов в ответ на действие липополисахарида [40]. Предполагается, что противовоспалительные эффекты грелина могут играть важную роль в предотвращении кардиометаболических расстройств, связанных с хроническим системным воспалением.
Терапевтический потенциал системы грелин-O-ацетилтрансферазы (GOAT)/грелин по борьбе с ожирением и инсулинорезистентностью
Увеличение распространенности ожирения во всем мире является серьезным фактором риска развития сердечно-сосудистых заболеваний и СД2. Поэтому разработка стратегий по борьбе с эпидемией ожирения является важной проблемой здравоохранения. В связи с этим, различные формы грелина (AG и UAG), а также модификаторы их действия могут быть использованы при разработке фармакологических методов лечения ожирения и диабета [55]. В частности, показано, что антагонисты грелиновых рецепторов блокируют секрецию гормона роста и тем самым улучшают течение диабета, поскольку усиливается глюкозозависимая выработка инсулина, происходит потеря веса и подавляется аппетит [74]. При химической или иммунологической блокаде грелиновых рецепторов — GHRP — снижается аппетит и, соответственно, происходит потеря массы тела [4]. В последнее время был разработан новый класс
L-РНК-антагонистов гормонов — spiegelmers (SPMs) [72]. Показано, что antighrelin Spiegelmer NOX-B11-3 через нейтрализацию секреции гормона роста способен значительно снижать прием пищи и таким образом препятствовать развитию ожирения у экспериментальных животных [30]. Многообразие метаболических функций грелина требует, однако, крайней осторожности в использовании терапевтических подходов, направленных на блокаду его действия.
Источники
- ↑ Cao J. M., Ong H., Chen C. Effects of ghrelin and synthetic GH secretagogues on the cardiovascular system //Trends in Endocrinology & Metabolism. – 2006. – Т. 17. – №. 1. – С. 13-18.
- ↑ Ühing P. W. S., Lastekliinik T. Ü. K. Prader-Willi sündroomi ravi olevik ja tulevik.
- ↑ ТЕРЕЩЕНКО И. В., КАЮШЕВ П. Е. Грелин и его роль в норме и патологии. – 2013.
- ↑ Романцова Т. И., Волкова Г. Е. Лептин и грелин: антагонизм и взаимодействие в регуляции энергетического обмена //Ожирение и метаболизм. – 2005. – №. 2.
- ↑ Frascarelli S, Ghelardoni S, Ronca-Testoni S, Zucchi R. Effect of ghrelin and synthetic growth hormone secretagogues in normal and ischemic rat heart. Basic Research in Cardiology. 2003;98(6):401-405. [PubMed]
- ↑ Nagaya N, Moriya J, Yasumura Y, et al. Effects of ghrelin administration on left ventricular function, exercise capacity, and muscle wasting in patients with chronic heart failure. Circulation. 2004;110(24):3674-3679. [PubMed]
- ↑ Kissebah AH, Sonnenberg GE, Myklebust J, et al. Quantitative trait loci on chromosomes 3 and 17 influence phenotypes of the metabolic syndrome. Proceedings of the National Academy of Sciences of the United States of America. 2000;97(26):14478-14483. [PMC free article] [PubMed]
- ↑ Mizia-Stec K, Zahorska-Markiewicz B, Olszanecka-Glinianowicz M, et al. Ghrelin as a potential blood pressure reducing factor in obese women during weight loss treatment. Endokrynologia Polska. 2008;59(3):207-211. [PubMed]
- ↑ Soeki T, Kishimoto I, Schwenke DO, et al. Ghrelin suppresses cardiac sympathetic activity and prevents early left ventricular remodeling in rats with myocardial infarction. American Journal of Physiology. 2008;294(1):H426-H432. [PubMed]
- ↑ Garcia EA, Korbonits M. Ghrelin and cardiovascular health. Current Opinion in Pharmacology. 2006;6(2):142-147. [PubMed]
- ↑ Wiley KE, Davenport AP. Comparison of vasodilators in human internal mammary artery: ghrelin is a potent physiological antagonist of endothelin-1. British Journal of Pharmacology. 2002;136(8):1146-1152. [PMC free article] [PubMed]
- ↑ Rabe K, Lehrke M, Parhofer KG, Broedl UC. Adipokines and insulin resistance. Molecular Medicine. 2008;14(11-12):741-751. [PMC free article] [PubMed]
- ↑ Tesauro M, Schinzari F, Rovella V, et al. Ghrelin restores the endothelin 1/nitric oxide balance in patients with obesity-related metabolic syndrome. Hypertension. 2009;54(5):995-1000. [PubMed]
- ↑ Iglesias MJ, Pineiro R, Blanco M, et al. Growth hormone releasing peptide (ghrelin) is synthesized and secreted by cardiomyocytes. Cardiovascular Research. 2004;62(3):481-488. [PubMed]
- ↑ Kola B, Hubina E, Tucci SA, et al. Cannabinoids and ghrelin have both central and peripheral metabolic and cardiac effects via AMP-activated protein kinase. Journal of Biological Chemistry. 2005;280(26):25196-25201. [PubMed]
- ↑ Garcia EA, Korbonits M. Ghrelin and cardiovascular health. Current Opinion in Pharmacology. 2006;6(2):142-147. [PubMed]
- ↑ Barazzoni R, Zanetti M, Ferreira C, et al. Relationships between desacylated and acylated ghrelin and insulin sensitivity in the metabolic syndrome. Journal of Clinical Endocrinology and Metabolism. 2007;92:3935-3940. [PubMed]
- ↑ Chen C-Y, Inui A, Asakawa A, et al. Des-acyl ghrelin acts by CRF type 2 receptors to disrupt fasted stomach motility in conscious rats. Gastroenterology. 2005;129(1):8-25. [PubMed]
- ↑ Toshinai K, Yamaguchi H, Sun Y, et al. Des-acyl ghrelin induces food intake by a mechanism independent of the growth hormone secretagogue receptor. Endocrinology. 2006;147(5):2306-2314. [PubMed]
- ↑ Hosoda H, Kojima M, Kangawa K. Ghrelin and the regulation of food intake and energy balance. Molecular Interventions. 2002;2(8):494-503. [PubMed]
- ↑ Legro RS, Kunselman AR, Dodson WC, Dunaif A. Prevalence and predictors of risk for type 2 diabetes mellitus and impaired glucose tolerance in polycystic ovary syndrome: a
- ↑ Pagotto U, Gambineri A, Vicennati V, Heiman ML, Tschop M, Pasquali R. Plasma ghre-lin, obesity, and the polycystic ovary syndrome: correlation with insulin resistance and androgen levels. Journal of Clinical Endocrinology and Metabolism. 2002;87(12):5625-5629. [PubMed]
- ↑ Santosa S, Demonty I, Lichtenstein AH, Cianflone K, Jones PJH. An investigation of hormone and lipid associations after weight loss in women. Journal of the American College of Nutrition. 2007;26(3):250-258. [PubMed]
- ↑ Cummings DE, Clement K, Purnell JQ, et al. Elevated plasma ghrelin levels in Prader-Willi syndrome. Nature Medicine. 2002;8(7):643-644.
- ↑ Sakata I, Yang J, Lee CE, et al. Colocalization of ghrelin O-acyltransferase and ghrelin in gastric mucosal cells. American Journal of Physiology. 2009;297(1):E134-E141. [PMC free article] [PubMed]
- ↑ English PJ, Ghatei MA, Malik IA, Bloom SR, Wilding JPH. Food fails to suppress ghrelin levels in obese humans. Journal of Clinical Endocrinology and Metabolism. 2002;87(6):2984-2987. [PubMed]
- ↑ DeBoer MD, Zhu X, Levasseur PR, et al. Ghrelin treatment of chronic kidney disease: improvements in lean body mass and cytokine profile. Endocrinology. 2008;149(2):827-835. [PMC free article] [PubM
- ↑ Tschop M, Wawarta R, Riepl RL, et al. Post-prandial decrease of circulating human ghrelin levels. Journal of Endocrinological Investigation. 2001;24(6):RC19-RC21. [PubMed]
- ↑ Dixit VD, Schaffer EM, Pyle RS, et al. Ghrelin inhibits leptin- and activation-induced proinflammatory cytokine expression by human monocytes and T cells. Journal of Clinical Investigation. 2004;114(1):57-66. [PMC free article] [PubMed]
- ↑ Ukkola O. Ghrelin and metabolic disorders. Current Protein and Peptide Science. 2009;10(1):2-7. [PubMed]
- ↑ St-Pierre DH, Karelis AD, Coderre L, et al. Association of acylated and nonacylated ghrelin with insulin sensitivity in overweight and obese postmenopausal women. Journal of Clinical Endocrinology and Metabolism. 2007;92(1):264-269. [PubMed]
- ↑ Barazzoni R, Zanetti M, Ferreira C, et al. Relationships between desacylated and acylated ghrelin and insulin sensitivity in the metabolic syndrome. Journal of Clinical Endocrinology and Metabolism. 2007;92:3935-3940. [PubMed]
- ↑ Langenberg C, Bergstrom J, Laughlin GA, Barrett-Connor E. Ghrelin and the metabolic syndrome in older adults. Journal of Clinical Endocrinology and Metabolism. 2005;90(12):6448-6453. [PubMed]
- ↑ Schofl C, Horn R, Schill T, Schlosser HW, Muller MJ, Brabant G. Circulating ghrelin levels in patients with polycystic ovary syndrome. Journal of Clinical Endocrinology and Metabolism. 2002;87(10):4607-4610. [PubMed]
- ↑ Langenberg C, Bergstrom J, Laughlin GA, Barrett-Connor E. Ghrelin and the metabolic syndrome in older adults. Journal of Clinical Endocrinology and Metabolism. 2005;90(12):6448-6453. [PubMed]
- ↑ St-Pierre DH, Karelis AD, Coderre L, et al. Association of acylated and nonacylated ghrelin with insulin sensitivity in overweight and obese postmenopausal women. Journal of Clinical Endocrinology and Metabolism. 2007;92(1):264-269. [PubMed]
- ↑ Barazzoni R, Zanetti M, Ferreira C, et al. Relationships between desacylated and acylated ghrelin and insulin sensitivity in the metabolic syndrome. Journal of Clinical Endocrinology and Metabolism. 2007;92:3935-3940. [PubMed]
- ↑ English PJ, Ghatei MA, Malik IA, Bloom SR, Wilding JPH. Food fails to suppress ghrelin levels in obese humans. Journal of Clinical Endocrinology and Metabolism. 2002;87(6):2984-2987. [PubMed]