Левомицетин (хлорамфеникол)
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Левомицетин (хлорамфеникол)
Историческая справка
Левомицетин (хлорамфеникол) — антибиотик, вырабатываемый Streptomyces venezuelae. Этот микроорганизм был впервые выделен в 1947 г. из пробы почвы, взятой в Венесуэле (Bartz, 1948). Химическая структура хлорамфеникола оказалась довольно простой, и вскоре антибиотик был синтезирован искусственно. В том же 1947 г. полученный в небольшом количестве хлорамфеникол применили при вспышке сыпного тифа в Боливии и получили превосходные результаты. Впоследствии препарат с успехом использовали для лечения цуцугамуши на полуострове Малакка. К 1948 г. хлорамфеникол стал доступным для широкого применения, однако уже к 1950 г. стало ясно, что он может вызывать тяжелые и даже смертельные нарушения кроветворения. По этой причине использование препарата ограничили тяжелыми инфекциями (менингит, сыпные и брюшной тифы), при которых лечение более безопасными антибиотиками невозможно из-за устойчивости возбудителя или аллергии. Кроме того, хлорамфеникол применяют при пятнистой лихорадке Скалистых гор.
Химические свойства
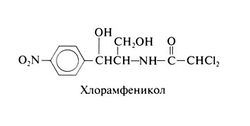
Структурная формула хлорамфеникола следующая:
Левомицетин — уникальное природное соединение, молекула которого содержит остатки нитробензола и дихлоруксусной кислоты. Биологической активностью обладает левоврашаюший изомер.
Механизм действия
Левомицетин подавляет синтез белка у бактерий и, в меньшей степени, у эукариот. Препарат легко проникает в бактериальную клетку (вероятно, путем облегченной диффузии) и обратимо связывается с 505-субъединицей рибосом. Левомицетин конкурентно ингибирует связывание с рибосомами макролидов и клиндамицина, так как точки приложения этих препаратов близки. По-видимому, хлорамфеникол нарушает присоединение аминокислотного остатка амино-ацил-тРНК к расположенному на 505-субъединице пептидилтрансферазному участку (взаимодействие антикодона тРНК с расположенным на 305-субъединице кодоном мРНК при этом не нарушается). В результате пептидилтрансфера за не взаимодействует со своим субстратом — аминокислотой, и пептидная связь не образуется (рис. 47.2).
Левомицетин угнетает синтез белка в митохондриях млекопитающих, возможно, потому, что митохондриальные рибосомы млекопитающих, как и бактериальные рибосомы, имеют массу 70S, а цитоплазматические — 80S. Поэтому митохондриальные рибосомы чувствительны к хлорамфениколу, а цитоплазматические — нет. Наиболее уязвимы для хлорамфеникола клетки эритроидного ростка.
Антимикробная активность
Левомицетин обладает широким спектром действия. Штаммы считаются чувствительными к препарату, если МП К для них не превышает 8 мкг/мл. Исключение составляют Neisseria gonorrhoeae, Streptococcus pneumoniae и Haemophilus influenzae: для этих микроорганизмов МПК должна быть ниже. Хлорамфеникол — преимущественно бактериостатический антибиотик, хотя на некоторые микроорганизмы ( Neisseria meningitidis. Streptococcus pneumoniae и Haemophilus influenzae) он оказывает бактерицидное действие. In vitro в концентрации 8 мкг/мл или менее хлорамфеникол подавляет рост более чем 95% штаммов следующих аэробных грамотрицательных бактерий: Haemophilus influenzae. Neisseria meningitidis, Neisseria gonorrhoeae, Brucella spp. и Bordetella pertussis. В тех же концентрациях хлорамфеникол действует бактериостатиче-ски и на большинство анаэробных бактерий, включая грамполо-жительные кокки, Clostridium spp., грамотрицательные палочки (в том числе Bacteroides fragilis). В концентрации 8 мкг/мл препарат подавляет рост некоторых аэробных грамположительных кокков, включая Streptococcus pyogenes, Streptococcus agalactiae (стрептококки группы В) и Streptococcus pneumoniae. Штаммы Staphylococcus aureus менее чувствительны к хлорамфениколу (МПК > 8 мкг/мл, Standiford, 2000). Кроме того, хлорамфеникол активен в отношении микоплазм, хламидий и риккетсий.
Чувствительность энтеробактерий к хлорамфениколу колеблется. Так, к нему чувствительны большинство штаммов Escherichia coli (не менее 75%) и Klebsiella pneumoniae, а среди Proteus mirabilis и индолположительных Proteus spp. доля чувствительных штаммов составляет около 50% (Standiford, 2000). Pseudomonas aeruginosa устойчива даже к высоким концентрациям препарата. Штаммы Vibrio cholerae, как правило, чувствительны. Среди Shigella spp. и Salmonella spp. растет число штаммов, устойчивых ко многим антибактериальным средствам, включая хлорамфеникол (Prats et al., 2000; Replogle et al., 2000). Большую опасность представляет распространение полирезистентности среди штаммов Salmonella typhi, особенно за пределами США (Prats et al., 2000; Ackers et al., 2000).
Устойчивость к хлорамфениколу
В большинстве случаев устойчивость обусловлена кодируемым плазмидными генами бактериальным ферментом хлорамфеникол-ацетилтрансферазой, который инактивирует препарат. Описаны по крайней мере 3 типа этого фермента (Gaffney and Foster, 1978). Ацетилированные производные хлорамфеникола теряют способность связываться с рибосомами бактерий. У Salmonella typhi этот тип устойчивости впервые стал серьезной проблемой во время эпидемии брюшного тифа 1972—1973 гг. в Мексике и США (Baine et al., 1977). Штаммы, синтезирующие хлорамфеникол-ацетилтрансферазу, все чаще встречаются и среди стафилококков. Распространенность таких штаммов колеблется; в некоторых больницах она достигает 50% и более, особенно среди метициллиноустойчивых стафилококков. Описаны и другие механизмы устойчивости к хлорамфениколу — уменьшение проницаемости бактериальных мембран (у Escherichia coli и Pseudomonas spp.), снижение сродства рибосом к препарату, обусловленное мутацией.
Фармакокинетика
Для приема внутрь прежде предназначались две лекарственные формы хлорамфеникола: первая содержала активное вещество, вторая, суспензия, — неактивный предшественник (хлорамфеникола пальмитат). В настоящее время в США суспензию больше не выпускают. Левомицетин быстро всасывается в ЖКТ; после приема в дозе 1 г максимальная концентрация достигается через 2—3 ч и составляет 10—13 мкг/мл.
Лекарственная форма для парентерального введения содержит водорастворимый предшественник действующего вещества, хлорамфеникола сукцинат. Сывороточные концентрации хлорамфеникола сукцината после в/в и в/м введения одинаковы (Shann et al., 1985). Где именно препарат гидролизуется in vivo, не известно; возможно, в этом процессе участвуют эстеразы печени, почек и легких. Хлорамфеникола сукцинат быстро выводится почками, что снижает биодоступность активного вещества: до 20—30% препарата выводится из организма еще до того, как произойдет гидролиз. При сниженной функции почек (у новорожденных, больных с почечной недостаточностью) сывороточные концентрации хлорамфеникола и хлорамфеникола сукцината увеличиваются (Slaughter et al., 1980; Mulhall et al., 1983). У новорожденных и грудных детей снижена активность эстераз, поэтому максимальная концентрация хлорамфеникола достигается позже (через 4 ч) и большее его количество выводится в виде неактивного предшественника.
Левомицетин хорошо проникает в ткани и биологические жидкости. Он быстро достигает терапевтического уровня в СМЖ, где его концентрация составляет примерно 60% (40—99%) от сывороточной даже в отсутствие воспаления мозговых оболочек (Friedman et al., 1979), и может накапливаться в ткани головного мозга (Kramer et al., 1969). Хлорамфеникол обнаруживают в желчи, молоке, а при введении под конъюнктиву — в водянистой влаге. Препарат легко проходит через плаценту.
Основной путь элиминации хлорамфеникола — метаболизм в печени с образованием неактивного глюкуро-нида. Кроме того, хлорамфеникол и его метаболит выводятся с мочой путем клубочковой фильтрации и канальцевой секреции. В течение 24 ч экскретируются 75—90% принятой внутрь дозы, причем 5—10% приходятся на долю биологически активной формы препарата. При печеночной недостаточности (например, у больных с циррозом печени) печеночный клиренс хлорамфеникола снижен, поэтому дозу препарата уменьшают.
Скорость элиминации хлорамфеникола зависит от концентрации билирубина в плазме (Koup et al., 1979). Т1/2 составляет около 4 ч. Примерно на 50% хлорамфеникол связывается с белками плазмы (у больных с циррозом печени и у новорожденных этот показатель ниже). При почечной недостаточности Т,/2 хлорамфеникола существенно не меняется, поэтому дозу не снижают. При гемодиализе коррекция дозы, как правило, тоже не требуется. Однако больным с циррозом печени, получающим меньшие дозы хлорамфеникола и находящимся на гемодиализе, необходимо дополнительно вводить поддерживающую дозу препарата в конце сеанса гемодиализа. Фармакокинетика хлорамфеникола (в частности, метаболизм) имеет возрастные особенности, поэтому у детей, в первую очередь новорожденных и грудных, необходимо следить за сывороточной концентрацией препарата, особенно при одновременном назначении лекарственных средств, ускоряющих его метаболизм, — фенобарбитала, фенитоина, рифампицина (McCracken et al., 1987).
Применение
Левомицетин назначают только в тех случаях, когда польза от лечения заведомо перевешивает риск побочных эффектов и препарат нельзя заменить другим, столь же эффективным, но более безопасным антибиотиком (Standiford, 2000).
Брюшной тиф
Хотя хлорамфеникол остается важнейшим средством лечения брюшного тифа и других системных инфекций, вызванных сальмонеллами, основными препаратами служат более безопасные цефалоспорины третьего поколения и фторхинолоны. К тому же в развивающихся странах спорадические случаи и эпидемии брюшного тифа бывают вызваны высокоустойчивыми к хлорамфениколу штаммами Salmonella typhi (Miller et al., 1995; Ackers, 2000).
Взрослым хлорамфеникол назначают в дозе 1 г каждые 6 ч в течение 4 нед. Препарат можно назначать как в/в, так и внутрь (в последнем случае улучшение наступает быстрее). При рецидивах обычно эффективен повторный курс лечения, а выделенный штамм, как правило, сохраняет чувствительность к хлорамфениколу in vitro.
Менингит
Хотя хлорамфеникол — преимущественно бактерио-статический антибиотик, на многих возбудителей менингита (например, Haemophilus influenzae) он действует бактерицидно (Rahal and Simberkoff, 1979). При менингите, вызванном Haemophilus influenzae, лечение хлорамфениколом дает отличные результаты: по эффективности препарат не уступает ампициллину или даже превосходит его (Jones and Hanson, 1977; Koskiniemi et al., 1978). Детям хлорамфеникол вводят по 50—75 мг/кг/сут в/в в течение 2 нед; суточную дозу разделяют на 4 введения. В настоящее время при подозрении на менингит, вызванный Haemophilus influenzae, вместо хлорамфеникола применяют менее токсичные цефалоспорины третьего поколения. При менингококко-вом менингите хлорамфеникол назначают только больным с тяжелой аллергией к p-лакгамным антибиотикам; в остальных случаях лучше использовать цефалоспорины третьего поколения (гл. 45). При пневмококковом менингите хлорамфеникол часто малоэффективен, поскольку на некоторые штаммы Streptococcus pneumoniae препарат действует лишь бактериостатически. Более того, пенициллиноустойчивые штаммы Streptococcus pneumoniae часто устойчивы и к хлорамфениколу. В тех редких случаях, когда хлорамфеникол все же используют, через 2—3 сут после начала лечения проводят люмбальную пункцию, чтобы оценить эффективность лечения (Scheld et al., 1979). Иногда требуются высокие дозы хлорамфеникола (100 мг/кг/сут).
Анаэробные инфекции
Левомицетин действует на большинство анаэробных бактерий, включая Bacteroides spp., и потому может применяться при тяжелых инфекциях брюшной полости и абсцессах головного мозга, которые часто бывают вызваны анаэробами. Однако назначают его редко, поскольку существует множество не менее эффективных, но более безопасных антимикробных средств.
Риккетсиозы
Основные препараты при риккетсиозах — тетрациклины. Но у больных с аллергией к тетрациклинам, почечной недостаточностью, у беременных, детей младше 8 лет, а также у некоторых больных с тяжелыми инфекциями, требующими в/в введения антимикробных средств, применяют хлорамфеникол. На ранних стадиях пятнистой лихорадки Скалистых гор эффективны и тетрациклин, и хлорамфеникол (Saah, 1995). )Хлорамфениколом хорошо лечатся сыпной и эндемический блошиный тиф, цуцугамуши, болезнь Брилла, Ку-лихорадка. При всех риккетсиозах используют одинаковую схему лечения. Суточная доза хлорамфеникола для взрослых — 50 мг/кг. По возможности препарат назначают внутрь. Суточная доза для детей — 75 мг/кг (ее разделяют на 3—4 введения).
При назначении хлорамфеникола пальмитата суточная поддерживающая доза может достигать 100 мг/кг при тех же интервалах между введениями. Лечение продолжают до тех пор, пока не улучшится общее состояние, а температура тела не будет оставаться нормальной в течение 24—48 ч. Антимикробная терапия уменьшает продолжительность болезни, а также частоту рецидивов и осложнений.
Бруцеллез
При бруцеллезе хлорамфеникол по эффективности уступает тетрациклинам. Его назначают в тех случаях, когда тетрациклины противопоказаны. Доза составляет 750—1000 мг внутрь каждые 6 ч. Препарат применяют как при острой, так и при хронической форме болезни. При рецидивах курс лечения повторяют.
Побочные эффекты
Большинство токсических эффектов хлорамфеникола обусловлено тем, что он подавляет синтез белка в митохондриях, вероятно, путем угнетения пептидилтрансферазы митохондриальных рибосом. В результате нарушается синтез субъединиц ферментов внутренней мембраны митохондрий — цитохром-с-оксидазы, комплекса III дыхательной цепи (убихинол:цитохром-с-редуктаза), Н+-АТФазы.
Аллергические реакции
Довольно редкий побочный эффект — пятнистая или везикулярная сыпь. Одновременно с сыпью или сама по себе может появиться лихорадка. Изредка возникает отек Квинке.
Реакция Яриша—Герксгеймера
Это осложнение может развиться при сифилисе, бруцеллезе и брюшном тифе вскоре после начала лечения.
Угнетение кроветворения
Это самый серьезный побочный эффект хлорамфеникола. Он бывает двух типов: дозозависимый, проявляющийся анемией, лейкопенией и тромбоцитопенией, и дозонезависимый — идиосинкразическая апластическая анемия. Последняя во многих случаях заканчивается смертельной панцитопенией. Идиосинкразическая апластическая анемия чаще наблюдается при длительном лечении, особенно у больных, получающих хлорамфеникол повторно. Данные наблюдений за однояйцовыми близнецами свидетельствуют о наличии генетической предрасположенности. Хотя частота этого осложнения невелика (1 случай на 30 000 или более курсов лечения), смертность при нем высокая, а у выживших увеличен риск острого лейкоза (Shu et al., 1987). На долю идиосинкразической апластической анемии приходится около 70% всех нарушений кроветворения, вызванных хлорамфениколом. В остальных случаях наблюдается обратимое угнетение кроветворения с анемией, агранулоцитозом и тромбоцитопенией.
Поскольку первоначально апластическая анемия была выявлена только у больных, получавших хлорамфеникол внутрь, предполагалось, что она обусловлена всасыванием в ЖКТ токсичного продукта распада препарата (Holt, 1967). Впоследствии было описано несколько случаев апластической анемии после в/в введения хлорамфеникола. Однако некоторые из этих больных одновременно получали и другие препараты, угнетающие кроветворение (фенилбутазон, глутетимид). Поэтому вопрос о патогенезе данного осложнения остался открытым. Было высказано предположение, что за развитие апластической анемии отвечает нитрогруппа, преобразование которой кишечными бактериями превращает препарат в токсичный метаболит (Jimenez et al., 1987). Но точный биохимический механизм этого превращения пока не установлен.
Риск апластической анемии не должен препятствовать назначению хлорамфеникола в тех случаях, когда польза от лечения заведомо перевешивает вред. Если же эта польза сомнительна или заболевание можно быстро, безопасно и эффективно излечить другими антимикробными средствами, применять хлорамфеникол нельзя.
Обратимое дозозависимое угнетение эритропоэза частый и предсказуемый побочный эффект хлорамфеникола. Вероятно, оно обусловлено нарушением включения железа в гем вследствие подавления синтеза белка в митохондриях (Ward, 1966). Возможны также лейкопения и тромбоцитопения. Частота и тяжесть этих проявлений зависят от дозы. Обратимое угнетение кроветворения развивается при длительном лечении и использовании высоких доз хлорамфеникола, когда сывороточная концентрация препарата составляет 25 мкг/мл и более. Дозозависимое угнетение кроветворения тоже может закончиться смертельной аплазией костного мозга. У некоторых больных по окончании лечения сохраняется стойкое угнетение кроветворения, которое может закончиться острым миелобластным лейкозом.
Угнетение эритропоэза часто развивается при назначении хлорамфеникола на фоне заболеваний печени; у больных с тяжелой почечной недостаточностью этот побочный эффект возникает примерно в трети случаев.
Прочие побочные эффекты
После приема хлорамфеникола внутрь возможны тошнота, рвота, неприятный привкус во рту, понос, раздражение промежности. К редким токсическим эффектам относятся нечеткость зрения и парестезия пальцев. У 3—5% детей с муковисцидозом, получающих хлорамфеникол, развивается нейропатия зрительного нерва, которая характеризуется двусторонней гибелью ганглиозных клеток сетчатки и атрофией нервных волокон (Godel et al., 1980).
У новорожденных, особенно недоношенных, высокие дозы хлорамфеникола могут вызвать серый синдром со смертельным исходом. Симптомы обычно появляются спустя 2—9 сут (в среднем 4 сут) после начала лечения. В первые 24 ч наблюдаются рвота, отказ от еды, учащенное и неритмичное дыхание, вздутие живота, периодический цианоз, жидкий зеленый стул. К концу первых суток все дети находятся в тяжелом состоянии. В последующие 24 ч возникает мышечная гипотония, гипотермия, кожа становится пепельно-серой. Сходный синдром отмечался и у взрослых, случайно получивших избыточную дозу хлорамфеникола. В течение 2 сут от начала заболевания около 40% больных умирают. У выживших симптомы обычно проходят без следа.
В основе серого синдрома лежат два механизма (Craft et al., 1974): 1) неспособность печени метаболизировать хлорамфеникол путем конъюгации с глюкуроновой кислотой, обусловленная недостаточностью глюкуронил-трансфераз у детей первых 3—4 нед жизни, 2) замедленное выведение неконъюгированного препарата почками. При появлении первых симптомов сывороточная концентрация хлорамфеникола обычно превышает 100 мкг/мл, но можетбытьи ниже, до 75 мкг/мл. Сывороточная концентрация глюкуронида хлорамфеникола, несмотря на его медленное образование, тоже повышена из-за функциональной недостаточности канальцевой секреции, путем которой метаболит выводится. У детей младше 2 нед суточная доза хлорамфеникола не должна превышать 25 мг/кг; доношенным детям постарше можно назначать до 50 мг/кг/сут. При назначении хлорамфеникола роженицам в дозе до 1 г каждые 2 ч у новорожденных никаких токсических эффектов не наблюдалось.
При перитонеальном диализе и гемодиализе хлорамфеникол выводится в незначительном количестве. В случае передозировки препарата у грудных детей применяют обменное переливание крови и гемосорбцию с активированным углем (Freundlich et al., 1983).
Угнетение синтеза митохондриальных ферментов может лежать в основе токсического действия хлорамфеникола на органы и ткани, характеризующиеся высокой потребностью в кислороде: описаны случаи энцефалопатии (Levine et al., 1970) и кардиомиопатии (Biancaniello etal., 1981).
Лекарственные взаимодействия
Левомицетин ингибирует микросомальные ферменты печени (Halpert, 1982), замедляя выведение препаратов, метаболизируемых этими ферментами, — варфарина, дикумарола, фенитоина, хлорпропамида, ингибиторов протеазы ВИЧ, рифабутина и толбутамида. Незнание лекарственных взаимодействий хлорамфеникола становилось причиной тяжелых осложнений, в том числе со смертельным исходом.
Другие препараты, в свою очередь, тоже влияют на элиминацию хлорамфеникола. Фенобарбитал (при длительном применении) и рифампицин ускоряют его выведение (вероятно, вследствие индукции микросомальных ферментов печени), в результате чего сывороточная концентрация хлорамфеникола может упасть ниже терапевтического уровня.