Механизм мышечного сокращения
Источник: «Спортивная диагностика»
Автор: профессор В.П. Губа, 2016 год
Содержание
Механика мышечных сокращений
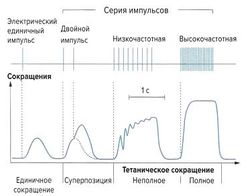
Если мышцу стимулировать коротким электрическим импульсом, спустя небольшой латентный период происходит ее сокращение. Такое сокращение называется «одиночное сокращение мышцы». Одиночное мышечное сокращение длится около 10-50 мс, причем оно достигает максимальной силы через 5-30 мс.
Каждое отдельное мышечное волокно подчиняется закону «все или ничего», т. е. при силе раздражения выше порогового уровня происходит полное сокращение с максимальной для данного волокна силой, а ступенчатое повышение силы сокращения по мере увеличения силы раздражения невозможно. Поскольку смешанная мышца состоит из множества волокон с различным уровнем чувствительности к возбуждению, сокращение всей мышцы может быть ступенчатым в зависимости от силы раздражения, при этом при сильных раздражениях происходит активация глубжележащих мышечных волокон.
Механизм скольжения филаментов
Укорочение мышцы происходит за счет укорочения образующих ее саркомеров, которые, в свою очередь, укорачиваются за счет скольжения относительно друг друга актиновых и миозиновых филаментов (а не укорочения самих белков). Теория скольжения филаментов была предложена учеными Huxley и Hanson (Huxley, 1974; рис. 6). (В 1954 г. две группы исследователей — X. Хаксли с Дж. Хэнсон и А. Хаксли с Р. Нидергерке — сформулировали теорию, объясняющую мышечное сокращение скольжением нитей. Независимо друг от друга они обнаружили, что длина диска А оставалась постоянной в расслабленном и укороченном саркомере. Это позволило предположить, что есть два набора нитей — актиновые и миозиновые, причем одни входят в промежутки между другими, и при изменении длины саркомера эти нити каким-то образом скользят друг по другу. Сейчас эта гипотеза принята почти всеми.)
Актин и миозин — два сократительных белка, которые способны вступать в химическое взаимодействие, приводящее к изменению их взаимного расположения в мышечной клетке. При этом цепочка миозина прикрепляется к актиновой нити с помощью целого ряда особых «головок», каждая из которых сидит на длинной пружинистой «шее». Когда происходит сцепление между миозиновой головкой и актиновой нитью, конформация комплекса этих двух белков изменяется, миозиновые цепочки продвигаются между актиновыми нитями и мышца в целом укорачивается (сокращается). Однако, чтобы химическая связь между головкой миозина и активной нитью образовалась, необходимо подготовить этот процесс, поскольку в спокойном (расслабленном) состоянии мышцы активные зоны белка актина заняты другим белком — тропохмиозином, который не позволяет актину вступить во взаимодействие с миозином. Именно для того, чтобы убрать тропомиозиновый «чехол» с актиновой нити, требуется быстрое выливание ионов кальция из цистерн саркоплазматического ретикулума, что происходит в результате прохождения через мембрану мышечной клетки потенциала действия. Кальций изменяет конформацию молекулы тропомиозина, в результате чего активные зоны молекулы актина открываются для присоединения головок миозина. Само это присоединение осуществляется с помощью так называемых водородных мостиков, которые очень прочно связывают две белковые молекулы — актин и миозин — и способны в таком связанном виде находиться очень долго.
Для отсоединения миозиновой головки от актина необходимо затратить энергию аденозинтрифосфа-та (АТФ), при этом миозин выступает в роли АТФазы (фермента, расщепляющего АТФ). Расщепление АТФ на аденозиндифосфат (АДФ) и неорганический фосфат (Ф) высвобождает энергию, разрушает связь между актином и миозином и возвращает головку миозина в исходное положение. В дальнейшем между актином и миозином могут снова образовываться поперечные связи.
При отсутствии АТФ актин-миозиновые связи не разрушаются. Это и является причиной трупного окоченения (rigor mortis) после смерти, т. к. останавливается выработка АТФ в организме — АТФ предотвращает мышечную ригидность.
Даже при мышечных сокращениях без видимого укорочения (изометрические сокращения, см. выше) активируется цикл формирования поперечных связей, мышца потребляет АТФ и выделяет тепло. Головка миозина многократно присоединяется на одно и то же место связывания актина, и вся система миофиламентов остается неподвижной.
Внимание: Сократительные элементы мышц актин и миозин сами по себе не способны к укорочению. Мышечное укорочение является следствием взаимного скольжения миофиламентов относительно друг друга (механизм скольжения филаментов).
Как же образование поперечных связей (водородных мостиков) переходит в движение? Одиночный саркомер за один цикл укорачивается приблизительно на 5-10 нм, т.е. примерно на 1 % своей общей длины. За счет быстрого повторения цикла поперечных связей возможно укорочение на 0,4 мкм, или 20% своей длины. Поскольку каждая миофибрилла состоит из множества саркомеров и во всех них одновременно (но не синхронно) образуются поперечные связи, суммарно их работа приводит к видимому укорочению всей мышцы. Передача силы этого укорочения происходит через Z-линии миофибрилл, а также концы сухожилий, прикрепленных к костям, в результате чего и возникает движение в суставах, через которые мышцы реализуют перемещение в пространстве частей тела или продвижение всего тела.
Связь между длиной саркомера и силой мышечных сокращений
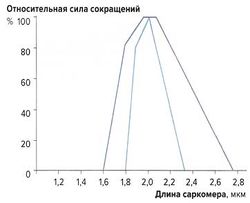
Наибольшую силу сокращений мышечные волокна развивают при длине 2-2,2 мкм. При сильном растяжении или укорочении саркомеров сила сокращений снижается (рис. 7). Эту зависимость можно объяснить механизмом скольжения филаментов: при указанной длине саркомеров наложение миозиновых и актиновых волокон оптимально; при большем укорочении миофиламенты перекрываются слишком сильно, а при растяжении наложение миофиламентов недостаточно для развития достаточной силы сокращений.
Скорость укорочения мышечных волокон
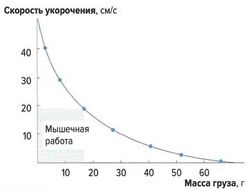
Скорость укорочения мышцы зависит от нагрузки на эту мышцу (закон Хилла, рис. 8). Она максимальна без нагрузки, а при максимальной нагрузке практически равна нулю, что соответствует изометрическому сокращению, при котором мышца развивает силу, не изменяя своей длины.
Влияние растяжения на силу сокращений: кривая растяжения в покое
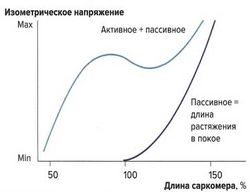
Важным фактором, влияющим на силу сокращений, является величина растяжения мышцы. Тяга за конец мышцы и натяжение мышечных волокон называются пассивным растяжением. Мышца обладает эластическими свойствами, однако в отличие от стальной пружины зависимость напряжения от растяжения не линейна, а образует дугообразную кривую. С увеличением растяжения повышается и напряжение мышцы, но до определенного максимума. Кривая, описывающая эти взаимоотношения, называется кривой растяжения в покое.
Данный физиологический механизм объясняется эластическими элементами мышцы — эластичностью сарколеммы и соединительной ткани, располагающимися параллельно сократительным мышечным волокнам.
Также при растяжении изменяется и наложение друг на друга миофиламентов, однако это не оказывает влияния на кривую растяжения, т. к. в покое не образуются поперечные связи между актином и миозином. Предварительное растяжение (пассивное растяжение) суммируется с силой изометрических сокращений (активная сила сокращений).