Препараты для лечения гриппа
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Препараты, действующие на вирус гриппа
Грипп (от фр. grippe) — острое инфекционное заболевание дыхательных путей, вызываемое вирусом гриппа. Входит в группу острых респираторных вирусных инфекций (ОРВИ). Периодически распространяется в виде эпидемий и пандемий. В настоящее время выявлено более 2000 вариантов вируса гриппа, различающихся между собой антигенным спектром. По оценкам ВОЗ от всех вариантов вируса во время сезонных эпидемий в мире ежегодно умирают от 250 до 500 тыс. человек (большинство из них старше 65 лет), в некоторые годы число смертей может достигать миллиона.
Симптомы гриппа не являются специфическими, то есть без особых лабораторных исследований (выделение вируса из мазков горла, прямая и непрямая иммунофлуоресценция на мазках эпителия слизистой оболочки носа, серологический тест на наличие антигриппозных антител в крови и т. п.) невозможно наверняка отличить грипп от других ОРВИ. На практике диагноз «грипп» устанавливается на основании лишь эпидемических данных, когда наблюдается повышение заболеваемости среди населения данной местности. В отличие от других ОРВИ, для гриппа существует этиотропная терапия, и специфическая профилактика — вакцинация. Читайте также отдельную статью: лечение простуды (ОРВИ).
Клиническая картина гриппа
Инкубационный период может колебаться от нескольких часов до 3-х дней, обычно 1-2 дня. Тяжесть заболевания варьирует от лёгких до тяжёлых гипертоксических форм. Типичная гриппозная инфекция начинается обычно с резкого подъёма температуры тела (до 38 °C — 40 °C), которая сопровождается обычными симптомами интоксикации: ознобом, болями в мышцах, головной болью и чувством усталости. Выделений из носа, как правило, нет, напротив, есть выраженное чувство сухости в носу и глотке. Обычно появляется сухой, напряжённый кашель, сопровождающийся болью за грудиной. При гладком течении эти симптомы сохраняются 3-5 дней, и больной выздоравливает, но несколько дней сохраняется чувство выраженной усталости, особенно у пожилых больных.
Следует сказать, что грипп представляет большую опасность из-за развития серьёзных осложнений (порой смертельно опасных), особенно у детей, пожилых и ослабленных больных.
Диагностика
На данный момент есть возможность точной диагностики гриппа в домашних условиях. Для этого существуют специальные тест-наборы, например, iCHECK – Influenza A+B, которые позволяют выявить антигены вируса гриппа типов А и В в образцах мазков, смывах или выделениях, взятых из носа человека. Средняя стоимость около 350 руб.
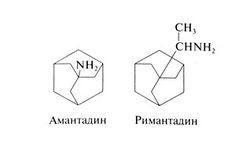
Амантадин и римантадин
Строение и противовирусная активность
Амантадин (1-адаман-танамина гидрохлорид) и его производное римантадин (а-метил-1-адамантанметиламина гидрохлорид) — представляют собой трициклические амины необычного строения. Их структурные формулы следующие:
Оба препарата уже в низких концентрациях избирательно подавляют репродукцию вируса гриппа A (Hayden and Aoki, 1999). Концентрации, в которых эти препараты действуют на вирусы гриппа А, в зависимости от штамма и метода анализа колеблются от 0,03 до 1 мкг/мл. Обычно римантадин в 4—10 раз активнее амантадина. В концентрациях > 10 мкг/мл оба препарата подавляют репродукцию и других вирусов с внешней оболочкой, но на практике такие концентрации недостижимы из-за цитотоксичности. В концентрациях 1—2,5 мкг/мл римантадин in vitro подавляет размножение Trypanosoma brucei — возбудителя африканского трипаносомоза (сонной болезни) (Kelly et al., 1999). In vitro ни амантадин, ни римантадин не способны подавить ферменты вируса гепатита С и трансляцию его мРНК, происходящую при участии внутреннего сайта связывания рибосомы (IRES) (Jubin et al., 2000).
Механизм действия и устойчивость
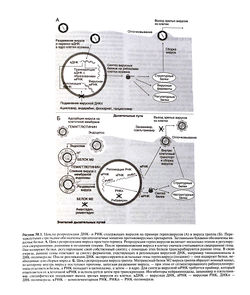
Противовирусная активность амантадина и римантадина опосредована двумя механизмами (Hayden and Aoki, 1999). Во-первых, эти препараты действуют на раннем этапе вирусной репродукции, подавляя раздевание вируса (рис. 50.1, Б). Во-вторых, у некоторых штаммов они могут действовать и на позднем этапе (сборке вируса) — возможно, за счет изменения процессинга гемагглютинина. Первичная мишень для этих препаратов — это белок М2 вируса гриппа А, формирующий ионный канал в его оболочке. При подавлении функции этого белка протоны из эндосом не могут попасть внутрь вируса, в результате чего блокируется необходимый этап диссоциации рибонуклеопротеида и выхода вируса в цитоплазму.
Среди диких штаммов устойчивость к амантадину и риман-тадину встречается редко (< 1%) (Ziegler et al., 1999). Но в перевиваемой культуре вируса in vitro она, напротив, возникает легко. Устойчивые штаммы выделены и от больных, принимавших эти препараты. Установлено, что замена одной аминокислоты в трансмембранном участке белка М2 приводит к возрастанию устойчивости более чем на 2 порядка (Hayden, 1996). Чувствительность и устойчивость вирусов к амантадину и римантадину перекрестная.
Фармакокинетика
Оба препарата хорошо всасываются при приеме внутрь (табл. 50.4) (Aoki and Sitar, 1988; Wills et al., 1987).
У здоровых молодых людей при приеме амантадина по 100 мг I раза в сутки максимальная сывороточная концентрация препарата составляет 0,5—0,8 мкг/мл. Прием римантадина в сравнимых дозах дает максимальную и минимальную сывороточные концентрации 0,4—0,5 и 0,2—0,4 мкг/мл соответственно. Пожилым для достижения минимальной сывороточной концентрации 0,3 мкг/мл требуется вдвое меньшая доза амантадина в пересчете на килограмм веса (Aoki and Sitar, 1988). Кроме того, сывороточная концентрация римантадина у них в 2 раза выше, чем у здоровых взрослых.
Для обоих препаратов характерен очень большой объем распределения. Концентрации амантадина в носовой слизи и в слюне почти такие же, как в плазме. Амантадин проникает в молоко. Концентрация римантадина в носовой слизи в среднем на 50% превышает сывороточную.
Большая часть амантадина выводится с мочой в неизмененном виде путем клубочковой фильтрации и, возможно, канальцевой секреции. Т1/2 у молодых людей составляет 12—18 ч. Поскольку амантадин выводится в основном почками, у пожилых Т 1/2 возрастает почти вдвое, а при почечной недостаточности — еще больше (Horadam et al., 1981). Поэтому дозу амантадина рекомендуют уменьшать даже при незначительном нарушении функции почек. Напротив, римантадин активно метаболизируется в печени путем гидроксилирования и конъюгации (в том числе с глюкуроновой кислотой). Его Т1/2 составляет в среднем 24—36 ч; на 60—90% он выводится с мочой в виде метаболитов (Wills etal., 1987). Почечный клиренс неизмененного римантадина сходен с клиренсом креатинина.
Таблица 50.4. Фармакологические свойства препаратов, действующих на вирус гриппа
|
Показатель |
Амантадин |
Римантадин |
Занамивир |
Озельтамивир |
|
Спектр действия (тип вируса гриппа) |
А |
А |
А, В |
А, В |
|
Путь введения и лекарственная форма |
Внутрь (таблетки, капсулы, сироп) |
Внутрь (таблетки, сироп) |
Ингаляции(порошок), В/в |
Внутрь (капсулы сироп) |
|
Биодоступность при приеме внутрь, % |
50-90 |
>90 |
<56 |
80 |
|
Влияние приема пищи на ПФК |
Незначительно |
Незначительно |
— |
Незначительно |
|
Т1/2 в плазме, ч |
12-18 |
24-36 |
2,5-5 |
6-10’ |
|
Связывание с белками плазмы, % |
67 |
40 |
<10 |
3 |
|
Метаболизм |
<10% |
75% |
Незначителен |
Незначителен |
|
Выведение почками (в не измененном виде), % |
50-90 |
«25 |
100 |
95 |
|
Коррекция дозы |
СКФ<80 Возраст >65 лет |
СКФ<10 Возраст >65 лет |
Не требуется |
СКФ<30 |
Побочные эффекты
Чаще всего при приеме обоих препаратов отмечаются незначительные дозозависимые нарушения со стороны ЖКТ (потеря аппетита и тошнота) и ЦНС (раздражительность, дурнота, нарушение концентрации внимания, бессонница) (Hayden and Aoki, 1999). Центральные побочные эффекты возникают в 5—33% случаев при приеме амантадина в дозе 200 мг/сут и намного реже — при приеме римантадина. Из-за снижения функции почек пожилым людям назначают не более 100 мг амантадина в сутки. Однако даже при такой низкой дозе у 20—40% ослабленных пожилых людей возникают побочные эффекты. Прием 100 мг римантадина в сутки такие больные переносят намного лучше (Keyser et al., 2000).
При высоких сывороточных концентрациях (1—5 мкг/мл) амантадин может оказывать значительное нейротоксическое действие (спутанность сознания, галлюцинации, эпилептические припадки, кома) и вызывать нарушения ритма сердца. Прием амантадина и, возможно, римантадина может спровоцировать припадки у больных эпилепсией и вызвать обострение психических расстройств. Выявлено тератогенное действие амантадина у животных. Безопасность обоих препаратов при беременности не установлена.
По-видимому, нейротоксическое действие амантадина усиливается (особенно у пожилых людей) при одновременном приеме с Н1блокаторами, М-холиноблокаторами или психотропными средствами.
Применение
Амантадин и римантадин эффективны для профилактики и лечения гриппа А. Прием этих препаратов во время эпидемии гриппа (200 мг/сут в 1—2 приема для молодых людей) позволяет избежать инфекции в 70— 90% случаев (Hayden and Aoki, 1999). Профилактика в дозе 100 мг/суг, видимо, тоже эффективна, но переносится лучше. Оба препарата с успехом применяли для лечения и профилактики во время эпидемий и при больничных вспышках гриппа. Профилактика амантадином и римантадином помогает и при непосредственном контакте с вирусом, например когда в семье заболевают дети (если только больной ребенок не лечится теми же препаратами — в противном случае повышается вероятность появления и передачи устойчивых штаммов).
Больным из группы риска, которым вакцинация противопоказана, принимать амантадин или римантадин рекомендуется все время, пока сохраняется риск заражения (обычно в течение 4—8 нед с первого случая гриппа в коллективе или населенном пункте), так как уже через несколько дней после отмены препаратов их защитное действие исчезает. Прием препаратов можно начать одновременное вакцинацией и отменить с появлением иммунного ответа (через 2 нед).
У взрослых с неосложненным гриппом А лечение амантадином и римантадином (200 мг/сут в 1—2 приема в течение 5 сут), начатое на ранней стадии заболевания, на 1—2 сут уменьшает длительность лихорадки и обших симптомов, ускоряет выздоровление и иногда сокращает период выделения вируса (Hayden and Aoki, 1999). У детей, принимающих римантадин, уже в первые 2 сут лечения улучшается обшее состояние и уменьшается титр вируса, но период выделения вируса при этом удлиняется. Оптимальные доза и продолжительность приема препаратов для детей не установлены. Не ясно также, уменьшают ли римантадин и амантадин вероятность осложнений у больных из группы риска, и есть ли смысл принимать эти препараты при уже развившихся легочных осложнениях.
Примерно у 30% детей и взрослых, принимавших амантадин или римантадин, к 5-му дню лечения обнаруживались устойчивые штаммы вируса (Hayden, 1996). Такие штаммы часто появляются и при приеме этих препаратов на фоне иммунодефицита (Englund et al., 1998). Описаны случаи передачи устойчивых штаммов от уже заболевших членов семьи или коллектива к здоровым. При этом первые получали римантадин и амантадин в качестве лечения, а вторые — для профилактики. Устойчивые штаммы вируса вызывают типичную для гриппа картину заболевания.
Амантадин и римантадин применяли в виде монотерапии и в комбинации с интерферонами и другими препаратами при хроническом гепатите С, но насколько эффективно такое лечение, пока не ясно (Younossi and Per-rillo, 1999). Помимо действия на вирусы гриппа амантадин обладает антипаркинсоническим эффектом.
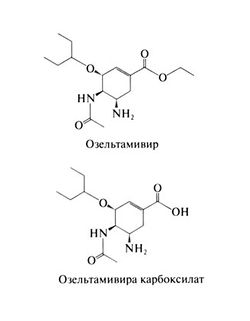
Озельтамивир
Строение и противовирусная активность
Озельтамивир (озельта-мивира фосфат) представляет собой неактивный предшественник, который в организме превращается в активный метаболит — (3R, 4R, 55)-4-ацетиламино-5-амино-3( 1 -этилоксипропил)-1 -циклогексен-1 -карбоновую кислоту, или озельтамивира карбоксилат. Как видно из приведенных ниже структурных формул, озельтамивир представляет собой фосфат этилового эфира озельтамивира карбоксилата. Озельтамивир — это переходный аналог сиаловой кислоты и мощный избирательный ингибитор нейраминидазы вирусов гриппа А и В (Kim et al., 1997). Сходный по спектру действия и активности с занамивиром (см. ниже), озельтамивир тем не менее действует на некоторые из устойчивых к занамивиру штаммов (Mendel et al., 1998). Кроме того, он подавляет штаммы вируса гриппа А, устойчивые к амантадину и римантадину.
Механизм действия и устойчивость
Нейраминидаза вируса гриппа отщепляет концевые остатки сиаловых кислот и тем самьш разрушает рецепторы, находящиеся на поверхности клеток d новых вирусов, а также в секретах дыхательных путей (к этиv рецепторам с помошью гемагглютинина прикрепляются вирусы) (Gubareva et al., 2000). Таким образом, нейраминидаза способствует выходу вируса из клетки по окончании репродукции. Озельтамивира карбоксилат вызывает конформационные изменения в активном центре нейраминидазы и подавляет ее функцию. В результате происходит агрегация вирусов на поверхности клетки и замедляется их распространение в дыхательных путях.
In vitro выделены штаммы вируса гриппа А, устойчивые к озельтамивира карбоксилату за счет мутаций гемагглютинина «ли нейраминидазы (McKimm-Breschkin, 2000). In vivo устойчивость чаще всего связана с заменами 292-й и 274-й аминокислот в нейраминидазе; при этом снижаются патогенность и вирулентность штамма. Устойчивые штаммы обнаруживают у 1—2% больных, принимающих озельтамивир внутрь. Устойчивые к озельтамивира карбоксилату штаммы вируса гриппа В на сегодняшний день не описаны.
фармакокинетика
При приеме внутрь озельтамивир быстро всасывается (табл. 50.4) и подвергается ферментативному гидролизу в ЖКТ и печени с образованием активного озельтамивира карбоксилата. Сывороточная концентрация исходного вещества составляет лишь 3—5% сывороточной концентрации озельтамивира карбоксилата. При приеме 75 мг озельтамивира его максимальная сывороточная концентрация составляет 0,07 мкг/мл, тогда как для озельтамивира карбоксилата она достигает 0,35 мкг/мл. Биодоступность озельтамивира карбоксилата — около 80% (Не etal., 1999). Сывороточная концентрация его становится максимальной через 2,5—5 ч. Прием пищи не влияет на биодоступность озельтамивира карбоксилата, но снижает риск побочного действия на ЖКТ. Объем распределения озельтамивира карбоксилата приближается к общему объему жидкости в организме. У животных концентрация озельтамивира карбоксилата в жидкости, полученной при бронхоальвеолярном лаваже, примерно такая же, как в плазме. Т1/2 озельтамивира и его активного метаболита составляет 1—3 и 6—10 ч соответственно. Оба соединения выводятся главным образом почками в неизмененном виде. При приеме озельтамивира вместе с пробенецидом Т1/2 озельтамивира карбоксилата возрастает вдвое, что говорит о роли канальцевой системы переноса органических анионов в его выведении.
Побочные эффекты
При приеме внутрь озельтамивир может вызывать тошноту и неприятные ощущения в животе, реже — рвоту (по-видимому, из-за раздражения слизистой). Желудочно-кишечные нарушения (от легких до умеренных) обычно проходят через 1—2 сут, даже если больной продолжает принимать озельтамивир. Избежать их помогает прием препарата во время еды. Побочное действие на ЖКТ встречается у 10—15% больных при лечении гриппа и менее чем у 5% — при приеме озельтамивира для профилактики. Поданным одного из исследований, при профилактическом приеме озельтамивира у пожилых людей отмечались частые головные боли.
In vitro и озельтамивира карбоксилат, и его предшественник взаимодействуют с микросомальными ферментами печени. С белками плазмы оба вещества связываются слабо. Клинически значимых взаимодействий озельтамивира и озельтамивира карбоксилата с другими лекарственными средствами до сих пор не выявлено. У мышей при приеме озельтамивира в больших дозах озельтамивира карбоксилат может в виде кристаллов оседать в почечных канальцах, а также вызывать задержку родов, но клиническое значение этих эффектов не установлено.
Применение
Озельтамивир применяют для лечения и профилактики гриппа. При гриппе ранее здоровым взрослым озельтамивир назначают по 75 мг 2 раза в сутки, детям от 1 года до 12 лет — по 2 мг/кг 2 раза в сутки в течение 5 сут. При этом выздоровление наступает на 1—2 сут раньше и на 40—50% снижается частота бактериальных осложнений (Treanoretal., 2000; Whitley etal., 2001). Изучается эффективность препарата у пожилых и больных из группы риска (с заболеваниями сердечно-сосудистой и дыхательной систем). Профилактический прием озельтамивира в период эпидемии (75 мг 1 раз в сутки) снижает заболеваемость как среди невакцинированных работающих взрослых, так и среди получивших противогриппозную вакцину обитателей домов престарелых (Hayden et al., 1999; Peters et al., 1999). Короткие курсы озельтамивира (7 сут) защищают от заражения гриппом в тех случаях, когда в семье уже есть заболевшие.
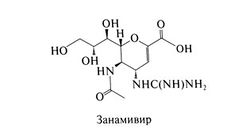
Занамивир
Строение и противовирусная активность
Занамивир, или 4-гуанидино-2,4-дидезокси-2,3-дегидро-N-ацетилнейраминовая кислота, — это аналог сиаловой кислоты и мощный избирательный ингибитор нейраминидазы вирусов гриппа А и В, конкурирующий с этим ферментом за общий субстрат — сиаловую кислоту (von Itzstein et al., 1993). В зависимости от штамма вируса занамивир подавляет нейраминидазу в концентрациях примерно 0,2—3 нг/мл (Woods et al., 1993). Концентрации же, в которых он действует на нейраминидазы других патогенных микроорганизмов и нейраминидазы млекопитающих, на 6 порядков выше. In vitro занамивир подавляет репродукцию вирусов гриппа А и В, в том числе штаммов, устойчивых к амантадину и ри-мантадину. Опыты на животных показали, что занамивир эффективен и при местном применении. Структурная формула занамивира следующая:
Механизм действия и устойчивость
Как и озельтамивир, занамивир подавляет вирусную нейраминидазу, вызывая агрегацию вирусов на поверхности клетки и тем самым замедляя распространение вируса в дыхательных путях (Gubareva et al., 2000).
In vitro устойчивость вируса гриппа к занамивиру обусловлена мутациями вирусного гемагглютинина или нейраминидазы (McKimm-Breschkin, 2000). Мутации гемагглютинина обычно локализуются в участке гена, отвечающем за связывание с рецептором, или вблизи этого участка. Поскольку гемагглютинин необходим для прикрепления вирусов к клеточной мембране, мутантные штаммы с поврежденным гемагглютинином не могут удержаться на поверхности клетки. Поэтому для выхода из клетки они не нуждаются в нейраминидазе (которая способствует отделению вирусов от клеточной мембраны) и in vitro в меньшей степени, чем дикие штаммы, зависят от ее активности. Тем не менее мутантные штаммы могут сохранять чувствительность к занамивиру in vivo (Woods et al., 1993). На штаммы с мутациями гемагглютинина не действуют и другие ингибиторы нейраминидазы. Мутации затрагивают активный центр нейраминидазы, что снижает ее сродство к занамивиру, но в то же время уменьшает активность и стабильность фермента. У животных устойчивые к занамивиру штаммы иногда обладают и сниженной вирулентностью. Возникновение устойчивых штаммов при лечении занамивиром больных с нормальным иммунитетом не описано. Устойчивый штамм вируса гриппа В с мутациями генов и гемагглютинина, и нейраминидазы был выделен от ребенка с ослабленным иммунитетом после ингаляций занамивира (Gubareva et al., 1998).
Фармакокинетика
Биодоступность занамивира при приеме внутрь невелика (< 5%; табл. 50.4), поэтому в большинстве клинических испытаний занамивир вводили путем закапывания в нос или ингаляций. В ингаляторе занамивир находится в виде смешанного с носителем (лактозой) порошка. В дыхательные пути порошок поступает при вдохе, поэтому, прежде чем начинать лечение, нужно убедиться, что больной правильно выполняет ингаляцию. При каждой ингаляции около 15% дозы оседает в трахее и бронхах и около 80% — в ротоглотке (Cass et al.,1999). В целом биодоступность занамивира при ингаляциях — менее 20%, а сывороточная концентрация при ингаляции 10 мг препарата составляет около 35—100 нг/мл как у детей, так и у взрослых (Penget al., 2000а). У здоровых добровольцев медиана концентрации занамивира в мокроте (полученной методом стимуляции) через 6 ч после однократной ингаляции 10 мг препарата составляет 1336 нг/мл, а через 24 ч — 47 нг/мл (Peng et al., 2000b). Средний в плазме при ингаляции около 2,5—5 ч, а при в/в введении — 1,7 ч. Более 90% дозы выводится с мочой в неизмененном виде.
Побочные эффекты
Амбулаторные больные (и взрослые, и дети) обычно хорошо переносят занамивир для местного применения. С другой стороны, описан бронхоспазм с удушьем и экспираторной одышкой в ответ на ингаляцию занамивира у больных гриппом, не страдающих заболеваниями дыхательных путей. У лиц же, страдающих бронхиальной астмой и ХОЗЛ, возможно резкое ухудшение функции внешнего дыхания, вплоть до летального исхода. Однако в отсутствие гриппа ингаляции занамивира в течение 2 нед не вызывали у добровольцев с легкой или умеренной бронхиальной астмой значительных изменений функции внешнего дыхания и реактивности бронхов (Cass et all., 2000). Переносимость занамивира при более тяжелых легочных заболеваниях и при интубации трахеи не изучена. Назначение занамивира больным с заболеваниями дыхательных путей допустимо только при постоянном наблюдении и наличии быстродействующих бронходилататоров. При тяжелых побочных эффектах лечение следует прекратить.
В доклинических испытаниях у занамивира не обнаружено мутагенного, тератогенного или канцерогенного действия. Не описано и клинически значимых лекарственных взаимодействий. Эффективность противогриппозной вакцины при приеме занамивира не уменьшается.
Применение
Ингаляции занамивира эффективны для лечения и профилактики гриппа. При назначении ингаляций занамивира амбулаторным больным (детям старше 5 лет и взрослым) в начале заболевания (по 10 мг 2 раза в сутки в течение 5 сут) выздоровление наступало на 1—3 сут раньше (Hayden etal., 1997; Hedrick etal., 2000). У больных гриппом, не страдающих хроническими заболеваниями, на фоне ингаляций занамивира на 40% реже развивались бактериальные пневмония и бронхит. Ингаляционное (но не интраназальное) введение занамивира 1 раз в сутки весьма эффективно для профилактики внебольничного гриппа (Monto et al., 1999). Чтобы предупредить распространение инфекции в семье, достаточно делать такие ингаляции в течение 10 сут (Hayden et al., 2000). У лабораторных животных грипп, вызванный вирусами, циркулирующими среди населения, хорошо излечивался в/в введением занамивира, но эффективность препарата при в/в введении больным людям не изучалась.