Механизмы действия антидепрессантов
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Механизмы действия антидепрессантов
Трициклические антидепрессанты и другие ингибиторы обратного захвата норадреналина
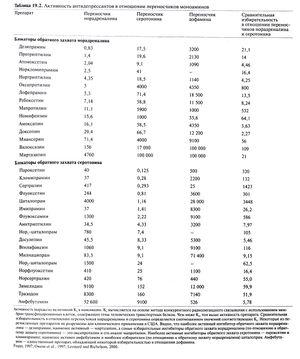
Отметим прежде всего, что наши знания о механизмах действия антидепрессантов ограничены, а последовательная интерпретация известных фактов затруднена из-за отсутствия убедительной психобиологической теории происхождения аффективных расстройств. Трициклические антидепрессанты, по структуре боковой цепи представляющие собой вторичные амины, и N-деметилированные (нор-) метаболиты третичных аминов (например, амоксапин, дезипрамин, мапротилин, норкломипрамин, нордоксепин, нортриптилин) относительно избирательно подавляют обратный захват норадреналина. Большинство трициклических антидепрессантов из группы третичных аминов блокируют также обратный захват серотонина. Подавление антидепрессантами обратного захвата аминов развивается сразу же после начала приема препарата и сохраняется вплоть до его отмены. Важно, что механизм действия трициклических антидепрессантов включает помимо первичного эффекта (блокада обратного захвата норадреналина и, в большей или меньшей степени, серотонина; табл. 19.2) ряд сложных вторичных компенсаторных реакций (Barker and Blakely, 1995; Beasley etal., 1992; Heningerand Chamey, 1987; Leonard and Richelson, 2000; Potter et al., 1998; Wamsley et al., 1987). Эти реакции будут рассмотрены ниже.
Судя по всему, избирательные ингибиторы обратного захвата норадреналина (например, ребоксетин) обладают примерно таким же спектром действия, как и более ранние средства, также ингибирующие этот захват (например, дезипрамин) (Delgado and Michaels, 1999). Среди трициклических антидепрессантов тримипрамин уникален в том отношении, что он не оказывает сколько-нибудь значительного влияния на транспорт моноаминов (табл. 19.2). Механизм его действия остается неизвестным.
Трициклические и другие антидепрессанты, подавляющие обратный захват норадреналина, не влияют на транспорт дофамина (табл. 19.2). В этом отношении они отличаются от психостимуляторов, таких, как кокаин, метилфенидат и амфетамины . Тем не менее упомянутые антидепрессанты могут оказывать непрямое облегчающее действие на дофаминергическую передачу, повышая концентрацию норадреналина в области дофаминергических окончаний — прежде всего в коре головного мозга, где плотность адренергических окончаний выше, чем дофаминергических. Кроме того, трициклические антидепрессанты могут вызывать десенситизацию D2-ауторецепторов путем непрямого облегчения дофаминергической передачи в переднем мозге. Этот эффект способствует повышению настроения и уменьшению заторможенности (Potter et al., 1998).
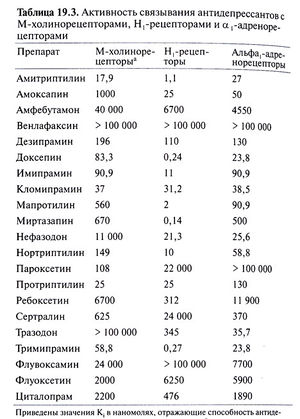
Помимо влияния на обратный захват медиаторов трициклические антидепрессанты могут взаимодействовать с адренорецепторами (табл. 19.3). Реакция на повышенную концентрацию норадреналина в синаптической щели или вблизи нее во многом определяется наличием или отсутствием такого взаимодействия. Большинство трициклических антидепрессантов обладают по крайней мере умеренной активностью в отношении а1-адренорецепторов, значительно меньшей — в отношении а2-адренорецепторов и почти не действуют на β-адренорецепторы. К а2-адренорецепторам относятся, в частности, тормозные пресинаптические ауторецепторы на окончаниях нейронов голубоватого места, медиатором которых служит норадреналин. Волокна от этих нейронов идут в средний и передний мозг, а также к холинергическим преганглионарным симпатическим нейронам спинного мозга. Активация пресинаптических а2-адренорецепторов сопровождается снижением активности тирозингидроксилазы — фермента, катализирующего лимитирующую реакцию синтеза норадреналина. Возможно, это обусловлено подавлением цАМФ-зависимого фосфорилирования данного фермента. Кроме того, активация этих рецепторов снижает высвобождение медиатора посредством других, не совсем ясных механизмов. По-видимому, они включают подавление потенциалзависимого кальциевого тока и открывание связанных с G-белком калиевых каналов (Foote and Aston-Jones, 1995).
Механизмы отрицательной обратной связи, опосредованной а2-адренорецепторами, включаются вскоре после начала приема антидепрессанта. Ограничивая конентрацию норадреналина в синаптической щели, эти механизмы препятствуют чрезмерному усилению адренергической передачи. Однако на фоне длительного приема препарата они постепенно ослабевают. Возможно, это происходит в результате десенситизации а2-адренорецепторов, связанной с продолжительным воздействием норадреналина. Другое возможное объяснение — аллостерическое ингибирование переносчика норадреналина вследствие длительного его связывания с субстратом (подобный эффект описан для переносчиков серотонина в серотонинергических нейронах; Chaputetal., 1991). Через несколько суток или недель эти адаптивные механизмы приводят к тому, что выработка норадреналина в пресинаптических окончаниях и его высвобождение возвращаются к исходному уровню или даже превышают его (Baldessarini, 1989; Heninger and Chamey, 1987; Foote and Aston-Jones, 1995; Potter et al., 1998). Однако длительное лечение может привести к снижению экспрессии гена тирозингидроксилазы (Nestleretal., 1990).
Плотность функционально активных постсинаптических β-адренорецепторов также постепенно снижается на протяжении нескольких недель. Эта реакция отмечается при лечении всеми типами антидепрессантов (трициклическими антидепрессантами, некоторыми ингибиторами обратного захвата серотонина, ингибиторами МАО), а также, как показали опыты на животных, при электросудорожной терапии (Sulser and Mobley, 1980). Сочетание ингибитора обратного захвата серотонина и трициклического антидепрессанта, по-видимому, ускоряет снижение плотности β-адренорецепторов. Фармакодинамические и фармакокинетические основы этого явления не изучены, а его клиническая значимость не доказана (Nelson et al., 1991). Снижение активации β-адренорецепторов вряд ли вносит непосредственный вклад в антидепрессивный эффект — β-блокаторы, напротив, могут вызвать депрессию или ухудшить ее течение у предрасположенных лиц. Тем не менее снижение опосредованных β-адренорецепторами тормозных влияний на серотонинергические нейроны может увеличивать высвобождение серотонина и тем самым косвенно усиливать антидепрессивное действие (гл. 10; Leonard and Richelson, 2000; Wamsley et al., 1987).
В начале лечения, по-видимому, происходит частичная блокада постсинаптических а1-адренорецепторов. Это может быть одной из причин артериальной гипотонии, развивающейся при первых приемах многих трициклических антидепрессантов. Однако на протяжении нескольких последующих недель лечения, по мере постепенного развития антидепрессивного действия, большая часть этих рецепторов все же остаются свободными, а их чувствительность к норадреналину может возрасти. Таким образом, к тому моменту, когда состояние больного улучшается, обратный захват медиатора остается заблокированным, выработка и высвобождение норадреналина из пресинаптических окончаний возвращаются к исходному уровню или превышают его, а активация постсинаптических а1-адренорецепторов становится вполне достаточной для того, чтобы обеспечить столь важные для борьбы с депрессией общие функциональные резервы (Baldessarini, 1989).
Развитию антидепрессивного эффекта могут способствовать и некоторые дополнительные механизмы. К ним относится непрямое облегчение серотонинергической и, возможно, дофаминергической передачи вследствие активации возбуждающих a1-адренорецепторов других моноаминергических нейронов и десенситизации тормозных а2-адренорецепторов и D2-ауторецепторов. Усиленное высвобождение серотонина и дофамина может, в свою очередь, приводить ко вторичному снижению плотности 5-НТ1-ауторецепторов, постсинаптических 5-НТ2-рецепторов, а также, возможно, D2-aутopeцепторов и постсинаптических D2-рецепторов (Leonard and Richelson, 2000).
В ответ на длительный прием трициклических антидепрессантов наблюдаются и другие адаптивные сдвиги. Они включают изменение чувствительности М-холинорецепторов, а также снижение плотности рецепторов ГАМКВ и, возможно, глутаматных NMDA-рецепторов (Kitamura et al., 1991; Leonard and Richelson, 2000). Кроме того, в некоторых клетках отмечается увеличение выработки цАМФ и активности протеинкиназ, в том числе взаимодействующих с белками цитоскелета и другими структурными белками, способными, по-видимому, влиять на рост и ветвление нейронов (Racagni et al., 1991; Wong et al., 1991). Изменяется активность внутриядерных факторов транскрипции, включая белок CREB (белок, связывающийся с цАМФ-чувствительным регуляторным элементом) и мозговой нейротрофический фактор (BDNF) (Duman et al., 1997; Siuciak et al., 1997). Другие изменения, возможно, связаны с непрямыми последствиями лечения антидепрессантами или отражают выздоровление от депрессии. Они включают нормализацию выработки глюкокортикоидов и чувствительности глюкокортикоидных рецепторов, а также сдвиги в образовании простагландинов и цитокинов и в активности лимфоцитов (Kitayama et al., 1988; Leonard and Richelson, 2000).
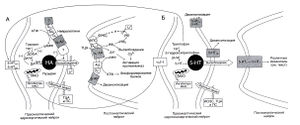
Физиологические и психические последствия многочисленных клеточных и молекулярных процессов, развивающихся при длительном лечении антидепрессантами, остаются неясными. Тем не менее само наличие таких процессов лишний раз говорит о том, что продолжительный прием психотропных веществ приводит к сложной цепи адаптивных реакций. В частности, действие трициклических антидепрессантов не сводится лишь к блокаде обратного захвата норадреналина, хотя именно этот эффект, несомненно, и запускает упомянутые вторичные процессы (Duman et al., 1997; Hyman and Nestler, 1996; Leonard and Richelson, 2000). Влияние антидепрессантов на моноаминергическую передачу отображено на рис. 19.1. Ингибиторы обратного захвата серотонина. Отсроченные и непрямые эффекты этих широко распространенных средств изучены гораздо меньше, чем соответствующие эффекты трициклических антидепрессантов. Вместе с тем изменения, развивающиеся под действием препаратов этих двух групп соответственно в серотонинергической и адренергической передаче, имеют много общего. Блокада обратного захвата серотонина развивается сразу же после начала приема ингибитора и сохраняется вплоть до его отмены, что приводит к сложной цепи вторичных реакций; как уже говорилось, точно так же действуют трициклические антидепрессанты на адренергическую передачу.
Увеличение концентрации серотонина в синаптической щели сопровождается повышенной активацией многочисленных типов постсинаптических 5-НТ-рецепторов (гл. 11; Azmitia and Whitaker-Azmitia, 1995). Стимуляция 5-НТ3-рецепторов, по-видимому, играет важную роль в развитии присущих этому классу препаратов побочных эффектов, включая желудочно-кишечные (тошнота, рвота) и половые (нарушения оргазма) расстройства. Кроме того, стимуляция 5-НТ2С-рецепторов может вносить вклад в развитие беспокойства и возбуждения, иногда вызываемых ингибиторами обратного захвата серотонина.
Еще одно важное сходство в действии ингибиторов обратного захвата серотонина и норадреналина заключается в быстром включении механизмов отрицательной обратной связи (Azmitia and Whitaker-Azmitia, 1995). Активация серотониновых ауторецепторов серотонинергических нейронов ядер шва (5-НТ,А и, возможно, 5-НТ7 — нателах и дендритах, 5-НТ1D — на окончаниях аксонов) приводит к торможению этих нейронов. Один из механизмов такого торможения заключается в снижении активности триптофангидроксилазы (видимо, путем уменьшения степени ее фосфорилирования, как и в случае ингибирования тирозингидроксилазы при активации пресинаптических а2-адренорецепторов; см. выше) и уменьшении высвобождения серотонина. Через несколько недель после начала лечения происходит постепенное снижение чувствительности и плотности ауторецепторов (особенно 5-НТ1D-рецепторов). В результате синтез и высвобождение серотонина возвращаются к исходному уровню или даже превышают его (Blier et al., 1990; Chaput et al., 1991; Tome et al., 1997). Ко вторичным эффектам относятся также постепенное снижение плотности постсинаптических 5-НТ2А-рецепторов (что может способствовать развитию антидепрессивного эффекта) и изменения активности других нейронов посредством активации серотониновых гетерорецепторов. Многие другие постсинаптические 5-НТ-рецепторы, по-видимому, остаются незатронутыми, что делает возможным облегчение серотонинергической передачи и вносит определенный вклад в антидепрессивный и анксиолитический эффекты ингибиторов обратного захвата серотонина.
Наконец, продолжительное лечение ингибиторами обратного захвата серотонина (как и ингибиторами обратного захвата норадреналина) запускает ряд отсроченных механизмов. К этим механизмам относится непрямое усиление адренергической передачи посредством ослабления тонических тормозных влияний, опосредованных активацией 5-НТ2А-гетерорецепторов. Наконец, и те, и другие препараты вызывают сходные изменения на клеточном, втом числе ядерном, уровне. Они включают увеличение образования цАМФ, белка CREB и мозгового нейротрофического фактора (Azmitia and Whitaker-Az-mitia, 1995; Hyman and Nestler, 1996).
Описание к рис. 19.1. Точки приложения антидепрессантов. А. В расширениях, расположенных по ходу конечных разветвлений адренергических волокон, идущих из ствола в передний мозг, тирозингидроксипаза окисляет тирозин до ДОФА. Последний декарбоксилируется декарбоксилазой ароматических L-аминокислот с образованием дофамина. Дофамин сохраняется в пузырьках, где его боковая цепь окисляется дофамин-р-монооксигеназой (дофамин-Р-гидроксилазой) с образованием норадреналина. Вход в волокно Са2 в ответ на деполяризацию приводит к высвобождению норадреналина (этот механизм подавляется литием). Норадреналин взаимодействует с постсинаптическими а- и р-адрено-рецепторами, а также с пресинаптическими а2-ауторецепторами. Активация последних приводит к подавлению высвобождения норадреналина, преимущественно посредством уменьшения кальциевого и усиления калиевого тока. Инактивация норадреналина осуществляется в основном путем его активного транспорта (обратного захвата) в преси-наптические окончания (этот транспорт подавляется большинством трициклических антидепрессантов и психостимуляторов) с последующим дезаминированием митохондриальной МАО (блокируемой ингибиторами МАО). Подавление трициклическими антидепрессантами обратного захвата норадреналина первоначально приводит к опосредованному а2-ауторецепторами снижению электрической и метаболической активности пресинаптических нейронов и уменьшению высвобождения норадреналина. Однако постепенно а2-аугорецепторы десенситизируются, и активность пресинаптических нейронов возвращается к прежнему уровню. Постсинаптические p-адренорецепторы посредством белков Gs активируют аденилатциклазу, превращающую АМФ в цАМФ. Стимуляция ai-адренореиепторов (и прочих адренорецепторов) посредством других G-белков приводит к активации фосфолипазы С, превращающей ФИФ2в ИФ3и ДАГ; это, в свою очередь, влияет на внутриклеточные потоки Са2+ и активность протеинкиназ. Постсинаптические p-адренорецепторы, в отличие от а,-адренорецепторов, подвержены десенситизации. Б. Действие ингибиторов обратного захвата серотонина и трициклических антидепрессантов на серотонинергические нейроны сходно (подробнее см. в тексте, а также в гл. 11 и 12). Серотонин синтезируется из L-триптофанатриптофангидроксилазой (это лимитирующая реакция синтеза серотонина). Продукт этой реакции 5-гидрокситриптофан дезаминируется декарбоксилазой ароматических L-аминокислот с образованием серотонина (5-гидрокситриптамина). Выделяемый нервными окончаниями серотонин взаимодействует с большим числом различных постсинаптических рецепторов, которые в настоящее время разделяют на типы 1 —7. Это приводит в действие разнообразные механизмы, включающие активацию ряда фосфолипаз и циклаз. Ингибирующие серотони-новые ауторецепторы включают подтипы 5-НТ,А и, возможно, 5-НТ7, располагающиеся на телах и дендритах серотонинергических нейронов, а также 5-HT,D-рецепторы на окончаниях аксонов. Эти рецепторы, вероятно, десенситизируются на фоне длительного лечения ингибиторами обратного захвата серотонина. Адренергическая и серотони-нергическая системы взаимодействуют, отчасти путем взаимных гетерорецепторных механизмов (на серотонинергических нейронах расположены ингибирующие а2-рецепто-ры, а на адренергических нейронах — ингибирующие 5-HT)D- и 5-НТм-рецепторы). АР — адренорецептор, АЦ — аденилатциклаза, ДрМ^-дофамин-р-монооксигеназа, ДАщ-дофамин, ДАЛА — декарбоксилаза ароматических L-аминокислот, ИОЗС — ингибиторы обратного захвата серотонина, ИФ — инозитолфосфат, ИФ2 — инозитолдифосфат, НА — норадреналин, ПС —психостимуляторы, ТГ — тирозингидроксилаза, ТФГ — триптофангидроксилаза, ТЦА — трициклические антидепрессанты, ФЛС — фосфолипа-за С, 5-НТ — серотонин (5-гидрокситриптамин).
Другие механизмы действия
Некоторые антидепрессанты влияют одновременно на адренергическую и серотонинергическую передачу. Они включают трициклические антидепрессанты первого поколения, особенно третичные амины (амитриптилин, кломипрамин, доксепин и имипрамин; табл. 19.2). Амитриптилин и кломипрамин оказывают мощное ингибирующее действие на обратный захват серотонина, но их N-деалкилированные метаболиты — сильные ингибиторы обратного захвата норадреналина. Венлафаксин, относящийся к ингибиторам обратного захвата серотонина, блокирует и обратный захват норадреналина. В последние годы создан ряд новых препаратов — смешанных ингибиторов транспорта норадреналина и серотонина. К ним относятся дулоксетин и милнаципран.
На обратный захват дофамина оказывают сильное ингибирующее действие психостимуляторы первого поколения (гл. 10; Fawcett and Busch, 1998). Применение этих препаратов при депрессии ограничено, так как они могут усиливать возбуждение, психотические симптомы, бессонницу и снижение аппетита, часто наблюдающиеся при тяжелой депрессии. Номифензин — эффективный антидепрессант, подавляющий обратный захват как норадреналина, так и дофамина (табл. 19.2). Ароматический аминокетон амфебутамон и его амфетаминоподобные активные метаболиты также влияют на транспорт норадреналина и дофамина (Ascher et al., 1995). Ингибитор МАО транилципромин по своей химической структуре напоминает амфетамины, но оказывает лишь незначительное влияние на транспорт дофамина.
Фенилпиперазиновое производное нефазодон и, в меньшей степени, структурно родственный ему тразодон оказывают некоторое ингибирующее влияние на обратный захват серотонина. Нефазодон, кроме того, оказывает слабое действие на обратный захват норадреналина. Он является также достаточно мощным 5-НТ2А-блокатором, что, видимо, играет роль в его антидепрессивном и анксиолитическом эффектах. Оба препарата блокируют пресинаптические 5-НТ1-ауторецепторы, тем самым увеличивая высвобождение серотонина из нервных окончаний. В то же время они, видимо, представляют собой по крайней мере частичные агонисты постсинаптических 5-НТ1рецепторов (Golden et al., 1998). Тразодон блокирует также а1адренорецепторы и Н1-рецепторы, что, возможно, служит одной из причин соответственно приапизма и сонливости — побочных эффектов этого препарата.
Наконец, структурно сходные друг с другом миртазапин и миансерин — мощные блокаторы нескольких типов постсинаптических серотониновых рецепторов (включая 5-НТ2A, 5-НТ2С и 5-НТ3). Они могут вызвать постепенное снижение плотности 5-НТ2А-рецепторов (Golden et al., 1998). Кроме того, миртазапин блокирует тормозные а2-адренорецепторы (гетерорецепторы) серотонинергических нейронов, а также тормозные а2-адренорецепторы (ауторецепторы) и 5-НТ2А-гетерорецепторы адренергических нейронов. Эти эффекты могут приводить к увеличению высвобождения обоих медиаторов и, вероятно, вносят вклад в развитие антидепрессивного действия. Миртазапин является также сильным Н1блокатором и поэтому вызывает сонливость.
Ингибиторы МАО
МАО — это флавинсодержащий митохондриальный фермент. Он обнаружен в нервных окончаниях, печени, слизистой кишечника и других органах (Cesura and Pletsc-her, 1992). Биохимически МАО отличается от неспецифических аминоксидаз, содержащихся в плазме. Она функционально родственна алкогольдегидрогеназе и альдегидцегидрогеназе: продуктами катализируемых всеми этими ферментами реакций могут быть, в зависимости от субстрата и ткани, карбоновые кислоты или спирты. МАО осуществляет распад катехоламинов и серотонина в ЦНС и периферических тканях. Печеночная МАО выполняет важнейшую защитную функцию, разрушая моноамины крови, в том числе потребляемые с пищей или образующиеся в кишечнике и поступающие в портальный кровоток (например, тирамин). Существует два основных типа МАО: МАО А, действующая преимущественно на серотонин и избирательно ингибируемая клоргилином, и МАО В, действующая преимущественно на фенилэтиламины и избирательно ингибируемая селегилином. Оба типа найдены в печени и головном мозге большинства видов животных. В серотонинергических и адренергических нервных окончаниях и в кишечнике человека содержится в основном МАО А, а в тромбоцитах — МАО В. За исключением селегилина (в низких дозах) ингибиторы МАО, используемые в клинической практике (фенелзин и транилципромин), ингибируют как МАО А, так и МАО В.
Ингибиторы МАО А обычно более эффективны как антидепрессанты, чем ингибиторы МАО В (Murphy et al., 1987, 1995; Krishnan, 1998). Ингибитор МАО В селегилин используется при ранних стадиях болезни Паркинсона. Он предотвращает распад дофамина в окончаниях нейронов черной субстанции, а также, возможно, оказывает на эти нейроны защитное действие, снижая образование нейротоксинов, в частности продуктов окислительного метаболизма дофамина (гл. 22). Селегилин (особенно в высоких дозах) может оказывать также антидепрессивное действие, блокируя МАО А или приводя к образованию амфетаминоподобных метаболитов (Murphy et al., 1987).
Избирательные обратимые ингибиторы МАО А (например, брофаромин и моклобемид) характеризуются коротким действием и по сравнению с неизбирательными необратимыми ингибиторами МАО гораздо меньше усиливают гипертензивное действие тирамина и других симпатомиметиков (Delini-Stula et al., 1988; Lotufo-Netoet al., 1999).
Ингибиторы МАО, использующиеся в клинической практике, включая соединения с гидразиновой группой (фенелзин, изокарбоксазид) и ацетиленовой (тройной) связью (паргилин, клоргилин, селегилин), окисляются МАО с образованием активных метаболитов и затем специфически и необратимо связываются с флавиновой простетической группой (Krishnan, 1998). Так, действие транилципромина (производного циклопропиламина), по-видимому, включает образование под действием МАО активного иминового метаболита и его взаимодействие с сульфгидрильной группой в активном центре фермента. Максимальное снижение активности МАО обычно наблюдается уже через несколько дней после начала приема ингибиторов МАО, в то время как антидепрессивный эффект, как и в случае большинства других антидепрессантов, развивается лишь через несколько недель. Улучшение самочувствия, видимо, наступает при подавлении активности МАО В тромбоцитов по меньшей мере на 85% (Robinson et al., 1978). Эта закономерность наиболее четко доказана в отношении фенелзина. Она служит доводом в пользу применения высоких доз ингибиторов МАО для достижения максимального терапевтического эффекта.
Поскольку все использующиеся в настоящее время ингибиторы МАО (за исключением моклобемида) действуют необратимо, для восполнения запасов фермента и возвращения метаболизма аминов к исходному уровню после отмены препарата требуется до 2 нед (Singer et al., 1979). Тем не менее наилучший эффект достигается при ежедневном приеме препарата. Обычно считается, что антидепрессивное действие ингибиторов МАО связано с повышением концентрации медиаторов-моноаминов в синапсах ЦНС и симпатической нервной системы, однако эта точка зрения не доказана. Как уже говорилось, ингибирование МАО происходит быстро, но антидепрессивный эффект обычно развивается в течение нескольких недель. Причины этого не ясны. Возможно, для терапевтического эффекта необходимо развитие тех же вторичных компенсаторных процессов, которые были описаны в отношении трициклических антидепрессантов и ингибиторов обратного захвата серотонина, в частности снижение плотности а2- и β-адренорецепторов (Murphy et al., 1987).
Читайте также
- Новые антидепрессанты
- Открытие и разработка антидепрессантов
- Химические свойства и структура антидепрессантов
- Экспериментальные исследования новых антидепрессантов
- Фармакокинетика антидепрессантов
- Толерантность и физическая зависимость к антидепрессантам
- Побочные эффекты антидепрессантов
- Передозировка антидепрессантами
- Антидепрессанты: лекарственные взаимодействия
- Применение антидепрессантов
- Препараты для лечения тревожных состояний