Андроген — различия между версиями
Admin (обсуждение | вклад) (→Андрогены) |
(→Естественные андрогены: povtor odnogo i togo zhe na 5 strok vyshe) |
||
| Строка 14: | Строка 14: | ||
* Androstenediol | * Androstenediol | ||
* Androsterone | * Androsterone | ||
| − | |||
== Андрогены в бодибилдинге == | == Андрогены в бодибилдинге == | ||
Версия 04:55, 4 декабря 2013
Содержание
Андрогены
Андрогены (греч. ανδρεία (мужество, храбрость) + греч. γένος (род, колено))— общее собирательное название группы стероидных гормонов, производимых половыми железами (яичками у мужчин и яичниками у женщин) и корой надпочечников и обладающих свойством в определённых концентрациях вызывать андрогенез, вирилизацию организма — развитие мужских вторичных половых признаков — у обоих полов.
У женщин андрогены в характерных для мужчин концентрациях вызывают увеличение размеров клитора и половых губ и сближение половых губ (что делает их более похожими на мошонку), частичную атрофию молочных желез, матки и яичников, прекращение менструаций и овуляций, бесплодие.
Естественные андрогены
- Тестостерон - неактивная форма
- Дигидротестостерон
- Дегидроэпиандростерон (Dehydroepiandrosterone, DHEA)
- Androstenedione (Andro)
- Androstenediol
- Androsterone
Андрогены в бодибилдинге
В бодибилдинге широко применяются анаболические стероиды, однако следует отдавать предпочтение тем препаратам, которые обладают наименьшей андрогенной активностью, они способствуют увеличению мышечной массы, при этом меньше вызывают такие побочные эффекты как: акне, раздражительность, облысение, себорея, гипертрофия простаты, маскулинизация, и самое главное, стероиды с низкой активностью в меньшей степени вызывают атрофию яичек и после цикла естественный уровень тестостерона восстанавливается лучше и полнее. Это связано с тем, что стероиды с высокой андрогенной активностью связываются в большей степени с андрогенными рецепторами, которые располагаются в гипофизе и гипоталамусе, в результате чего снижается уровень гонадотропина.
Хотя в последнее время данные об андрогенной активности подвергаются инсинуациям со стороны дилетантов, которые распространяют ложные сведения о том, что анаболическая и андрогенная активность это понятия не применимые к стероидным гормонам.
Клиническая фармакология
Источник:
Клиническая фармакология по Гудману и Гилману, том 4.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Биосинтез андрогенов
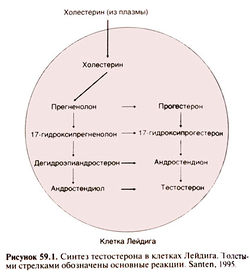
Тестостерон — основной андроген у мужчин и, по-видимому, у женщин. У мужчин большая его часть синтезируется в клетках Лейдига (рис. 59.1). У женщин тестостерон синтезируется тем же путем, но в желтом теле и коре надпочечников. Предшественники тестостерона андростендион и дегидроэпиандростерон обладают слабой андрогенной активностью.
Секреция и перенос кровью
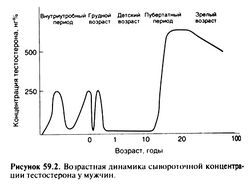
Практически в любом возрасте у мужчин образуется больше тестостерона, чем у женщин, и это объясняет почти все различия между полами. В I триместре беременности яички плода начинают выделять тестостерон (вероятно, под влиянием секретируемого плацентой ХГ), который играет основную роль в формировании мужских половых органов. К началу II триместра его сывороточная концентрация становится почти такой же, как в середине пубертатного периода — около 250 нг% (рис. 59.2) (Dawood and Saxena, 1977; Forest, 1975). К концу II триместра она падает, но к родам опять достигает примерно 250 нг% (Forest and Cathiard, 1975; Forest, 1975; Dawood and Saxena, 1977), возможно, за счет стимуляции клеток Лейдига Л Г, образующимся в гипофизе плода. В первые дни жизни концентрация тестостерона вновь снижается, затем к 2—3 мес поднимается до 250 нг% и далее падает ниже 50 нг%, оставаясь на таком уровне до начала пубертатного периода (Forest, 1975), С 12—17 лет концентрация тестостерона у мальчиков возрастает значительно сильнее, чем у девочек, к концу подросткового возраста достигая 500—700 и 30—50 нг% соответственно. У мужчин высокая концентрация тестостерона обеспечивает половое созревание и дальнейшее развитие вторичных половых признаков. С возрастом она постепенно уменьшается, внося, возможно, свой вкладв различные проявления старения.
ЛГ, секретируемый гонадотропными клетками гипофиза (гл. 56), — основной стимулятор секреции тестостерона. Возможно, действие Л Г усиливается в присутствии ФСГ — второго гормона этих клеток. В свою очередь, секрецию ЛГ стимулирует гонадолиберин, образующийся в гипоталамусе, а тормозит тестостерон, который напрямую действует на гонадотропные клетки. Секреция ЛГ происходит импульсно, интервал между пиками секреции составляет около 2 ч, а амплитуда пиков выше вут-ренние часы. Такой характер секреции ЛГ, по-видимому, определяется импульсной секрецией гонадолиберина в гипоталамусе. При гипоталамическом гипогонадизме импульсное введение гонадолиберина нормализует секрецию Л Г и тестостерона, тогда как длительная инфузия гонадолиберина не помогает (Crowley et al., 1985).
Секреция тестостерона также происходит импульсно и в основном днем. Его концентрация максимальна в 8:00 и минимальна в 20:00. С возрастом утренняя концентрация тестостерона снижается (Bremner et al., 1983).
У женщин Л Г вызывает выработку тестостерона в желтом теле, образующемся на месте фолликула после овуляции. Однако в норме основными ингибиторами секреции ЛГ у женщин служат эстрадиол и прогестерон, а не тестостерон. В крови около 2% тестостерона находится в свободной форме, 40% прочно удерживается глобулином, связывающим половые гормоны, а остальной тестостерон непрочно связан с альбумином.
Метаболизм
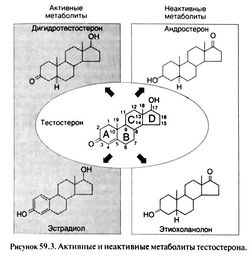
Тестостерон оказывает разнообразное действие на многие ткани. Одна из причин такого разнообразия — превращение тестостерона в два других стероидных гормона, дигидротестостерон и эстрадиол (рис. 59.3). Одни эффекты тестостерон вызывает сам, другие оказывает дигидротестостерон, третьи — эстрадиол.
Необратимое восстановление тестостерона в дигидротестостерон катализируется 5а-редуктазой. Оба гормона активируют одни и те же андрогеновые рецепторы, но дигидротестостерон имеет большее сродство к рецепторам (Wilbert et al., 1983) и сильнее влияет на экспрессию генов (Deslypere et al., 1992). Превращаясь в дигидротестостерон в тканях, содержащих 5а-редукгазу, тестостерон может оказывать на них дополнительное воздействие. Описаны два типа 5а-редуктазы: тип 1 (главным образом в печени и экстрагенитальных участках кожи) и тип 11 (в мочевых путях и половых органах у мужчин, а также в коже наружных половых органов у мужчин и женщин). Действие дигидротестостерона на эти ткани описано ниже.
Ароматаза, содержащаяся во многих тканях, особенно в печени и жировой клетчатке, необратимо превращает тестостерон в эстрадиол. У мужчин этим путем образуется 75% эстрадиола; остальное вырабатывается непосредственно в яичках, возможно, клетками Лейдига (MacDonald et al., 1979). Действие тестостерона, связанное, как предполагается, с превращением в эстрадиол, описано ниже.
Тестостерон инактивируется в печени с образованием андростерона и этиохоланолона (рис. 59.3). Дигидротестостерон превращается в андростерон, андростандион и андростандиол.
Физиологические эффекты и механизмы действия
Эффекты тестостерона зависят от того, на какие рецепторы он действует, а также от ткани и от возраста человека. Тестостерон оказывает как андрогенное действие, связываясь с андрогеновыми рецепторами напрямую или после превращения в дигидротестостерон, так и эстрогенное, путем превращения в эстрадиол и активации эстрогеновых рецепторов (рис. 59.4).
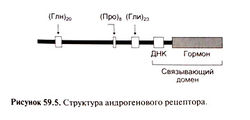
Действие на андрогеновые рецепторы. Тестостерон и дигидротестостерон стимулируют одни и те же андрогеновые рецепторы (рис. 59.5), которые относятся к группе внутриклеточных рецепторов, включающей также рецепторы стероидных гормонов, тиреоидных гормонов, кальцитриола, ретиноидов и ряд рецепторов с неизвестными лигандами. Тестостерон и дигидротестостерон взаимодействуют с рецепторным доменом рецептора, что позволяет гормон-рецепторному комплексу посредством ДНК-связывающего домена связываться с определенными генами. Гормон-рецепторный комплекс действует как фактор транскрипции, усиливая экспрессию этих генов (Brinkmann and Trapman, 2000).
Лишь в последние годы появились данные о причинах разнообразия эффектов андрогенов в различных тканях. Одна из них — более высокое сродство дигидротестостерона к андрогеновым рецепторам по сравнению с тестостероном (Deslypere et al., 1992; Wilbert et al., 1983). Недавно был описан и другой механизм, связанный с факторами транскрипции (коактиваторами и корепрессорами), специфичными для различных тканей.
Значение андрогенового рецептора четко выявляют последствия мутаций кодирующего его гена. Как и следовало ожидать, мутации, меняющие первичную структуру белка (достаточно замены одной аминокислоты в ДНК-связывающем или рецепторном доменах), вызывают резистентность к тестостерону уже во внутриутробном периоде (McPhaul and Griffin, 1999). Это ведет к нарушению половой дифференцировки и задержке полового развития.
Мутация другого типа вызывает Х-сцепленную бульбоспинальную амиотрофию (синдром Кеннеди). У таких больных увеличено число повторов ЦАГ, кодирующих глутамин, из-за чего удлинен полиглутаминовый участок на N-конце рецептора (Laspada et al., 1991). Это лишь немного снижает чувствительность рецептора к андрогенам, но приводит к прогрессирующей атрофии мотонейронов (механизм последней не известен).
Наконец, мутации объясняют развитие устойчивости к антиандрогенной терапии при метастазирующем раке предстательной железы. Вначале опухоль бывает гормонально-зависимой, по крайней мере отчасти, на чем и основана антиандрогенная терапия. Часто вначале опухоль поддается лечению и размеры ее уменьшаются, но затем вырабатывается устойчивость. У таких бальных описаны различные мутации гена андрогенового рецептора, из-за чего рецептор может активироваться другими лигандами или вообще в отсутствие лиганда (Visakorpi et al., 1995).
Действие на эстрогеновые рецепторы
Превращение в эстрадиол под действием ароматазы объясняет влияние тестостерона на кости, а возможно, и на некоторые другие ткани. В тех редких случаях, когда в организме мужчины отсутствуют ароматаза (Carani etal., 1997; Morishmaetal., 1995) или эстрогеновые рецепторы (Smith et al., 1994), эпифизарные зоны роста не закрываются и трубчатые кости растут неограниченно долго; кроме того, развивается остеопороз. Эстрадиол устраняет все эти нарушения при недостаточности ароматазы (Bilezikian et al., 1998), но не при дефекте эстрогеновых рецепторов. Есть данные, что превращение тестостерона в эстрадиол определяет половое поведение самцов крыс, но аналогичный эффект у людей не выявлен.
Андрогены в разные периоды жизни
Внутриутробный период. Примерно на 8-й неделе беременности под влиянием ХГ яички плода начинают выделять тестостерон. Местное повышение концентрации тестостерона вызывает дифференцировку вольфовых протоков во внутренние мужские половые органы: придатки яичка, семявыносящие протоки и семенные пузырьки. В закладках наружных половых органов тестостерон превращается в дигидротестостерон, под действием которого развиваются половой член и мошонка, а также предстательная железа (George and Wilson, 1992). Усиление секреции тестостерона к концу внутриутробного развития вызывает рост полового члена.
Новорожденные. Значение повышенной секреции тестостерона в первые месяцы жизни не известно.
Пубертатный период. У мужчин этот период начинается примерно в 12 лет с повышения секреции гонадолиберина в гипоталамусе. Это усиливает выработку гонадотропными клетками ФСГ и ЛГ, которые способствуют росту яичек. Увеличение яичек служит первым признаком полового созревания. Усиленный синтез тестостерона наряду с действием ФСГ на клетки Сертоли стимулирует развитие извитых семенных канальцев в которых и образуются сперматозоиды. Повышение концентрации тестостерона в крови одновременно воздействует на многие ткани, но изменения в большинстве из них происходят постепенно, в течение нескольких лет. Увеличиваются длина и толщина полового члена, появляются складки мошонки, предстательная железа начинает выделять секрет, входящий в состав спермы. Возрастает выработка кожного сала, кожа становится более грубой и жирной, что способствует развитию угрей. Появляются волосы в подмышечных впадинах, на лобке, затем на голенях и наконец на других частях тела и на лице. Развитие оволосения может занять около 10 лет, его завершение говорит об окончании пубертатного периода. Повышаются масса и сила мышц, особенно мышц плечевого пояса, истончается подкожная клетчатка. Быстрее удлиняются трубчатые кости, что веди к общему ускорению роста, однако эпифизарные зоны роста постепенно закрываются, из-за чего рост замедляется и в итоге прекращается. Одновременно утолщаются кости. В результате повышения массы мышц и костной ткани заметно увеличивается вес. Усиливается эритропоэз, и концентрация гемоглобина у мужчин становится выше, чем у мальчиков и женшин. Утолщаются хрящи гортани и понижается голос. Развивается половое влечение.
Повышение концентрации тестостерона в пубертатном периоде отражается и на нервной деятельности: мужчины обычно лучше ориентируются в пространстве, и их поведение в ряде отношений отличается от поведения женщин, в частности мужчины более агрессивны.
Зрелый возраст. В молодом и среднем возрасте как сывороточная концентрация тестостерона, так и характерные черты взрослого мужчины почти не меняются. Однако постепенно развивается андрогенетическая алопеция, начинающаяся с появления залысин и выпадения волос на темени.
Намного большее медицинское значение имеют изменения в предстательной железе. Во-первых, у всех мужчин в той или иной степени развивается аденома предстательной железы. Иногда это приводит к сдавлению мочеиспускательного канала и нарушению оттока мочи. Появление аденомы связано с превращением тестостерона в ди гидротестостерон в клетках предстательной железы под действием 5а-редуктазы типа II (Wilson, 1980). Один из современных подходов к лечению аденомы предстательной железы основан на ингибировании этого фермента (McConnell et al.. 1998), как описано ниже.
Во-вторых, может развиться рак предстательной железы. Хотя прямых доказательств этиологической роли тестостерона нет, опухоль является гормонально-зависимой, по крайней мере частично и в течение какого-то времени. В связи с этим при мета-стазируюшем раке предстательной железы стремятся снизить концентрацию тестостерона (Huggins and Hodges, 1941; Iversen et al., 1990).
Пожилой возраст. С возрастом сывороточная концентрация тестостерона постепенно падает (рис. 59.2), в то же время растет концентрация глобулина, связывающего половые гормоны. К 80 годам общая концентрация тестостерона составляет около 85%, а концентрация свободного тестостерона — лишь около 40% соответствующих концентраций в 20 лет (Purifoy et al., 1981; Deslypereand Vermeulen, 1984). С падением концентрации тестостерона могут быть связаны такие возрастные изменения, как уменьшение работоспособности, полового влечения, мышечной массы (Forbes, 1976) и силы (Murray et al., 1980), а также плотности костной ткани (Riggs etal., 1982). На эту зависимость указывают похожие изменения при гипогонадизме у молодых мужчин (см. ниже).
Дефицит андрогенов
Последствия дефицита андрогенов зависят от степени дефицита и возраста, в котором он возник. Внутриутробный период. В I триместре беременности дефицит тестостерона у плода ведет к неполной половой дифференцировке. Причиной дефицита тестостерона могут быть только изменения в яичках (например, недостаточность 17а-гидроксилазы): недостаток ЛГ при болезнях гипофиза или гипоталамуса на этой стадии развития не приводит к дефициту тестостерона, так как вначале секрецию тестостерона клетками Лейдига регулирует ХГ.
В отсутствие тестостерона формируются наружные женские половые органы; в менее тяжелых случаях происходит неполная вирилизация и развиваются наружные половые органы промежуточного типа, их строение зависит от уровня тестостерона. Нарушается и дифференцировка вольфовых протоков в семявыносящие протоки и семенные пузырьки, в то же время секретируемый яичками фактор регрессии мюллеровых протоков не позволяет им развиваться в женские половые органы. Подобные изменения происходят и при нормальной секреции тестостерона, если его активность снижена вследствие дефекта андрогеновых рецепторов или недостаточности 5а-редуктазы. Встречаются разные дефекты андрогеновых рецепторов. В наиболее тяжелых случаях рецептор полностью неактивен, и наблюдается тестикулярная феминизация с развитием наружных женских половых органов. В среднетяжелых случаях происходит их неполная вирилизация; в легких случаях нарушается лишь сперматогенез у взрослых (McPhaul and Griffin, 1999). Недостаточность 5а-редуктазы сопровождается неполной вирилизацией наружных половых органов при нормальном развитии внутренних, так как последнее зависит от самого тестостерона (Wilson et al., 1993).
Дефицит тестостерона в III триместре беременности из-за болезней яичек или дефицита ЛГ у плода ведет к двум нарушениям. Во-первых, не происходит нормального роста полового члена и возникает микропения. Она часто наблюдается у мальчиков с дефицитом Л Г, вызванным нарушением синтеза гонадолиберина. Во-вторых, яички не опускаются в мошонку, то есть возникает крипторхизм; это состояние также нередко наблюдается при дефиците Л Г.
Пубертатный период. Если у мальчика во внутриутробном периоде тестостерон синтезируется нормально, а его дефицит возникает до наступления пубертатного периода, то наблюдается задержка полового развития. В зависимости от степени дефицита в той или иной мере замедляются описанные выше изменения наружных половых органов, оволосения, мышечной массы, голоса и поведения. Кроме того, при нормальной секреции СТГ на фоне недостатка тестостерона в пубертатном возрасте запаздывает закрытие эпифизарных зон роста, что ведет к избыточному удлинению трубчатых костей и непропорциональному росту рук и ног относительно туловища, из-за чего телосложение становится евнухоидным. Наконец, разрастается железистая ткань молочных желез и возникает гинекомастия.
Зрелый возраст. Если дефицит тестостерона возникает после завершения полового развития, происходит обратное развитие вторичных половых признаков, причем выраженность этого процесса зависит от степени и длительности дефицита. В тяжелых случаях уже через 1—2 нед наблюдается снижение полового влечения и работоспособности, другие симптомы развиваются медленнее. Снижение мышечной массы и силы в среднем происходит уже через несколько месяцев, но для появления заметных изменений у отдельных больных требуются годы.
В течение нескольких месяцев происходит существенное снижение гематокрита и концентрации гемоглобина. Двухфотонная рентгеновская абсорбциометрия способна обнаружить снижение плотности костной ткани уже через 2 года, хотя риск переломов повышается лишь через много лет. Уменьшение оволосения по мужскому типу также происходит постепенно, в течение многих лет. Дефицит андрогенов у женщин уменьшает лобковое и /1 подмышечное оволосение, но это становится заметным лишь через нескольких лет. У женщин андрогены, возможно, выполняют и другие важные функции, утрачиваемые в их отсутствие (особенно при сочетанном дефиците яичниковых и надпочечниковых андрогенов на фоне апитуитаризма). Сейчас разрабатываются препараты тестостерона, которые могут поддерживать физиологическую концентрацию этого гормона у женщин. Применение этих препаратов позволит узнать, насколько заместительная терапия тестостероном при дефиците андрогенов у женщин способна повысить половое влечение, массу и силу мышц, плотность костной ткани и работоспособность.
Препараты андрогенов
При приеме внутрь тестостерон неэффективен: он хорошо всасывается, но быстро инактивируется в печени. Поэтому при гипогонадизме для поддержания нормальной сывороточной концентрации тестостерона препарат пришлось бы принимать слишком часто и в слишком высоких дозах. Соответственно, большинство препаратов андрогенов имеют структуру, препятствующую их быстрому разрушению в печени. Кроме того, ведется поиск препаратов, обладающих более избирательным действием.
Эфиры тестостерона
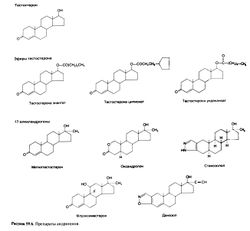
Этерификация 17β-гидроксильной группы тестостерона еще больше увеличивает его липофильность. Для лечения гипогонадизма тестостерона энантат или ципионат (рис. 59.6)
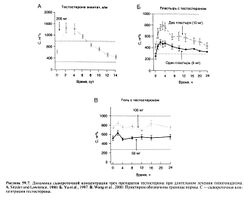
, растворенный в масле, вводят в/м каждые 2—4 нед. В организме эфир гидролизуется; в первые дни после инъекции сывороточная концентрация тестостерона превышает норму, но перед очередной инъекцией опускается до ее нижней границы (Snyder and Lawrence, 1980) (рис. 59.7)
. Попытки сделать инъекции более редкими за счет увеличения дозы ведут к большим колебаниям концентрации и снижению эффективности. Тестостерона ундеканоат (рис. 59.6), растворенный в масле, при приеме внутрь всасывается в лимфу, минуя портальный кровоток. Препарат применяют также в/м; при этом постоянная сывороточная концентрация тестостерона поддерживается в течение месяца (Zhang et al., 1998). В США тестостерона ундеканоат не применяют. 17-алкиландрогены. В 1950-х гг. было установлено, что добавление 17-алкильной группы (рис. 59.6) повышает устойчивость тестостерона к разрушению в печени и такие соединения обладают андрогенной активностью при приеме внутрь. Однако их активность ниже, чем у тестостерона, и в то же время они обладают не свойственной тестостерону гепатотоксичностью (Petera et al., 1962; Саbasso, 1994).
Препараты андрогенов для накожного применения
Другая возможность избежать инактивации вводимого тестостерона — это использование пластыря, из которого неизмененный гормон медленно всасывается через кожу. Ежедневное наклеивание пластыря позволяет уменьшить колебания концентрации тестостерона по сравнению с в/м введением его эфиров. Первые такие пластыри наклеивались на кожу мошонки (Findlay et al., 1989). Здесь кожа настолько тонкая, что тестостерон всасывается в достаточном количестве и без добавления веществ, облегчающих всасывание. Затем были разработаны пластыри, содержащие такие вещества, благодаря чему эти пластыри можно было наклеивать на другие участки кожи (Yu et al., 1997; Dobs et al., 1999). Недавно создан препарат тестостерона в виде водно-спиртового геля (Wang et al., 2000). Все эти препараты наносят 1 раз в сутки, что обеспечивает нормальную концентрацию тестостерона у большинства больных гипогонадизмом (рис. 59.7).
Поиск избирательных андрогенов
Алкиландрогены
Полвека назад велись работы по синтезу аналогов тестостерона с преобладанием анаболической активности над андрогенной. Казалось, ряд веществ обладал такими свойствами, поскольку у крыс они оказывали большее влияние на мышцу, поднимающую задний проход, чем на передний отдел предстательной железы (Hershberger and Meyer, 1953). Эти вещества назвали анаболическими стероидами, большинство из них было 17-алкиландрогенами. Однако ни один из них не показал желаемой избирательности у людей. Тем не менее анаболические стероиды широко применяются спортсменами в качестве допинга (см. ниже). Особенность другого алкиландрогена, 7а-метил-19-нортестостерона, — устойчивость к действию 5а-редуктазы (Kumar et al., 1992). Избирательные модуляторы андрогеновых рецепторов. Создание избирательных модуляторов эстрогеновых рецепторов (тамоксифена, ралоксифена), активирующих эстрогеновые рецепторы в одних тканях и блокирующих в других, стимулировало разработку аналогичных модуляторов андрогеновых рецепторов
(Negro-Vilar, 1999). Впрочем, избирательность ралоксифена, по-видимому, связана с большим сродством к одной изоформе эстрогеновых рецепторов, преобладающей в костях и в миокарде, и меньшим сродством к другой форме, характерной для молочной железы и эндометрия. Поскольку обнаружена лишь одна форма андрогеновых рецепторов, избирательное действие на них должно быть основано на тканевой специфичности коактиваторов и корепрессоров — белков, регулирующих влияние внутриклеточных рецепторов на транскрипцию генов-мишеней (Moilanen et al., 1999). Получена группа хинолинов с избирательной андрогенной активностью (Zhi et al., 1999).
См. также: SARMs (селективные модуляторы андрогенных рецепторов)
Применение андрогенов
Очевидное показание к назначению андрогенов — дефицит тестостерона (гипогонадизм) у мужчин. Андрогены применяют и в других случаях; вероятно, в будущем появятся новые показания к их назначению.
Гипогонадизм у мужчин. При дефиците тестостерона назначают любой из описанных выше препаратов тестостерона для накожного применения или эфиры тестостерона. У подростков и пожилых необходимо особенно тщательно следить за эффективностью и безопасностью лечения.
Оценка эффективности
Цель лечения — поддержание сывороточной концентрации тестостерона как можно ближе к нормальной, поэтому измерение этой концентрации служит основным методом оценки эффективности лечения. Время измерения зависит от препарата: если используются препараты тестостерона для накожного применения, концентрацию можно определять в любой день и в любое время. При этом следует учитывать, что концентрация достигает максимума через 2—4 ч после наклеивания пластыря для кожи мошонки (Findlay et al., 1987) или пластыря Тестодерм для экстрагенитальных участков кожи (Yu etal., 1997) и через 6—9 ч при использовании пластыря Андродерм для экстрагенитальных участков кожи (Dobs et al., 1999), а минимальная концентрация перед наклеиванием следующего пластыря составляет 60—70% максимальной (Findlay et al., 1987). При использовании геля сывороточная концентрация тестостерона в течение суток меняется мало, но стационарная концентрация препарата иногда устанавливается лишь через месяц после начала лечения. При использовании тестостерона энантата или ципионата, вводимых каждые 2 нед, концентрацию тестостерона измеряют в середине этого интервала. Измеренная концентрация тестостерона не должна отличаться от нормальной, в противном случае режим введения меняют. Если дефицит тестостерона вызван поражением яичек (в этом случае повышена концентрация ЛГ), об эффективности лечения свидетельствует нормализация концентрации ЛГ в течение 2 мес после начала заместительной терапии (Snyder and Lawrence, 1980; Findlay etal., 1989).
Нормализация сывороточной концентрации тестостерона у мужчин с гипогонадизмом ведет к завершению развития вторичных половых признаков и их поддержанию. В течение нескольких недель у таких мужчин должны повыситься половое влечение и работоспособность (Davidson et al., 1979). Через несколько месяцев возрастают мышечная масса и сила и уменьшается масса жировой ткани (Katznelson et al., 1996). Плотность костной ткани достигает максимума в течение 2 лет (Snyder et al., 2000).
Побочные эффекты тестостерона
Препараты тестостерона для накожного применения и эфиры тестостерона не обладают каким-либо действием, отличным от действия эндогенного тестостерона (если не превышена терапевтическая доза). Однако при проведении заместительной терапии могут возникать нежелательные эффекты. Некоторые из них появляются вскоре после начала лечения, другие — обычно лишь через несколько лет. Повышение концентрации тестостерона от уровня препубертатного или середины пубертатного периода до уровня, характерного для взрослого мужчины, может вести к таким явлениям, свойственным пубертатному периоду, как акне, гинекомастия и агрессивное половое поведение. Физиологические количества тестостерона не влияют на липидный профиль крови. Заместительная терапия иногда оказывает нежелательное действие при сопутствующих заболеваниях. Так, стимуляция эритропоэза приводит к нормализации гематокрита у здорового в остальном мужчины, однако при склонности к эритроцитозу (например, на фоне ХОЗЛ) гематокрит может превысить норму. Подобным же образом небольшая задержка натрия и воды не отразится на здоровом человеке, но усугубит сердечную недостаточность. При передозировке тестостерона эритроцитоз и, изредка, задержка воды с отеками развиваются и в отсутствие предрасположенности к этим состояниям. Когда нормальная концентрация тестостерона поддерживается долгие годы (за счет его эндогенной секреции или заместительной терапии), в возрасте старше 40 лет повышается риск таких гормонально-зависимых состояний, как аденома и рак предстательной железы.
Производные тестостерона 17-алкиландрогены обладают побочным действием на печень, иногда вызывая холестаз и, изредка, пелиоз печени (образование лакун, наполненных кровью). Описаны отдельные случаи печеночноклеточного рака, но этиологическая роль этих препаратов сомнительна. Кроме того, 17-алкиландрогены, особенно в больших дозах, снижают уровень ЛПВП.
Гипогонадизм в пубертатном периоде. Если гипогонадизм наблюдается у мальчиков, то в пубертатном периоде им назначают препараты тестостерона, исходя из изложенных выше принципов. Важно помнить, что тестостерон ускоряет закрытие эпифизарных зон роста, поэтому сначала он вызывает бурный рост, но затем рост окончательно прекращается. Соответственно, надо учитывать рост мальчика и уровень СТГ у него. При низком росте и дефиците СТГ сначала назначают соматропин, а уже потом лечат гипогонадизм.
Старение у мужчин. По предварительным данным, заместительная терапия тестостероном у мужчин с возрастным снижением концентрации этого гормона повышает плотность костной ткани и безжировую массу тела и снижает массу жировой ткани (Snyderet ah, 1999а, b). Однако не ясно, не вызывает ли такое лечение рост аденомы предстательной железы, и не увеличивается ли риск проявляющегося клинически рака предстательной железы. Гипогонадизм у женщин. Пока не доказано, что назначение тестостерона женщинам с пониженной сывороточной концентрацией тестостерона способствует росту полового влечения, работоспособности, мышечной массы и силы, а также плотности костной ткани.
Допинг. Для достижения лучших результатов некоторые спортсмены прибегают к допингу, в том числе используют андрогены. Обычно эти препараты принимают тайком, поэтому их действие изучено хуже, чем действие препаратов, назначаемых при лечении гипогонадизма. Препараты. Спортсмены использовали в качестве допинга почти все андрогены, применяемые в медицине и ветеринарии. Эго началось более 20 лет назад, и исходно предпочтение отдавали анаболическим стероидам — 17-алкиландрогенам и другим веществам, якобы обладавшим преимущественно анаболическим действием по сравнению с тестостероном. Поскольку такие соединения могут быть легко выявлены контролирующими организаниями, большее распространение получили ХГ и эфиры тестостерона, повышающие сывороточную концентрацию тестостерона. В последние годы увеличилось использование предшественников тестостерона (андростендиона и дегидроэпианд-ростерона), не входящих в списки запрещенных препаратов. Эффективность. Большинство испытаний, посвященных влиянию тестостерона на мышечную силу, были неконтролируе-мыми. В одном двойном слепом испытании 43 человека (все мужчины) были разделены на 4 группы: в первых двух группах испытуемые выполняли силовые упражнения на фоне введения тестостерона энантата в дозе 600 мг 1 раз в неделю (более чем в 6 раз выше, чем при заместительной терапии) или плацебо, в третьей и четвертой группах испытуемые получали те же препараты в отсутствие упражнений. Тестостерон увеличивал безжировую массу тела и мышечную силу, а упражнения давали дополнительный эффект (Bhasin et al., 1997).
В другом двойном слепом испытании андростендион (по 100 мг 3 раза в сутки в течение 8 нед) не приводил к увеличению мышечной силы по сравнению с плацебо. Впрочем, это не удивительно, так как средняя концентрация тестостерона также не повышалась (King et al., 1999).
Побочные эффекты андрогенов
При приеме терапевтических доз любого андрогена некоторые побочные эффекты возникают всегда; появление других эффектов зависит от препарата или дополнительных условий. Все андрогены в высоких дозах подавляют секрецию ЛГ и ФСГ, угнетая функции яичек: падает выработка эндогенного тестостерона и сперматозоидов, что сн ижает способность к оплодотворению. Прием андрогенов в течение многих лет может вести к уменьшению яичек. Функция яичек обычно восстанавливается через несколько месяцев после отмены препарата, но иногда для этого требуется больше времени. Высокие дозы всех андрогенов вызывают эритроцитоз (Drinka et al., 1995);
Андрогены, способные превращаться в эстрогены (прежде всего сам тестостерон), в высоких дозах вызывают гинекомастию. Препараты с модифицированным кольцом А, не подвергающимся ароматизации, например дигидротестостерон, лишены этого действия.
Гепатотоксическое действие свойственно только 17-алкиландрогенам (см. выше). Кроме того, в высоких дозах они чаще других андрогенов нарушают липидный обмен, снижая уровень ЛПВП и повышая уровень ЛПНП. Имеются неподтвержденные сообщения о таких побочных эффектах, как психические расстройства и внезапная смерть от ИБС, предположительно связанная с изменением липидного профиля и повышением свертываемости крови.
Некоторые побочные эффекты андрогенов особенно заметны у женщин и детей — свойственный мужчинам характер оволосения, залысины и угри. У мальчиков увеличивается половой член, у женщин — клитор. Мальчики и девочки прекращают расти из-за преждевременного закрытия эпифизарных зон роста. Контрацепция у мужчин. Разрабатываются контрацептивы для мужчин, содержащие андрогены (в том числе в сочетании с другими препаратами). Их действие основано на подавлении секреции ЛГ в гипофизе и последующем уменьшении синтеза эндогенного тестостерона. В норме концентрация тестостерона в яичках примерно в 100 раз превышает таковую в крови. Высокая концентрация тестостерона нужна для сперматогенеза, нее снижение резко тормозит этот процесс. Впрочем, в первых попытках использования тестостерона для подавления сперматогенеза потребовалась вдвое большая дозa тестостерона энантата, чем для заместительной терапии, и все равно не удавалось полностью подавить сперматогенез у всех мужчин (WHO Task Force for the Regulation of Male Fertility, 1996). В других ранних испытаниях применяли антагонисты гонадолиберина, подавляющие секрецию ЛГ, в сочетании с заместительной терапией тестостероном (Pavlou et al., 1991). Однако такое сочетание не подходит для широкого применения, так как имеющиеся антагонисты гонадолиберина надо вводить в виде ежедневных инъекций, вызывающих выброс гистамина. Более перспективно сочетание прогестагенов с физиологическими дозами тестостерона для подавления секреции Л Г и сперматогенеза при сохранении нормальной сывороточной концентрации тестостерона (Bebb et al., 1996). Сейчас проходят испытание тестостерона ундеканоат для инъекций, обеспечивающий относительно стабильную сывороточную концентрацию тестостерона в течение месяца (Zhang et al., 1999), и 7а-метил-19-нортестостерон, синтетический андроген, не восстанавливаемый 5а-редуктазой и потому не действующий на предстательную железу (Cummings et al., 1998).
Истощение. Анаболическую активность тестостерона пытались использовать для лечения атрофии мышц и истощения, но в большинстве случаев этот метод оказался неэффективным. Исключение составляет лечение атрофии мышц при СПИДе, сопровождающейся гипогонадизмом. У больных СПИДом мужчин с атрофией мышц и пониженной сывороточной концентрацией тестостерона такое лечение повышает мышечную массу и силу (Bhasin et al., 2000).
Отек Квинке. Постоянное лечение андрогенами предотвращает приступы отека Квинке. Болезнь связана с наследственной недостаточностью ингибитора С1-эстеразы или выработкой антител к нему (Cicardi et al., 1998). 17-алкиландрогены (станозолол и даназол) стимулируют синтез ингибитора С1-эстеразы в печени. К сожалению, они вызывают вирилизацию у женщин. Из-за вирилизации и преждевременного закрытия эпифизарных зон роста андрогены не используют для профилактики отека Квинке у детей, но иногда их назначают при приступах. Болезни крови. До появления эритропоэтина андрогены применяли для стимуляции эритропоэза при анемиях различной этиологии. Андрогены (в частности, даназол) до сих пор иногда назначают при гемолитической анемии и идиопатической тромбоцитопенической пурпуре, устойчивых к стандартному лечению.
Читайте отдельную статью: Побочные эффекты стероидов и как снизить вред стероидов