Взаимодействие лекарственных средств с рецепторами — различия между версиями
Zabava (обсуждение | вклад) (→Взаимосвязь между усилением сигнала и фармакологическим эффектом) |
Zabava (обсуждение | вклад) (→Количественная оценка взаимодействия рецепторов с агонистами) |
||
| Строка 28: | Строка 28: | ||
=== Количественная оценка взаимодействия рецепторов с агонистами === | === Количественная оценка взаимодействия рецепторов с агонистами === | ||
| + | [[Image:Gud_2_7.jpg|300px|thumb|right|Рисунок 2.7. Два способа количественной оценки взаимодействия агонистов с рецепторами.]] | ||
Взаимодействие лекарственных средств с биологическими системами можно охарактеризовать двумя показателями — активностью и эффективностью. Об эффективности судят по величине максимального фармакологического эффекта. Активность препарата зависит от четырех параметров: два из них характеризуют биологическую систему (плотность рецепторов и эффективность механизма усиления сигнала), два других — взаимодействие вещества с рецептором (сродство препарата к рецепторам и его внутренняя активность). Если два равноэффективных препарата испытывают в одной и той же биологической системе (то есть механизм внутриклеточной передачи сигнала от рецепторов к эффекторам одинаков), их сравнительная активность служит относительным показателем внутренней активности и сродства к рецепторам (рис. 2.7, А). Таким образом, измерение сравнительной активности агонистов позволяет оценить их способность вызывать ответную реакцию исследуемой системы и предсказывать сравнительную активность этих препаратов в другой системе. Еще один метод оценки действия агонистов — сравнение их эффективности в биологической системе, где они не вызывают максимально возможную реакцию (рис. 2.7, В). Преимущество второго метода в том, что эффективность зависит только от внутренней активности, а активность — как от внутренней активности, так и от сродства препарата к рецепторам. | Взаимодействие лекарственных средств с биологическими системами можно охарактеризовать двумя показателями — активностью и эффективностью. Об эффективности судят по величине максимального фармакологического эффекта. Активность препарата зависит от четырех параметров: два из них характеризуют биологическую систему (плотность рецепторов и эффективность механизма усиления сигнала), два других — взаимодействие вещества с рецептором (сродство препарата к рецепторам и его внутренняя активность). Если два равноэффективных препарата испытывают в одной и той же биологической системе (то есть механизм внутриклеточной передачи сигнала от рецепторов к эффекторам одинаков), их сравнительная активность служит относительным показателем внутренней активности и сродства к рецепторам (рис. 2.7, А). Таким образом, измерение сравнительной активности агонистов позволяет оценить их способность вызывать ответную реакцию исследуемой системы и предсказывать сравнительную активность этих препаратов в другой системе. Еще один метод оценки действия агонистов — сравнение их эффективности в биологической системе, где они не вызывают максимально возможную реакцию (рис. 2.7, В). Преимущество второго метода в том, что эффективность зависит только от внутренней активности, а активность — как от внутренней активности, так и от сродства препарата к рецепторам. | ||
| + | |||
| + | '''''Описание к рис. 2.7.''' Два способа количественной оценки взаимодействия агонистов с рецепторами. А. Сравнительная активность двух агонистов (А и Б) в одной и той же биологической системе служит относительным показателем их внутренней активности и сродства к рецепторам. Б. Сравнительная эффективность агонистов в биологической системе, в которой они не вызывают максимально возможную ответную реакцию, служит относительным показателем их внутренней активности (нелинейно зависит от нее). Л — лекарственное средство.'' | ||
=== Количественная оценка взаимодействия рецепторов с антагонистами === | === Количественная оценка взаимодействия рецепторов с антагонистами === | ||
Версия 21:14, 28 марта 2014
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Количественные аспекты взаимодействия лекарственных средств с рецепторами
Основы фармакологии рецепторов
Фармакология рецепторов изучает количественную сторону действия лекарственных средств на биологические системы. Разные биологические системы реагируют на один и тот же препарат по-разному; это касается и организма человека, с одной стороны, и экспериментальных фармакологических моделей — с другой. В результате могут возникать ошибки. Чтобы прогнозировать действие лекарственных средств в любых условиях, необходимо разработать стандартную шкалу оценки фармакологической активности, применимую для любой биологической системы. В этом и состоит задача фармакологии рецепторов.
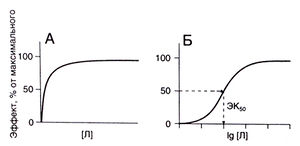
Основным понятием в фармакологии рецепторов служит кривая доза—эффект, описывающая зависимость эффекта лекарственного средства от его концентрации в области рецепторов. На рис. 2.4, А представлена классическая кривая доза—эффект, которая выходит на плато, когда лекарственным средством заняты все рецепторы. Для построения такой кривой необходим слишком широкий диапазон концентраций, поэтому на практике ее часто представляют в полулогарифмических координатах (по горизонтальной оси откладывают логарифм концентрации — рис. 2.4, Б). Кривая доза—эффект описывается тремя основными параметрами; порогом, наклоном и максимумом. Эти параметры количественно характеризуют активность лекарственного средства.
Взаимодействие лекарственного средства с рецептором включает 2 компонента: 1) связывание, 2) активацию. Способность препарата связываться с рецептором, то есть вступать с ним в химическое взаимодействие, называется сродством. Способность лекарственного средства после образования комплекса с рецептором вызывать его активацию называется внутренней активностью. Внутренняя активность зависит от химической структуры препарата. На практике внутренняя активность рассматривается как константа пропорциональности, характеризующая степень активации рецептора при связывании с лекарственным средством.
Описание к рис. 2.4. Кривая доза—эффект для лекарственного средства Л. А. В обычных координатах кривая имеет форму гиперболы. Б. В полулогарифмических координатах кривая имеет S-образ-ную форму. Концентрация, при которой эффект лекарственного средства составляет 50% максимального (ЭК»), служит мерой активности препарата.
Оккупационная теория
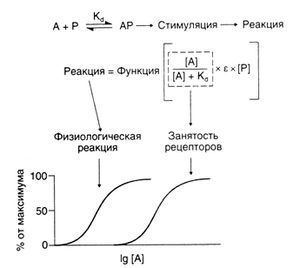
Согласно этой классической теории взаимодействия веществ с рецепторами, фармакологический эффект возникает при связывании рецептора с лекарственным средством, а образование комплекса препарат—рецептор подчиняется закону действующих масс. С некоторыми изменениями эта теория была использована для создания модели, описывающей действие агонистов (Arins, 1954; Stephenson, 1956; Fur-chgott, 1966) и антагонистов (Gaddum, 1937, 1957; Schild, 1957). Стефенсоном было введено также важное понятие стимуляции, отражающее степень активации рецепторов под действием того или иного агониста (см. ниже и рис. 2.5).
Основные элементы оккупационной теории представлены на рис. 2.5. Мерой сродства лекарственного средства к рецептору служит Kd комплекса препарат—рецептор; доля занятых рецепторов зависит от концентрации лекарственного средства и Кd. Константа пропорциональности е — это внутренняя активность препарата, то есть его способность вызывать фармакологический эффект. Произведение доли занятых рецепторов, внутренней активности препарата и общего числа рецепторов представляет собой величину стимуляции (см. выше), то есть сигнала, который получает биологическая система. Этот сигнал запускает цепь биохимических изменений, в ходе которых он передается конечным эффекторным белкам, генерирующим ответную реакцию. Эффект лекарственного средства зависит от доли занятых рецепторов и механизмов внутриклеточной передачи сигнала. Поскольку в ходе этой передачи сигнал усиливается, кривая доза—эффект сдвинута влево относительно кривой доза — занятость рецепторов. Прежде чем количественно оценивать взаимодействие лекарственного средства с рецептором, рассмотрим более подробно механизм усиления сигнала, так как от этого во многом зависит выраженность фармакологического эффекта.
Описание к рис. 2.5. Основные положения оккупационной теории. Лекарственное средство А связывается с рецептором Р и образует комплекс АР, сигнал от которого обрабатывается клеткой и преобразуется в фармакологический эффект. Степень занятости рецепторов, в соответствии с уравнением изотермы адсорбции Ленгмюра, равна [A]/([AJ + Kj). Величина сигнала, который получает каждый связанный с лекарственным средством рецептор, пропорциональна внутренней активности препарата (б). Умножив эту величину на число рецепторов ([Р]), получим величину стимуляции — суммарного сигнала, поступающего в биологическую систему от всех рецепторов. Этот сигнал запускает цепь биохимических изменений, в ходе которых он преобразуется в ответную реакцию системы. На рисунке представлена зависимость ответной реакции (в процентах от максимальной) и доли занятых рецепторов от концентрации лекарственного средства ([А]) в полулогарифмических координатах.
Взаимосвязь между усилением сигнала и фармакологическим эффектом
Первоначальный сигнал, который рецептор получает при связывании лекарственного средства, в дальнейшем усиливается клеткой. Степень усиления сигнала в разных типах клеток неодинакова: в одних клетках слабый сигнал не приводит к заметному эффекту, зато в других вызывает сильную реакцию. От способности клетки усиливать полученный рецептором сигнал (то есть от эффективности сопряжения стимула с ответной реакцией) зависит выраженность фармакологического эффекта. На рис. 2.6 представлено действие трех лекарственных средств с разной внутренней активностью на три клетки, различающиеся эффективностью сопряжения стимула с ответной реакцией. Клетка I незначительно усиливает сигнал от рецептора, но лекарственное средство А вызывает максимальную ответную реакцию, то есть является полным агонистом этого рецептора. Лекарственное средство Б вызывает менее выраженную реакцию, а значит, является частичным агонистом. Лекарственное средство В, в отличие от препаратов А и Б, не вызывает клеточной реакции, но связывается с рецепторами и, следовательно, относится к антагонистам. В клетке II сопряжение стимула с ответной реакцией происходит более эффективно. При испытании лекарственных средств А, Б и В на клетке II первое и второе вели себя как полные агонисты, а третье — как частичный агонист, хотя в клетке I внутренней активности препарата В оказалось недостаточно для формирования ответной реакции. Итак, свойства исследуемых препаратов остались прежними, изменилась лишь эффективность сопряжения стимула с ответной реакцией. В результате препарат Б из частичного агониста превратился в полного агониста, а препарат В — из антагониста в частичного агониста. Более того, при испытании тех же лекарственных средств на клетках III типа, с еще более эффективным механизмом усиления сигнала, все три препарата вели себя как полные агонисты. Этот пример показывает, насколько ошибочной может быть классификация лекарственных средств, когда она основана не на их природе, а на наблюдаемых фармакологических эффектах. Это особенно важно, если препарат испытывают на одном типе клеток, а применяют для воздействия на другой тип — ведь фармакологический эффект зависит от свойств рецептора и сопряженных с ним сигнальных белков. Выход состоит в том, чтобы классифицировать лекарственные средства по выраженности их свойств: сродства к рецепторам и внутренней активности. На основании количественной оценки этих свойств можно предсказать действие лекарственного средства на любую биологическую систему, если известно, с какими рецепторами оно взаимодействует.
Количественная оценка взаимодействия рецепторов с агонистами
Взаимодействие лекарственных средств с биологическими системами можно охарактеризовать двумя показателями — активностью и эффективностью. Об эффективности судят по величине максимального фармакологического эффекта. Активность препарата зависит от четырех параметров: два из них характеризуют биологическую систему (плотность рецепторов и эффективность механизма усиления сигнала), два других — взаимодействие вещества с рецептором (сродство препарата к рецепторам и его внутренняя активность). Если два равноэффективных препарата испытывают в одной и той же биологической системе (то есть механизм внутриклеточной передачи сигнала от рецепторов к эффекторам одинаков), их сравнительная активность служит относительным показателем внутренней активности и сродства к рецепторам (рис. 2.7, А). Таким образом, измерение сравнительной активности агонистов позволяет оценить их способность вызывать ответную реакцию исследуемой системы и предсказывать сравнительную активность этих препаратов в другой системе. Еще один метод оценки действия агонистов — сравнение их эффективности в биологической системе, где они не вызывают максимально возможную реакцию (рис. 2.7, В). Преимущество второго метода в том, что эффективность зависит только от внутренней активности, а активность — как от внутренней активности, так и от сродства препарата к рецепторам.
Описание к рис. 2.7. Два способа количественной оценки взаимодействия агонистов с рецепторами. А. Сравнительная активность двух агонистов (А и Б) в одной и той же биологической системе служит относительным показателем их внутренней активности и сродства к рецепторам. Б. Сравнительная эффективность агонистов в биологической системе, в которой они не вызывают максимально возможную ответную реакцию, служит относительным показателем их внутренней активности (нелинейно зависит от нее). Л — лекарственное средство.
Количественная оценка взаимодействия рецепторов с антагонистами
Как правило, антагонисты так или иначе блокируют рецепторы. Конкурентный антагонист не обладает внутренней активностью, но имеет сродство к рецептору и конкурирует с агонистом за участки связывания. Для конкурентных антагонистов характерен параллельный сдвиг вправо кривой доза—эффект для агониста; максимальный эффект агониста не изменяется (рис. 2.8, А). Величина этого сдвига зависит от концентрации антагониста и его сродства к рецепторам и, следовательно, может служить показателем сродства антагониста к рецепторам. Впервые это было отмечено Шилдом в 1957 г. Следует помнить, что частичные агонисты тоже могут конкурировать с полными агонистами за участки связывания с рецептором. Но, в отличие от антагонистов, которые в достаточной концентрации могут полностью заблокировать действие полных агонистов, частичные агонисты с ростом концентрации подавляют эффект полных агонистов только до определенного уровня — своего максимального эффекта. Таким образом, частичные агонисты можно применять в тех случаях, когда необходимо ослабить стимуляцию рецепторов, полностью не блокируя их.
Иногда диссоциация комплекса антагонист—рецептор происходит столь медленно, что связь между ними можно считать необратимой. При определенных концентрациях антагониста максимальный эффект агониста уменьшается (рис. 2.8, Б). Такие препараты относят к неконкурентным антагонистам. В основе неконкурентного антагонизма могут лежать и иные молекулярные механизмы. Аналогичная картина (рис. 2.8, Ё) наблюдается и в том случае, когда за участки связывания с рецептором конкурируют истинно необратимые антагонисты.
Если участки связывания агониста и антагониста с рецептором разные, последний тоже относят к неконкурентным антагонистам. Такой антагонизм обусловлен аллостерическим взаимодействием (рис. 2.8, В). Амостерические антагонисты снижают сродство рецептора к агонистам. В некоторых случаях аллостерическое взаимодействие приводит к усилению действия агонистов, то есть препараты действуют как синергисты (рис. 2.8, Г). Синергисты можно использовать для усиления сигнала от рецепторов и, что особенно важно, для восстановления опосредованных ими физиологических эффектов в тех случаях, когда снижено число рецепторов (миастения, болезнь Альцгеймера).
Рисунок 2.6. Действие лекарственных средств с разной внутренней активностью на клетки, отличающиеся эффективностью сопряжения стимула (сигнала от рецептора) с ответной реакцией. Л — лекарственное средство. Подробнее см. в тексте.
Рисунок 2.7. Два способа количественной оценки взаимодействия агонистов с рецепторами. А. Сравнительная активность двух агонистов (А и Б) в одной и той же биологической системе служит относительным показателем их внутренней активности и сродства к рецепторам. Б. Сравнительная эффективность агонистов в биологической системе, в которой они не вызывают максимально возможную ответную реакцию, служит относительным показателем их внутренней активности (нелинейно зависит от нее). Л — лекарственное средство.
Благодаря молекулярно-генетическим методам, которые позволили усилить экспрессию рецепторов, выявить и синтезировать дефектные рецепторы, постоянно активированные вследствие мутаций, был открыт новый тип антагонистов — обратные агонисты. Как уже упоминалось выше, рецепторы могут спонтанно (в отсутствие лиганда) принимать активированную конформацию и вызывать клеточную реакцию. Наблюдать клеточную реакцию в отсутствие агониста обычно не удается из-за того, что доля активированных рецепторов слишком мала. Если же усилить экспрессию рецепторов или сдвинуть с помощью направленного мутагенеза равновесие между неактивированными и спонтанно активированными рецепторами в сторону последних, конститутивная (не обусловленная связыванием с агонистом) активация рецепторов вызовет заметную клеточную реакцию, которая не подавляется при добавлении конкурентного антагониста. Поскольку обратные агонисты избирательно связываются с неактивированными рецепторами, сдвигая равновесие в сторону последних, они подавляют конститутивный сигнал от рецепторов. В отсутствие конститутивной активации рецепторов обратные агонисты ведут себя как конкурентные антагонисты. Этим отчасти можно объяснить, почему обратный агонизм был открыт недавно, а некоторые препараты, которые теперь относят к обратным агонистам, прежде считались конкурентными антагонистами.
Роль конститутивной активации рецепторов в развитии заболеваний не вполне ясна, что затрудняет терапевтическое применение обратных агонистов. Тем не менее в некоторых случаях обратные агонисты имеют явные преимущества перед конкурентными антагонистами. Например, ген герпесвируса человека типа 8 кодирует постоянно активированный рецептор хемокинов, который через второго посредника регулирует клеточную пролиферацию и репродукцию вируса (Arvanitakis et al., 1997). Поскольку агонист в этих процессах не участвует, применять конкурентные антагонисты нецелесообразно, а обратные агонисты, возможно, окажутся эффективными.
Перспективы
Расшифровка генома человека дала новый толчок открытию ранее неизвестных рецепторов и новых их классов. Вместе с колоссальными возможностями, открывшимися благодаря новым методам разработки лекарственных средств (комбинаторная химия, технологии рекомбинантных ДНК), это позволяет надеяться на появление огромного разнообразия высокоизбирательных лекарственных средств.
Рисунок 2.8. Механизмы действия антагонистов. А. Конкурентный антагонист Б связывается с тем же участком рецептора, что и агонист А. Кривая доза—эффект для агониста сдвинута вправо. Вели-чина этого сдвига зависит от концентрации антагониста — с увеличением концентрации антагониста ЭК*, (рис. 2.4) для агониста линейно растет. Б. Если антагонист связывается с тем же участком рецептора, что и агонист, но образует истинно необратимое (в случае ковалентной связи) либо малодиссоциирующее соединение, наблюдается не только сдвиг вправо кривой доза—эффект для агониста, но и уменьшение его максимального эффекта (неконкурентный антагонизм). При аллостерическом взаимодействии двух препаратов возможно как ослабление реакции на агонист — неконкурентный антагонизм (В), так и ее усиление — синергизм (Г). Аллостерическое взаимодействие характеризуется насыщаемостью: максимальное подавление действия агониста достигается при полной занятости участков связывания для антагониста.
Читайте также
Литература
- Aliens, E.J. Affinity and intrinsic activity in the theory of competitive inhibition. I. Problems and theory. Arch. Int. Pharmacodyn., 1954,99:32— 49.
- Arvanitakis, L., Geras-Raaka, E., Varma, A., Gershengom, M.C., Ce-sarman, E. Human herpesvirus KSHV encodes a constitutively active G protein-coupled receptor linked to cell proliferation. Nature, 1997, 385: 347-350.
- Clapham, D.E. Mutations in G protein-linked receptors: novel insights on disease. Cell, 1993,75:1237-1239.
- Furchgott, R.F. The use of [3-haloalkylamines in the diiTerentiation of receptors and in the determination of dissociation constants of receptor-agonist complexes. In, Advances in Drug Research, Vfol. 3 (Harper, N J., and Simmonds, A.B., eds.) London, New York, Academic Press, 1966, pp. 21—55.
- Gaddum, J.H. The quantitative effects of antagonistic drugs. J. Physiol., London, 1937, 89:7P—9P.
- Gaddum, J.H. Theories of drug antagonism. Pharmacol. Rev., 1957,9: 211-218.
- Ross, E.M.G proteins and receptors in neuronal signaling. In, An Introduction to Molecular Neurobiology. (Hall, Z.W., ed.) MA, Sinauer Associates, 1992, pp. 181—206.
- Schild, H.O. Drug antagonism and pAx. Pharmacol Rev., 1957, 9: 242-246.
- Young, D., Waitches, G., Birchmeier, C., Fasano, O., Wigler, M. Isolation and characterization of a new cellular oncogene encoding a protein with multiple potential transmembrane domains. Cell, 1986,45:711—719.