Стимуляторы М-холинорецепторов — различия между версиями
Febor (обсуждение | вклад) (Новая страница: «{{Клинфарм1}} == Стимуляторы М-холинорецепторов == Эти вещества можно разделить на 2 группы:…») |
Zabava (обсуждение | вклад) (→Эфиры холина и природные алкалоиды) |
||
| Строка 128: | Строка 128: | ||
Симптомы отравления грибами, содержащими мускарин, были известны давно. Однако подробное исследование этого алкалоида стало возможным лишь после того, как в 1869 г. Шмидберг выделил его из красного мухомора Amanita muscaria. Значение мускарина в развитии теории химической передачи нервного импульса подробно рассматривалось в [[Холинергические рецепторы и синапсы]]. Ареколин — это главный алкалоид семян арековой (бетельной) пальмы (Агеса catechu). Эти семена вместе с известью и листьями перца бетель (Piper betle) входят в состав так называемой бетелевой жвачки, которую жители Индии и некоторых других страд используют в качестве стимулирующего и наркотического средства. | Симптомы отравления грибами, содержащими мускарин, были известны давно. Однако подробное исследование этого алкалоида стало возможным лишь после того, как в 1869 г. Шмидберг выделил его из красного мухомора Amanita muscaria. Значение мускарина в развитии теории химической передачи нервного импульса подробно рассматривалось в [[Холинергические рецепторы и синапсы]]. Ареколин — это главный алкалоид семян арековой (бетельной) пальмы (Агеса catechu). Эти семена вместе с известью и листьями перца бетель (Piper betle) входят в состав так называемой бетелевой жвачки, которую жители Индии и некоторых других страд используют в качестве стимулирующего и наркотического средства. | ||
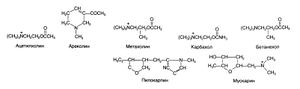
| + | [[Image:Gud_7_1.jpg|300px|thumb|right|Рисунок 7.1. Структурные формулы М-холиностимуляторов ]] | ||
'''Структурно-функциональная зависимость'''. По сравнению с синтетическими эфирами холина природные алкалоиды с мускариноподобным действием значительно различаются по структуре (рис. 7.1). Ареколин и пилокарпин — это третичные амины, а мускарин — четвертичное аммониевое основание (поэтому он хуже всасывается). Подробно химические и фармакологические свойства многих природных и синтетических М-холиностимуляторов рассмотрены в обзоре Bebbington and Brimblecombe (1965). Высказывались предположения, что McN-A-343 может избирательно стимулировать М (-холинорецепторы. Однако его преимущественное действие на симпатические ганглии и тормозные нейроны межмышечного сплетения объясняется скорее физиологическими особенностями, чем повышенным сродством к данному типу рецепторов. На настоящий момент избирательных М гхолиностимупяторов не существует (Caulfield and Birdsall, 1998). | '''Структурно-функциональная зависимость'''. По сравнению с синтетическими эфирами холина природные алкалоиды с мускариноподобным действием значительно различаются по структуре (рис. 7.1). Ареколин и пилокарпин — это третичные амины, а мускарин — четвертичное аммониевое основание (поэтому он хуже всасывается). Подробно химические и фармакологические свойства многих природных и синтетических М-холиностимуляторов рассмотрены в обзоре Bebbington and Brimblecombe (1965). Высказывались предположения, что McN-A-343 может избирательно стимулировать М (-холинорецепторы. Однако его преимущественное действие на симпатические ганглии и тормозные нейроны межмышечного сплетения объясняется скорее физиологическими особенностями, чем повышенным сродством к данному типу рецепторов. На настоящий момент избирательных М гхолиностимупяторов не существует (Caulfield and Birdsall, 1998). | ||
Версия 11:01, 5 апреля 2014
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Стимуляторы М-холинорецепторов
Эти вещества можно разделить на 2 группы: 1) ацетилхолин и синтетические эфиры холина, 2) природные алкалоиды (пилокарпин, мускарин, ареколин) и их синтетические производные. Кроме того, парасимпатомиметическим действием обладают ингибиторы АХЭ (гл. 8) и ганглиостимуляторы (гл. 9). Это действие непрямое и бывает опосредовано влиянием не только на нейроэффекторные парасимпатические синапсы, но и на иные, отдаленные от них структуры.
Ацетилхолин
Ацетилхолин был впервые синтезирован Байером в 1867 г. Как лекарственное средство он почти не применяется в связи с генерализованным действием и быстрым гидролизом АХЭ и псевдохолинэстеразой. Для того чтобы получить препараты с более избирательным и продолжительным эффектом, были синтезированы многочисленные производные ацетилхолина.
Механизм действия. Действие эндогенного ацетилхолина во всех четырех видах холинергических синапсов рассматривалось в статье Холинергические рецепторы и синапсы. Вспомним, что эти четыре вида синапсов следующие:
- образованные постганглионарными парасимпатическими волокнами на внутренних органах,
- образованные преганглионарными волокнами на постганглионарных симпатических и парасимпатических нейронах и клетках мозгового вещества надпочечников,
- образованные соматическими волокнами на скелетных мышцах,
- на некоторых центральных и периферических нейронах, где ацетилхолин может действовать как на пресинаптические, так и на постсинаптические рецепторы.
При системном введении ацетилхолин может действовать на все эти синапсы, хотя через гематоэнцефалический барьер он проникает плохо (как и все другие четвертичные аммониевые основания), а в крови быстро разрушается псевдохолинэстеразой и поэтому достигает органов с невысоким кровотоком лишь в низких концентрациях.
Действие ацетилхолина и подобных ему веществ на внутренние органы называется мускариноподобным, так как может быть воспроизведено мускарином. Таким образом, эффекты рассматриваемых здесь М-холиностимуляторов почти такие же, как и действие парасимпатических постганглионарных волокон (табл. 6.1). Различия во влияниях типичных М-холиностимуляторов носят в основном количественный характер, а их избирательность в отношении тех или иных органов ограничена. М-холинорецепторы обнаружены также в вегетативных ганглиях и на клетках мозгового вещества надпочечников; полагают, что они модулируют передачу, осуществляемую через N-холинорецепторы. Все влияния ацетилхолина и сходных с ним веществ на М-холинорецепторы могут быть блокированы атропином. Никотиноподобным же эффектом называют стимулирующее (а в больших дозах — часто блокирующее) действие на вегетативные ганглии, мозговое вещество надпочечников и скелетные мышцы. Это действие воспроизводится никотином. Подтипы М-холинорецепторов. Первоначально М-холинорецепторы были разделены на подтипы на основании различий в реакциях разных тканей на фармакологические вещества. В частности, разные влияния двух М-холиностимуляторов — бетанехола и McN-A-343 — на тонус нижнего пищеводного сфинктера послужили основанием для выделения Мг и М2-холино-рецепторов; предполагалось, что первые располагаются на нейронах вегетативных ганглиев, а вторые — на иннервируемых органах (Goyal and Rattan, 1978; см. также гл. 6). Однако причины избирательного действия этих двух веществ на самом деле не ясны, и вообще нет убедительных доказательств того, что стимуляторы могут влиять преимущественно на тот или иной подтип М-холинорецепторов (Eglen et al., 1996; Caulfield and Bird-sall, 1998). В то же время исследования связывания меченых лигандов показали, что существует несколько типов участков связывания М-холиноблокаторов (Hammer et al., 1980). В частности, пирензепин обладал высоким сродством к рецепторам в коре головного мозга и симпатических ганглиях (М1-холинорецепторам), но низким сродством — к рецепторам в сердце, гладких мышцах и железах. Именно поэтому пирензепин в низких концентрациях блокирует эффекты М-холиностимуляторов, обусловленные активацией М-холинорецепторов постганглионарных нейронов симпатических и парасимпатических ганглиев, но лишь в высоких концентрациях — обусловленные активацией М-холинорецепторов самих эффекторных органов. Разработаны избирательные блокаторы и других подтипов М-холинорецепторов. Так, трипитрамин обладает большей активностью в отношении М2-холинорецепторов (преобладающих в сердце), чем в отношении М3-холинорецепторов (преобладающих в гладких мышцах и железах), а дарифенацин — наоборот (Caulfield and Birdsall, 1998; Birdsall et al., 1998; Levine et al., 1999).
Клонирование кДНК М-холинорецепторов позволило выявить 5 генных продуктов (Bonner et al., 1987), которые теперь обозначаются как М(—М5-холинорецепторы (гл. 6). Все известные подтипы М-холинорецепторов связаны с G-белками (гетеротримерными ГТФ-связывающими регуляторными белками), которые, в свою очередь, сопряжены с различными системами внутриклеточной сигнализации (гл. 2). С помощью направленного мутагенеза и получения химерных М-холинорецепторов разных подтипов были обнаружены участки этих рецепторов, отвечающие за специфическое сродство к тому или иному G-белку. Один такой участок был выявлен у С-концевой области третьей внутриклеточной петли; он обладает высокой степенью гомологии у Мг, М3- и М5-холинорецепторов, с одной стороны, и у М2- и М4-холинорецепторов — с другой (Wees, 1996; Caulfield, 1993; Caulfield and Birdsall, 1998). В распознавании конкретных G-белков участвуют также консервативные участки второй внутриклеточной петли. Хотя сродство к той или иной разновидности G-белка у разных подтипов М-холинорецепторов не абсолютно, но все же стимуляция Мр и М3-холинорецепторов приводит преимущественно к активации белка Gq и, как следствие, к активации фосфолипазы С, гидролизу фосфоинозитидов и высвобождению Са2+ из внутриклеточных депо (гл. 6); в свою очередь, Са2+ вызывает ряд внутриклеточных реакций — либо сам по себе, либо через фосфорилирование эффекторных белков. Напротив, стимуляция М2- и М4-холинорецепторов сопровождается активацией чувствительных к коклюшному токсину белков G, и G0 (гл. 2 и 12), ингибированием аденилатциклазы и изменением проницаемостей некоторых ионных каналов (например, открыванием калиевого канала в предсердиях).
Использование специфических к разных подтипам М-холинорецепторов антител и лигандов позволило установить локализацию этих подтипов, например в разных структурах голов-ного мозга и гладкомышечных органах (Levey, 1993; Yasudaet al., 1993; Eglen et al., 1996; Caulfield and Birdsall, 1998). У мышей удалось инактивировать гены всех подтипов, кроме М5 (Hamilton etal., 1997; Gomezaet al., 1999a, b; Matsui et al., 2000). Оказалось, что отсутствие Mp, M2- или М4-холинорецепторов приводит к нарушению центральных реакций на М-холиностимуляторы — эти вещества вызывали, в частности, эпилептические припадки, гипотермию, тремор, анальгезию. Отсутствие же М3-холинорецепторов сопровождалось периферическими расстройствами — нарушением слюноотделения, сужения зрачков, мочеиспускания. В целом же физиологические последствия отсутствия какого-либо одного подтипа М-холинорецепторов были незначительными, что может свидетельствовать о том, что в разных тканях имеется несколько разных подтипов.
Фармакологические свойства
Сердечно-сосудистая система. Ацетилхолин вызывает следующие основные реакции со стороны сердечно-сосудистой системы: 1) расширение сосудов, 2) снижение ЧСС (отрицательный хронотропный эффект), 3) замедление проведения в синусовом и АВ-узле (отрицательный дромотропный эффект), 4) снижение силы сокращений сердца (отрицательный инотропный эффект, выраженный главным образом в предсердиях). Некоторые из этих реакций могут быть сглаженными из-за вторичной активации барорефлекса и других рефлексов.
Ацетилхолин почти не используют как лекарственное средство, однако влияния его на сердце имеют большое клиническое значение — при многих вмешательствах происходит непрямое усиление холинергических воздействий. Примером может быть прием препаратов с ваготропным действием (сердечных гликозидов, некоторых антиаритмических средств), рефлекторное усиление парасимпатических влияний в ответ на стимуляцию рецепторов внутренних органов при операциях и т. д. В/в введение ацетилхолина в малых дозах приводит к мимолетному снижению АД (из-за генерализованного расширения сосудов) и, обычно, к рефлекторной тахикардии. Для того чтобы проявилось прямое действие ацетилхолина на сердце (брадикардия, АВ-блокада), нужны значительно большие дозы. При введении же таких доз на фоне атропина, напротив, АД возрастает из-за стимуляции мозгового вещества надпочечников, симпатических ганглиев и окончаний симпатических постганглионарных волокон.
Хотя в большинстве сосудов холинергические волокна не обнаружены, ацетилхолин вызывает расширение почти всех сосудов, в том числе легочных и коронарных. В последнем случае эффект ацетилхолина опосредован N0. Расширение коронарных сосудов можно вызвать стимуляцией баро- или хеморецепторов либо прямым раздражением двигательных волокон блуждающих нервов (FeigI, 1998). Однако ни парасимпатическая вазодилатация, ни симпатическая вазоконстрикция не играют такой важной роли в регуляции коронарного кровотока, как местные факторы — Р02, аденозин и другие (Berne and Levy, 1997).
Сосудорасширяющее влияние ацетилхолина опосредовано М-холинорецепторами, преимущественно подтипа М3 (Bruning et al., 1994; Eglen et al., 1996; Caulfield and Birdsall, 1998). Очевидно, эти рецепторы располагаются на эндотелиальных клетках, и при их активации выделяется NO (Moncada and Higgs, 1997); это вещество диффундирует к прилегающим гладкомышечным клеткам и вызывает их расслабление (Furchgott, 1999; Ignarro et al., 1999; см. также гл. 6). Кроме того, сосудорасширяющий эффект ацетилхолина может быть обусловлен и торможением выброса норадреналина из адренергических окончаний. При повреждении эндотелия ацетилхолин действует непосредственно на гладкомышечные клетки, вызывая их сокращение.
На сердце ацетилхолин может действовать как непосредственно, так и путем подавления симпатических влияний. Последний эффект зависит, разумеется, от выраженности этих влияний. Его механизмами могут быть, в частности, торможение образования цАМФ и снижение вероятности открывания медленных кальциевых каналов L-типа (Brodde and Michel, 1999). Парасимпатическая иннервация синусового и АВ-узлов и предсердий чрезвычайно обильна, и поэтому блуждающие нервы оказываютсильное влияние на эти структуры. Напротив, парасимпатическая иннервация желудочков скудна, и большинство холинергических волокон оканчиваются на клетках проводящей системы сердца, например волокнах Пуркинье (Kent et al., 1974; Levy and Schwartz, 1994).
Самопроизвольное возникновение импульсов в синусовом узле обусловлено спонтанной диастолической деполяризацией клеток — водителей ритма (гл. 35). Очередной потенциал действия возникает, когда в результате этой деполяризации достигается критический уровень. Затем потенциал действия распространяется по предсердиям, АВ-узлу, желудочковой проводящей системе и рабочему миокарду желудочков. Снижение ЧСС поддействием ацетилхолина обусловлено замедлением спонтанной диастолической деполяризации в клетках — водителях ритма и их гиперполяризацией; и то, и другое приводит ктому, что критический уровень деполяризации достигается позднее (DiFrancesco, 1993).
Отрицательный инотропный эффект ацетилхолина на предсердия обусловлен стимуляцией М2-холинорецепторов и открыванием активируемых G-белком калиевых каналов (Wickman and Clapham, 1995). Увеличение калиевой проницаемости приводит к гиперполяризации и укорочению потенциала действия и рефрактерного периода. Скорость проведения возбуждения по предсердиям в норме не меняется либо возрастает; последний эффект обусловлен тем, что гиперполяризация приводит к открыванию дополнительного числа быстрых натриевых каналов. Все это объясняет, почему возбуждение блуждающих нервов провоцирует или делает более устойчивой мерцательную аритмию либо трепетание предсердий. Напротив, в АВ-узле (и в гораздо меньшей степени в волокнах Пуркинье) ацетилхолин замедляет проведение и удлиняет рефрактерный период. При введении в больших дозах М-холиностимуляторы могут ухудшить АВ-проведение вплоть до полной блокады. Повышение парасимпатического тонуса (например, под действием сердечных гликозидов) может приводить к тому, что из-за удлинения рефрактерного периода АВ-узла снижается предельная частота проходящих через него импульсов; в условиях мерцательной аритмии или трепетания предсердий это оказывает благотворный эффект, так как ограничивает частоту желудочковых сокращений.
В желудочках ацетилхолин (будь то эндогенный или экзогенный) также оказывает отрицательный инотропный эффект, хотя гораздо менее выраженный, чем в предсердиях. У человека и большинства млекопитающих этот эффект проявляется только на фоне предварительной адренергической стимуляции (Higgins et al., 1973; Levy and Schwartz, 1994; Brodde and Michel, 1999). Кроме того, ацетилхолин подавляет автоматизм волокон Пуркинье и повышает порог фибрилляции желудочков (Kent et al., 1974; Kent and Epstein, 1976). Поскольку симпатические и парасимпатические окончания лежат рядом, полагают, что М-холинорецепторы могут быть не только постсинаптическими, но и пресинаптическими (Wellstein and Pitschner, 1988). Таким образом, способность ацетилхолина снижать реакцию желудочков на катехоламины может быть обусловлена как подавлением их действия, так и уменьшением их высвобождения.
ЖКТ и мочевые пути. Раздражение блуждающих нервов приводит к повышению тонуса и силы сокращений и увеличению секреции желудка и кишечника, однако экзогенный ацетилхолин вызывает такие реакции не всегда — концентрация его в области рецепторов ограничена из-за невысокого кишечного кровотока и разрушения псевдохолинэстеразой. То же касается и воспроизведения ацетилхолином эффектов крестцовых парасимпатических нервов — сокращения детрузора, повышения давления в мочевом пузыре, усиления перистальтики мочеточника.
Прочие органы. Влияние ацетилхолина на разные органы и ткани подробно рассмотрено в гл. 6. Ацетилхолин и его аналоги стимулируют секрецию всех желез с парасимпатической иннервацией, в том числе слезных, трахеобронхиальных, слюнных и других пищеварительных и потовых. Влияние ацетилхолина на дыхательную систему включает не только повышение секреции, но и сокращение бронхиол и стимуляцию хеморецепторов аортальных телец и сонных гломусов. При закапывании в глаз аналоги ацетилхолина вызывают сужение зрачка (Офтальмологические средства (препараты)).
Холиноблокаторы. Действие ацетилхолина и его аналогов на М-холинорецепторы избирательно блокируется атропином за счет конкурентного связывания с этими рецепторами — прежде всего на эффекторных органах, но также в вегетативных ганглиях. Никотиноподобный же эффект ацетилхолина в вегетативных ганглиях блокируется гексаметонием и триметафана камсилатом, а в нервно-мышечных синапсах — тубокурарином и другими миорелаксантами (гл. 9).
Эфиры холина и природные алкалоиды
Метахолин (ацетил-β-метилхолин) отличается от ацетилхолина главным образом продолжительностью и избирательностью действия. Продолжительность его влияния обусловлена тем, что он гидролизуется значительно медленнее ацетилхолина, и на него почти не действует псевдохолинэстераза. Избирательность же проявляется слабым никотиноподобным и сильным мускариноподобным действием, особенно выраженным в сердечно-сосудистой системе (табл. 7.1).
Незамещенные карбамоиловые эфиры карбахол и бетанехол не гидролизуются ни АХЭ, ни иными холинэстеразами, и их Т1/2 достаточен для того, чтобы они могли проникнуть в достаточно больших концентрациях в ткани с низким кровотоком. Бетанехол оказывает преимущественно мускариноподобное действие и обладает некоторой избирательностью в отношении ЖКТ и мочевого пузыря. Карбахол же оказывает и достаточно выраженное никотиноподобное действие, главным образом на вегетативные ганглии. Возможно, его эффекты по меньшей мере частично обусловлены выбросом ацетилхолина из нервных окончаний.
Таблица 7.1. Фармакологические свойства эфиров холина и природных холиномиметических алкалоидов
|
Вещество |
Чувствительность к холинэстеразам |
Мускариноподооное действие |
никотино-подобное действие | ||||
|
Сердечно-сосудистая система |
ЖКТ |
Мочевой пузырь |
Глаза (при местном применении) |
Устранение эффектов атропином | |||
|
Ацетилхолин |
+++ |
++ |
++ |
++ |
+ |
+++ |
++ |
|
Метахолин |
+ |
+++ |
++ |
++ |
+ |
+++ |
+ |
|
Карбахол |
- |
+ |
+++ |
+++ |
++ |
+ |
+++ |
|
Бетанехол |
- |
+ |
+++ |
+++ |
++ |
+++ |
- |
|
Мускарин |
- |
++ |
+++ |
+++ |
++ |
+++ |
- |
|
Пилокарпин |
- |
+ |
+++ |
+++ |
++ |
+++ |
- |
Механизмы действия М-холиностимуляторов из группы природных алкалоидов — пилокарпина, мускарина и ареколина — такие же, как и эфиров холина. Мускарин действует исключительно на М-холинорецепторы, что, собственно, и послужило основанием для их выделения. Ареколин действует также на N-холинорецепторы. Пилокарпин обладает преимущественно мускариноподобным действием, но оказывает некоторые необычные влияния на сердечно-сосудистую систему, и к нему особенно чувствительны потовые железы. Эти три препарата очень важны для научных исследований, но их применение в клинике сводится главным образом к использованию пилокарпина как средства, сужающего зрачок (гл. 66) и стимулирующего слюноотделение.
Историческая справка. Источники. Из нескольких сотен известных синтетических производных холина в клинике применяют только метахолин, карбахол и бетанехол. Их структура приведена на рис. 7.1. Бета-метилированный аналог ацетилхолина метахолин был исследован Хантом и Тавоуже в 1911 г. Карбамоиловый эфир холина карбахол и его β-метилированный аналог бетанехол были синтезированы и изучены в 1930-х гг. Пилокарпин — это главный алкалоид листьев южноамериканских растений рода Pilocarpus. Местным жителям издавна было известно, что жевание этих листьев вызывает обильное слюноотделение; первые же опыты с их экстрактом были проведены, видимо, в 1874 г. бразильским врачом по фамилии Котиньо. В 1875 г. пилокарпин был выделен, и вскоре Вебер описал его действие на зрачки, потовые и слюнные железы.
Симптомы отравления грибами, содержащими мускарин, были известны давно. Однако подробное исследование этого алкалоида стало возможным лишь после того, как в 1869 г. Шмидберг выделил его из красного мухомора Amanita muscaria. Значение мускарина в развитии теории химической передачи нервного импульса подробно рассматривалось в Холинергические рецепторы и синапсы. Ареколин — это главный алкалоид семян арековой (бетельной) пальмы (Агеса catechu). Эти семена вместе с известью и листьями перца бетель (Piper betle) входят в состав так называемой бетелевой жвачки, которую жители Индии и некоторых других страд используют в качестве стимулирующего и наркотического средства.
Структурно-функциональная зависимость. По сравнению с синтетическими эфирами холина природные алкалоиды с мускариноподобным действием значительно различаются по структуре (рис. 7.1). Ареколин и пилокарпин — это третичные амины, а мускарин — четвертичное аммониевое основание (поэтому он хуже всасывается). Подробно химические и фармакологические свойства многих природных и синтетических М-холиностимуляторов рассмотрены в обзоре Bebbington and Brimblecombe (1965). Высказывались предположения, что McN-A-343 может избирательно стимулировать М (-холинорецепторы. Однако его преимущественное действие на симпатические ганглии и тормозные нейроны межмышечного сплетения объясняется скорее физиологическими особенностями, чем повышенным сродством к данному типу рецепторов. На настоящий момент избирательных М гхолиностимупяторов не существует (Caulfield and Birdsall, 1998).
Фармакологические свойства
ЖКТ. Все М-холиностимуляторы усиливают сокращения гладких мышц ЖКТ, то есть его тонус и перистальтику. В больших дозах они вызывают спазмы кишечника и тенезмы. Действие на ЖКТ карбахола, бетанехола и пилокарпина (в отличие от метахолина) не сопровождается существенными реакциями со стороны сердечно-сосудистой системы.
Мочевые пути. М-холиностимуляторы вызывают сокращение детрузора, тем самым повышая давление в мочевом пузыре и снижая его податливость. Кроме того, они стимулируют перистальтику мочеточника и вызывают расслабление мускулатуры пузырного треугольника и сфинктера мочевого пузыря. Бетанехол оказывает гораздо более выраженное действие на мочевой пузырь, чем на сердечно-сосудистую систему. У спинальных животных М-холиностимуляторы способствуют опорожнению мочевого пузыря.
Экзокринные железы. М-холиностимуляторы усиливают секрецию всех желез с парасимпатической или симпатической холинергической иннервацией — слезных, трахеобронхиальных, потовых, слюнных и других пищеварительных. Пилокарпин в дозе 10—15 мг п/к вызывает у человека профузное потоотделение — выделяется до 2—3 л пота. Одновременно резко повышается и слюноотделение. При приеме внутрь пилокарпин оказывает более длительное стимулирующее действие на слюноотделение. Мускарин и ареколин вызывают профузное пото- и слюноотделение, атакже икоту, тошноту, рвоту, слабость, иногда — падение АД.
Дыхательная система. М-холиностимуляторы усиливают секрецию трахеобронхиальных желез и вызывают сокращение гладких мышц бронхов. У больных бронхиальной астмой это приводит к бронхоспазму и снижению жизненной емкости легких. Сердечно-сосудистая система. Метахолин при непрерывном в/в введении вызывает снижение АД и ЧСС в дозе, в 200 раз меньшей, чем ацетилхолин. Мускарин в малых дозах также вызывает падение АД и замедление или даже временную остановку сердечных сокращений. Напротив, карбахол и бетанехол в дозах, оказывающих выраженное влияние на ЖКТ и мочевые пути, приводят лишь к временному снижению АД. Введение пилокарпина также сопровождается кратковременным снижением АД. На фоне же N-холиноблокаторов пилокарпин, напротив, вызывает существенное повышение АД. Оба эффекта устраняются атропином, а повышение АД — еще и а-адреноблокаторами. Это действие пилокарпина не совсем понятно. Полагают, что оно обусловлено стимуляцией симпатических постганглионарных нейронов и клеток мозгового вещества надпочечников. Глаза. М-холиностимуляторы вызывают сокращение сфинктера зрачка и ресничной мышцы, что приводит соответственно к сужению зрачка и спазму аккомодации.
ЦНС. При в/в введении в сравнительно небольших дозах пилокарпин, мускарин и ареколин вызывают у кошек характерную реакцию активации на ЭЭГ (такую же, как при введении ингибиторов АХЭ или электрическом раздражении ретикулярной формации). Эта реакция устраняется атропином и другими М-холиноблокаторами (Krnjevic, 1974). Синтетические эфиры холина — это четвертичные аммониевые основания, не проникающие через гематоэнцефалический барьер.
Применение
Бетанехол (хлорид) в таблетках или инъекциях применяют для стимуляции моторики ЖКТ, но особенно — мочевого пузыря. Пилокарпин (гидрохлорид) выпускается в таблетках по 5 мгдля лечения ксеростомии, а также в виде глазных препаратов (капель, мазей). Метахолин (хлорид) применяется в диагностике обструктивных заболеваний легких (например, бронхиальной астмы). Непредсказуемость всасывания и действия метахолина не позволяет использовать его как сосудорасширяющее и кардиотропное средство.
Заболевания ЖКТ. Бетанехол иногда используют при парезе желудка или послеоперационном парезе кишечника. Предпочтителен прием внутрь, обычно 10—20 мг 3—4 раза в сутки перед каждым приемом пиши. Однако в случае, когда эвакуация желудочного содержимого в двенадцатиперстную кишку полностью нарушена, бетанехол назначают п/к — из желудка он всасывается плохо. Его применяют также при болезни Гиршспрун-га и паралитической кишечной непроходимости, развившейся на фоне интоксикации. В настоящее время вместо бетанехола при парезе желудка и желудочно-пищеводном рефлюксе широко применяют средства, сочетающие М-холиностимулирующее и антидофаминергическое (метоклопрамид) или антисеротонинергическое (гл. 38) действие.
Нарушения мочеиспускания. Бетанехол применяют при задержке мочи и неполном опорожнении мочевого пузыря в отсутствие органической обструкции, например при послеоперационной или послеродовой задержке мочи и некоторых типах нейрогенной дисфункции мочевого пузыря (Wein, 1991). Бывает полезно одновременно назначить а-адреноблокаторы, так как они вызывают расслабление сфинктера мочевого пузыря (гл. 10).
У больных с повреждением спинного мозга бетанехол при сохранном мочеиспускательном рефлексе может усиливать сокращения детрузора. Некоторый положительный эффект наблюдается при частичном сенсорном или моторном типе гипорефлекторного мочевого пузыря. Иногда применение бетанехола позволяет избежать катетеризации. При острой задержке мочи порой прибегают к многократным п/к введениям бетанехола в дозе 2,5 мг (желудок при этом должен быть опорожнен).
В случае хронической задержки мочи иногда назначают бетанехол, 10—50 мг внутрь 2—4 раза в сутки во время еды (во избежание тошноты и рвоты). Когда восстанавливается произвольное или автоматическое мочеиспускание, препарат постепенно отменяют.
Ксеростомия. При ксеростомии, обусловленной облучением головы и шеи либо синдромом Шегрена, назначают пилокарпин, 5—10 мг внутрь (Wiseman and Faulds, 1995). Синдром Шегрена — это аутоиммунное заболевание, поражающее преимущественно женщин и сопровождающееся нарушением секреции желез — особенно слезных и слюнных (Anaya and Talal, 1999; Nusair and Rubinow, 1999). В таких случаях пилокарпин (если только сохранилась функционирующая ткань слюнных желез) вызывает повышение слюноотделения, облегчает глотание и приводит к субъективному улучшению, уменьшая сухость во рту. Побочные эффекты связаны со стимуляцией М-холинорецепторов других органов, главный из них — потливость. Иногда вместо пилокарпина используют бетанехол — некоторые больные считают, что он меньше усиливает потоотделение (Epstein et al., 1994). Недавно появился новый М-холиностимулятор — цевимелин. Этот препарат оказывает выраженное влияние на М3-холинорецепторы (напомним, что именно рецепторы этого подтипа имеются в слюнных и слезных железах). Его действие на слюноотделение более длительное, а побочные эффекты, возможно, менее выражены, чем у пилокарпина (Anaya and Talal, 1999), хотя сравнительные клинические испытания этих двух препаратов еще предстоят.
Глазные болезни. Пилокарпин (0,5—4% глазные капли) применяют при глаукоме. Обычно он переносится лучше, чем ингибиторы АХЭ. При открытоугольной глаукоме лечение начинают именно с него. Внутриглазное давление снижается через несколько минут после закапывания пилокарпина и держится на пониженном уровне в течение 4—8 ч. Пилокарпин используют и при приступе закрытоугольной глаукомы, а также для устранения мидриаза, вызванного атропином. В чередовании со средствами, расширяющими зрачок, пилокарпин назначают для разрыва спаек между радужкой и хрусталиком. Подробнее применение пилокарпина в офтальмологии, в том числе в сочетании с другими препаратами, рассматривается в Офтальмологические средства (препараты).
Нервные болезни. Некоторые фармакологические компании пытались разработать избирательные М1- и М2-холиностимуляторы. Отдельные М1-холиностимуляторы проходили клинические испытания при болезни Альцгеймера. Предполагалось, что эти средства будут стимулировать постсинаптические М1-холинорецепторы, не влияя на пресинаптические М2-холинорецепторы, активация которых приводит к снижению высвобождения ацетилхолина. Однако клинический эффект с точки зрения улучшения когнитивных функций был несущественным, и поэтому интерес к такого рода препаратам сильно снизился.
Побочные эффекты и противопоказания. При выраженных побочных эффектах назначают атропин (взрослым — 0,5—1 мг) п/к или в/в. Кроме того, при тяжелых реакциях со стороны сердечно-сосудистой и дыхательной систем с успехом используют адреналин (0,3—1 мгп/к).
Основные противопоказания к применению синтетических эфиров холина — это бронхиальная астма, тиреотоксикоз, ИБС и язвенная болезнь с повышенной кислотностью. При бронхиальной астме эти препараты могут спровоцировать приступ (в связи с влиянием на гладкие мышцы бронхов), при тиреотоксикозе — вызвать мерцательную аритмию, а при ИБС — уменьшить коронарный кровоток (в связи с гипотензивным действием). К другим побочным эффектам относятся приливы, потливость, схваткообразная боль в животе, отрыжка, чувство стеснения в мочевом пузыре, нарушения аккомодации, головная боль, повышенное слюноотделение.
Отравление
Картина отравления пилокарпином, мускарином и ареколином обусловлена чрезмерной активацией М-холинорецепторов и сходна с отравлением грибами рода волоконница (Inocybe) (см. ниже). Лечение сводится к назначению атропина в таких дозах, при которых он проникает через гематоэнцефалический барьер, поддержанию дыхания и кровообращения и предупреждению отека легких.
Отравления ядовитыми грибами. Ядовитые грибы известны с древности. Полагают, что именно от отравления грибами погибли жена и трое детей Еврипида. В последние годы такие отравления участились из-за увлечения дикорастущими грибами. Различных грибных токсинов много, и они могут быть различными даже у разных видов грибов, принадлежащих одному роду.
Хотя мускарин был впервые выделен из красного мухомора Amanita muscaria, содержание его в этом грибе настолько низкое (около 0,003%), что в общей картине отравления мухомором мускарин существенной роли не играет. Гораздо больше его в фибах рода волоконница (Inocybe) и говорушка (Clito-cybe). Картина отравления мускарином развивается быстро — через 30—60 мин после употребления гриба возникают обильное слюноотделение, слезотечение, тошнота, рвота, головная боль, нарушения зрения, схваткообразная боль в животе, понос, бронхоспазм, брадикардия и, наконец, падение АД и шок. Все эти проявления эффективно снимаются атропином, 1—2 мг в/м каждые 30 мин (Koppel, 1993; Goldfrank, 1998).
Отравление красным мухомором и другими мухоморами (Amanita) связано с влияниями на ЦНС мусцимола, иботеновой кислоты и других производных изоксазола. Все эти вещества активируют рецепторы возбуждающих и тормозных аминокислотных медиаторов. Симптомы отравления варьируют от возбудимости, беспокойства, атаксии, галлюцинаций и делирия до сонливости и сопора. Лечение преимущественно симптоматическое; при возбуждении показаны бензодиазепины. Атропин часто усугубляет делирий.
Грибы видов Psilocybe и Panaeolus содержат псилоцибин и сходные с ним производные триптамина, вызывающие кратковременные галлюцинации. Строчки (Gyromitra) вызывают желудочно-кишечные нарушения и отсроченное поражение печени. Их яд — гиромитрин — в организме превращается в токсичные гидразины. Описаны случаи смерти от печеночной и почечной недостаточности, но в целом отравление этими грибами протекает значительно легче, чем грибами, содержащими аматоксины (см. ниже).
Самые тяжелые отравления вызывают бледная поганка (Amanita phalloides), некоторые другие представители рода мухоморов, а также родов лепиота (Lepiota) и галерина (Galerina) (Gold-frank, 1998). На долю этих грибов приходится более 90% всех смертельных отравлений. Употребление всего 50 г бледной поганки может привести к смерти. Основные яды этих грибов — это аматоксины (а- и β-аманитин). Они представляют собой циклические октапептиды, ингибирующие РНК-полимеразу II и тем самым блокирующие образование мРНК. Это приводит к гибели клеток, особенно слизистой кишечника, печени и почек. Первые симптомы, обусловленные другими ядами (понос, боль в животе), часто остаются незамеченными. Через 24 ч развивается поражение печени и почек. Смерть наступает на 4— 7-е сутки от почечной и печеночной недостаточности (Gold-frank, 1998). Лечение в основном симптоматическое. Есть одиночные сообщения об эффективности пенициллинов, липоевой кислоты и силибинина (Koppel, 1993).
Прежде всего необходимо установить вид гриба, поскольку от него зависят тяжесть отравления и лечение. Симптомы часто появляются поздно, и тогда промывание желудка и активированный уголь бесполезны. В местных центрах отравлений СЦЦ имеется постоянно обновляющаяся информация о случаях oтравлений грибами и способах их лечения.