Лептин — различия между версиями
Django (обсуждение | вклад) (→Лептин) |
Django (обсуждение | вклад) (→Строение и физиологическая роль) |
||
| Строка 5: | Строка 5: | ||
=== Строение и физиологическая роль === | === Строение и физиологическая роль === | ||
| − | Лептин является высокомолекулярным белком с массой 16 кДа, состоящим из 167 аминокислотных остатков. | + | Лептин был открыт в 1994 году как продукт ob-гена, не функционирующего у подопытных мышей с ожирением. Гормон является высокомолекулярным белком с массой 16 кДа, состоящим из 167 аминокислотных остатков. Выделяют 2 изоформы рецепторов лептина: длинный рецептор (Rb), локализующийся в головном мозге, и короткий (Ra) во всех других органах. Рецептор Rb локализуется в центре насыщения — вентромедиальном ядре гипоталамуса, а также в дугообразном, дорсомедиальном и паравентрикулярном ядрах. Связывание лептина с рецептором Rb вызывает фосфорилирование цитоплазматической тирозинкиназы JAK 2 (Janus kinase), которая, в свою очередь, фосфорилирует белки — переносчики сигнала и активаторы транскрипции STAT 3 (Signal transducer and activator of transcription) |
| − | + | Гормон преимущественно секретируется адипоцитами белой [[Жировая ткань|жировой ткани]], кроме того, источниками его синтеза являются плацента, эпителий грудных желез, скелетная мускулатура и слизистая желудка.<ref>Романцова Т. И., Волкова Г. Е. Лептин и грелин: антагонизм и взаимодействие в регуляции энергетического обмена //Ожирение и метаболизм. – 2005. – №. 2.</ref> Факторы, определяющие уровень экспрессии лептина, приведены в таблице. | |
| − | |||
| − | + | Таблица: '''Регуляция экспрессии лептина''' (по Ashima R.S., Flier J.S., 2000) | |
| + | |||
| + | {| class="wikitable" | ||
| + | |- | ||
| + | ! Органы и ткани !! Увеличение !! Снижение | ||
| + | |- | ||
| + | | ''Жировая ткань'' || Прием пищи || Голодание | ||
| + | |- | ||
| + | | || Ожирение (кроме случаев мутации ob-гена) || Тестостерон | ||
| + | |- | ||
| + | | || Инсулин || β-адренергические агонисты | ||
| + | |- | ||
| + | | || Глюкокортикоиды || Тиазолидиндионы (in vitro) | ||
| + | |- | ||
| + | | || Острая инфекция || Тиреоидные гормоны | ||
| + | |- | ||
| + | | || Цитокины (α-ФНО, ИЛ-1, ФИЛ) || Холодовое воздействие | ||
| + | |- | ||
| + | | ''Плацента'' || Инсулин || Курение | ||
| + | |- | ||
| + | | || Глюкокортикоиды || Низкий вес новорожденного | ||
| + | |- | ||
| + | | || Гипоксия || | ||
| + | |- | ||
| + | | ''Скелетная мускулатура'' || Глюкозамин || | ||
| + | |- | ||
| + | | || Глюкоза || | ||
| + | |- | ||
| + | | || Липиды || | ||
| + | |- | ||
| + | | ''Желудок'' || || Холецистокинин | ||
| + | |- | ||
| + | | || || Прием пищи | ||
| + | |} | ||
| + | |||
| + | |||
| + | Рецепторы лептина обнаружены во многих органах, в том числе в головном мозге, сердце, легких, почках, печени, поджелудочной железе, селезенке, тимусе, простате, яичниках, тонкой и толстой кишке. | ||
Версия 21:35, 10 августа 2014
Лептин
Лептин - пептидный гормон жировой ткани - адипокин.
Строение и физиологическая роль
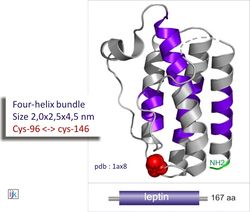
Лептин был открыт в 1994 году как продукт ob-гена, не функционирующего у подопытных мышей с ожирением. Гормон является высокомолекулярным белком с массой 16 кДа, состоящим из 167 аминокислотных остатков. Выделяют 2 изоформы рецепторов лептина: длинный рецептор (Rb), локализующийся в головном мозге, и короткий (Ra) во всех других органах. Рецептор Rb локализуется в центре насыщения — вентромедиальном ядре гипоталамуса, а также в дугообразном, дорсомедиальном и паравентрикулярном ядрах. Связывание лептина с рецептором Rb вызывает фосфорилирование цитоплазматической тирозинкиназы JAK 2 (Janus kinase), которая, в свою очередь, фосфорилирует белки — переносчики сигнала и активаторы транскрипции STAT 3 (Signal transducer and activator of transcription)
Гормон преимущественно секретируется адипоцитами белой жировой ткани, кроме того, источниками его синтеза являются плацента, эпителий грудных желез, скелетная мускулатура и слизистая желудка.[1] Факторы, определяющие уровень экспрессии лептина, приведены в таблице.
Таблица: Регуляция экспрессии лептина (по Ashima R.S., Flier J.S., 2000)
| Органы и ткани | Увеличение | Снижение |
|---|---|---|
| Жировая ткань | Прием пищи | Голодание |
| Ожирение (кроме случаев мутации ob-гена) | Тестостерон | |
| Инсулин | β-адренергические агонисты | |
| Глюкокортикоиды | Тиазолидиндионы (in vitro) | |
| Острая инфекция | Тиреоидные гормоны | |
| Цитокины (α-ФНО, ИЛ-1, ФИЛ) | Холодовое воздействие | |
| Плацента | Инсулин | Курение |
| Глюкокортикоиды | Низкий вес новорожденного | |
| Гипоксия | ||
| Скелетная мускулатура | Глюкозамин | |
| Глюкоза | ||
| Липиды | ||
| Желудок | Холецистокинин | |
| Прием пищи |
Рецепторы лептина обнаружены во многих органах, в том числе в головном мозге, сердце, легких, почках, печени, поджелудочной железе, селезенке, тимусе, простате, яичниках, тонкой и толстой кишке.
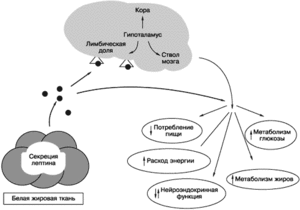
Размер адипоцита является важной детерминантой синтеза лептина: крупные жировые клетки содержат гораздо большее количество гормона, чем мелкие адипоциты. Уровень лептина в крови коррелирует с запасами жировых депо. У грызунов концентрация гормона повышается спустя несколько часов после еды, у человека — через несколько дней после периода переедания, снижение показателей у животных и человека наблюдается в течение нескольких часов после начала голодания. Таким образом, лептин является как индикатором энергетических запасов, так и медиатором энергетического баланса. После однократного введения экзогенного лептина у экспериментальных животных через 8-10 часов урежается частота эпизодов приема пищи, при повторных инъекциях постепенно уменьшается содержание жира в организме и масса тела. Дефицит гормона у человека не сопровождается гиперинсулинемией, гипергликемией, гиперкортицизмом и гипотермией, что свидетельствует о существенных межвидовых различиях биологических эффектов гормона.
- ↑ Романцова Т. И., Волкова Г. Е. Лептин и грелин: антагонизм и взаимодействие в регуляции энергетического обмена //Ожирение и метаболизм. – 2005. – №. 2.