Противосудорожные препараты — различия между версиями
Django (обсуждение | вклад) (→Топирамат) |
Django (обсуждение | вклад) (→Топирамат) |
||
| Строка 412: | Строка 412: | ||
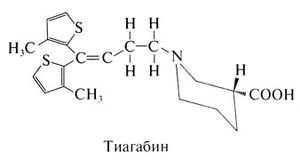
'''Побочные эффекты'''. В начале лечения нередки легкие или умеренные дурнота, сонливость и тремор, которые вскоре проходят. Как и другие препараты, усиливающие ГАМКергическую передачу, тиагабин облегчает разряды пик—волна в экспериментальных моделях абсансов, поэтому при абсансах он может быть противопоказан. | '''Побочные эффекты'''. В начале лечения нередки легкие или умеренные дурнота, сонливость и тремор, которые вскоре проходят. Как и другие препараты, усиливающие ГАМКергическую передачу, тиагабин облегчает разряды пик—волна в экспериментальных моделях абсансов, поэтому при абсансах он может быть противопоказан. | ||
| − | === | + | === Топирамат === |
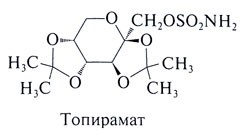
[[Image:Gud_427_1.jpg|300px|thumb|right|Структурная формула топирамита]] | [[Image:Gud_427_1.jpg|300px|thumb|right|Структурная формула топирамита]] | ||
| Строка 424: | Строка 424: | ||
'''Побочные эффекты'''. Топирамат хорошо переносится, хотя возможны сонливость, утомляемость, раздражительность, похудание. | '''Побочные эффекты'''. Топирамат хорошо переносится, хотя возможны сонливость, утомляемость, раздражительность, похудание. | ||
| + | |||
| + | '''Читайте также:''' [[Топирамат|Топирамат для похудения]] | ||
=== Зонисамид === | === Зонисамид === | ||
Версия 02:18, 19 августа 2014
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
- 1 Противосудорожные средства
- 2 Классификация эпилепсии
- 3 Патогенез припадков и механизмы действия противосудорожных средств
- 4 Общие сведения о противосудорожных средствах
- 5 Гидантоины
- 6 Барбитураты
- 7 Дезоксибарбитураты
- 8 Иминостилбены
- 9 Сукцинимиды
- 10 Вальпроевая кислота
- 11 Бензодиазепины
- 12 Прочие противосудорожные средства
- 13 Общие принципы противосудорожной терапии
- 14 Перспективы
- 15 Литература
Противосудорожные средства
Эпилепсия — тяжелая распространенная болезнь: только в США ею страдают около 2,5 млн человек. Выделяют более 40 форм эпилепсии. Припадки обычно протекают с потерей сознания и нередко сопровождаются травмами. У многих больных есть трудности в учебе, ограничены профессиональные возможности. Лечение эпилепсии симптоматическое: противосудорожные препараты способны прекратить
припадки или уменьшить их частоту, но средств профилактики и излечения эпилепсии нет. Серьезная проблема — несоблюдение врачебных предписаний: лечение эпилепсии проводится долго, а многие противосудорожные средства вызывают побочные эффекты.
Известны три основных механизма действия противосудорожных средств. Первый — усиление инактивации потенциалзависимых натриевых каналов и тем самым торможение высокочастотных нейронных разрядов, второй — усиление ГАМКергической тормозной передачи на пресинаптическом или постсинаптическом уровне; эти механизмы действия присущи препаратам, влияющим на самые распространенные припадки — парциальные (включая вторично генерализованные). Третий механизм — снижение активации медленных кальциевых каналов Т-типа — характерен для препаратов, влияющих на абсансы.
Круг противосудорожных средств продолжает расширяться. Особенно перспективны новые подходы к лечению, связанные с раскрытием генетических, клеточных и молекулярных механизмов повышенной нейронной возбудимости.
Классификация эпилепсии
Эпилептическим припадком называют временное изменение поведения и сознания, вызванное патологическим синхронным ритмичным разрядом группы нейронов головного мозга. Эпилепсия — неврологическое заболевание, проявляющееся непредсказуемо повторяющимися припадками. Припадок может быть вызван, например, электросудорожной терапией или некоторыми препаратами, и в таких случаях его не считают признаком эпилепсии; эпилептические же припадки возникают без видимых провоцирующих факторов. Препараты, которыми лечат больных эпилепсией, называют противосудо-рожными, поскольку они подавляют припадки. Однако не доказано, что эти препараты предупреждают развитие эпилепсии, то есть влияют на эпилептогенез.
Источник припадков — кора головного мозга, в других отделах ЦНС (таламусе, стволе мозга, мозжечке) такие нейронные разряды не возникают. Согласно международной классификации 1981 г., припадки делят на парциальные (фокальные, локальные), при которых эпилептическая активность исходит из какого-либо участка коры (очага), и генерализованные, при которых эта активность сразу захватывает всю кору обоих полушарий (Commission, 1981). Картина припадка зависит от локализации очага. Например, если очаг находится в моторной коре, возникают клонические судороги части тела, проецирующейся на пораженный участок коры. При простых парциальных припадках сознание не страдает, при сложных оно в той или иной степени нарушено. Сложные парциальные припадки чаще вызваны поражением височной доли. К генерализованным относят абсансы, тонико-клонические и миоклонические припадки. Выбор противосудорожного средства определяется типом припадков (табл. 21.1).
Наряду с классификацией припадков существует международная классификация эпилепсии и эпилептических синдромов, учитывающая помимо типа припадков их этиологию, возраст начала и некоторые другие признаки (Commission, 1989). Выделяют более 40 самостоятельных форм эпилепсии. Как и припадки, их разделяют на парциальные и генерализованные. Около 60% случаев приходится на парциальные формы, проявляющиеся различными парциальными припадками (табл. 21.1). Их причиной чаше всего является поражение определенного участка коры (опухоль, порок развития, травма, инсульт и т. д.), обычно обнаруживаемое при КТ и МРТ. Некоторые парциальные формы имеют наследственную этиологию. Многочисленные формы генерализованной эпилепсии, на долю которых в целом приходится около 40% случаев, проявляются генерализованными припадками одного или нескольких типов (табл. 21.1), этиология этих форм в основном наследственная. Самая частая из них (около 10% случаев) — юношеская миоклоническая эпилепсия. Она начинается в раннем подростковом возрасте, типичные припадки — миоклонические и то-нико-клонические, нередки также абсансы. Налицо семейное накопление, но, как и при других формах генерализованной эпилепсии, наследование не носит моногенный характер, а связано, видимо, с несколькими генами предрасположенности. Классификация эпилепсии необходима для диагностики и прогнозирования болезни, но не столь важна для выбора противосудорожных средств.
Патогенез припадков и механизмы действия противосудорожных средств
Парциальные припадки
Еще в XIX веке Джон Хьюлингс Джексон, основоположник современной эпилептологии, предположил, что причина припадка — «быстрые сверхсильные разряды, непредсказуемо и внезапно воз никаюшие в какой-либо области серого вещества», а генерализованный припадок возникает при распространении эпилептической активности из этого очага на здоровую ткань мозга. Эта провидческая идея сыграла важнейшую роль в изучении природы парциальной эпилепсии. Появившаяся в 1930-х гг. ЭЭГ, позволившая регистрировать электрическую активность мозга, доказала связь эпилепсии с нарушением нейронной возбудимости.
Поскольку главная роль в межнейронных связях мозга млекопитающих принадлежит синапсам, появилась гипотеза о том, что возникновение припадка связано с нарушением синаптических функций — подавлением тормозного синаптического действия или усилением возбуждающего. Эту гипотезу подтвердили фармакологические исследования. Главным тормозным медиатором в головном мозге млекопитающих является ГАМК, возбуждающим — глутаминовая кислота. Введение экспериментальным животным in vivo блокаторов рецепторов ГАМК либо стимуляторов различных глутаматных рецепторов (NMDA-, АМРА-, каинатных) вызывает припадки. Напротив, агонисты ГАМК и блокаторы глутаматных рецепторов обладают противосудорожным действием при различных экспериментальных припадках, в том числе вызванных электрическим разрядом и химическими веществами (пентетразолом и др.).
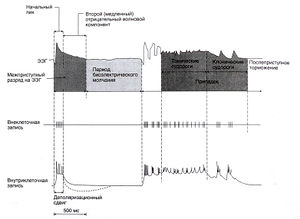
Таким образом, фармакологические воздействия на синаптическую передачу меняют подверженность припадкам. Эти данные послужили основой для электрофизиологических исследований синаптических и несинаптических механизмов припадков и эпилепсии. Появление новых электрофизиологических методов позволило постепенно перейти от изучения активности больших корковых зон (ЭЭГ) к исследованию групп нейронов, затем — единичных нейронов и даже отдельных синапсов и одиночных ионных каналов. Электрофизиологические исследования эпилепсии на клеточном уровне, начавшиеся еше с середины 1960-х гг., сосредоточились на изучении деполяризационного сдвига мембранного потенциала, соответствующего межприступному разряду на ЭЭГ (рис. 21.1). Межприступный разряд — это остроконечная волна, регистрирующаяся «больных эпилепсией в межприступном периоде и не имеющая клинических проявлений. Локализация этого разряда помогает определить эпилептический очаг. Деполяризационный сдвиг представляет собой выраженную деполяризацию нейрона, сопровождающуюся вспышкой потенциалов действия. В большинстве корковых нейронов деполяризационный сдвиг возникает в результате мощных ВПСП и дополнительно усиливается за счет активации потенциалзависимых каналов (Dichter and Ayala, 1987). Хотя механизм деполяризационного сдвига достаточно изучен, не ясна связь межприступного разряда с припадком: запускается ли припадок этим разрядом или подавляется, либо непосредственной связи нет, и межприступный разряд — просто одно из электрофизиологических проявлений эпилептической активности.
Таблица 21.1. Характеристика основных эпилептических припадков
|
Тип припадка |
Клиническая картина |
Общепринятые противосудорожные средства |
Новые противосудорож-ные средства |
|
Парциальные | |||
|
Простые парциальные |
Симптомы различны в зависимости от локализации очага (например, поражение моторной коры в зоне проекции левого большого пальца проявляется его клоническими подергиваниями, а сенсорной коры в зоне проекции того же пальца — его парестезией), длительность припадка — 20—60 с. Главный отличительный признак — сохранное сознание |
Карбамазепин, фенитоин, вальпроевая кислота |
Габапентин, ламотригин, леветирацетам, тиагабин, топирамат, зонисамид |
|
Сложные парциальные |
Потеря сознания на 0,5—2 мин, часто сопровождающаяся нецеленаправленными движениями (чмоканье губами, выворачивающие движения рук) |
Карбамазепин, фенитоин, вальпроевая кислота |
Габапентин, ламотригин, леветирацетам, тиагабин, топирамат, зонисамид |
|
Парциальные со вторично генерализованными тонико-клоническими |
Простой или сложный парциальный припадок перерастает в генерализованный тони-ко-клонический с потерей сознания; общее напряжение мышц (тоническая фаза) сменяется чередованием их сокращения и расслабления (клоническая фаза), типичная продолжительность припадка — 1—2 мин |
Карбамазепин, фенобарбитал, фенитоин, примидон, вальпроевая кислота |
Габапентин, ламотригин, леветирацетам, тиагабин, топирамат, зонисамид |
|
Генерализованные | |||
|
Абсансы |
Внезапное нарушение сознания с остановкой взгляда и «застыванием» длительностью до 30 с |
Этосуксимид, вальпроевая кислота |
Ламотригин |
|
Миоклонические |
Резкие короткие (порядка 1 с) мышечные сокращения — локальные (например, части руки или ноги) либо генерализованные |
Вальпроевая кислота |
Ламотригин, топирамат |
|
Тонико-клонические |
Картина та же, что при вторично генерализованных припадках, но без парциального начала |
Карбамазепин, фенобарбитал, фенитоин, примидон, вальпроевая кислота |
Ламотригин, топирамат |
В 1980-х гг. были созданы многочисленные модели припадков in vitro на срезах головного мозга с сохранными синаптическими связями. Электрическую активность, аналогичную эпилептической, регистрировали в срезах гиппокампа, например в гипокальциевом, гиперкалиевом или безмагниевом растворе (McNamara, 1994). Такие исследования получили распространение благодаря относительной простоте и возможности контроля. На моделях in vitro подтвердилась важная роль синаптического звена в патогенезе припадков: даже умеренное снижение тормозной синаптической активности (например, на 20%) провоцирует эпилептические разряды, а усиление возбуждающих синаптических входов — ключевое звено в возникновении припадка. Установлена патогенетическая роль и других факторов, в частности объема внеклеточного пространства, некоторых характеристик нейронов, особенно потенциалзависимых ионных каналов — натриевых, калиевых и кальциевых (Тraynelis and Dingledine, 1988). Результаты исследований in vitro помогают выявить патогенетические звенья для фармакологического воздействия in vivo.
Еще одна проблема — механизм превращения здорового мозга в«эпилептический». Парциальная эпилепсия может возникнуть спустя месяцы и даже годы после повреждения коры (в результате травмы, инсульта или других причин). Огромную роль могла бы играть профилактика улиц с высоким риском эпилепсии, однако существующие противосудорожные средства, подавляя припадки при уже развившейся болезни, не препятствуют эпилептогенезу и не обладают профилактическим действием.
Разработка новых направлений в лечении опирается на современные представления об эпилептогенезе на клеточном и молекулярном уровнях. Важная роль в таких исследованиях принадлежит экспериментальной эпилепсии у животных. В основе одной из моделей — феномен облегчения судорожной активности, или так называемой раскачки (kindling). Повторно проводят непродолжительную слабую электростимуляцию миндалевидного тела или других отделов лимбической системы. Если первые сеансы провоцируют только кратковременный эпилептический разряд на ЭЭГ без внешних проявлений (судорог), то после 10—20 сеансов электростимуляция вызывает все более сильные припадки вплоть до генерализованных тонико-клонических (Goddard et al., 1969), причем сформировавшаяся реакция на электростимуляцию сохраняется до конца жизни животного. Спонтанные, то есть истинно эпилептические припадки, возникают лишь после 100—200 сеансов. Преимущества модели- возможность дозировать «раскачку» и количественно оценить эпилептогенез (по числу сеансов электростимуляции, предшествующих появлению генерализованных тонико-клонических припадков). Фармакологическими исследованиями на этой модели показано, что снижение активации глутаматных NMDA-peцепторов и нейротрофиновых ГАМК-рецепторов тормозит эпилептогенез. Эти данные помогают понять клеточные и молекулярные механизмы эпилептогенеза при «раскачке».
Две другие модели — припадки, вызванные каиновой кислотой и пилокарпином. Оба вещества провоцируют тяжелый зaтяжной статус лимбических и тонико-клонических припадков, спустя несколько недель после которого начинаются спонтанные припадки (Lemos and Cavalheiro, 1995; Longo and Mello, 1998). Напрашивается сравнение с осложненными фебрильными припадками у детей младшего возраста, на смену которым спустя годы могут прийти эпилептические припадки. В отличие от припадков при «раскачке*, не вызывающих гибели нейронов, химически вызванные припадки сопровождаются значительным разрушением нейронов гиппокампа, что сопоставимо со склерозом гиппокампа при тяжелых лимбических припадках у человека. Недавно обнаружено, что осложненные фебрильные припадки у детей младшего возраста также вызывают склероз гиппокампа (VanLandingham et al., 1998), то есть прослеживается еще одно общее звено между экспериментальными припадками и эпилепсией у человека.
Многие вопросы, связанные с этими экспериментальными моделями, пока остаются нерешенными. Какие процессы происходят во время латентного периода между химически вызванным эпилептическим статусом и последующими спонтанными припадками, то есть каков механизм эпилептогенеза в этом случае? Сходен ли он с механизмом «раскачки»? В каких случаях противосудорожный препарат, эффективный в одной из моделей, будет действовать и в другой.
В последние два десятилетия стали гораздо понятнее механизмы действия препаратов, влияющих на парциальные припадки (Macdonald and Greenfield, 1997). Большую роль в этом сыграли электрофизиологические исследования на сравнительно простых моделях in vitro, в частности на культуре нейронов ЦНС млекопитающих. Относительная простота, возможность контроля и воспроизводимость этих исследований определили их успех. Хотя результаты, полученные in vitro, нельзя автоматически перенести на животных и человека, в основном они отражают действие противосудорожных средств в организме.
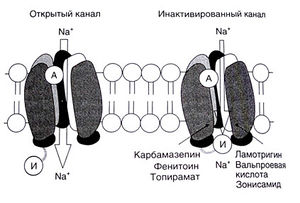
Электрофизиологическое изучение отдельных нейронов показало, что во время парциального припадка нейроны деполяризуются и генерируют высокочастотные потенциалы действия (рис. 21.1), не возникающие в норме. Соответственно, избирательное устранение таких разрядов должно обеспечить противосудорожный эффект с наименьшими осложнениями. Действительно, карбамазепин, ламотригин, фенитоин и вальпроевая кислота в терапевтических концентрациях подавляют именно высокочастотные разряды (Macdonald and Greenfield, 1997). Считают, что этот эффект обусловлен замедлением деинактивации быстрых натриевых каналов (рис. 21.2). Для возникновения потенциала действия в аксоне необходимо открывание этих каналов, затем каналы спонтанно закрываются — инактивируются. Эта инактивация сопровождается коротким рефрактерным периодом, во время которого новый потенциал действия не может возникнуть. По мере восстановления (деинактивации) быстрые натриевые каналы вновь приобретают способность генерировать потенциал действия. На низкочастотную импульсацию длительность инактивации существенно не влияет, поскольку к моменту очередного потенциала действия натриевые каналы заведомо успевают деинактивироваться. Напротив, высокочастотная импульсация при замедлении деинактивации подавляется. Таков, очевидно, механизм действия карбамазепина, ламотригина, фенитоина, топирамата, вальпроевой кислоты и зонисамида при парциальных припадках.
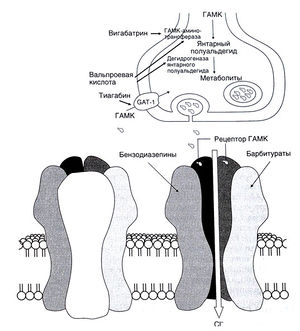
При усилении тормозного действия ГАМК снижается возбудимость нейронов и повышается порог судорожной готовности. На этом основан эффект некоторых противосудорожных средств (Macdonald and Greenfield, 1997). Активация ГАМКд-рецепторов — основных постсинаптических рецепторов ГАМК — сопровождается увеличением хлорного тока, и как следствие, — гиперполяризацией и торможением постсинаптического нейро-на(гл. 17). Бензодиазепины и барбитураты в терапевтических дозах усиливают действие ГАМК на ГАМКдтрецепторы (рис. 21.3).
Вероятно, с этим связана их эффективность при парциальных и генерализованных тонико-клонических припадках у человека. Те же препараты в больших дозах (используемых, например, при эпилептическом статусе), кроме того, подавляют высокочастотные потенциалы действия. Действие вигабатрина (у-винил-ГАМК), как считают, обусловлено тем, что он необратимо инактивирует ГАМК-аминотрансферазу (фермент, разрушающий ГАМК) и тем самым увеличивает количество ГАМК, высвобождающееся из пресинаптического окончания. Еще один связанный с ГАМК механизм лежит в основе действия тиагабина: этот препарат ингибирует переносчик ГАМК (GAT-1) и в результате уменьшает захват ГАМК нейронами и глией (Suzdak and Jansen, 1995) (рис. 21.3).
Первично генерализованные припадки: абсансы
В отличие от парциальных припадков, источником которых является ограниченный участок коры, первично генерализованные припадки обусловлены реципрокным возбуждением коры и таламуса (Coulter, 1998). Из всех форм генерализованных припадков наиболее изучены абсансы. Удивительная синхронность разрядов на обширной поверхности коры позволила предположить, что синхронизацию обеспечивают таламус или ствол мозга либо обе эти области (Penfield and Jasper, 1947). Особую роль придавали таламусу, поскольку низкочастотная стимуляция срединных структур таламуса вызывает корковые разряды пик—волна, типичные для абсансов (Jasper and Droogleever-Fortu-yn, 1947). С помощью внутримозговых электродов показано, что в происхождении комплексов пик—волна при абсансах у человека участвуют и таламус, и кора.
Описание к рис. 21.1. ЭЭГ, внеклеточная и внутриклеточная регистрация активности нейрона в корковом очаге эпилептической активности, вызванной местным нанесением химического вещества у млекопитающего. Внеклеточная запись произведена с использованием высокочастотного фильтра. На вне- и внутриклеточной записи видны высокочастотные разряды в момент деполяризацион-ного сдвига. Ayala et al., 1973.
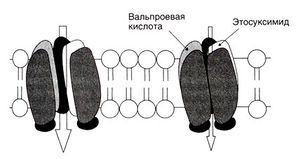
Эквивалент абсансов на ЭЭГ — генерализованные комплексы пик—волна с частотой 3 Гц. В последнее десятилетие изучены многие структурные и функциональные свойства таламуса и коры, связанные с этими комплексами (Coulter, 1998). Они представляют собой двусторонние синхронные разряды, регистрирующиеся в таламусе и коре и обусловленные реципрокными разрядами этих двух отделов. Сопоставление ЭЭГ и внутриклеточных записей показало, что пики на ЭЭГ соответствуют разрядам потенциалов действия, а последующая медленная волна — длительному торможению. Возникновение этих реверберирующих низкочастотных разрядов обеспечивается двусторонними возбуждающими связями между корой и таламусом, с одной стороны, и некоторыми свойствами таламических нейронов — с другой (Coulter, 1998). Важнейшее из этих свойств — значительный ток через кальциевые каналы Т-типа. Именно этот ток обусловливает вспышки разрядов в нейронах таламуса; кроме того, он усиливает периодические таламические разряды, каждый из которых представляет собой типичный комплекс пик—волна. Торможение данного тока считается главным механизмом действия препаратов, эффективных при абсансах, — этосуксимида, триметадиона, вальпроевой кислоты (рис. 21.4) (Macdonald and Kelly, 1993). Таким образом, общее свойство разных противосудорожных средств — торможение потенциалзависимых ионных каналов, но препараты, эффективные при парциальных припадках, влияют на натриевые каналы, а действенные при абсансах — на кальциевые.
Описание к рис. 21.2. Усиление инактивации быстрых натриевых каналов. Некоторые противосудорожные средства продлевают инактивацию быстрых натриевых каналов, тем самым подавляя высокочастотные разряды нейронов. А — активационные ворота, И — инактивационные ворота.
Генетические факторы
Наследственность вносит тот или иной вклад почти во все формы эпилепсии. Существуют редкие моногенные формы с разным типом наследования. Преимущественно генетическую природу имеют и некоторые частые формы, например юношеская миоклоническая эпилепсия и детская абсансная эпилепсия, наследственная предрасположенность к которым обусловлена двумя или более генами. Роль наследственных факторов прослеживается даже при эпилепсии, вызванной органическим повреждением головного мозга (Вегkovic, 1998).
В последние годы достигнут огромный прогресс в изучении генетики эпилепсии у млекопитающих. Если к 1994 г. была обнаружена всего одна мутация, вызывающая эпилепсию у мышей, то сейчас известно более 30 таких мутаций (Puranam and McNamara, 1999). В генетических исследованиях эпилепсии у человека также произошел большой скачок. До 1990 г. мы не знали ни одного гена, связанного с эпилепсией человека, сейчас обнаружено более дюжины таких генов. В основном это гены дегенеративных заболеваний ЦНС, сопровождающихся симптоматической эпилепсией. Механизмы такой эпилепсии, развивающейся на фоне тяжелого прогрессирующего поражения мозга, и идиопатической эпилепсии, не имеющей других симптомов, конечно, не идентичны. Что касается идиопатической эпилепсии, к настоящему времени установлены гены четырех ее форм, причем все это гены потенциалзависимых или хемочувствительных ионных каналов. Это особенно интересно, поскольку с генами потенциалзависимых ионных каналов связан ряд других болезней с приступообразным течением: некоторые заболевания сердца, сопровождающиеся аритмиями, сосудов (семейная гемиплегическая мигрень), скелетных мышц (семейные периодические параличи), мозжечка (периодическая атаксия) и некоторых других органов (Ptacek, 1997).
Описание к рис.21.3. Усиление ГАМКергической передачи, дкгивация ГАМКЛ-рецептора (внизу) приводит к открыванию хлорных каналов, входу хлора и, как следствие, к гиперполяризации. Некоторые противосудорожные средства подавляют инактивацию ГАМК, другие действуют на ГАМКА-рецепторы, усиливая вызываемый ГАМК хлорный ток. Габапентин усиливает высвобождение ГАМК из пресинаптических окончаний, молекулярный механизм его действия изучается. GAT-1 — белок — переносчик ГАМК.
Четыре формы идиопатической эпилепсии, для которых обнаружены генные мутации, следующие. Генерализованную эпилепсию с фебрильными припадками вызывает точечная мутация гена, кодирующего р-субъединицу быстрого натриевого канала (SCN1B). В результате мутации нарушается инактивация этих каналов (Wallace et al.,1998). Два варианта доброкачественных семейных неонатальных припадков обусловлены мутациями отдельных, хотя и родственных, генов субъединиц калиевых каналов (KCNQ2 и KCNQ3) (Biervert et al., 1998; Singh et al., 1998; Charlier et al., 1998). Аутосомно-доминантная лобная эпилепсия с ночными припадками связана с мутацией гена а4-субъединицы нейронального N-холинорецептора (CHRNA4). Все четыре формы редки и вместе составляют гораздо меньше 1% всех случаев эпилепсии у человека. Каким путем мутации этих генов приводят к эпилепсии, как генотип реализуется в фенотип, пока не известно. Ответить на эти вопросы поможет изучение мутантных мышей с эпилепсией. Гены соответствующих ионных каналов могут стать точкой приложения принципиально новых противосудорожных средств. Несомненно, в ближайшие годы мы узнаем много новых генов эпилепсии.
Описание к рис. 21.4. Подавление тока через кальциевые каналы Т-типа. Некоторые противосудорожные средства снижают ток через кальциевые каналы Т-типа в нейронах таламуса; этим током обусловлена ритмичная активность типа пик—волна при абсансах.
Общие сведения о противосудорожных средствах
Историческая справка
Первым синтезированным органическим веществом с противосудорожным эффектом был фенобарбитал (Hauptmann, 1912). Седативное действие фенобарбитала навело исследователей на мысль применить его при эпилепсии. Важнейший вклад в разработку противосудорожных средств внесли Мерритт и Патнам (Merritt and Putnam, 1938а). Разработав модель припадков, вызванных электрическим разрядом, они изучали на ней противосудорожные свойства различных веществ и обнаружили, что фенитоин подавляет припадки, не обладая седативным действием. Эта модель эпилепсии оказалась очень ценной: препараты, подавляющие тоническое разгибательное напряжение задних лап у животных при таких припадках, эффективны также при генерализованных тонико-клонических и парциальных припадках у человека. В поиске средств для лечения абсансов использовали другую модель — припадки, вызванные пентетразолом. Обе модели не потеряли значения и в наши дни. Большинство препаратов, синтезированных до 1965 г., химически родственны фенобарбиталу. К ним относятся гидантоины, оксазолидиндионы и сукцинимиды. Позже появились многочисленные противосудорожные средства разнообразной химической природы: бензодиазепины (клоназепам и клоразепат), иминостилбены (карбамазепин), карбоновые кислоты с разветвленной цепью (вальпроевая кислота), фенилтриазины (ламотригин), циклические аналоги ГАМК (габапентин), сульфамат-замещенные моносахариды (топирамат), производные нипекотиновой кислоты (тиагабин) и пирролидины (леветирацетам).
Основы противосудорожной терапии
Идеальным был бы противосудорожный препарат, помогающий всем больным и не вызывающий осложнений. К сожалению, существующие средства не удовлетворяют обоим этим условиям. Спектр их побочных эффектов очень широк по характеру и тяжести — от легких неврологических расстройств до смертельной апластической анемии и печеночной недостаточности. Задача врача — подобрать для конкретного больного препарат (или их сочетание), в наибольшей степени предупреждающий припадки и дающий наименьшие побочные эффекты. У половины больных при правильном лечении припадки прекращаются, еще у четверти становятся гораздо более редкими. Успех зависит от характера припадков, их этиологии и от других факторов.
Предпочтительной считают монотерапию. Если при достаточной сывороточной концентрации препарата не удается достичь результата, рекомендуется замена, а не добавление второго средства. Однако порой приходится сочетать препараты, особенно у больных с припадками нескольких видов.
Важную роль играет определение сывороточной концентрации препарата — особенно при подборе дозы, а также при неэффективном лечении, появлении осложнений и при переходе на комбинированную терапию. Однако клинический эффект и сывороточная концентрация препарата не всегда коррелируют, и рекомендуемые концентрации носят ориентировочный характер; главный критерий подбора терапии — эффективность и переносимость препарата.
Гидантоины
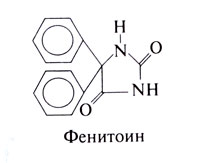
Фенитоин
Этот препарат эффективен при всех парциальных и при генерализованных тонико-клонических припадках, но не при абсансах. Другие гидантоины (мефенитоин, этотоин) описаны в прошлых изданиях настоящего руководства.
Историческая справка. Фенитоин синтезировал в 1908 г. Билц, но его противосудорожное действие стало известным только в 1938 г. (Merritt and Putnam, 1938а, b). Если противоэпилептическая активность брома и фенобарбитала была обнаружена случайно, то у фенитоина ее выявили при направленном испытании веществ, по строению близких к фенобарбиталу, но без снотворного действия. Фенитоин оказался эффективным при экспериментальных припадках, вызванных электрическим разрядом, и сразу нашел применение в клинике. Это стало знаменательным этапом: была доказана возможность противосудорожного действия без сопутствующего снотворного, и поиск препаратов с избирательным противосудорожным действием заметно активизировался.
Химические свойства. Структурно-функциональная зависимость. Структурная формула фенитоина следующая:
Действие на генерализованные тонико-клонические припадки обусловлено фенильной группой или другим ароматическим заместителем в положении 5. Алкильные группы в этом положении обеспечивают снотворное действие, отсутствующее у фенитоина. Углерод в положении 5 служит хиральным центром, но по активности изомеры существенно не различаются.
Фармакодинамика. Влияние на ЦНС. Противосудорожное действие фенитоина не сопровождается общим угнетением ЦНС. Передозировка может вызвать возбуждение, а близкие к смертельным дозы — децеребрационную ригидность.
Характерное свойство фенитоина — способность менять картину экспериментальных припадков, вызванных электрическим разрядом. Он подавляет типичную для утих припадков тоническую фазу вплоть до ее исчезновения, но клоническую фазу усиливает и продлевает. Аналогично действуют многие другие препараты, применяемые при генерализованных тонико-клонических припадках. На клонические припадки, вызванные пентетразолом, фенитоин не влияет.
Механизм действия. Фенитоин подавляет высокочастотные разряды изолированных корковых и спинальных нейронов мыши, вызванные их деполяризацией (McLean and Macdonald, 1983). Этот эффект обусловлен замедлением деинактивации быстрых натриевых каналов; он зависит от мембранного потенциала (сильнее при деполяризации) и длительности применения препарата. Такое действие наблюдается при концентрациях фенитоина, сходных с его терапевтической концентрацией в СМЖ у человека. В этих условиях действие фенитоина на быстрые натриевые каналы достаточно избирательно: спонтанная импульсная активность и реакция на электрофоретически введенные ГАМК и глутаминовую кислоту не меняются. В более высоких (в 5—10 раз) концентрациях фенитоин вызывает снижение спонтанной импульсной активности, усиление реакции на ГАМК и ряд других сдвигов. Возможно, этим объясняются некоторые побочные эффекты высоких доз фенитоина.
Фармакокинетика. Фармакокинетические свойства фенитоина определяются его значительным связыванием с белками сыворотки, дозозависимой элиминацией и участием в его метаболизме микросомальных ферментов печени. С белками сыворотки, преимущественно с альбумином, связывается около 90% фенитоина. Небольшие изменения доли связанного фенитоина сопровождаются резкими колебаниями абсолютного содержания свободного (фармакологически активного) препарата: оно выше у новорожденных, у больных с гипоальбуминемией и уремией. Некоторые лекарственные средства, в частности вальпроевая кислота, конкурируют с фенитоином за участки связывания с белками; так как вальпроевая кислота еще и подавляет метаболизм фенитоина, не удивительно, что при сочетании фенитоина с вальпроевой кислотой сывороточная концентрация свободного фенитоина заметно повышается. Концентрация же фенитоина в СМЖ коррелирует с сывороточной концентрацией именносвободного препарата. Таким образом, в клинической практике важнее определять сывороточную концентрацию не общего, а свободного фенитоина.
Фенитоин — один из немногих препаратов с дозозависимой элиминацией. При сывороточной концентрации до 10 мкг/мл Т1/2 фенитоина составляет 6—24 ч; при больших концентрациях Т1/2 с увеличением сывороточной концентрации возрастает. Вследствие этого между дозой фенитоина и его сывороточной концентрацией нет линейной зависимости, даже в терапевтическом диапазоне.
Фенитоин на 95% метаболизируется микросомальными ферментами печени, при этом главная роль принадлежит изоферменту IIC9, меньшая — изоферменту ПС 19 цитохрома Р450 (табл. 21.2). Основной метаболит — неактивное производное парагидроксифенила. Метаболизм фенитоина характеризуется насыщением, поэтому другие препараты, в превращении которых участвуют те же ферменты, тормозят элиминацию фенитоина и тем самым увеличивают его сывороточную концентрацию. Фенитоин, в свою очередь, тормозит метаболизм этих препаратов. Один из них — варфарин; назначение фенитоина больным, принимающим варфарин, может вызвать гипопротромбинемию. Другой механизм лекарственного взаимодействия связан с тем, что фенитоин индуцирует микросомальные ферменты печени: распад препаратов, в метаболизме которых участвуют эти ферменты, усиливается при сочетании с фенитоином. К таким препаратам принадлежат пероральные контрацептивы, метаболизирующиеся с участием изофермента IIIА4; при сочетании с фенитоином они быстрее распадаются, и может наступить нежелательная беременность. Это особенно важно в связи с тератогенным действием фенитоина. Так же взаимодействуют с пероральными контрацептивами карбамазепин, окскарбазепин, фенобарбитал и примидон.
Поскольку фенитоин плохо растворим, создано его водорастворимое производное для парентерального введения — фосфенитоин. Под действием печеночных и эритроцитарных фосфатаз он превращается в фенитоин; Т1/2 этой реакции составляет 8—15 мин. Фосфенитоин назначают взрослым с парциальными и генерализованными припадками при наличии показаний к парентеральному введению.
Побочные эффекты. Побочные эффекты фенитоина зависят от способа введения, длительности лечения и дозы. При передозировке фосфенитоина (например, при в/в введении при эпилептическом статусе) возможны аритмии (с артериальной гипотонией либо без нее) и угнетение ЦНС. Сердечно-сосудистые осложнения чаще возникают у пожилых с кардиологическими заболеваниями, но возможны и у молодых со здоровой сердечно-сосудистой системой. Во избежание этих осложнений скорость введения фосфенитоина не должна превышать 150 мг фенитоина в 1 мин (1,5 мг фосфенитоина соответствует 1 мг фенитоина). Острое отравление фенитоином при приеме внутрь проявляется мозжечковыми и вестибулярными расстройствами; значительная передозировка может вызвать выраженную атрофию мозжечка. Эти же осложнения наиболее типичны при длительном лечении фенитоином; возможны также психические расстройства, учащение припадков, желудочно-кишечные нарушения, гипертрофия десен, мегалобластная анемия, остеомаляция, гирсутизм (особенно неприятное осложнение для молодых женщин). Обычно при правильно подобранной дозе осложнения не тяжелы и не препятствуют лечению. При редких тяжелых реакциях с поражением кожи, костного мозга или печени (возможно, аллергических) фенитоин отменяют. Умеренное повышение активности печеночных ферментов, отчасти вызванное их усиленным синтезом, не требует отмены препарата.
Почти у трети больных при электромиограмме обнаруживаются признаки нейропатии, но, как правило, бессимптомной. Гипертрофия десен при длительном лечении фенитоином встречается примерно в 20% случаев, у детей и подростков это, возможно, самое частое осложнение. Нередко гипертрофия десен сочетается с огрублением лица, оба симптома объясняют нарушением метаболизма коллагена. Участки десен, лишенные зубов, не страдают. При гипертрофии десен нужна тщательная гигиена полости рта, отменять фенитоин не обязательно.
Фенитоин вызывает различные эндокринные сдвиги: тормозит высвобождение АДГ у больных с гиперсекрецией АДГ, тормозит секрецию инсулина, что ведет к гипергликемии и глюко-зурии. Он нарушает метаболизм витамина D и подавляет всасывание кальция в кишечнике, вызывая остеомаляцию с гипокальциемией и повышенным уровнем щелочной фосфатазы. Кроме того, фенитоин усиливает метаболизм витамина К и снижает содержание витамин-К-зависимых белков, играющих важную роль в обмене кальция в костной ткани. Вероятно, именно поэтому при вызванной фенитоином остеомаляции не всегда помогает витамин D.
Наблюдаются аллергические реакции: у 2—5% больных возникает кореподобная сыпь, в отдельных случаях — более тяжелые кожные реакции, в том числе синдром Стивенса—Джонсона; редкие осложнения — волчаночный синдром и угрожающий жизни некроз печени. Возможны нейтропения и лейкопения. Описаны случаи аплазии эритроидного ростка, агранулоцитоза и умеренной тромбоцитопении. Встречается увеличение лимфоузлов, требующее дифференциальной диагностики с лимфогранулематозом и лимфомой и сопровождающееся сниженным образованием IgA. У новорожденных, чьи матери во время беременности принимали фенитоин, может развиться гипопротромбинемия с кровотечениями и кровоизлияниями; эффективное средство лечения и профилактики в таких случаях — витамин К.
Сывороточная концентрация. Действие фенитоина коррелирует с его общей сывороточной концентрацией: терапевтический эффект обычно достигается при концентрации более 10 мкг/мл, а когда концентрация приближается к 20 мкг/мл, возникают побочные реакции, например нистагм.
Лекарственные взаимодействия. Препараты, метаболизирующиеся с участием изофермента IIC9 цитохрома Р450, подавляют метаболизм фенитоина и повышают его сывороточную концентрацию. Карбамазепин, напротив, усиливает метаболизм фенитоина и соответственно снижает его сывороточную концентрацию; аналогично влияет и фенитоин на сывороточную концентрацию карбамазепина. Взаимодействие фенитоина с фенобарбиталом неоднозначно.
Применение. Эпилепсия. Фенитоин — один из самых распространенных противосудорожных препаратов, он действует на парциальные и генерализованные тонико-клонические припадки, но не эффективен при абсансах. Место фенитоина и других средств в лечении эпилепсии обсуждается к конце главы. Поскольку препараты фенитоина, выпускаемые разными производителями, весьма существенно различаются по биодоступности и скорости всасывания, больной должен придерживаться препарата одной и той же фирмы.
Другие показания. Фенитоин иногда помогает при невралгии тройничного нерва и других невралгиях, хотя обычно эффективнее карбамазепин. Кроме того, фенитоин применяют при аритмиях (гл. 35).
Барбитураты
Свойства барбитуратов подробно изложены в Барбитураты. Здесь рассмотрены только два препарата, применяющиеся при эпилепсии. Третий препарат, метарбитал, пока еще производится, но почти вышел из употребления.
Фенобарбитал
Как уже говорилось, фенобарбитал был первым противосудорожным средством органической природы (Hauptmann, 1912), и до сих пор этот действенный, удовлетворительно переносимый и дешевый препарат остается в числе основных.
Химические свойства. Структурно-функциональная зависимость. Формула фенобарбитала (5-фенил-5-этилбарбитуровой кислоты) приведена в гл. 17. Связь между строением барбитуратов и их свойствами хорошо изучена. Наибольшая противосудорожная активность достигается при наличии одной фенильной группы в положении 5. Противосудорожная активность 5,5-дифенилбарбитуровой кислоты меньше, зато у нее нет снотворного эффекта. Противоположным действием обладает 5,5-дибен-зилбарбитуровая кислота, вызывающая судороги.
Противосудорожные свойства. Противосудорожной активностью обладают большинство барбитуратов. Однако лишь у некоторых из них, как у фенобарбитала, этот эффект достигается при дозах, не вызывающих сильной сонливости, что позволяет использовать эти препараты в лечении эпилепсии. Фенобарбитал эффективен при большинстве экспериментальных припадков, его действие не избирательно. Он подавляет тоническое разгибательное напряжение задних лап у животных при припадках, вызванных электрическим разрядом, подавляет клонические припадки, вызванные пентетразолом, атакже припадки, вызванные «раскачкой».
Таблица 21.2. Взаимодействие противосудорожных средств с микросомальными ферментами печени
Механизм действия. Фенобарбитал действует на ГАМКд-рецепторы и тем самым усиливает постсинаптическое торможение. Методом внутриклеточной регистрации показано, что фенобарбитал в терапевтических концентрациях усиливает ответ корковых и спинальных нейронов мыши на введенную электрофоретически ГАМК (Macdonald and Barker, 1979). Исследование активности одиночных ионных каналов нейронов спинного мозга мыши показало, что фенобарбитал усиливает вызываемый ГАМК хлорный ток за счет удлинения вспышек открывания каналов, но не за счет учащения этих вспышек (Twyman etal., 1989). В концентрациях выше терапевтических фенобарбитал, кроме того, тормозит длительные высокочастотные разряды; отсюда, вероятно, эффективность высоких доз фенобарбитала при эпилептическом статусе.
Различия между противосудорожным и снотворным эффектами барбитуратов долгое время были не понятны. Так, и пентобарбитал, и фенобарбитал усиливают ток, возникающий при активации ГАМКд-рецепторов; однако пентобарбитал проявляет противосудорожное действие только в высоких дозах с сильным снотворным действием, а фенобарбитал — в дозах, почти не вызывающих сонливости. Сегодня полагают, что эти различия могут объясняться разным действием барбитуратов на ГАМКергическую передачу, с одной стороны, и на медленные кальциевые каналы — с другой (Ffrench-Mullen et al., 1993). Максимальный эффект фенобарбитала на ГАМКергическую передачу (усиление вызванного ГАМКтока) составляет всего40% эффекта активного изомера пентобарбитала. Способность подавлять ток через медленные кальциевые каналы также выше у пентобарбитала (Ffrench-Mullen etal., 1993); в результате такого действия ионы кальция не поступают в пресинаптические нервные окончания и блокируется высвобождение возбуждающих медиаторов, в частности глутаминовой кислоты. Таким образом, в основе сильного седативного и снотворного эффекта пентобарбитала лежит мошное усиливающее действие на ГАМКергическую передачу и подавление кальциевого тока.
Фармакокинетика. При приеме внутрь фенобарбитал всасывается полностью, но довольно медленно; максимальная сывороточная концентрация достигается через несколько часов. На 40—60% фенобарбитал связывается с белками плазмы; он также активно связывается с белками тканей, в том числе головного мозга. Около четверти принятой дозы выводится в неизмененном виде с мочой (экскреция зависит от pH), остальная часть метаболизируется в печени с участием цитохрома Р450 (в основном изофермента ИС9, но в небольшой степени также изоферментов IIC19 и 1IE1). Фенобарбитал индуцирует глюкуронил-трансферазы, а также изоферменты подсемейств ПС и IIIA цитохрома Р450 и, следовательно, ускоряет распад препаратов, в метаболизме которых участвуют эти ферменты. Это относится, в частности, к пероральным контрацептивам, за метаболизм которых отвечает изофермент IIIA4.
Побочные эффекты. Самый частый побочный эффект — сонливость. В начале лечения она возникает у всех больных, но со временем развивается толерантность. При передозировке появляются нистагм и атаксия. У детей фенобарбитал может вызвать возбуждение и гиперактивность, у пожилых — беспокойство и спутанность сознания. У 1—2% больных возникает скарлатиноподобная или кореподобная сыпь, иногда наряду с другими аллергическими реакциями; редкое осложнение — эритродермия. У новорожденных, чьи матери принимали фенобарбитал вовремя беременности, возможна гипопротромбинемия с кровоточивостью; эффективное средство лечения и профилактики — витамин К. Длительный прием фенобарбитала, как и фенитоина, может осложниться мегалобластной анемией (лечение — фолиевая кислота) и остеомаляцией (лечение — витамин D в больших дозах). Подробнее о побочных эффектах барбитуратов см. гл. 17. Сывороточная концентрация. При длительном лечении фенобарбиталом его сывороточная концентрация у взрослых составляет 10 мкг/мл, а у детей — 5—7 мкг/мл на каждый I,мг/кг/сут. Хотя четкой линейной зависимости между сывороточной концентрацией и клиническим эффектом нет, существуют рекомендуемые показатели: 10—35 мкг/мл для лечения эпилепсии; не менее 15 мкг/мл для профилактики фебрильных припадков.
Побочные эффекты зависят не только от сывороточной концентрации препарата, но и от степени толерантности. На фоне длительного лечения с постоянной сывороточной концентрацией фенобарбитала до 30 мкг/мл сонливости, атаксии и нистагма обычно нет, но в начале лечения или в период увеличения дозы они возможны даже при меньших сывороточных концентрациях (хотя за несколько дней проходят). При сывороточной концентрации выше 60 мкг/мл у больных, плохо переносящих фенобарбитал, возможны выраженные побочные эффекты.
Поскольку фенобарбитал может вызвать психические нарушения даже в отсутствие других побочных реакций, его не следует назначать в очень высоких дозах в качестве монотерапии, особенно детям. Сывороточная концентрация фенобарбитала может превышать 30—40 мкг/мл только при явной необходимости и при хорошей переносимости препарата.
Лекарственные взаимодействия. Взаимодействие фенобарбитала с другими препаратами прежде всего определяется влиянием на микросомапьные ферменты печени. Взаимодействие с фенитоином изложено выше. При сочетании фенобарбитала с вальпроевой кислотой его сывороточная концентрация может повышаться, достигая 140% исходной (см. ниже, «Вальпроевая кислота»).
Применение. Фенобарбитал эффективен при генерализованных тонико-клонических и при парциальных припадках. Благодаря действенности, удовлетворительной переносимости и дешевизне он сохраняет свою роль в лечении эпилепсии. Однако его Применение ограничивают такие побочные эффекты, как поведенческие расстройства у детей и сонливость.
Еще один препарат этой группы — метилфенобарбитал — деметилируется под действием микросомальных ферментов печени, и его действие при длительном лечении сводится к действию фенобарбитала; соответственно, у них сходны фармакологические свойства, побочные эффекты и показания.
Дезоксибарбитураты
Примидон
Этот препарат эффективен при парциальных и генерализованных тонико-клонических припадках.
Химические свойства. Примидон отличается от фенобарбитала только тем, что карбонильная группа в положении 2 заменена на метиленовую:
Противосудорожные свойства. По действию на экспериментальные припадки примидон сходен с фенобарбиталом, но гораздо слабее его в отношении припадков, вызванных пентетразолом. Противосудорожной активностью обладают как сам препарат, так и его активные метаболиты, прежде всего фенобарбитал.
Фармакокинетика. При приеме внутрь примидон всасывается быстро и почти полностью, но с довольно широкими индивидуальными различиями. Максимальная сывороточная концентрация достигается примерно через 3 ч. Т1/2 существенно варьирует: его среднее значение колеблется от 5 до 15 ч.
У примидона имеются два активных метаболита: фенобарбитал и фенилэтилмалонамид. Примидон и фенил-этилмалонамид мало связываются с белками плазмы, а фенобарбитал связывается на 40—60%. Т1/2 фенилэтилмалонамида составляет 16 ч, при длительном лечении оба метаболита накапливаются в организме. После начала лечения примидоном фенобарбитал может появиться в плазме лишь через несколько суток. Примерно на 40% примидон выводится с мочой в неизмененном виде, остальные 60% приходятся на фенилэтилмалонамид и — в меньшей степени — на фенобарбитал и его метаболиты.
Побочные эффекты. Самые частые побочные эффекты примидона — сонливость, головокружение, дурнота, тошнота, рвота, атаксия, диплопия и нистагм. Возможно острое отравление сразу после приема примидона — еще до образования метаболитов. Между побочными эффектами и дозой примидона нет строгой зависимости, поскольку эти эффекты связаны не только с самим препаратом, но и с его активными метаболитами; кроме того, при длительном лечении развивается толерантность. В начале лечения побочные эффекты могут быть тяжелыми.
Тяжелые осложнения относительно редки. Среди них пятнисто-папулезная или кореподобная сыпь, лейкопения, тромбоцитопения, волчаночный синдром, увеличение лимфоузлов, острые психозы. Так же, как фенобарбитал и фенитоин, примидон может вызвать гипопротромбинемию у новорожденных, мегалобластную анемию и остеомаляцию.
Сывороточная концентрация. Зависимость сывороточной концентрации примидона и его метаболитов от дозы у разных больных существенно различается. При длительном лечении сывороточная концентрация примидона составляет в среднем 1 мкг/мл, фенобарбитала — 2 мкг/мл, а фенилэтилмалонамида — около 1,5 мкг/мл на каждый 1 мкг/кг/сут. Нет также четкой взаимосвязи между сывороточной концентрацией примидона и его метаболитов и клиническим эффектом. Ориентиром в подборе дозы примидона может служить прежде всего сывороточная концентрация фенобарбитала (как при лечении фенобарбиталом) и лишь затем — сывороточная концентрация самого примидона. Если последняя превышает 10 мкг/мл, велик риск выраженных побочных эффектов.
Лекарственные взаимодействия. Превращение примидона в фенобарбитал ускоряется под действием фенитоина. Взаимодействие с другими препаратами такое же, как у фенобарбитала.
Применение. Примидон назначают при генерализованных тонико-клонических, а также при простых и сложных парциальных припадках. Сочетать его с фенобарбиталом бессмысленно. При абсансах примидон не помогает, но бывает эффективен при миоклонических припадках у детей младшего возраста.
Иминостилбены
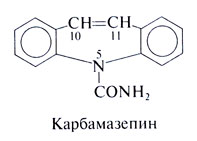
Карбамазепин
В начале 1960-х гг. Блом предложил применять карбамазепин при невралгии тройничного нерва, а в 1974 г. этот препарат был утвержден в США как противосудорожное средство. Сегодня он считается одним из основных средств для лечения парциальных и генерализованных тонико-клонических припадков.
Химические свойства. Структурно-функциональная зависимость. По строению карбамазепин близок к трициклическим антидепрессантам. Это производное иминостилбена с карбамоильной группой в положении 5, обеспечивающей мощную противосудорожную активность. Его структурная формула следующая:
Фармакодинамика. По фармакологическим свойствам карбамазепин во многом сходен с фенитоином, но есть и важные различия. Карбамазепин эффективен при маниакально-депрессивном психозе, в том числе у некоторых больных, которым не помогает литий. Кроме того, он оказывает антидиуретическое действие, иногда сочетающееся со снижением сывороточной концентрации АДГ. Механизмы этих эффектов карбамазепина мало изучены. Механизм действия. Как и фенитоин, карбамазепин подавляет высокочастотные разряды изолированных корковых и спинальных нейронов мыши, вызванные их деполяризацией (McLean and Macdonald, 1986b), за счет замедления деинактивации быстрых натриевых каналов. Такое действие карбамазепина достигается при сывороточной концентрации, соответствующей терапевтической концентрации в СМЖ. При этом карбамазепин действует избирательно, то есть не меняет ни спонтанную импульсную активность, ни реакцию на электрофоретически подведенные ГАМК и глутаминовую кислоту. Активный метаболит карбамазепина, 10,11-эпоксикарбамазепин, втерапевтических концентрациях тоже подавляет высокочастотные разряды и, вероятно, вносит вклад в противосудорожное действие препарата.
Фармакокинетика. У карбамазепина довольно сложная Фармакокинетика. Во-первых, он плохо растворим; во-вторых, как и многие другие противосудорожные средства, он индуцирует микросомальные ферменты печени и тем самым ускоряет собственный метаболизм (в том числе образование активных метаболитов).
При приеме внутрь карбамазепин всасывается медленно и неравномерно. Максимальная сывороточная концентрация обычно достигается через 4—8 ч, но иногда гораздо позже (вплоть до 24 ч), особенно при большой дозе. Карбамазепин быстро распределяется по всем тканям и примерно на 75% связывается с белками плазмы. Его концентрация в СМЖ, видимо, соответствует сывороточной концентрации свободного препарата.
Метаболизм карбамазепина у человека происходит в основном через образование 10,11-эпоксикарбамазепина. Этот метаболит не менее активен, чем сам карбамазепин, и его концентрация в сыворотке и головном мозге достигает 50% концентрации карбамазепина, особенно при сочетании последнего с фенитоином или фенобарбиталом. Затем 10,11-эпоксикарбамазепин распадается на неактивные производные, которые выводятся с мочой восновном в виде глюкуронидов. Инактивация карбамазепина происходит также путем конъюгации и гидроксилирования. Основная роль в метаболизме карбамазепина принадлежит изоферменту IIIA4 цитохрома Р450. Карбамазепин индуцирует изоферменты подсемейств IIС и IIIA, а также глюкуронилтрансферазы, тем самым ускоряя элиминацию препаратов, в метаболизме которых участвуют эти ферменты. Особенно важно, что к этим препаратам принадлежат пероральные контрацептивы, метаболизирующиеся под действием изофермента III4.
Побочные эффекты. Симптомы острого отравления карбамазепином — сопор, кома или, напротив, возбуждение, судороги, угнетение дыхания. Основные осложнения при длительном лечении — сонливость, головокружение, атаксия, диплопия, нечеткость зрения. Могут участиться припадки, особенно при передозировке. Другое побочные эффекты — тошнота и рвота, возможны выраженные гематологические осложнения (апластическая анемия, агранулоцитоз) и аллергические реакции (дерматит, эозинофилия, увеличение лимфоузлов, спленомегалия). Придлительном приеме карбамазепина возможна задержка жидкости с гипонатриемией и со снижением осмоляльности крови, особенно у пожилых с сердечно-сосудистыми болезнями.
Осложнения, возникающие в начале лечения, со временем ослабевают. Тщательный постепенный подбор дозы помогает их предотвратить. Карбамазепин вызывает изменения со стороны печени и поджелудочной железы, чаще это временное повышение активности печеночных ферментов — у 5—10% больных; у 10% в начале лечения возникает легкая лейкопения, прекращающаяся за 4 мес; возможна преходящая тромбоцитопения. Примерно в 2% случаев развивается стойкая лейкопения, требующая отмены препарата. Прежде опасались апластической анемии, однако это осложнение оказалось очень редким: оно возникает всего у одного из 200 ООО человек, и даже в этих случаях причинная связь неоднозначна из-за комбинированной терапии или сопутствующих болезней. Не ясно, можно ли предотвратить это осложнение постоянным слежением за картиной крови. Отмеченное у крыс канцерогенное действие карбамазепина у человека не обнаружено. Тератогенное действие обсуждается ниже.
Сывороточная концентрация. Прямой зависимости сывороточной концентрации карбамазепина от дозы нет. Терапевтическая концентрация составляет в среднем 6— 12 мкг/мл, хотя индивидуальный разброс шире. При сывороточной концентрации выше 9 мкг/мл часто возникают неврологические осложнения.
Лекарственные взаимодействия. Фенобарбитал, фенитоин и вальпроевая кислота индуцируют изофермент IIIА4 цитохрома Р450, усиливая метаболизм карбамазепина. Он, в свою очередь, усиливает метаболизм фенитоина и превращение примидона в фенобарбитал. Карбамазепин может снизить сывороточные концентрации вальпроевой кислоты, ламотригина, тиагабина и топирамата. Карбамазепин уменьшает также сывороточную концентрацию и действие галоперидола. Декстропропоксифен, эритромицин, циметидин, флуоксетин и изониазид тормозят метаболизм карбамазепина.
Применение. Карбамазепин показан при генерализованных тонико-клонических, а также при простых и сложных парциальных припадках. Во время лечения необходимо следить за функцией почек и печени и за картиной крови. Роль карбамазепина в лечении эпилепсии обсуждается в конце главы.
Карбамазепин является препаратом первого ряда при невралгиях тройничного и языкоглоточного нервов. Вначале он помогает почти всем больным, но у 30% со временем перестает действовать, а у 5—20% препарат приходится отменять из-за осложнений. Терапевтическая сывороточная концентрация карбамазепина при невралгиях та же, что при эпилепсии. Карбамазепин уменьшает стреляющие боли при спинной сухотке. Кроме того, он находит применение при маниакально-депрессивном психозе (гл. 20).
Окскарбазепин
Окскарбазепин (10, 11-дигидро-10-оксокарбамазепин) — кетопроизводное карбамазепина. В организме быстро образуется активное 10-гидроксилированное производное окскарбазепина, которое затем выводится с мочой в виде неактивного глюкуронида.
Механизм действия тот же, что у карбамазепина, но индуцирующее влияние на микросомальные ферменты печени слабее. Поэтому замена карбамазепина на окскарбазепин при комбинированной терапии приводит к повышению сывороточных концентраций фенитоина и вальпроевой кислоты. На ферменты, участвующие в его собственном метаболизме, окскарбазепин не влияет. Он не подавляет антикоагулянт-ное действие варфарина, но снижает сывороточные концентрации пероральных контрацептивов, поскольку активирует изоферменты подсемейства ША. Окскарбазепин используют в комбинированной терапии при парциальных припадках у взрослых и у детей старше 4 лет; у взрослых он может быть и средством монотерапии.
Сукцинимиды
Этосуксимид
Сукцинимиды (производные янтарной кислоты) появились в результате направленного поиска менее токсичных, чем производные оксазолидиндиона, средств для лечения абсансов. Этосуксимид стал основным препаратом при абсансах.
Химические свойства. Структурно-функциональная зависимость. Структурная формула этосуксимида следующая:
Взаимосвязь между химическим строением и фармакологическими свойствами у сукцинимидов подчиняется тем же закономерностям, что у других противосудорожных средств. Месуксимид и фенсуксимид, имеющие фенильные заместители, сильнее влияют на экспериментальные припадки, вызванные электрическим разрядом (сведения об этих вышедших из употребления препаратах можно найти в прежних изданиях настоящего руководства). Этосуксимид, являющийся алкилированным производным, действует на припадки, вызванные пентетразолом, а у человека — избирательно на абсансы.
Фармакодинамика. Самая характерная особенность этосуксимида в терапевтических дозах — способность подавлять припадки, вызванные пентетразолом. Те же дозы препарата не влияют на тоническое разгибательное напряжение задних лап у животных при припадках, вызванных электрическим разрядом, и на припадки, вызванные «раскачкой». Такие особенности обычно сочетаются с эффективностью при абсансах у человека.
Механизм действия. Этосуксимид снижает ток через кальциевые каналы Т-типа в нейронах таламуса. Таламусу принадлежит существенная роль в формировании типичной для абсансов ритмичной активности пик—волна с частотой 3 Гц (Coulter, 1998). Для нейронов таламуса характерен мощный ток через кальциевые каналы Т-типа, вызывающий разряды потенциалов действия и, возможно, играющий важную роль в формировании активности пик—волна. Методом фиксации потенциала на изолированных нейронах вентробазальных отделов таламуса крыс и морских свинок показано, что этосуксимид в терапевтических концентрациях подавляет ток через эти каналы. При этом он не влияет на потенциалза-висимость их инактивации и на время деинактивации. Производные янтарной кислоты, вызывающие припадки, таким действием на кальциевые каналы Т-типа не обладают. Этосуксимид в терапевтических концентрациях не тормозит высокочастотную импульсацию и не усиливает реакцию на ГАМК. Данные последних лет подтверждают, что его влияние на абсансы обусловлено именно торможением кальциевых каналов Т-типа.
Фармакокинетика. При приеме внутрь этосуксимид всасывается полностью, максимальная сывороточная концентрация достигается примерно через 3 ч. Он мало связывается с белками плазмы. При длительном лечении сывороточная концентрация препарата соответствует концентрации в СМЖ. Объем распределения составляет около 0,7 л/кг.
Примерно на 25% этосуксимид выводится с мочой в неизмененном виде. Остальная часть метаболизируется микросомальными ферментами печени, но участие изоферментов цитохрома Р450 не доказано. Около 40% препарата превращается в неактивное гидроксиэтильное производное, которое выводится с мочой — как таковое либо в виде глюкуронида. Т1/2 этосуксимида у взрослых 40—50 ч, у детей около 30 ч.
Побочные эффекты. Характерны дозозависимые осложнения со стороны ЖКТ (тошнота, рвота, снижение аппетита) и ЦНС (сонливость, заторможенность, эйфория, дурнота, головная боль, икота). Со временем развивается частичная толерантность. Описаны паркинсонизм и светобоязнь. Такие реакции, как беспокойство, возбуждение, тревожность, агрессивность, рассеянность, свойственны больным, уже имеющим психические расстройства.
Возможны крапивница и другие кожные аллергические реакции, включая синдром Стивенса—Джонсона, а также волчаночный синдром, эозинофилия, лейкопения, тромбоцитопения, панцитопения, апластическая анемия. Лейкопения нередко проходит без отмены препарата, но описано и тяжелое угнетение кроветворения с летальным исходом. Осложнения со стороны печени и почек не характерны.
Сывороточная концентрация. На фоне длительного лечения сывороточная концентрация этосуксимида составляет около 2 мкг/мл на каждый 1 мг/кг/сут. У большинства больных с абсансами терапевтический эффект достигается при сывороточной концентрации 40—100 мкг/мл.
Применение. Этосуксимид помогает при абсансах, но при генерализованных тонико-клонических припадках неэффективен. Он вызывает меньше осложнений, чем прежде применявшийся триметадион (сведения о нем есть в прошлых изданиях настоящего руководства). В лечении абсансов этосуксимиду принадлежит ведущая роль.
Начальная доза у детей 3—6 лет — 250 мг/сут, у детей старше 6 лет и у взрослых — 500 мг/сут. Далее ее еженедельно повышают на 250 мг/сут до достижения эффекта либо до появления побочных реакций. Если однократный прием сопровождается тошнотой или сонливостью, суточную дозу делят на несколько приемов. Стандартная доза — 20 мг/кг/сут. При назначении высоких доз (больше 1500 мг/суту взрослых и 750—1000 мг/суту детей) требуется большая осторожность. В конце главы изложены показания к применению этосуксимида в сопоставлении с другими противосудорожными средствами.
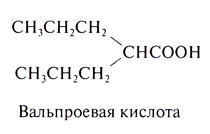
Вальпроевая кислота
Этот препарат применяется в США с 1978 г. Противосудорожные свойства вальпроевой кислоты обнаружили случайно, используя ее как лекарственную основу других веществ, испытываемых на предмет противосудорожной активности.
Химические свойства. Структурно-функциональная зависимость. Вальпроевая (л-дипропилуксусная) кислота представляет собой простую разветвленную карбоновую кислоту со следующей формулой:
Способностью подавлять припадки, вызванные пентетразолом, обладают и некоторые другие разветвленные карбоновые кислоты, однако увеличение числа атомов углерода сообщает им сильные седативные свойства. Неразветвленные карбоновые кислоты не обладают противосудорожным действием. Первичный амид вальпроевой кислоты вдвое активнее самой кислоты.
Фармакодинамика. Вальпроевая кислота действует на разные экспериментальные припадки, чем существенно отличается от фенитоина, этосуксимида и других препаратов. В терапевтических концентрациях она подавляет тоническое разгибательное напряжение задних лап у животных при припадках, вызванных электрическим разрядом, и припадки, вызванные «раскачкой» (как фенитоин и карбамазепин), а в близких к токсическим — тормозит клонические припадки, вызванные пентетразолом (как этосуксимид). Соответственно, препарат эффективен и при разных припадках у человека: абсансах, парциальных, генерализованных тонико-клонических.
Механизм действия. По действию на изолированные нейроны вальпроевая кислота сочетает в себе свойства фенитоина и этосуксимида. В терапевтических концентрациях она подавляет высокочастотные разряды корковых и спинальных нейронов мыши, вызванные их деполяризацией (McLean and Macdonald, 1986а). В основе этого эффекта, свойственного также фенитоину и карбамазепину, лежит замедление деинактивации быстрых натриевых каналов. Вальпроевая кислота не изменяет реакцию нейронов на электрофоретически подведенную ГАМК. В нейронах узловатого ганглия вальпроевая кислота (в слегка большей концентрации, чем в случае подавления высокочастотных разрядов) несколько снижает ток через кальциевые каналы Т-типа (Kelly et al., 1990). Этот эффект аналогичен действию этосуксимида на нейроны таламуса (Coulter et al., 1989). Способность подавлять высокочастотные разряды объясняет эффективность валь-проевой кислоты при парциальных и генерализованных тонико-клонических припадках, а действие на кальциевые каналы Т-типа — при абсансах.
Еше один предполагаемый механизм противосудорожного действия вальпроевой кислоты связан с метаболизмом ГАМК. Вальпроевая кислота не меняет реакцию нейронов на введенную ГАМК, она увеличивает количество ГАМК в головном мозге животных. In vitro вальпроевая кислота активирует глутаматдекарбоксилазу, участвующую в синтезе ГАМК (Phillips and Fowler, 1982), а также инактивирует ферменты, разрушающие ГАМК, — ГАМК-аминотрансферазу и дегидрогеназу янтарного полуальдегида (Chapman et al., 1982). Однако связь противосудорожной активности вальпроевой кислоты с ее влиянием на метаболизм ГАМК не доказана.
Фармакокинетика. При приеме внутрь вальпроевая кислота быстро и полностью всасывается. Максимальная сывороточная концентрация достигается через 1—4 ч, а если препарат принимают во время еды либо в таблетках с кислотоустойчивой оболочкой, то позже. Объем распределения составляет около 0,2 л/кг. С белками плазмы вальпроевая кислота связывается на 90%, но при увеличении общей сывороточной концентрации эта доля уменьшается. Концентрация вальпроевой кислоты в СМЖ равна сывороточной концентрации свободного препарата, что свидетельствует о диффузионном равновесии; в то же время есть данные о наличии двустороннего опосредованного переносчиком транспорта вальпроевой кислоты через гематоэнцефалический барьер.
На 95% вальпроевая кислота метаболизируется в печени, остальные 5% выводятся в неизмененном виде. Метаболизм большей частью происходит под действием глюкуронилтрансфераз и путем β-окисления; участвуют также изоферменты 1IC9 и IIC19 цитохрома Р450, но их роль невелика. Некоторые метаболиты вальпроевой кислоты, а именно 2-пропил-2-пентеновая и 2-про-пил-4-пентеновая кислоты, обладают почти столь же мощным противосудорожным действием, что и сама вальпроевая кислота, однако только 2-пропил-2-пентеновая кислота достигает достаточной концентрации в крови и головном мозге. Т1/2 вальпроевой кислоты составляет 15 ч, но при комбинированной противосудорожной терапии снижается.
Побочные эффекты. Основные побочные эффекты — снижение аппетита, тошнота и рвота, они возникают у 16% больных и со временем обычно проходят. Неврологические осложнения — сонливость, атаксия и тремор — редки и, как правило, исчезают при снижении дозы. Изредка появляются сыпь, алопеция, повышенный аппетит. Характерны реакции со стороны печени. Почти у 40% больных в первые месяцы лечения повышается активность печеночных ферментов, чаще бессимптомно. Редкое осложнение — острый токсический некроз печени с высокой летальностью (Dreifuss et al., 1989). Его морфологическая картина — мелкокапельная жировая дистрофия печени без воспалительных и аллергических изменений. Это осложнение обычно встречается удетей до 2 лет с сопутствующими болезнями, получающих комбинированную противосудорожную терапию. У больных старше 10 лет, получающих только вальпроевую кислоту, поражения печени со смертельным исходом не зарегистрированы. Довольно частые осложнения — острый панкреатит и гипераммониемия.
Сывороточная концентрация. Терапевтическая сывороточная концентрация вальпроевой кислоты составляет 30—100 мкг/мл. Однако строгой зависимости между сывороточной концентрацией и клиническим эффектом нет. Очевидно, существует пороговая концентрация в диапазоне 30—50 мкг/мл, при которой происходит насыщение участков связывания вальпроевой кислоты на альбумине.
Лекарственные взаимодействия. Вальпроевая кислота ингибирует изофермент IIC9 цитохрома Р450, а следовательно, и метаболизм таких препаратов, как фенитоин и фенобарбитал. Кроме того, вальпроевая кислота подавляет глюкуронилтрансферазы и тем самым — метаболизм ламотригина и лоразепама. Большая часть вальпроевой кислоты связывается с альбумином; поскольку ее молекула сравнительно мелкая, при назначении обычных доз достигается высокая молярная концентрация, и в результате вальпроевая кислота вытесняет из связи с альбумином фенитоин и другие препараты. Таким образом, с одной стороны, вальпроевая кислота тормозит метаболизм этих препаратов (тем самым повышая их сывороточную концентрацию), с другой — препятствует их соединению с альбумином (тем самым снижая общую сывороточную концентрацию); особенно это относится к фенитоину. Комбинация вальпроевой кислоты с клоназепамом может вызвать статус абсансов, хотя, это редкое осложнение.
Применение. Вальпроевую кислоту назначают при абсансах, парциальных и генерализованных миоклонических и тонико-клонических припадках. Начальную дозу (15 мг/кг/сут) повышают еженедельно на 5— 10 мг/кг/сут; максимальная доза 60 мг/кг/сут; дозу выше 250 мг/сут делят на несколько приемов. Применение вальпроевой кислоты в лечении эпилепсии обсуждается в конце главы.
Бензодиазепины
Бензодиазепины применяют прежде всего как транквилизаторы и снотворные (гл. 17 и 19); здесь же мы рассмотрим лишь их использование при эпилепсии. Противосудорожной активностью обладают многие бензодиазепины, но в США для долгосрочного лечения эпилепсии используют только клоназепам и клоразепат. Два других препарата, диазепам и лоразепам, применяют при эпилептическом статусе. Химические формулы бензодиазепинов приведены в гл. 17.
Противосудорожные свойства. Бензодиазепины гораздо эффективнее при экспериментальных припадках, вызванных пентетразолом, чем электрическим разрядом; клоназепам, в частности, чрезвычайно активен при первых и почти не действует на вторые. Клоназепам и другие бензодиазепины подавляют припадки при «раскачке» и генерализованные припадки при электростимуляции миндалевидного тела, однако не устраняют патологические разряды в области стимуляции.
Механизм действия. В основе противосудорожного и других эффектов бензодиазепинов (в дозах, не вызывающих сонливости) лежит способность усиливать тормозное действие ГАМК. Клонирование и исследование рекомбинантных рецепторов показали, что бензодиазепиновый рецептор является составной частью ГАМКд-рецептора (гл. 17). Бензодиазепины в терапевтических концентрациях действуют на различные подклассы ГАМКд-рецепторов. При этом учащаются (но не удлиняются) вспышки открывания хлорных каналов в ответ на аппликацию ГАМК (Twyman et al., 1989). Диазепам и многие другие бензодиазепины в больших концентрациях подавляют высокочастотные разряды (аналогично фенитоину, карбамазепину и вальпроевой кислоте). В таких концентрациях диазепам применяют только при эпилептическом статусе; при длительной противосудорожной или анксиолитической терапии сывороточные концентрации бензодиазепинов гораздо ниже.
Фармакокинетика. При приеме внутрь бензодиазепины хорошо всасываются; максимальная сывороточная концентрация достигается через 1—4 ч. При в/в введении они распределяются в организме как все жирорастворимые вещества (гл. 1): центральные эффекты развиваются быстро, но по мере перераспределения в другие ткани быстро убывают. Особенно быстро перераспределяется диазепам (начальный Т|/2, соответствующий фазе распределения, около 1 ч). Связывание бензодиазепинов с белками плазмы зависит от их жирорастворимости и колеблется от 99% (у диазепама) до 85% (у клоназепама) (см. также Приложение II).
Главный метаболит диазепама нордазепам (десметилдиазепам) несколько менее активен, чем сам диазепам, и обладает свойствами частичного агониста. Этот же метаболит образуется в результате быстрого декарбоксилирования клоразепата (при его приеме внутрь). Диазепам и нордазепам медленно гидроксилируются до других активных метаболитов, в частности оксазепама. Т1/2 диазепама 1—2 сут, а нордазепама — около 2,5 сут. Основной путь метаболизма клоназепама — восстановление нитрогруппы в положении 7 с образованием неактивных 7-аминопроизводных; менее 1% клоназепама выводится с мочой в неизмененном виде. Т1/2 клоназепама равен примерно 24 ч. Метаболизм лоразепама происходит путем соединения с глюкуроновой кислотой, Т,/2 составляет около 14 ч.
Побочные эффекты. Основной побочный эффект клоназепама при постоянном приеме — сонливость. В начале лечения она наблюдается у половины больных, но затем обычно развивается толерантность. Реже возникают расстройства координации; обычно они уменьшаются при коррекции дозы, но иногда приходится отменить препарат. Другие осложнения — артериальная гипотония, дизартрия, дурнота. Нередки психические изменения, особенно у детей: агрессивность, гиперактивность, раздражительность, рассеянность. Иногда снижается либо усиливается аппетит. Встречаются слюнотечение и бронхо-рея, которые особенно плохо переносят дети. Возможно учащение припадков, а при резкой отмене препарата — эпилептический статус. Другие побочные эффекты бензодиазепинов изложены в гл. 17. В/в введение диазепама, клоназепама и лоразепама может сопровождаться угнетением дыхания и кровообращения, особенно если до бензодиазепина вводились другие противосудорожные средства и препараты, угнетающие ЦНС.
Сывороточная концентрация. В случае бензодиазепинов сывороточная концентрация не показательна для оценки эффективности, так как многое зависит от развития толерантности.
Применение. Клоназепам назначают при абсансах и мио-клонических припадках у детей. Однако через 1—6 мес к нему обычно развивается толерантность, и даже увеличение дозы не помогает. Начальная доза клоназепама для взрослых не более 1,5 мг/сут, для детей 0,01 —0,03 мг/кг/сут. Деление суточной дозы на 2—3 приема уменьшает дозозависимые побочные эффекты. Дозу можно увеличивать каждые 3 сут: детям на 0,25—0,5 мг/сут, взрослым на 0,5—1 мг/сут. Максимальная доза для взрослых и детей — 20 мг/сут и 0,2 мг/кг/сут соответственно.
Диазепам в/в применяют при эпилептическом статусе, из-за кратковременности действия его часто сочетают с фенитоином в/в. Скорость введения — не более 5 мг/мин; взрослым вводят 5—10 мг, при необходимости повторно каждые 10—15 мин до 30 мг в целом. При показаниях эту схему можно повторить спустя 2—4 ч, но общая доза не должна превысить 100 мг за 24 ч.
Для долгосрочного лечения эпилепсии диазепам внутрь не применяют. При парциальных припадках используют клоразепат в комбинации с другими противосудорожными средствами. Лечение у взрослых начинают с дозы не более 22,5 мг/сут в 3 приема, у детей старше 9 лет — не более 15 мг/сут в 2 приема. Детям младше 9 лет клоразепат противопоказан.
Прочие противосудорожные средства
Габапентин
Этот препарат одобрен ФДА в 1993 г. По химическому строению он представляет собой ГАМК, ковалентно связанную с липофильным циклогексановым кольцом. Габапентин был получен путем направленного синтеза как жирорастворимый аналог ГАМК, лучше проникающий через гематоэнцефалический барьер. Его структурная формула следующая:
Фармакодинамика. Габапентин подавляет тоническое разгибательное напряжение задних лап у животных при припадках, вызванных электрическим разрядом, и подавляет клонические припадки, вызванные пентетразолом. Действие на разные виды экспериментальных припадков сближает габапентин с вальпроевой кислотой и отличает от фенитоина и карбамазепина. Механизм противосудорожной активности габапентина не установлен. Хотя он является аналогом ГАМК, но иначе действует на изолированные нейроны головного мозга. Вероятно, каким-то образом габапентин усиливает высвобождение ГАМК, не связанное с экзоцитозом синаптических пузырьков (Honmou et al., 1995). Габапентин связывается с мембранным белком корковых нейронов, имеющим ту же аминокислотную последовательность, что и комплекс субъединиц а26 кальциевых каналов L-типа. При этом он не действует на кальциевые каналы Т-, N- и L-типа в нейронах спинномозговых ганглиев (Macdonald and Greenfield, 1997). Отчетливого тормозного действия на высокочастотные разряды габапентин не оказывает (Macdonald and Greenfield, 1997).
Фармакокинетика. У человека габапентин не метаболизируется: он всасывается и затем выводится в неизмененном виде, в основном с мочой; Т1/2 составляет 5—9 ч. Добавление габапентина к фенитоину, карбамазепину, фенобарбиталу или вальпроевой кислоте не меняет их сывороточные концентрации.
Применение. Габапентин одобрен ФДА как дополнительный препарат для лечения различных парциальных припадков, включая вторично генерализованные, у взрослых. В двойном слепом плацебо-контролируемом испытании была показана эффективность габапентина в составе комбинированной терапии при устойчивых к лечению парциальных припадках: у получавших габапентин частота припадков снизилась на 27%, у получавших плацебо — на 12%. Еще одно двойное слепое контролируемое исследование показало, что монотерапия габапентином (900— 1800 мг/сут) по эффективности близка к лечению карбамазепином (600 мг/сут). Габапентин применяют также при мигрени, хронических болях и маниакально-депрессивном психозе.
Обычная доза составляет 900—1800 мг/сут в 3 приема; в первый день принимают 300 мг однократно и увеличивают дозу на 300 мг ежедневно до достижения эффекта. Побочные эффекты. Частые побочные реакции — сонливость, дурнота, нарушения координации, утомляемость. Эти легкие или умеренные расстройства обычно проходят за 2 нед, в целом габапентин переносится хорошо.
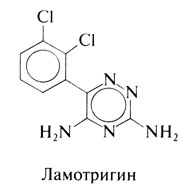
Ламотригин
Этот препарат, одобренный ФДА в 1994 г., представляет собой производное фенилтриазина. Его синтезировали как антагонист фолиевой кислоты, исходя из ложной предпосылки, что низкое содержание фолиевой кислоты препятствует припадкам. Доказано, однако, что противосудорожные свойства ламотригина с этим не связаны (Macdonald and Greenfield, 1997). Структурная формула ламотригина следующая:
Фармакодинамика. Ламотригин подавляет тоническое разгибательное напряжение задних лап у животных при припадках, вызванных электрическим разрядом, а также парциальные и вторично генерализованные припадки при «раскачке», но не влияет на клонические припадки, вызванные пентетразолом. Он подавляет высокочастотные разряды в спинальных нейронах мыши и замедляет деинактивацию быстрых натриевых каналов аналогично фенитоину и карбамазепину (Xie et al., 1995). Эти свойства ламотригина объясняют его действенность при парциальных припадках, в том числе вторично генерализованных. Однако спектр действия у ламотригина шире, чем у фенитоина и карбамазепина; очевидно, помимо влияния на быстрые натриевые каналы существуют другие, еще неизвестные механизмы действия. Например, ламотригин тормозит стимулированное вератридином (средством, подавляющим инактивацию быстрых натриевых каналов) высвобождение глутаминовой кислоты из нейронов срезов коры головного мозга крысы. Можно предположить, что ламотригин подавляет высвобождение из пресинаптических окончаний глутаминовой кислоты, действуя на быстрые натриевые каналы.
Фармакокинетика. Ламотригин полностью всасывается в ЖКТ и метаболизируется в основном путем конъюгации сглюкуроновой кислотой; Т1/2 после однократного приема равен 24—35 ч. При сочетании ламотригина с фенитоином, карбамазепином, фенобарбиталом и примидоном его Т1/2 уменьшается до 15 ч, а сывороточная концентрация снижается. При сочетании с вальпроевой кислотой сывороточная концентрация ламотригина, напротив, существенно выше — видимо, из-за уменьшения его конъюгации с глюкуроновой кислотой. Добавление ламотригина к вальпроевой кислоте снижает ее сывороточную концентрацию примерно на 25%; это действие длится несколько недель. Комбинация ламотригина с карбамазепином сопряжена с усиленным образованием 10,11-эпоксикарбамазепина и побочными реакциями у части больных.
Применение. Ламотригин используют в моно- или комбинированной терапии парциальных припадков (включая вторично генерализованные) у взрослых, а также синдрома Леннокса—Гасто у взрослых и детей (синдром Леннокса—Гасто — форма эпилепсии, начинающейся в детстве и характеризующейся разнообразием припадков, устойчивостью к лечению и умственной отсталостью). В двойном слепом плацебо-контролируемом испытании показано, что у прежде не лечившихся больных с парциальными и вторично генерализованными тонико-клоническими припадками монотерапия ламотригином и карбамазепином одинаково эффективна, но ламотригин лучше переносится (Brodie et al., 1995). Другое контролируемое исследование выявило эффективность добавления ламотригина к другим противосудорожным средствам при генерализованных тонико-клонических и атонических припадках у детей с синдромом Леннокса—Гасто (Motte et al., 1997). Есть данные об эффективности ламотригина при юношеской миоклонической эпилепсии и абсансной эпилепсии. Если больные уже лечатся препаратами, вызывающими индукцию микросомальных ферментов печени (карбамазепином, фенитоином, фенобарбиталом, примидоном, но не вальпроевой кислотой), то ламотригин добавляют к этим препаратам по следующей схеме: сначала 50 мг/сут в 1 прием в течение 2 нед, затем 100 мг/сут в 2 приема в течение еще 2 нед, и далее дозу увеличивают еженедельно на 100 мг/сут до 300—500 мг/сут в 2 приема. Если помимо препаратов, индуцирующих печеночные ферменты, больной получает вальпроевую кислоту, то схема иная: сначала 25 мг/сут в 1 прием через сутки в течение 2 нед, затем 25 мг/сут в 1 прием ежедневно в течение еще 2 нед, и далее дозу увеличивают на 25—50 мг/сут каждые 1—2 нед до постоянной дозы 100—150 мг/сут в 2 приема.
Побочные эффекты. Типичные побочные реакции при добавлении ламотригина к другим препаратам — дурнота, нарушение координации, нечеткость зрения, диплопия, тошнота, рвота, сыпь. Описано несколько случаев синдрома Стивенса—Джонсона и ДВС-синдрома.
Ацетазоламид
Этот ингибитор карбоангидразы подробно описан в гл. 29. Его противосудорожные свойства рассматривались в предыдущих изданиях руководства. Ацетазоламид помогает некоторым больным с абсансами, но к нему быстро развивается толерантность. В средних дозах и при непродолжительном лечении он почти не вызывает осложнений.
Фелбамат
Фелбамат, или 2-фенил-1,3-пропандиола дикарбамат, разрешен ФДА к применению при парциальных припадках в 1993 г. Однако из-за риска тяжелой апластической анемии (зарегистрировано не менее 10 случаев) ФДА и фирмы-производители вскоре резко ограничили показания к его использованию. Структурная формула фелбамата следующая:
Фелбамат действует на экспериментальные припадки, вызванные электрическим разрядом и пентетразолом. На изолированных нейронах гиппокампа крыс методом локальной фиксации в конфигурации «целая клетка» показано, что в терапевтических концентрациях фелбамат подавляет эффекты стимуляторов глутаматных NMDA-рецепторов и усиливает эффекты ГАМК (Rho et al., 1994). Возможно, именно такое двойное действие (на возбуждающую и на тормозную передачу) обеспечивает эффективность фелбамата при различных экспериментальных припадках.
В рандомизированном клиническом исследовании, проведенном двойным слепым методом, показана эффективность фелбамата при устойчивых к другим препаратам парциальных припадках, включая вторично генерализованные (Sachdeo et al.,1992). Кроме того, фелбамат эффективен при синдроме Леннокса—Гасто (The Felbamate Study Group in Lennox-Gastaut Syndrome, 1993). Эффективность этого препарата побуждает к поиску других противосудорожных средств аналогичного двойного действия.
Леветирацетам
Это производное пирролидина, представляющее собой оптически чистый S-изомер а-этил-2-оксо-1-пирролидинацетамида. В 1999 г. он был разрешен ФДА в качестве дополнительного средства при парциальных припадках у взрослых. Его структурная формула следующая:
Фармакодинамика. Леветирацетам — препарат нового типа: он подавляет парциальные припадки, в том числе вторично генерализованные, вызванные «раскачкой», но не действует на припадки, вызванные электрическим разрядом и пентетразолом. У человека он эффективен при парциальных припадках, включая вторично генерализованные. Механизм противосудорожной активности леветирацетама не известен. Не доказано его действие ни на быстрые натриевые каналы, ни на ГАМКергическую либо глутаматергическую передачу. Показано, что в мозге крыс имеется участок связывания, специфичный в отношении только одного оптического изомера леветирацетама, но его молекулярная природа не известна.
Фармакокинетика. При приеме внутрь леветирацетам быстро и почти полностью всасывается. На 95% он выводится с мочой, в том числе на 65% — в неизмененном виде; четверть дозы метаболизируется путем гидролиза ацетамидной группы. В метаболизме леветирацетама не участвуют ни цитохром Р450, ни глюкуронилтрансферазы; леветирацетам, в свою очередь, не влияет на эти ферменты. В связи с этим он не взаимодействует с другими противосудорожными средствами, пероральными контрацептивами и антикоагулянтами.
Применение. В двойном слепом плацебо-контролируемом испытании показано, что леветирацетам эффективен в качестве дополнительного средства при устойчивых к лечению парциальных припадках у взрослых. Его ценность для монотерапии еще изучается.
Побочные эффекты. Леветирацетам хорошо переносится. Возможны сонливость, утомляемость, дурнота.
Тиагабин
Тиагабин представляет собой производное нипекотиновой кислоты. Он одобрен ФДА в 1998 г. как дополнительный препарат при парциальных припадках у взрослых. Структурная формула тиагабина следующая:
Фармакодинамика. Тиагабин ингибирует переносчик ГАМК (GAT-1) и тем самым уменьшает захват ГАМК нейронами и глией. Продлевая тормозное действие ГАМК, он удлиняет ТПСП в нейронах поля СА1 гиппокампа. В эксперименте тиагабин действует на припадки, вызванные электрическим разрядом, а также на лимбические и вторично генерализованные припадки, вызванные «раскачкой». Следовательно, он должен быть эффективным при парциальных и генерализованных тонико-клонических припадках у человека.
Фармакокинетика. Тиагабин быстро всасывается в ЖКТ, активно связывается с белками и метаболизируется большей частью в печени при участии изоферментов подсемейства IIIA цитохрома Р450. Т1/2 тиагабина составляет около 8 ч, но при одновременном приеме препаратов, вызывающих индукцию микросомальных ферментов печени (фенобарбитала, фенитоина, карбамазепина), укорачивается на 2—3 ч.
Применение. В двойном слепом плацебо-контролируемом испытании показано, что тиагабин эффективен как дополнительное средство при устойчивых к лечению парциальных припадках, включая вторично генерализованные. Эффективность монотерапии тиагабином не изучена.
Побочные эффекты. В начале лечения нередки легкие или умеренные дурнота, сонливость и тремор, которые вскоре проходят. Как и другие препараты, усиливающие ГАМКергическую передачу, тиагабин облегчает разряды пик—волна в экспериментальных моделях абсансов, поэтому при абсансах он может быть противопоказан.
Топирамат
Это сульфаматзамещенный моносахарид. В 1996 г. топирамат был одобрен ФДА как дополнительный препарат при парциальных припадках у взрослых. Его структурная формула следующая:
Фармакодинамика. Топирамат снижает ток через быстрые натриевые каналы в зернистых клетках мозжечка и, возможно, замедляет их деинактивацию подобно фени-тоину. Кроме того, топирамат усиливает хлорный ток, возникающий при активации ГАМКд-рецепторов, и уменьшает активацию глутаматных АМРА- и каинатных рецепторов. Наконец, он является слабым ингибитором карбоангидразы. Топирамат действует на экспериментальные припадки всех типов: вызванные электрическим разрядом, пентетразолом и «раскачкой»; следовательно, он может быть эффективным при разных формах эпилепсии у человека.
Фармакокинетика. Топирамат быстро всасывается в ЖКТ. Он элиминируется преимущественно путем выведения с мочой в неизмененном виде; остальная часть гидроксилируется, гидролизуется и связывается с глюкуроновой кислотой, причем содержание каждого из его метаболитов не превышает 5% дозы. Т1/2 составляет около 24 ч. При сочетании топирамата с пероральными контрацептивами сывороточная концентрация эстрадиола снижается, поэтому в таких случаях дозу контрацептивов, возможно, следует увеличивать.
Применение. В двойном слепом плацебо-контролируемом испытании показано, что топирамат эффективен при устойчивых к лечению парциальных припадках, в том числе вторично генерализованных, у взрослых и детей. Кроме того, доказана его эффективность при атонических и генерализованных тонико-клонических припадках у детей с синдромом Леннокса—Гасто, а также при первично генерализованных тонико-клонических и миоклонических припадках у взрослых и детей. Есть предварительные данные об эффективности топирамата при синдроме Уэста.
Побочные эффекты. Топирамат хорошо переносится, хотя возможны сонливость, утомляемость, раздражительность, похудание.
Читайте также: Топирамат для похудения
Зонисамид
Этот препарат, содержащий сульфаниламидную группу, был ободрен ФДА в 2000 г. как дополнительное средство при парциальных припадках у взрослых. Его структурная формула следующая:
Фармакодинамика. Зонисамид снижает ток через кальциевые каналы Т-типа. Кроме того, он подавляет высокочастотные разряды нейронов спинного мозга — видимо, за счет замедления деинактивации быстрых натриевых каналов (подобно фенитоину и карбамазепину). Зонисамид снимает тоническое разгибательное напряжение задних лап у животных при припадках, вызванных электрическим разрядом, и парциальные (включая вторично генерализованные) припадки, вызванные «раскачкой»; следовательно, можно ожидать его эффективности при парциальных (в том числе вторично генерализованных) припадках у человека. На клонические припадки, вызванные пентетразолом, зонисамид не действует и поэтому теоретически не должен влиять и на миоклонические припадки у человека. Поскольку зонисамид тормозит кальциевые каналы Т-типа, можно ожидать его эффективности при абсансах, однако экспериментальных доказательств этого пока нет.
Фармакокинетика. Зонисамид почти полностью всасывается в ЖКТ, имеет продолжительный Т1/2 (около 63 ч), связывается с белками плазмы на 40%. Около 85% выводится с мочой, преимущественно в неизмененном виде и в виде глюкуронида сульфамоилацетилфенола, образующегося при участии изофермента IIIA4 цитохрома Р450. Отношение сывороточная концентрация/доза для зонисамида уменьшается под действием фенобарбитала, фенитоина и карбамазепина и увеличивается — под действием ламотригина. Сам зонисамид почти не влияет на сывороточные концентрации других противосудорожных средств.
Применение. В двойном слепом плацебо-контролируемом испытании показано, что зонисамид эффективен при устойчивых к лечению парциальных припадках. Начаты его испытания при абсансах, синдроме Леннокса— Гасто и синдроме Уэста; пока есть лишь отдельные неопубликованные наблюдения.
Побочные эффекты. В целом зонисамид хорошо переносится. Основные побочные эффекты — сонливость, нарушение координации, снижение аппетита, раздражительность, утомляемость. У 1% больных возникает мочекаменная болезнь; механизм этого осложнения не понятен.
Общие принципы противосудорожной терапии
Для того чтобы противосудорожное лечение было эффективным, а его осложнения были сведены к минимуму, необходимы прежде всего ранняя диагностика и своевременно начатая монотерапия наиболее подходящим препаратом. Важно попытаться выяснить этиологию эпилепсии: возможно, имеется излечимое нейрохирургическое заболевание или устранимое нарушение обмена веществ. Однако, что касается противосудорожных средств, их выбирают в зависимости от вида припадков (табл. 21.1), а не от причины и формы эпилепсии; по этому же принципу проводят клинические испытания. В каждом случае выбор препарата определяется его эффективностью и побочными реакциями.
Первый вопрос: всегда ли нужно лечение и когда его начинать? Например, у здорового молодого человека впервые произошел генерализованный тонико-клонический припадок, в семье нет случаев эпилепсии, при неврологическом осмотре, ЭЭГ и МРТ головного мозга не обнаружено нарушений. Надо ли его лечить? В данном случае риск повторного припадка на протяжении следующего года составляет 15%, такова же вероятность достаточно серьезных побочных эффектов противосудорожных средств (Bazil and Pedley, 1998). Но если такой же припадок произошел у человека, имеющего родственников с эпилепсией, нарушения в неврологическом статусе, изменения на ЭЭГ и МРТ, риск возобновления припадков достигает 60% и перевешивает риск осложнений противосудорожной терапии; в таких случаях выбирают медикаментозное лечение.
Если нет особых обстоятельств (например, эпилептического статуса), начинать лечение следует с одного препарата. Начальная доза должна обеспечить хотя бы минимальную терапевтическую сывороточную концентрацию. Для того чтобы свести к минимуму дозозависимые осложнения, монотерапию многими препаратами начинают со сниженных доз. Затем дозу постепенно повышают, следя за динамикой припадков, побочными эффектами и регулярно измеряя сывороточную концентрацию препарата. Монотерапия правильно выбранным препаратом в максимальной переносимой дозе полностью избавляет от припадков половину больных. Если при достаточной сывороточной концентрации препарата все же возникает припадок, врач должен выяснить, не было ли каких-то провоцирующих обстоятельств: недосыпания, инфекции, приема других препаратов (припадки могут вызвать даже некоторые безрецептурные средства) или, например, употребления больших количеств кофе.
Если провоцирующих причин нет, больной добросовестно выполняет назначения врача, но припадки продолжаются, следует заменить препарат. Первый препарат отменяют постепенно (если только тяжелые осложнения не требуют быстрой замены), иначе возможны рикошетные припадки. Разнообразие средств для лечения парциальных припадков у взрослых позволяет выбрать ля замены препарат с другим механизмом действия. По некоторым данным (Smith et al., 1987), монотерапия вторым препаратом результативна в 55% случаев, но другие исследователи приводят гораздо меньшие цифры: из числа больных со сложными парциальными припадками, устойчивыми к одному препарату, при его замене удалось добиться эффекта лишь у 9—11% (Schmidt and Richter, 1986; Dasheiff et al., 1986).
Если и лечение вторым препаратом оказывается безуспешным, многие врачи переходят на комбинацию двух средств. Этот серьезный шаг надо хорошо взвесить, поскольку в большинстве случаев удается добиться результата монотерапией, а при комбинированной терапии выше риск осложнений. Однако некоторым больным действительно необходимы два препарата и более. Достоверных систематизированных данных о преимуществах тех или иных лекарственных комбинаций нет. Целесообразно сочетать препараты с разным механизмом действия (например, один замедляет деинактивацию натриевых каналов, другой усиливает ГАМКергическую передачу). Необходимо учесть возможные побочные эффекты каждого препарата и лекарственные взаимодействия. Многие противосудорожные средства индуцируют микросомальные ферменты печени (табл. 21.2), что влияет на их собственный метаболизм и на метаболизм других препаратов. Для большинства средств последнего поколения вопрос лекарственного взаимодействия не столь важен. Если монотерапия двумя последовательными препаратами не дала результата, то и у комбинированной терапии немного шансов на успех. В этих случаях надо подумать о хирургическом лечении.
В процессе лечения сам больной или родственники должны вести дневник припадков. В начале лечения больной должен довольно часто посещать врача или специализированную клинику: это позволяет вовремя заметить побочные эффекты (в частности, гематологические) и при необходимости поменять схему лечения. На всех этапах лечения нужны регулярные неврологические осмотры, при необходимости ЭЭГ, КТ либо МРТ. Крайне важен регулярный прием лекарств: сбои в лечении — самая частая причина неудачи.
Регулярно определять сывороточную концентрацию препарата важно, во-первых, при подборе дозы в начале лечения (для учета индивидуальных особенностей фармакокинетики препарата), во-вторых, при изменениях схемы в процессе лечения (для предотвращения осложнений без снижения эффективности). Кроме того, это исследование позволяет проследить, не нарушает ли больной предписания врача. Особенно важно следить за сывороточной концентрацией препаратов при комбинированной терапии: в случае осложнений легче выяснить, какой именно препарат их вызвал, а при лекарственном взаимодействии можно точнее скорректировать дозы.
Продолжительность лечения
Отмена противосудорожных средств у детей изучалась в проспективном исследовании Shinnar et al. (1994). Оно включало 264 больных, у которых противосудорожные препараты отменили в среднем через 2,9 года после прекращения припадков. За время наблюдения, средний срок которого составил 58 мес, у 36% детей припадки возобновились. Риск рецидива был выше при семейном характере эпилепсии, изменениях ЭЭГ (преобладании медленных ритмов) перед отменой препарата, начале болезни после 12 лет (по сравнению с более ранним началом), а также в случаях атипичных фебрильных припадков и при некоторых определенных формах, в частности при ювенильной миоклонической эпилепсии.
В другом проспективном исследовании участвовали дети и взрослые как с генерализованными, так и с парциальными припадками, у которых монотерапия (фенитоин, карбамазепин или вальпроевая кислота) была отменена через 2 года после прекращения припадков (Callaghan et al., 1988). За 3 года наблюдения эпилепсия рецидивировала у 33% больных всех возрастов. Несмотря на небольшой размер группы (92 человека), был сделан вывод о большей вероятности рецидивов у больных со сложными парциальными припадками и со стойкими изменениями ЭЭГ.
Хотя эти и многие другие исследования дали ценные сведения, трудно сформулировать однозначные рекомендации по отмене лечения. Требуется индивидуальный подход, учитывающий, с одной стороны, вероятность рецидива со всеми его медицинскими, психологическими и социальными последствиями, с другой — возможные осложнения непрерывного длительного приема противосудорожных препаратов.
В любом случае отмена препаратов должна быть постепенной и медленной — в течение нескольких месяцев. Резкая отмена может спровоцировать эпилептический статус.
Простые и сложные парциальные припадки, вторично генерализованные припадки. В двойном слепом проспективном исследовании сравнивали действие (эффективность и выраженность побочных эффектов) карбамазепина, фенобарбитала, фенитоина и примидона у взрослых с парциальными припадками, включая вторично генерализованные (Mattson et al., 1985). Позже те же авторы в сходном исследовании сравнивали карбамазепин и вальпроевую кислоту (Mattson etal., 1992). Поданным первого исследования, самыми эффективными для монотерапии парциальных (в том числе вторично генерализованных) припадков оказались карбамазепин и фенитоин; выбор между ними зависит от выраженности побочных реакций. Осложнения в начале лечения (тошнота, дурнота, расстройства координации, сонливость) чаще возникают при лечении примидоном. Снижение полового влечения и импотенцию вызывают все четыре препарата: карбамазепин (13% больных), фенобарбитал (16%), фенитоин (11%) и примидон (22% — достоверно выше). Карбамазепин эффективнее вальпроевой кислоты при сложных парциальных припадках. Из побочных эффектов карбамазепин чаще вызывает сыпь, а вальпроевая кислота — тремор и прибавку в весе. Общий вывод: препараты выбора при парциальных припадках — карбамазепин и фенитоин, но фенобарбитал, вальпроевая кислота и примидон тоже эффективны. Было проведено также сравнительное исследование ламотригина и карбамазепина: по действенности они не различаются, но ламотригин лучше переносится (Brodie et al., 1995). Ламотригин используют для монотерапии парциальных припадков, включая вторично генерализованные. Ряд новых препаратов — габапентин, леветирацетам, тиагабин, топирамат и зонисамид — применяют в качестве дополнительных средств при комбинированной терапии.
При вторично генерализованных припадках карбамазепин, фенобарбитал, фенитоин и примидон по эффективности оказались одинаковыми (Mattson et al., 1985), а вальпроевая кислота не отличалась от карбамазепина (Mattson et al., 1992). Поскольку парциальные припадки часто переходят во вторично генерализованные, основными препаратами при них следует считать карбамазепин, фенитоин и ламотригин.
Абсансы. Эффективность этосуксимида и вальпроевой кислоты при абсансах одинакова (Mikati and Browne, 1988): оба препарата прекращают абсансы у 50—75% ранее не леченных больных. При сочетании абсансов с тонико-клоническими припадками (в том числе если последние появляются в ходе лечения) препарат выбора — вальпроевая кислота. Сообщают об успешном лечении абсансов ламотригином (Bazil and Pedley, 1998).
Миоклонияеские припадки. Вальпроевая кислота — лучшее средство при миоклонических припадках у больных юношеской миоклонической эпилепсией. Для этой болезни кроме миоклонических характерны тонико-клонические припадки и абсансы. Если вальпроевая кислота неэффективна, то иногда может помочь ламотригин (Bazil and Pedley, 1998).
Фебрильные припадки. У 2—4% .г.етей фебрильный припадок возникает хотя бы однократно, а у 25—33% из них — повторно. У 2—3% детей с фебрильными припадками в последующем развивается эпилепсия, то есть риск эпилепсии у них повышен в 6 раз. Вероятность эпилепсии повышается, если у ребенка имеются другие неврологические нарушения или нарушения развития, есть случаи эпилепсии в семье, а также в случае осложненных фебрильных припадков (так называют припадки дольше 15 мин, односторонние припадки и неоднократные припадки в течение дня). При сочетании всех этих факторов вероятность эпилепсии достигает 10%.
Опасаясь развития эпилепсии и других неврологических последствий, многие врачи после первого же фебрильного припадка назначали противосудорожные препараты. Поскольку профилактический прием фенобарбитала вызывает осложнения, а эффективность такой профилактики не доказана (Farwell etal., 1990), сейчас ее считают неоправданной (Freeman, 1992). Детям с высоким риском повторных фебрильных припадков и эпилепсии при лихорадке назначают ректальные свечи с диазепамом.
Припадки у детей грудного и младшего возраста. При синдроме Уэста большинство противосудорожных средств неэффективны, и обычно назначают кортикотропин или глюкокортикоиды. Недавно проведенные клинические испытания доказали эффективность вигабатрина (у-винил-ГАМ К) (Appleton et al.,1999). У некоторых взрослых больных, лечившихся вигабатрином, отмечено сужение полей зрения (Miller et al., 1999). Вига-батрин еще не разрешен ФДА, но применяется в других странах.
Синдром Леннокса—Гасто — тяжелая детская эпилепсия, для которой характерны умственная отсталость и разнообразные упорные припадки (тонико-клонические, тонические, атонические, миоклонические, атипичные абсансы). В двойном слепом исследовании показано, что ламотригин в качестве дополнительного средства эффективен и хорошо переносится (Motte et al., 1997). Фелбамат тоже эффективен, но применяется ограниченно из-за риска апластической анемии.
Эпилептический статус. Это тяжелое экстренное состояние с летальностью у взрослых до 20% (Lowenstein and Alldredge, 1998). Задача лечения — как можно скорее прервать припадок и его эквиваленты на ЭЭГ. Чем продолжительнее эпилептический статус, тем труднее его прекратить и тем больше угроза стойких поражений мозга. Залог успеха — четкая программа лечения, срочное введение нужных препаратов в достаточных дозах, поддержание дыхания и АД. Поскольку противосудорожные средства в высоких дозах вызывают гиповентиляцию, может потребоваться ИВЛ. Противосудорожные средства применяют только в/в; введение в/м не подходит из-за медленного неконтролируемого всасывания. Проведены кооперированные исследования, ставившие задачей разработку оптимальной терапевтической схемы. Двойным слепым методом сравнивались четыре варианта начального лечения эпилептического статуса: 1) диазепам с последующим введением фенитоина, 2) только фенитоин, 3) лоразепам, 4) фенобарбитал (Treiman et al., 1998). Эффективность всех вариантов оказалась сходной (44—65%); лишь монотерапия лоразепамом оказалась достоверно эффективнее монотерапии фенитоином. Что касается осложнений лечения и частоты рецидивов, они одинаковы при всех схемах.
Противосудорожная терапия у беременных. Лечение эпилепсии у женщин — особая важная проблема, имеющая целый ряд аспектов (Morrell, 1998). Это взаимодействие противосудорожных средств с пероральными контрацептивами, тератогенное действие ряда противосудорожных средств, их влияние на метаболизм витамина К у беременных.
Многие противосудорожные препараты снижают эффективность пероральных контрацептивов. Если у принимающих только контрацептивы частота беременностей составляет 0,7 на 100 женщин в год, то при сочетании с противосудорожными средствами — 3,1. Это может быть связано с ускоренным распадом пероральных контрацептивов в присутствии противосудорожных средств, индуцирующих микросомальные ферменты печени, особенно изофермент IIIA4 цитохрома Р450 (табл. 21.2).
Взаимодействие противосудорожных средств с пероральными контрацептивами особенно важно в связи с тератогенным действием первых. На это действие указывают многие эпидемиологические данные. У детей, чьи матери страдают эпилепсией, грубые пороки развития (сердца, нервной трубки и прочие) встречаются в два раза чаще, чем у потомства здоровых матерей: 4—8 и 2—4% соответственно. Разумеется, эпидемиологические исследования, в которых всегда присутствует множество неучтенных факторов, не позволяют уверенно судить о причинно-следственных отношениях, однако о тератогенном действии противосудорожных препаратов свидетельствует и то, что частота пороков развития зависит от дозы препаратов, а при комбинированной терапии эта частота выше, чем при монотерапии. Есть основания говорить о тератогенном действии фенитоина, фенобарбитала, карбамазепина и вальпроевой кислоты. Обладают ли им препараты последнего поколения, покажет время. У женщины с эпилепсией, планирующей беременность, есть два пути: попытаться отменить противосудорожные препараты либо лечиться одним препаратом под контролем его сывороточной концентрации. Противопоказана комбинированная терапия высокими дозами препаратов. Что касается приема фолиевой кислоты (0,4 мг/сут) для профилактики дефектов нервной трубки, то в США его рекомендуют всем женщинам детородного возраста, больные эпилепсией — не исключение.
Противосудорожные препараты, индуцирующие микросомапьные ферменты печени, вызывают у новорожденных авитаминоз К с коагулопатией и кровоизлиянием в мозг; для профилактики назначают фитоменадион, 10 мг/сут в последний месяц беременности.
Перспективы
В ближайшее десятилетие можно ожидать важных достижений влечении эпилепсии, связанных с исследованиями в разных направлениях.
- Благодаря накопленному опыту и новым клиническим испытаниям препаратов последнего поколения их применение при разных формах эпилепсии расширится и получит надежное обоснование.
- На основе фундаментальных исследований появятся новые знания о генетических, клеточных и молекулярных механизмах эпилепсии, что позволит создать препараты с принципиально новыми механизмами действия.
- Экспериментальные модели эпилепсии у животных помогут раскрыть механизмы эпилептогенеза и разработать медикаментозную профилактику для лиц с высоким риском эпилепсии.
- Фармакогенетические исследования позволят на новом уровне проводить индивидуальный подбор терапии и своевременно выявлять больных, которым грозят тяжелые побочные эффекты.
Литература
- Anderson, G.D. A mechanistic approach to antiepileptic drug interactions. Ann. Pharmacother., 1998, 32:554—563.
- Appleton, R.E., Peters, A.C., Mumford, J.P., and Shaw, D.E. Randomised, placebo-controlled study of vigabatrin as first-line treatment of infantile spasms. Epilepsia, 1999,40:1627—1633.
- Ayala, G.F., Dichter, М., Gumnit, R.J., Matsumoto, H., and Spencer, W.A. Genesis of epileptic interictal spikes. New knowledge of cortical feedback systems suggests a neurophysiological explanation of brief paroxysms. Brain Res., 1973, 52:1—17.
- Biervert, C., Schroeder, B.C., Kubisch, C., Berkovic, S.F., Propping, P., Jentsch, T.J., and Steinlein, O.K. A potassium channel mutation in neonatal human epilepsy. Science, 1998, 279:403—406.
- Brodie, M.J., Richens, A., and Yuen, A.W. Double-blind comparison of lamotrigine and carbamazepine in newly diagnosed epilepsy. UK La-motrigine/Carbamazepine Monotherapy Trial Group. Lancet, 1995,345: 476-479.
- Callaghan, N., Garrett, A., and Goggin, T. Withdrawal of anticonvulsant drugs in patients free of seizures for two years. A prospective study. N. Engl. J. Med., 1988, 318:942-946.
- Chapman, A., Keane, P.E., Meldrum, B.S., Simiand, J., and Vernie-res, J.C. Mechanism of anticonvulsant action ofvalproate. Prog. Neurobioi., 1982, 19:315-359.
- Ffrench-Mullen, J.M., Barker, J.L., and Rogawski, M.A. Calcium current block by (—)-pentobarbital, phenobarbital, and CHEB but not (+)-pentobarbital in acutely isolated hippocampal CA1 neurons: comparison with effects on GABA-activated СГ current. J. Neurosci., 1993,13: 3211-3221.
- Goddard, G.V., McIntyre, D.C., and Leech, C.K. A permanent change in brain function resulting from daily electrical stimulation. Exp. Neurol, 1969, 25:295-330.
- Lemos, Т., and Cavalheiro, E.A. Suppression of pilocarpine-induced status epilepticus and the late development of epilepsy in rats. Exp. Brain Res., 1995, 102:423-428.
- Longo, B.M., and Mello, L.E. Supragranular mossy fiber sprouting is not necessary for spontaneous seizures in the intrahippocampal kainate model of epilepsy in the rat. Epilepsy Res., 1998, 32:172—182.
- Macdonald, R.L., and Barker, J.L. Anticonvulsant and anesthetic barbiturates: different postsynaptic actions in cultured mammalian neurons. Neurology, 1979, 29:432—447.
- McLean, M.J., and Macdonald, R.L. Multiple actions of phenytoin on mouse spinal cord neurons in cell culture. J. Pharmacol. Exp. Ther., 1983, 227:779-789.
- Merritt, H.H., and Putnam, T.J. A new series of anticonvulsant drugs tested by experiments on animals. Arch. Neurol. Psychiatry, 1938a, 39: 1003-1015.
- Motte, J., Trevathan, E., Arvidsson, J.F., Barrera, M.N., Mullens, E.L., ли) Manasco, P. Lamotrigine for generalized seizures associated with the Ijennox-Gastaut syndrome. Lamictal Lennox-Gastaut Study Group. N. M.J. Med., 1997, 337:1807-1812.
Ptnfield, W.G., and Jasper, H.H. Highest level seizures. Assoc. Res. Herv.Ment. Dis. Proc., 1947,26:252—271.
Phillips, N.I., and Fowler, L.J. The effects of sodium valproate on gam-ma-aminobutyrate metabolism and behaviour in naive and ethanolami-ne-0-sulphate pretreated rats and mice. Biochem. Pharmacol., 1982, 31: 2257-2261.
Ptacek, L.J. Channelopathies: ion channel disorders of muscle as a pa-udigm for paroxysmal disorders of the nervous system. Neuromuscul. Disord., 1997,7:250-255.
Puranam, R.S., and McNamara, J.O. Seizure disorders in mutant mice: ltlevance to human epilepsies. Curr. Opin. Neurobiol., 1999,9:281—287.
Rho.J.M., Donevan, S.D., and Rogawski, M.A. Mechanism of action ofthe anticonvulsant felbamate: opposing effects on N-methyl-D-aspar-tateand GABAa receptors, Ann. Neurol., 1994, 35:229—234.
Sachdeo R., Kramer, L.D., Rosenberg, A., and Sachdeo, S. Felbamate monotherapy: controlled trial in patients with partial onset seizures. Ann. Neurol., 1992,32:386-392.
Schmidt, D., and Richter, K. Alternative single anticonvulsant drug iherapy for refractory epilepsy. Ann. Neurol., 1986, 19:85—87.
Shinnar, S., Berg, A.Т., Moshe, S.L., Kang, H., O’Dell, C., Alema-a| М., Goldensohn, E.S., and Hauser, W.A. Discontinuing antiepileptic drags in children with epilepsy: a prospective study. Ann. Neurol., 1994, 35:534-545.
Singh, N.A., Charlier, C., Stauffer, D., DuPont, B.R., Leach, R.J., Melis, R., Ronen, G.M., Bjerre, I., Quattlebaum, Т., Murphy, J.V., McHarg, M.L., Gagnon, D., Rosales, T.O., Peiffer, A., Anderson, V.E., and Leppert, M. A novel potassium channel gene, KCNQ2, is mutated in minherited epilepsy of newborns. Nat. Genet., 1998, 18:25—29.
Smith, D.B., Mattson, R.H., Cramer, J.A., Collins, J.F., Novelly, R.A., and Craft, B. Results of a nationwide Veterans Administration cooperative study comparing the efficacy and toxicity of carbamazepine, phenobarbital, phenytoin, and primidone. Epilepsia, 1987, 28(suppl )):S50-S58.
Steinlein, O.K., Mulley, J.C., Propping, P., Wallace, R.H., Phillips, H.A., Sutherland, G.R., Scheffer, I.E., and Berkovic, S.F. A missense mutation in the neuronal nicotinic acetylcholine receptor a4 subunit is associated with autosomal dominant nocturnal frontal lobe epilepsy. Nat. Genet., 1995, 11:201-203.
Suzdak, P.D., and Jansen, J.A. A review of the preclinical pharmacology of tiagabine: a potent and selective anticonvulsant GABA uptake inhibitor. Epilepsia, 1995, 36:612—626.
Traynelis, S.F., and Dingledine, R. Potassium-induced spontaneous electrographic seizures in the rat hippocampal slice. J. Neurophysiol., 1988,59:259-276.
Treiman, D.M., Meyers, P.D., Walton, N.Y., Collins, J.F., Colling, C., Rowan, A.J., Handforth, A., Faught, E., Calabrese, V.P., Uthman, B.M., Ramsay, R.E., and Mamdani, M.B. A comparison of four treatments for generalized convulsive status epilepticus. Veterans Affairs Status Epilepti-cus Cooperative Study Group. N. Engl. J. Med., 1998, 339:792—798.
Twyman, R.E., Rogers, C.J., and Macdonald, R.L. Differential regulation of y-aminobutyric acid receptor channels by diazepam and pheno-baibital. Ann. Neurol., 1989, 25:213-220.
VanLandingham, K.E., Heinz, E.R., Cavazos, J.E., and Lewis, D.V. Magnetic resonance imaging evidence of hippocampal injury after prolonged febrile convulsions. Ann. Neurol., 1998,43:413—426.
Wallace, R.H., Wang, D.W., Singh, R., Scheffer, I.E., George, A.L. Jr., Phillips, H.A., Saar, K, Reis, A., Johnson, E.W., Sutherland, G.R., Berkovic, S.F., and Mulley, J.C. Febrile seizures and generalized epilepsy associated with a mutation in the Na+-channel pi subunit gene SCN1B. Nat. Genet., 1998, 19:366-370.
Xie, X., Lancaster, B., Peakman, Т., and Garthwaite, J. Interaction of the antiepileptic drug lamotrigine with recombinant rat brain type IIA Na+ channels and with native Na+ channelsS in rat hippocampal neurones. PflugersArch., 1995, 430:437-446.
22 Д. Штандерт, А. Юнг