Ингаляционная терапия кислородом — различия между версиями
Zabava (обсуждение | вклад) (→Легочные причины) |
Dormiz (обсуждение | вклад) |
||
| (не показаны 3 промежуточные версии 1 участника) | |||
| Строка 2: | Строка 2: | ||
== Ингаляционная терапия == | == Ингаляционная терапия == | ||
| − | Ингаляция некоторых газов, особенно кислорода, — важный метод лечения. Здесь рассматриваются транспорт кислорода в норме, последствия недостатка и избытка кислорода, а также методы ингаляции кислорода и слежения за уровнем оксигенации. Обсуждается также использование влечении и диагностике углекислого газа, окиси азота и гелия. | + | [[Ингаляционный путь введения|Ингаляция]] некоторых газов, особенно кислорода, — важный метод лечения. Здесь рассматриваются транспорт кислорода в норме, последствия недостатка и избытка кислорода, а также методы ингаляции кислорода и слежения за уровнем оксигенации. Обсуждается также использование влечении и диагностике [[Углекислый газ в организме|углекислого газа]], [[Окись азота в организме|окиси азота]] и [[Гелий (вдыхание)|гелия]]. |
== Кислород == | == Кислород == | ||
| Строка 17: | Строка 17: | ||
С кровью кислород переносится к тканям. Далее он выходит из капилляров и поступает в клетки — как и в легких, по градиенту парциального давления. В результате РО<sub>2</sub> в крови снижается и в венозной крови становится в среднем на 7,3 кПа (55 мм рт. ст.) меньше, чем в артериальной. Среднее РО<sub>2</sub> в тканях значительно ниже, чем в смешанной венозной крови, вследствие большого диффузионного барьера и потребления кислорода клетками. Величина РО<sub>2</sub> в митохондриях (где, собственно, и используется кислород) не известна, но очевидно, что окислительное фосфорилирование происходит даже при РО<sub>2</sub>, равном нескольким миллиметрам ртутного столба (Robiolio et al., 1989). | С кровью кислород переносится к тканям. Далее он выходит из капилляров и поступает в клетки — как и в легких, по градиенту парциального давления. В результате РО<sub>2</sub> в крови снижается и в венозной крови становится в среднем на 7,3 кПа (55 мм рт. ст.) меньше, чем в артериальной. Среднее РО<sub>2</sub> в тканях значительно ниже, чем в смешанной венозной крови, вследствие большого диффузионного барьера и потребления кислорода клетками. Величина РО<sub>2</sub> в митохондриях (где, собственно, и используется кислород) не известна, но очевидно, что окислительное фосфорилирование происходит даже при РО<sub>2</sub>, равном нескольким миллиметрам ртутного столба (Robiolio et al., 1989). | ||
| + | [[Image:Gud_16_1.jpg |300px|thumb|right|Рисунок 16.1. Кривая диссоциации оксигемоглобина цельной крови.]] | ||
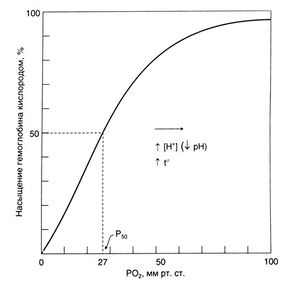
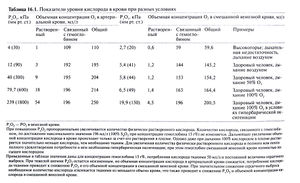
В крови кислород в основном связан с гемоглобином, и лишь незначительная его часть растворена в плазме. В норме при дыхании воздухом SaО<sub>2</sub> составляет примерно 98%. При полном насыщении 1 г гемоглобина связывает 1,3 мл кислорода. Связывание кислорода с гемоглобином зависит от РО<sub>2</sub>. Эта зависимость отражается S-образной кривой диссоциации оксигемоглобина (рис. 16.1). Крутой наклон центральной части кривой отражает быструю диссоциацию оксигемоглобина при снижении РО<sub>2</sub> в тканях, с одной стороны, и быстрое насыщение гемоглобина кислородом в легких — с другой. В тканях с интенсивным метаболизмом повышены температура и РСО<sub>2</sub> и снижен pH. Все эти три фактора приводят к сдвигу кривой вправо. Это означает, что степень насыщения гемоглобина при данном РО<sub>2</sub> снижается, что обеспечивает дополнительную отдачу кислорода тканям. Пологая часть кривой при высоких значениях РО<sub>2</sub> показывает, что в этой области при повышении РО<sub>2</sub> (например, при вдыхании газовой смеси, обогащенной кислородом) количество кислорода, связанного с гемоглобином, лишь незначительно возрастает. Дальнейшего увеличения содержания кислорода в крови при этом можно добиться лишь за счет растворенной в плазме фракции. Вследствие же низкой растворимости кислорода (0,026 мл/л на 1 кПа или 0,03 мл/л на 1 мм рт. ст. при температуре 37°С) при дыхании чистым кислородом его объемная концентрация в крови увеличивается лишь на 15 мл/л, что составляет менее трети метаболических потребностей. Однако в условиях гипербарической оксигенации, когда РО<sub>2</sub> во вдыхаемом воздухе достигает 3 атм (304 кПа), количество растворенного в плазме кислорода может покрыть метаболические потребности даже в отсутствие гемоглобина (табл. 16.1). | В крови кислород в основном связан с гемоглобином, и лишь незначительная его часть растворена в плазме. В норме при дыхании воздухом SaО<sub>2</sub> составляет примерно 98%. При полном насыщении 1 г гемоглобина связывает 1,3 мл кислорода. Связывание кислорода с гемоглобином зависит от РО<sub>2</sub>. Эта зависимость отражается S-образной кривой диссоциации оксигемоглобина (рис. 16.1). Крутой наклон центральной части кривой отражает быструю диссоциацию оксигемоглобина при снижении РО<sub>2</sub> в тканях, с одной стороны, и быстрое насыщение гемоглобина кислородом в легких — с другой. В тканях с интенсивным метаболизмом повышены температура и РСО<sub>2</sub> и снижен pH. Все эти три фактора приводят к сдвигу кривой вправо. Это означает, что степень насыщения гемоглобина при данном РО<sub>2</sub> снижается, что обеспечивает дополнительную отдачу кислорода тканям. Пологая часть кривой при высоких значениях РО<sub>2</sub> показывает, что в этой области при повышении РО<sub>2</sub> (например, при вдыхании газовой смеси, обогащенной кислородом) количество кислорода, связанного с гемоглобином, лишь незначительно возрастает. Дальнейшего увеличения содержания кислорода в крови при этом можно добиться лишь за счет растворенной в плазме фракции. Вследствие же низкой растворимости кислорода (0,026 мл/л на 1 кПа или 0,03 мл/л на 1 мм рт. ст. при температуре 37°С) при дыхании чистым кислородом его объемная концентрация в крови увеличивается лишь на 15 мл/л, что составляет менее трети метаболических потребностей. Однако в условиях гипербарической оксигенации, когда РО<sub>2</sub> во вдыхаемом воздухе достигает 3 атм (304 кПа), количество растворенного в плазме кислорода может покрыть метаболические потребности даже в отсутствие гемоглобина (табл. 16.1). | ||
| + | |||
| + | '''''Описание к рис. 16.1.''' Кривая диссоциации оксигемоглобина цельной крови. Кривая отражает связь между степенью насыщения гемоглобина кислородом и РО<sub>2</sub>. Ри — парциальное давление кислорода, которому соответствует 50% насыщение гемоглобина. Повышение температуры крови или снижение ее pH (например, в работающей мышце) вызывает сдвиг кривой вправо — степень насыщения гемоглобина кислородом при данном РО<sub>2</sub> снижается. Это приводит к увеличению поступления кислорода в ткани.'' | ||
| + | |||
| + | [[Image:Gud_tab_16_1.jpg|300px|thumb|right|Таблица 16.1. Показатели уровня кислорода в крови при разных условиях. ]] | ||
== Гипоксия == | == Гипоксия == | ||
| Строка 26: | Строка 31: | ||
=== Легочные причины === | === Легочные причины === | ||
| − | Принято выделять 5 основных причин гипоксемии: 1) низкая F, | + | Принято выделять 5 основных причин гипоксемии: 1) низкая F,О<sub>2</sub>, 2) нарушения диффузии, 3)гиповентиляция,4)неравномерность вентиляционно-перфузионного отношения, 5) внутрилегочное шунтирование крови или внелегочный сброс венозной крови в артериальную. |
| − | |||
| − | |||
| − | + | Гипоксемия на больших высотах или при неисправности дыхательного оборудования (например, при поломке газового смесителя или ошибочной маркировке баллона) возникает вследствие низкой F1О<sub>2</sub>. Нарушение диффузии кислорода в легких редко вызывает гипоксемию в покое, исключением являются терминальные стадии паренхиматозных заболеваний легких. В обоих случаях гипоксемию можно устранить, повысив F|О<sub>2</sub>, — это ликвидирует причину гипоксемии в первом случае и ускорит диффузию во втором. | |
| − | + | Гиповентиляция вызывает гипоксемию вследствие снижения РО<sub>2</sub> в альвеолярном воздухе. Это снижение в общих чертах обусловлено тем, что поступление кислорода в альвеолы уменьшается, а его поглощение кровью остается прежним. Углекислый газ, напротив, накапливается, причем парциальные давления кислорода и углекислого газа в альвеолярном воздухе связаны между собой в соответствии с так называемым уравнением альвеолярного газа: | |
| − | + | РαО2 = P<sub>1</sub>О2-РαCО2/R, | |
| − | + | где РαО<sub>2</sub> и РАСО<sub>2</sub> — парциальные давления О2 и СО2 в альвеолярном воздухе, Р1О<sub>2</sub> — парциальное давление 02 во вдыхаемом воздухе, R — дыхательный коэффициент. В норме при дыхании атмосферным воздухом на уровне моря (с учетом парциального давления водяных паров) РО<sub>2</sub> равно примерно 20 кПа (150 мм рт. ст.), РαСО<sub>2</sub> — 5,3 кПа (40 мм рт. ст.), R — 0,8 и РαО<sub>2</sub> — 13,3 кПа (100 мм рт. ст.). Лишь выраженная гиповентиляция с повышением РАСО<sub>2</sub> до 9,3 кПа (70 мм рт. ст.) и более может вызвать падение РАО<sub>2</sub> ниже 7,8 кПа (60 мм рт. ст.). Такую гипоксемию легко предотвратить с помощью даже небольших количеств кислорода. | |
| − | + | Механизмы развития гипоксемии при внугрилегочном шунтировании крови и неравномерности вентиляционно-перфузионного отношения между собой сходны, но реакция на ингаляцию кислорода различна. Для нормального газообмена в легких необходимо определенное количественное соотношение между вентиляцией и перфузией (вентиляционно-перфузионное отношение). Однако даже в норме имеется некоторая неравномерность вентиляционно-перфузионного отношения (то есть в разных отделах легких это отношение различно), а при легочных заболеваниях она особенно выражена. Если вентиляция преобладает над перфузией, то РО<sub>2</sub> в альвеолярном воздухе возрастает, но объемная концентрация кислорода в артериальной крови меняется мало. Это связано с тем, что при высоких значениях РО<sub>2</sub> гемоглобин почти полностью насыщен кислородом, чему соответствует пологий участок кривой диссоциации оксигемоглобина (рис. 16.1). Кроме того, в участках с высоким вентиляционно-перфузионным отношением кровоток снижен — вплоть до того, что они превращаются в функциональное мертвое пространство, которое не участвует ни в оксигенации крови, ни в удалении СО<sub>2</sub>. Когда же перфузия преобладает над вентиляцией (низкое вентиляционно-перфузионное отношение), РО<sub>2</sub> в крови, оттекающей от плохо вентилируемых участков, снижается. Поскольку низким значениям РО, соответствует крутая часть кривой диссоциации оксигемоглобина, насыщение гемоглобина кислородом и объемная концентрация кислорода в крови легочных вен значительно уменьшаются. При крайне низкой вентиляции перфузируемый участок превращается во внутрилегоч-ный шунт, и в оттекающей от него крови РО<sub>2</sub> и РСО<sub>2</sub> такие же, как и в смешанной венозной крови. | |
| + | [[Image:Gud_16_2.jpg|300px|thumb|right|Рисунок 16.2. Влияние внутрилегочного шунтирования на ок-сигенацию артериальной крови.]] | ||
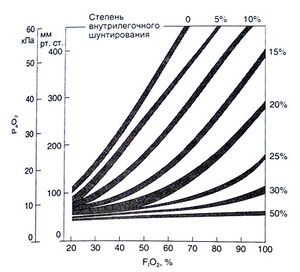
| − | + | Таким образом, нарушение оксигенации артериальной крови при неравномерности вентиляционно-перфузионного отношения объясняется характером диссоциации оксигемоглобина. Увеличение F1О<sub>2</sub> обычно компенсирует снижение РО<sub>2</sub> в плохо вентилируемых альвеолах и улучшает оксигенацию артериальной крови. Если же какие-то участки легких вообще не вентилируются и оксигенации крови в них не происходит, то увеличение F1О<sub>2</sub> не устраняет гипоксемию. Иными словами, даже при небольшом внугрилегочном шунтировании ингаляция кислорода уже недостаточно эффективна (рис. 16.2). Гипоксемия, вызванная неравномерностью вентиляционно-перфузионного отношения и внутрилегочным шунтированием, усугубляется при понижении РО<sub>2</sub> в венозной крови (например, при низком сердечном выбросе или повышенном потреблении кислорода). Это также обусловлено крутым наклоном кривой диссоциации оксигемоглобина при низких значениях РО<sub>2</sub>. | |
| − | + | '''''Описание к рис. 16.2.''' Влияние внутрилегочного шунтирования на ок-сигенацию артериальной крови. Показана зависимость РαО<sub>2</sub> от F1О<sub>2</sub> при различной степени внутрилегочного шунтирования. При значительном внугрилегочном шунтировании даже дыхание 100% кислородом не увеличивает РаО<sub>2</sub>. Кривые построены для концентрации гемоглобина в крови 10—14 г%, РαСО<sub>2</sub> 3,3—5,3 кПа (25—40 мм рт. ст.) и артериовенозной разницы по кислороду 5 мл/100 мл (Benatar et al., 1973).'' | |
=== Внелегочные причины === | === Внелегочные причины === | ||
| Строка 127: | Строка 131: | ||
'''ЦНС'''. Поражения ЦНС наблюдаются редко и лишь в тех случаях, когда Р02 превышает 200 кПа (2 атм). Наблюдаются эпилептические припадки и нарушения зрения, исчезающие при снижении Р02 до нормы. Это одна из причин, по которым при глубоководных погружениях используют кислородно-гелиевую смесь (см. ниже). | '''ЦНС'''. Поражения ЦНС наблюдаются редко и лишь в тех случаях, когда Р02 превышает 200 кПа (2 атм). Наблюдаются эпилептические припадки и нарушения зрения, исчезающие при снижении Р02 до нормы. Это одна из причин, по которым при глубоководных погружениях используют кислородно-гелиевую смесь (см. ниже). | ||
| + | == Читайте также == | ||
| + | |||
| + | *[[Ингаляционные анестетики]] | ||
| + | *[[Вспомогательные обезболивающие средства]] | ||
| + | *[[Окись азота в организме]] | ||
| + | *[[Гелий (вдыхание)]] | ||
Текущая версия на 21:55, 1 ноября 2014
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Ингаляционная терапия[править | править код]
Ингаляция некоторых газов, особенно кислорода, — важный метод лечения. Здесь рассматриваются транспорт кислорода в норме, последствия недостатка и избытка кислорода, а также методы ингаляции кислорода и слежения за уровнем оксигенации. Обсуждается также использование влечении и диагностике углекислого газа, окиси азота и гелия.
Кислород[править | править код]
Жизнь животных и человека без кислорода невозможна. Гипоксия — это опасное состояние, обусловленное несоответствием между доставкой кислорода к тканям и их метаболическими потребностями. Доставка кислорода равна произведению объемной скорости кровотока на объемную концентрацию кислорода в артериальной крови, поэтому гипоксия может возникать при снижении кровоснабжения тканей, уменьшении РαО2 или кислородной емкости крови. Гипоксию могут вызвать также нарушения транспорта кислорода из капилляров в ткани и использования его клетками. Независимо от причины, недостаточное поступление кислорода в конечном счете приводит к прекращению аэробного метаболизма и окислительного фосфорилирования, истощению запасов макроэргических соединений, нарушению функции клеток и смерти.
Историческая справка. Кислород был открыт Пристли в 1772г., и вскоре Лавуазье выяснил его роль в дыхании. Уже через несколько лет английский врач Беддоуз стал применять кислород в лечебных целях. В 1794 г. вышел его труд «О лечебном применении и получении искусственного воздуха», и с этого момента было положено начало ингаляционной терапии. Воодушевленный своими идеями, Беддоуз стал применять кислород чутьли не при всех болезнях — от проказы до параличей. Естественно, что его часто постигали неудачи, и он умер, не получив признания. Ассистенту Беддоуза сэру Хамфри Дэви, продолжившему его исследования, мы во многом обязаны знаниями о закиси азота — широко распространенном ингаляционном анестетике. Теоретические основы ингаляционной терапии с применением кислорода были заложены в работах Холдейна, Хилла, Баркрофта, Крога, Л. Гендерсона и Я. Гендерсона (Sackner, 1974). Использование кислорода под повышенным давлениемв лечебных целях изучал еще Поль Бер в 1870 г., и он же описал кислородное отравление (Bert, 1873). Однако лишь в 1950-х гг. гипербарическую оксигенацию стали применять в клинике (Lam-bertsen et al., 1953; Boeremaetal., I960).
Транспорт кислорода[править | править код]
Процентное содержание кислорода в атмосферном воздухе составляет 21%, что при нормальном атмосферном давлении на уровне моря (1 атм, или 101 кПа) соответствует РО2 в 21 кПа (158 мм рт. ст.). Процентное содержание кислорода в воздухе не зависит от давления, в то время как РО2 при уменьшении давления снижается. Поскольку диффузия кислорода зависит от его парциального давления, при подъеме набольшую высоту насыщение крови кислородом и его доставка к тканям уменьшаются. Наоборот, повышение давления (гипербарическая оксигенация или дыхание под водой на большой глубине) вызывает увеличение РО2 во вдыхаемом воздухе и усиливает поглощение кислорода. В газообменных отделах легких (дистальных дыхательных путях и альвеолах) РО2 снижается в результате поступления в альвеолярный воздух углекислого газа и водяных паров, а также поглощения кислорода кровью. Если вентиляция и перфузия легких происходят идеально равномерно, РО2 в альвеолярном воздухе составляет примерно 14,6 кПа (110 мм рт. ст.), парциальное давление водяных паров — 6,2 кПа (47 мм рт. ст.), αРСО2— 5,3 кПа (40 мм рт. ст.). В нормальных условиях между альвеолярным воздухом и капиллярной кровью устанавливается равновесие и РО2 в конце легочных капилляров лишь на доли миллиметра ртутного столба отличается от РО2 в альвеолярном воздухе. Если же диффузия газов затруднена (при некоторых заболеваниях) или резко увеличен сердечный выброс, а следовательно, скорость прохождения крови по легочным капиллярам (например, при физической нагрузке), это равновесие нарушается и может возникать достаточно существенная разница между РО2 в альвеолярном воздухе и в конце легочных капилляров.
В результате естественного внутрилегочного шунтирования (подмешивания венозной крови, РО2 которой равно примерно 5,3 кПа, или 40 мм рт. ст.) РαО2 становится меньше, чем РО2 в альвеолярном воздухе. Это шунтирование наряду с неравномерностью вентиляционно-перфузионного отношения в легких приводят к тому, что Р(А - α)О2 в норме составляет 1,3—1,5 кПа (10—12 мм рт. ст.) при дыхании атмосферным воздухом и 4—6,6 кПа (30—50 мм рт. ст.) при дыхании чистым кислородом (Clark and Lambertsen, 1971).
С кровью кислород переносится к тканям. Далее он выходит из капилляров и поступает в клетки — как и в легких, по градиенту парциального давления. В результате РО2 в крови снижается и в венозной крови становится в среднем на 7,3 кПа (55 мм рт. ст.) меньше, чем в артериальной. Среднее РО2 в тканях значительно ниже, чем в смешанной венозной крови, вследствие большого диффузионного барьера и потребления кислорода клетками. Величина РО2 в митохондриях (где, собственно, и используется кислород) не известна, но очевидно, что окислительное фосфорилирование происходит даже при РО2, равном нескольким миллиметрам ртутного столба (Robiolio et al., 1989).
В крови кислород в основном связан с гемоглобином, и лишь незначительная его часть растворена в плазме. В норме при дыхании воздухом SaО2 составляет примерно 98%. При полном насыщении 1 г гемоглобина связывает 1,3 мл кислорода. Связывание кислорода с гемоглобином зависит от РО2. Эта зависимость отражается S-образной кривой диссоциации оксигемоглобина (рис. 16.1). Крутой наклон центральной части кривой отражает быструю диссоциацию оксигемоглобина при снижении РО2 в тканях, с одной стороны, и быстрое насыщение гемоглобина кислородом в легких — с другой. В тканях с интенсивным метаболизмом повышены температура и РСО2 и снижен pH. Все эти три фактора приводят к сдвигу кривой вправо. Это означает, что степень насыщения гемоглобина при данном РО2 снижается, что обеспечивает дополнительную отдачу кислорода тканям. Пологая часть кривой при высоких значениях РО2 показывает, что в этой области при повышении РО2 (например, при вдыхании газовой смеси, обогащенной кислородом) количество кислорода, связанного с гемоглобином, лишь незначительно возрастает. Дальнейшего увеличения содержания кислорода в крови при этом можно добиться лишь за счет растворенной в плазме фракции. Вследствие же низкой растворимости кислорода (0,026 мл/л на 1 кПа или 0,03 мл/л на 1 мм рт. ст. при температуре 37°С) при дыхании чистым кислородом его объемная концентрация в крови увеличивается лишь на 15 мл/л, что составляет менее трети метаболических потребностей. Однако в условиях гипербарической оксигенации, когда РО2 во вдыхаемом воздухе достигает 3 атм (304 кПа), количество растворенного в плазме кислорода может покрыть метаболические потребности даже в отсутствие гемоглобина (табл. 16.1).
Описание к рис. 16.1. Кривая диссоциации оксигемоглобина цельной крови. Кривая отражает связь между степенью насыщения гемоглобина кислородом и РО2. Ри — парциальное давление кислорода, которому соответствует 50% насыщение гемоглобина. Повышение температуры крови или снижение ее pH (например, в работающей мышце) вызывает сдвиг кривой вправо — степень насыщения гемоглобина кислородом при данном РО2 снижается. Это приводит к увеличению поступления кислорода в ткани.
Гипоксия[править | править код]
Для правильного применения кислорода необходимо знать причины и последствия гипоксии. Под этим термином понимают недостаточную оксигенацию тканей. Снижение же содержания кислорода в артериальной крови, обусловленное, как правило, легочными нарушениями, называют гипоксемией.
Легочные причины[править | править код]
Принято выделять 5 основных причин гипоксемии: 1) низкая F,О2, 2) нарушения диффузии, 3)гиповентиляция,4)неравномерность вентиляционно-перфузионного отношения, 5) внутрилегочное шунтирование крови или внелегочный сброс венозной крови в артериальную.
Гипоксемия на больших высотах или при неисправности дыхательного оборудования (например, при поломке газового смесителя или ошибочной маркировке баллона) возникает вследствие низкой F1О2. Нарушение диффузии кислорода в легких редко вызывает гипоксемию в покое, исключением являются терминальные стадии паренхиматозных заболеваний легких. В обоих случаях гипоксемию можно устранить, повысив F|О2, — это ликвидирует причину гипоксемии в первом случае и ускорит диффузию во втором.
Гиповентиляция вызывает гипоксемию вследствие снижения РО2 в альвеолярном воздухе. Это снижение в общих чертах обусловлено тем, что поступление кислорода в альвеолы уменьшается, а его поглощение кровью остается прежним. Углекислый газ, напротив, накапливается, причем парциальные давления кислорода и углекислого газа в альвеолярном воздухе связаны между собой в соответствии с так называемым уравнением альвеолярного газа:
РαО2 = P1О2-РαCО2/R,
где РαО2 и РАСО2 — парциальные давления О2 и СО2 в альвеолярном воздухе, Р1О2 — парциальное давление 02 во вдыхаемом воздухе, R — дыхательный коэффициент. В норме при дыхании атмосферным воздухом на уровне моря (с учетом парциального давления водяных паров) РО2 равно примерно 20 кПа (150 мм рт. ст.), РαСО2 — 5,3 кПа (40 мм рт. ст.), R — 0,8 и РαО2 — 13,3 кПа (100 мм рт. ст.). Лишь выраженная гиповентиляция с повышением РАСО2 до 9,3 кПа (70 мм рт. ст.) и более может вызвать падение РАО2 ниже 7,8 кПа (60 мм рт. ст.). Такую гипоксемию легко предотвратить с помощью даже небольших количеств кислорода.
Механизмы развития гипоксемии при внугрилегочном шунтировании крови и неравномерности вентиляционно-перфузионного отношения между собой сходны, но реакция на ингаляцию кислорода различна. Для нормального газообмена в легких необходимо определенное количественное соотношение между вентиляцией и перфузией (вентиляционно-перфузионное отношение). Однако даже в норме имеется некоторая неравномерность вентиляционно-перфузионного отношения (то есть в разных отделах легких это отношение различно), а при легочных заболеваниях она особенно выражена. Если вентиляция преобладает над перфузией, то РО2 в альвеолярном воздухе возрастает, но объемная концентрация кислорода в артериальной крови меняется мало. Это связано с тем, что при высоких значениях РО2 гемоглобин почти полностью насыщен кислородом, чему соответствует пологий участок кривой диссоциации оксигемоглобина (рис. 16.1). Кроме того, в участках с высоким вентиляционно-перфузионным отношением кровоток снижен — вплоть до того, что они превращаются в функциональное мертвое пространство, которое не участвует ни в оксигенации крови, ни в удалении СО2. Когда же перфузия преобладает над вентиляцией (низкое вентиляционно-перфузионное отношение), РО2 в крови, оттекающей от плохо вентилируемых участков, снижается. Поскольку низким значениям РО, соответствует крутая часть кривой диссоциации оксигемоглобина, насыщение гемоглобина кислородом и объемная концентрация кислорода в крови легочных вен значительно уменьшаются. При крайне низкой вентиляции перфузируемый участок превращается во внутрилегоч-ный шунт, и в оттекающей от него крови РО2 и РСО2 такие же, как и в смешанной венозной крови.
Таким образом, нарушение оксигенации артериальной крови при неравномерности вентиляционно-перфузионного отношения объясняется характером диссоциации оксигемоглобина. Увеличение F1О2 обычно компенсирует снижение РО2 в плохо вентилируемых альвеолах и улучшает оксигенацию артериальной крови. Если же какие-то участки легких вообще не вентилируются и оксигенации крови в них не происходит, то увеличение F1О2 не устраняет гипоксемию. Иными словами, даже при небольшом внугрилегочном шунтировании ингаляция кислорода уже недостаточно эффективна (рис. 16.2). Гипоксемия, вызванная неравномерностью вентиляционно-перфузионного отношения и внутрилегочным шунтированием, усугубляется при понижении РО2 в венозной крови (например, при низком сердечном выбросе или повышенном потреблении кислорода). Это также обусловлено крутым наклоном кривой диссоциации оксигемоглобина при низких значениях РО2.
Описание к рис. 16.2. Влияние внутрилегочного шунтирования на ок-сигенацию артериальной крови. Показана зависимость РαО2 от F1О2 при различной степени внутрилегочного шунтирования. При значительном внугрилегочном шунтировании даже дыхание 100% кислородом не увеличивает РаО2. Кривые построены для концентрации гемоглобина в крови 10—14 г%, РαСО2 3,3—5,3 кПа (25—40 мм рт. ст.) и артериовенозной разницы по кислороду 5 мл/100 мл (Benatar et al., 1973).
Внелегочные причины[править | править код]
Эти причины гипоксии можно разделить на две категории — нарушение доставки кислорода и нарушение его потребления. Общее нарушение доставки кислорода наблюдается при низком сердечном выбросе, локальное — при нарушении местного кровотока, например при окклюзии сосудов (стеноз или тромбоз артерий, закупорка капилляров) или затруднении оттока крови (туннельные синдромы, венозный застой, повышение венозного давления). Уменьшение кислородной емкости крови также снижает доставку кислорода. Такая картина наблюдается при анемии, отравлении окисью углерода или при гемоглобинопатиях. Наконец, гипоксия возникает при нарушении транспорта кислорода из капилляров в ткани (например, при отеках) или при нарушении потребления кислорода клетками (отравление цианидами).
Часто гипоксию вызывают несколько факторов. Так, вдыхание дыма (например, при пожаре) может привести к гипоксии из-за обструкции дыхательных путей в результате ожога, а также из-за нарушения транспорта кислорода в результате отравления окисью углерода. Если кровоснабжение какого-либо органа существенно снижено вследствие атеросклеротической окклюзии артерий, то даже незначительное снижение Ра02 может вызвать тяжелую гипоксию.
Последствия[править | править код]
Независимо от причины гипоксия приводит к снижению (вплоть до полной остановки) аэробного метаболизма, истощению внутриклеточных запасов макроэргических соединений, нарушению функции клеток и их гибели. Продолжительность жизни клетки в условиях гипоксии зависит от метаболических потребностей, запасов кислорода и энергии, а также от способности поддерживать метаболизм в анаэробных условиях. Время сохранения функции (от момента прекращения кровотока до выраженного нарушения функции) состав ляет 1 мин для коры головного мозга, 5 мин для миокарда,10 мин для почек и печени. Реперфузия частично восстанавливает функцию органов. Критическое время ишемии (после которого восстановление функции невозможно) превышает время сохранения функции в 4—5 раз. Менее тяжелая, но хроническая гипоксия приводит к постепенному нарушению функции различных органов (Nunn, 1993b).
Дыхательная система. Гипоксия стимулирует хеморецепторы каротидных и аортальных телец, в результате чего возрастают частота и глубина дыхания. В норме при вдыхании газовой смеси с РО, 6,6 кПа (50 мм рт. ст.) МОД повышается почти вдвое. Небольшая гипоксия не всегда сопровождается одышкой, последняя обычно возникает лишь тогда, когда МОД достигает половины от максимальной вентиляции легких. Так, даже небольшая физическая нагрузка при легочных заболеваниях, снижающих максимальную вентиляцию легких, приводит к одышке. Потеря сознания при гипоксии обычно происходит без выраженных предвестников.
Сердечно-сосудистая система. Гипоксия вызывает повышение симпатического тонуса, что приводит к увеличению ЧСС и сердечного выброса. ОПСС же снижается, главным образом под действием местных сосудорасширяющих факторов. В результате, если только гипоксия не слишком тяжелая или длительная, АД обычно остается нормальным. Напротив, в легких гипоксия вызывает сужение сосудов, и давление в легочной артерии растет. Эта так называемая гипоксическая вазоконстрикция представляет собой нормальную регуляторную реакцию, направленную на восстановление соответствия между перфузией и вентиляцией.
ЦНС. Наиболее чувствительна к гипоксии ЦНС. Гипоксия вначале вызывает ухудшение когнитивных функций и психомоторную заторможенность. Далее эти расстройства усугубляются, появляются оглушенность, беспокойство, а при Ра02 ниже 4—5,3 кПа (30—40 мм рт. ст.) развивается сопор, кома и наступает смерть. Больные часто не осознают постепенного ухудшения своего состояния.
Влияние на клетки и метаболизм. Когда Р02 в митохондриях падает ниже 0,13 кПа (1 мм рт. ст.), аэробный метаболизм прекращается и выработка энергии в клетке осуществляется по менее эффективному пути анаэробного гликолиза. Конечные продукты анаэробного гликолиза, в частности молочная кислота, в значительном количестве поступают в кровь. Нарушается функция ионных насосов, снижаются трансмембранные ионные градиенты. Возрастает внутриклеточная концентрация Na+, Са2+, Н+, и в итоге клетки погибают. Продолжительность жизни клетки зависит от метаболических потребностей, запасов кислорода и энергии и способности к анаэробному метаболизму. Восстановление перфузии и оксигенации до наступления гибели клетки может оказать парадоксальный эффект, заключающийся в быстром усугублении повреждения клетки (реперфузионный синдром). Причиной считают образование активных форм кислорода (McCord, 1985).
Адаптация к гипоксии[править | править код]
Длительная гипоксия приводит к адаптационным изменениям. Лучше всего они изучены у проживающих в условиях высокогорья. Эти изменения включают увеличение числа альвеол, повышение концентрации гемоглобина в крови и миоглобина в мышцах, а также ослабление вентиляторной реакции на гипоксию (Cruz et al., 1980). Кратковременное пребывание на высоте вызывает сходные изменения. У предрасположенных людей быстрый подъем на высоту может вызвать горную болезнь — синдром, для которого характерны головная боль, тошнота, одышка, нарушение сна и когнитивных функций; далее может развиться отек легких и головного мозга (Johnson and Rock, 1988). Лечение заключается в быстрой эвакуации в низины, ингаляции кислорода или гипербарической оксигенации. Эффективны также диуретики (ингибиторы карбоангидразы) и глюкокортикоиды. Горная болезнь обычно не возникает, если высоту набирать медленно — при этом успевают развиться процессы адаптации.
Замечено, что у плода и новорожденного млекопитающих есть ряд физиологических особенностей, сходных со специальными адаптационными механизмами животных, устойчивых к гипоксии (Mortola, 1999; Singer, 1999): сдвиг кривой диссоциации оксигемоглобина (гемоглобин F), способность к уменьшению ЧСС, понижению основного обмена и температуры тела (как у животных во время зимней спячки), к перераспределению крови (как у ныряющих млекопитающих), к экономии энергии за счет ограничения расхода энергии на рост. Это объясняет относительную устойчивость плода и новорожденного и к хронической (при плацентарной недостаточности), и к кратковременной гипоксии.
Физиологические эффекты ингаляции кислорода[править | править код]
Ингаляцию кислорода применяют в основном для устранения или предупреждения гипоксии, ее значение в других случаях невелико. Однако вдыхание кислорода в больших количествах или в течение продолжительного времени приводит к вторичным физиологическим изменениям и может оказать токсическое действие.
Дыхательная система. Ингаляция кислорода под давлением выше 1 атм вызывает у здорового человека некоторое угнетение дыхания, по-видимому, вследствие снижения тонической импульсации от хеморецепторов. Однако через несколько минут после начала ингаляции вентиляция усиливается в результате парадоксального повышения РС02 в тканях. Это объясняется повышением концентрации оксигемоглобина в венозной крови, что затрудняет удаление углекислого газа из тканей (Lambertsenetal., 1953; Plewesand Farhi, 1983).
У некоторых больных с угнетением дыхательного центра вследствие длительной гиперкапнии, травмы или приема препаратов легочная вентиляция поддерживается в основном за счет стимуляции хеморецепторов каротидных и аортальных телец — так называемого гипоксического стимула. В этих условиях избыток кислорода может устранить гипоксический стимул и вызвать дыхательный ацидоз. Поэтому кислород у таких больных следует тщательно дозировать. При развитии гиповентиляции прибегают к ИВЛ с интубацией трахеи или без нее.
Плохо вентилируемые альвеолы поддерживаются в расправленном состоянии отчасти благодаря азоту, содержащемуся в альвеолярном воздухе, — этот газ, в отличие от кислорода, малорастворим и потому остается в дыхательных путях. Поступление в такие участки легких кислорода в высокой концентрации может вызвать ателектазы — кислород вытесняет азот и всасывается. Иногда это приводит к усилению внутрилегочного шунтирования крови и парадоксальному усугублению гипоксемии.
Сердечно-сосудистая система. В отсутствие гипоксии гемодинамические реакции на ингаляцию кислорода не значительны. При дыхании чистым кислородом отмечается небольшое уменьшение ЧСС и сердечного выброса, АД изменяется мало. В норме ингаляция кислорода почти не влияет на давление в легочной артерии. В то же время улиц с хронической легочной гипертензией, проживающих в условиях высокогорья, давление в легочной артерии при ингаляции кислорода (или после переезда на равнину) может снизиться (Grover et al., 1966; Spievogel et al., 1969). У новорожденных с врожденными пороками сердца со сбросом крови слева направо кислород следует тщательно дозировать из-за опасности уменьшения легочного сосудистого сопротивления и увеличения легочного кровотока.
Метаболизм. При дыхании чистым кислородом его потребление, дыхательный коэффициент, утилизация глюкозы и образование углекислого газа существенно не изменяются.
Методы ингаляции кислорода[править | править код]
Кислород поставляется в сжатом виде в стальных баллонах. Медицинский кислород имеет чистоту 99%. Во многих больницах кислород подают по трубам, идущим от специальных контейнеров с жидким кислородом. Из соображений безопасности баллоны с кислородом и трубы маркируют (в США их окрашивают в зеленый цвет), а переходники изготовляют так, чтобы к системе подачи кислорода нельзя было подключить баллоны с другими газами. Концентраторы кислорода, в которых используются молекулярное сито, мембрана или электрохимическая ячейка, обеспечивают низкий поток газовой смеси и могут применяться в домашних условиях. Концентрация кислорода в них составляет 30—95% в зависимости от скорости потока. Они не требуют периодической заправки или смены баллона.
Кислород обычно назначают в ингаляциях; лишь при искусственном кровообращении он вводится непосредственно в кровь. Точно контролировать F102 можно только при закрытой системе подачи кислорода с герметичным дыхательным контуром и полным разделением вдыхаемой и выдыхаемой смеси. Во всех других системах F,02 зависит от параметров дыхания (частоты, дыхательного объема, отношения длительности вдоха и выдоха, скорости потока на вдохе) и конструкции системы.
Системы с низким газовым потоком. В таких системах скорость подачи кислорода меньше, чем скорость потока на вдохе. С их помощью невозможно значительно увеличить F102, так как состав вдыхаемой газовой смеси зависит от доли в ней атмосферного воздуха. Поэтому F102 при использовании этих систем чрезвычайно чувствительна к небольшим изменениям параметров дыхания. Такие устройства, как кислородная палатка, используются главным образом для подачи увлажненной газовой смеси и не позволяют точно контролировать F(02. Через носовые канюли (раздваивающаяся гибкая трубочка, устанавливаемая в ноздри) можно подавать кислород со скоростью потока 1—6 л/мин. Носоглотка выполняет роль резервуара кислорода, а больной может дышать через рот или через нос (разумеется, если носовые ходы проходимы). Обычно носовые канюли обеспечивают подачу 2—3 л/мин газовой смеси, a F102 достигает 24—28%. При большей скорости потока F102 можно увеличить до 40%, однако из-за быстрого высыхания слизистой это переносится плохо. Обычную прозрачную пластиковую маску, снабженную боковыми отверстиями для выхода выдыхаемого газа и поступления воздуха, применяют в случаях, когда хотят повысить F102 без точного дозирования. При этом максимальная F102 может составить от 60% при скорости потока 6— 15 л/мин до более чем 85% при подсоединении дыхательного мешка объемом 600—1000 мл. В последнем случае большая часть вдыхаемой смеси поступает из дыхательного мешка, поэтому разбавления атмосферным воздухом и снижения F102 не происходит.
Системы с высоким газовым потоком. Чаше всего применяется маска Вентури, в которой с помощью так называемого клапана Вентури обеспечивается постоянное соотношение между кислородом и атмосферным воздухом во вдыхаемой смеси при относительно высокой скорости потока. Разные клапаны обеспечивают разную F102. Для меньших F102 используются клапаны, Создающие большую долю воздуха в смеси, так что скорость общего потока (кислород плюс воздух), поступающего к больному, увеличивается — от 40 л/мин при F|02 50% до 80 л/мин при F,02 24%. Хотя эта скорость значительно больше, чем у систем с низким газовым потоком, у больных с дыхательной недостаточностью она может быть меньше максимального потока на вдохе, поэтому фактическая F102 может быть ниже расчетной. Кислородные распылители, являющиеся разновидностью маски Вентури, обеспечивают высокую скорость потока увлажненной газовой смеси с F102 35—100%. Наконец, смесители-дозаторы обеспечивают высокую F102 при очень высокой скорости потока. В этих устройствах сжатые воздух и кислород смешиваются в различных пропорциях, обеспечивая F102 21—100% при скорости потока до 100 л/мин. Смесители-дозаторы используют для регуляции F1О2 в респираторах (в том числе обеспечивающих самостоятельное дыхание под постоянным положительным давлением), в оксигенаторах и других подобных аппаратах. В любом случае, несмотря на высокую скорость потока, для поддержания высокой F|02 необходим герметичный дыхательный контур или дыхательный мешок, сводящие к минимуму разбавление вдыхаемой смеси атмосферным воздухом.
Слежение за уровнем оксигенации. Для достижения лечебного эффекта и предупреждения осложнений необходимы точное дозирование кислорода и оценка уровня оксигенации. Цианоз, несмотря на важное клиническое значение этого симптома, не является ни ранним, ни чувствительным, ни надежным показателем нарушенной оксигенации. Цианоз появляется при концентрации дезоксигемоглобина в артериальной крови примерно 5 г% (Lundsgaard and Van Slyke, 1923), что при нормальной концентрации гемоглобина (15 г%) соответствует Sa0267%. Однако при анемии с концентрацией гемоглобина порядка 10 г% цианоз появляется лишь при снижении Sa02 до 50%. Инвазивные методы слежения за уровнем оксигенации включают периодический анализ газов артериальной или смешанной венозной крови и непрерывную регистрацию степени насыщения гемоглобина кислородом через сосудистый волоконно-оптический катетер. Последний метод применяется для непрерывного измерения насыщения кислородом гемоглобина смешанной венозной крови (Sv02) как показателя поглощения кислорода тканями — обычно у тяжелых больных.
Широко применяется непрерывная неинвазивная регистрация Sa02 с помощью пульс-оксиметрии. Этот метод основан на разном поглощении света оксигемоглобином и дезоксигемоглобином. О величине Sa02 судят по пульсирующему (артериальному) компоненту сигнала. Метод прост и не требует калибровки. С помощью пульс-оксиметрии измеряют только Sa02 (но не Р02), поэтому повышение Р02 при полном насыщении гемоглобина остается незамеченным. Тем не менее пульс-оксиметрия — это очень ценный метод. Ее применяют: 1) для слежения за уровнем оксигенации во время операций или исследований, проводимых с применением средств с седативным действием или общей анестезии, 2) для слежения за состоянием больных с возможными нарушениями оксигенации, 3) для коррекции дозы кислорода — особенно если есть риск кислородного отравления или других побочных эффектов.
Осложнения. Иногда увеличение Ft02 вызывает побочные эффекты. Помимо ателектазов и нарушений вентиляции, о которых было сказано выше, большой поток неувлажненного кислорода может вызвать сухость слизистых дыхательных путей и глаз, подавление восходящего тока слизи и затруднение отхождения мокроты. Поэтому, если ингаляция кислорода длится более часа, кислород следует увлажнять. Наконец, обогащенные кислородом газовые смеси взрывоопасны, поэтому при использовании таких смесей — как в больнице, так и в домашних условиях — необходимо соблюдать меры предосторожности.
Важно помнить, что ингаляция кислорода не всегда устраняет гипоксемию. Более того, если на фоне ингаляции кислорода развивается обструкция дыхательных путей или гиповентиляция, то уровень кислорода в крови снижается не сразу. В результате эти опасные состояния могут быть выявлены слишком поздно. Поэтому у таких больных необходимо следить не только за уровнем оксигенации, но и за показателями внешнего дыхания — независимо от того, производится ингаляция кислорода или нет.
Лечебное применение кислорода[править | править код]
Устранение гипоксии[править | править код]
Как уже говорилось, кислород применяют прежде всего для устранения гипоксии. Однако обычно гипоксия — это лишь симптом какого-либо основного заболевания, поэтому ингаляцию кислорода следует рассматривать как симптоматическое лечение, позволяющее выиграть время. Только изредка гипоксия бывает вызвана недостатком кислорода во вдыхаемом воздухе. Поскольку причины гипоксии многообразны, одной лишь ингаляции кислорода обычно оказывается недостаточно — необходимы меры, направленные на борьбу с этими причинами. Так, гипоксию, обусловленную обструкцией дыхательных путей, обычно не удается устранить просто увеличением F102. Еще более опасна гиповентиляция, обусловленная передозировкой наркотиков. Ингаляция кислорода при этом состоянии, конечно, уменьшает степень гипоксемии, но если не назначить больному антидоты, стимуляторы дыхательного центра или ИBЛ, то у него в любой момент может развиться дыхательная недостаточность. При большинстве легочных заболеваний ингаляция кислорода обычно позволяет устранить или уменьшить гипоксию, что позволяет провести патогенетическое лечение. Таким образом, ингаляция кислорода — важный компонент лечения при всех формах гипоксии, но эффективность ее зависит от характера основного расстройства. Снижение парциального давления азота. Концентрация азота в воздухе составляет примерно 79%, поэтому заполненные газом пространства тела человека содержат в основном азот. В некоторых случаях, например при воздушной эмболии сосудов, пневмотораксе или вздутии живота из-за кишечной непроходимости, необходимо уменьшить объем этих пространств. Азот плохо растворим, и поэтому повышение концентрации кислорода во вдыхаемой смеси (а следовательно, снижение концентрации в ней азота) вызывает быстрое снижение парциального давления азота в крови. В результате создается значительный градиент парциального давления азота между кровью и заполненными газом пространствами; азот выходит в кровь, а затем и удаляется. Ингаляция кислорода при воздушной эмболии, кроме того, уменьшает гипоксию в тканях дистальнее эмбола. Для предотвращения кессонной болезни перед декомпрессией и во время нее также проводят ингаляцию кислорода. В результате парциальное давление азота в крови и тканях снижается, избыточный азот удаляется и риск образования газовых пузырьков при декомпрессии снижается. Если же пузырьки в тканях или в сосудах все-таки образовались, то ингаляция кислорода также оказывает благотворное действие — как при описанной выше воздушной эмболии.
Гипербарическая оксигенация[править | править код]
Этот метод применяют, когда ингаляция чистого кислорода при нормальном давлении (1 атм) неэффективна (Buras, 2000; Shank and Muth, 2000; Myers, 2000). Для получения повышенного давления используют барокамеры. Они бывают самыми разными: от одноместных до многоместных, занимающих несколько комнат и оснащенных сложным оборудованием. В одноместные барокамеры обычно подается под давлением кислород, в многоместные — воздух (в последнем случае кислород под давлением подается через маску). Многоместные барокамеры удобны для лечения тяжелых больных, нуждающихся в ИВЛ, мониторинге и постоянном уходе. Барокамеры способны поддерживать давление до 200—600 кПа (2— 6 атм), хотя Р02 во вдыхаемой смеси редко превышает 300 кПа (3 атм) — во избежание кислородного отравления (см. ниже).
При гипербарической оксигенации действуют два фактора: повышенное барометрическое давление и повышенное Р02. Оба они играют важную роль в лечении кессонной болезни и воздушной эмболии. Повышенное барометрическое давление (а следовательно, и гидростатическое давление в крови и тканях) способствует уменьшению объема газовых пузырьков. Отсутствие же азота во вдыхаемой смеси приводит к тому, что азот по градиенту концентрации выходит из тканей, а затем — из крови. Кроме того, повышенное Р02 способствует уменьшению гипоксии в тканях дистальнее воздушных эмболов. Основная же цель гипербарической оксигенации при других состояниях — добиться повышения Р02 в тканях. Так, даже небольшое повышение Р02 в ишемизированных тканях усиливает бактерицидную активность лейкоцитов и стимулирует ангиогенез. Поэтому короткие повторные сеансы гипербарической оксигенации благоприятно сказываются на течении тяжелого хронического остеомиелита, лучевого некроза костей, синдрома длительного раздавливания, а также на регенерации кожи и на приживлении тканевых лоскутов и трансплантатов. Кроме того, повышенное Р02 само по себе оказывает бактериостатическое действие. Размножение возбудителей газовой гангрены (Clostridium perfringens) и образование ими токсинов подавляются при Р02 > 33 кПа (250 мм рт. ст.), поэтому при этой инфекции показано раннее применение гипербарической оксигенации.
Гипербарическую оксигенацию применяют также при некоторых формах общей гипоксии, например при отравлении окисью углерода (угарным газом). Окись углерода обладает высоким сродством к гемоглобину и миоглобину, и в ее присутствии эти белки утрачивают способность связывать кислород. Однако при высоком парциальном давлении кислород вытесняет окись углерода из соединения с гемоглобином и миоглобином, восстанавливая нормальную доставку кислорода к тканям. Гипербарическая оксигенация снижает риск неврологических осложнений при отравлении окисью углерода, причем это действие, возможно, не зависит от ускоренного выведения окиси углерода (Thom, 1989). По той же причине гипербарическую оксигенацию иногда используют при отравлении цианидами. Впрочем, в недавно проведенном испытании было показано, что гипербарическая оксигенация при отравлении окисью углерода неэффективна и может быть даже вредна (Scheinkestel et al.,1999). Гипербарическая оксигенация показана также при тяжелых формах острой анемии, так как количества кислорода, растворенного в плазме при Ра02 = 3 атм, достаточно для удовлетворения метаболических потребностей тканей. Однако такое лечение должно быть кратковременным — токсическое действие кислорода обусловлено именно повышением Р02, а не увеличением его объемной концентрации в крови.
Гипербарическую оксигенацию используют при таких разных состояниях, как рассеянный склероз, травмы спинного мозга, инсульт, проказа, переломы костей и применение костных трансплантатов. Однако данные клинических испытаний пока недостаточны, чтобы рекомендовать гипербарическую оксигенацию для лечения этих заболеваний. Кроме того, метод этот довольно дорогостоящий.
Кислородное отравление[править | править код]
Кислород необходим для выработки клеткой энергии — без него метаболизм невозможен. Однако кислород может оказать и токсическое действие, которое связывают с повышенным образованием его активных форм — супероксидного и гидроксильного радикалов, синглетного кислорода, перекиси водорода (Turrens et al., 1982). Эти вещества повреждают биологические мембраны и тем самым большинство клеточных структур. Токсическому действию активных форм кислорода препятствуют ферменты (например, супероксиддисмутаза, глутатионпероксидаза и каталаза) и восстановители (например, ионы железа, глутатион и аскорбиновая кислота). Однако этих защитных факторов недостаточно для предупреждения кислородного отравления у больных, дышащих кислородом в высоких концентрациях в течение длительного времени. Не все ткани одинаково чувствительны к токсическому действию кислорода, что, по-видимому связано с различиями в способности образовывать активные формы кислорода и в выраженности защитных механизмов. Подробнее о токсическом действии кислорода см. в обзоре Carraway and Piantadosi, 1999.
Дыхательная система. Органы дыхания первыми реагируют на кислородное отравление, так как Р02 в них выше, чем где-либо в организме. Первые, незначительные нарушения функции легких появляются уже через 8-12 ч дыхания чистым кислородом (Sackner et al., 1975). Через 18 ч отмечается повышение проницаемости капилляров; это может привести к увеличению P(A.a)02 и усугублению гипоксемии (Davis et al., 1983; Clark, 1988). Однако тяжелые нарушения и даже смерть наступаютто-лько при гораздо более длительном дыхании чистым кислородом. Повреждающее действие на легкие прямо зависит от Р02 во вдыхаемой смеси. Длительное дыхание газовой смесью, в которой Р02 меньше 0,5 атм, не опасно. Наиболее чувствителен к повреждающему действию кислорода эндотелий легочных капилляров. Его повреждение приводит к уменьшению площади газообменной поверхности в результате интерстициального отека и поступления жидкости в альвеолы (Crapo et al., 1980).
Главное в лечении кислородного отравления — снизить Р02 во вдыхаемой смеси. В эксперименте выявлено умеренное снижение токсического действия кислорода под влиянием ферментов-антиоксидантов: супероксиддисмутазы и каталазы (White etal., 1989). Возможно,определенную роль играет толерантность к кислороду: животные, подвергавшиеся кратковременному воздействию обогащенной кислородом смеси, оказались более устойчивыми к кислородному отравлению (Kravetz et al., 1980; Coursin et al., 1987). Дыхание газовыми смесями с повышенным или с пониженным Р02 влияет на устойчивость к кислородному отравлению и у человека (Hendricks et al., 1977; Clark, 1988). Получены убедительные данные о том, что важную роль в устойчивости к кислородному отравлению играют изменения выработки сурфактанта и активности супероксиддисмутазы и каталазы.
Сетчатка. Дыхание газовыми смесями с высоким Р02вызывает у новорожденных ретролентальную фиброплазию (Betts et al., 1977). Это осложнение, причиной которого считают ангиогенез, может привести к слепоте (Kushner et al., 1977; Ashton, 1979). В последнее время ретролентальная фиброплазия встречается реже — врачи стали осведомлены об этом осложнении и стараются не подвергать новорожденных действию высоких концентраций кислорода. У взрослых это осложнение не наблюдается.
ЦНС. Поражения ЦНС наблюдаются редко и лишь в тех случаях, когда Р02 превышает 200 кПа (2 атм). Наблюдаются эпилептические припадки и нарушения зрения, исчезающие при снижении Р02 до нормы. Это одна из причин, по которым при глубоководных погружениях используют кислородно-гелиевую смесь (см. ниже).