Функции почек — различия между версиями
Kron (обсуждение | вклад) (Новая страница: «Почки. Солевой и водный баланс Строение и работа почек В почках протекают три процесса:…») |
(нет различий)
|
Версия 00:17, 2 февраля 2015
Почки. Солевой и водный баланс
Строение и работа почек
В почках протекают три процесса: (1) большие количества воды и растворенных в ней веществ фильтруются из крови - образуется первичная моча; (2) первичная моча входит в почечные канальцы, где большая ее часть реабсорбируется, т. е. выходит из канальцев и поступает обратно в кровь; (3) некоторые вещества (например, токсины) не реабсорбируются, а активно секретируются в просвет канальцев. Нереабсорбированный остаточный фильтрат выводится (экскретируется) вместе с растворенными в нем веществами в виде вторичной мочи.
Функции. Почки (1) регулируют выведение из организма воды и солей с целью поддержания постоянного объема внеклеточной жидкости и осмоляльности (2) помогают поддерживать кислотно-основной гомеостаз; (3) удаляют конечные продукты метаболизма и чужеродные вещества; (4) предотвращают выведение полезных веществ (например, глюкозы) путем реабсорбции; (5) продуцируют гормоны (например, эритропоэтин) и активаторы гормонов (ренин); (6) выполняют метаболические функции (катаболизм белков и пептидов, глюконеогенез и т. д.).
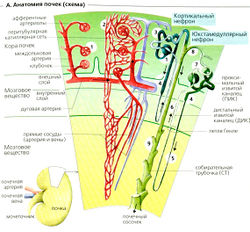
Строение нефрона
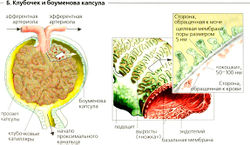
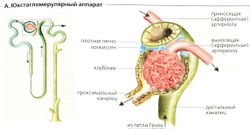
Каждая почка имеет около 106 нефронов, каждый состоит из мальпигиева тельца и канальца. Мальпигиево тельце расположено в коре почек (А) и состоит из пучка капилляров (клубочка), окруженного капсулой с двойными стенками (боуменовой капсулой, капсулой Боумена-Шумлянского). Первичная моча аккумулируется в просвете между двумя стенками капсулы (Б). Кровь входит в клубочек через приносящую артериолу (приносящий сосуд) и выходит через выносящую артериолу (выносящий сосуд), которая распадается на капиллярную сеть. Клубочковый фильтр (Б) отделяет кровеносную систему от просвета боуменовой капсулы.
Клубочковый фильтр состоит из фенестрированного (окончатого, дырчатого или перфорированного) эндотелия клубочковых капилляров (размер поры 50-100 нм), за ним следует второй слой базальной мембраны и со стороны мочи висцеральная мембрана боуменовой капсулы. Последняя мембрана образована подоцитами с многочисленными пальцеобразными отростками [ножками). Щели между ними покрыты щелевой мембраной, поры которой имеют около 5 нм в диаметре. Они образованы белком неф-рином, который заякорен на цитоскелете подоцитов.
• Проксимальный каналец (А, темно-зеленый цвет) - самый длинный отдел нефрона (примерно 10 мм). Его скрученный начальный сегмент [проксимальный извитой каналец, ПИК', АЗ) переходит в прямой отдел [собирательной трубочки', А4).
- Петля Генле состоит из толстого сегмента нисходящего колена, который тянется в мозговое вещество почки (А4 = ППК, проксимальный прямой каналец), тонкого сегмента нисходящего колена (А5), тонкого сегмента восходящего колена (только в юкстамедуллярных нефронах, имеющих длинную петлю) и толстого сегмента восходящего колена, СВК (А6). Петля Генле имеет плотное пятно - группу специализированных клеток, которые близко контактируют с клубочком соответствующего нефрона. Только около 20% всех петель Генле (глубоких юкстамедуллярных нефронов) имеют достаточную длину для того, чтобы проникнуть в мозговое вещество. Кортикальные нефроны имеют более короткие петли (А).
- Дистальный каналец (А, серо-зеленый цвет) имеет прямой начальный отдел (= СВК петли Генле, АБ), который сливается с извитым канальцем [дистальный извитой каналец, ДИК, А7).
ДИК переходит в соединительный каналец (А8). Большинство из них ведет в собирательную трубочку, СТ (А9), которая тянется сквозь кору почки (корковая собирательная трубочка) и мозговое вещество (мозговая собирательная трубочка). У почечных сосочков собирательная трубочка открывается в почечную лоханку. Отсюда моча, проталкиваемая перистальтическими сокращениями, по мочеточнику поступает в мочевой пузырь и далее в мочеиспускательный канал (уретру), по которому и выводится из организма. Мочеиспускание
Опорожнение мочевого пузыря регулируется реф-лекторно. Наполнение пузыря активирует гладкую мускулатуру стенки мочевого пузыря посредством сократительных рецепторов и парасимпатических нейронов (S2-S4). При малом объеме наполнения стенки расслабляются посредством симпатических нейронов (L1-L2), контролируемых супраспинальными центрами (варолиев мост). При увеличении объема наполнения (> 0,3 л) достигается пороговое давление (около 1 кПа), запускающее мочеиспускательный рефлекс по принципу положительной обратной связи. Мышцы стенки пузыря сокращаются, что ведет к увеличению давления, дальнейшему увеличению сокращения и т. д. до тех пор, пока не открываются внутренние (гладкомышечные) и внешние сфинктеры (поперечно-полосатые мышцы); в результате происходит мочеиспускание.
А. Анатомия почек (схема)— Б. Клубочек и боуменова капсула
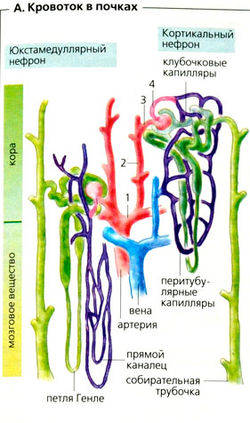
Почечная циркуляция
Дуговые артерии (А1) проходят между корой и мозговым веществом почек. По направлению к коре они разветвляются на междольковые артерии (А2), от которых отходят приносящие артериолы (или приносящие сосуды) (АЗ). Кровоснабжение почек уникально и устроено по принципу двух последовательных капиллярных сетей, которые соединены друг с другом выводящими артериолами (выносящими сосудами) (А, Б). Давление в первой сети клубочковых капилляров относительно высокое (Б) и регулируется путем изменения просвета междольковой артерии, приносящих и/или выносящих сосудов (АЗ, 4). Вторая сеть перитубулярных капилляров (А) обвивает кортикальные канальцы. Эта сеть снабжает кровью клетки канальцев, но также выполняет обмен веществ с просветом канальцев (реабсорбция, секреция).
Почечный кровоток (ПКТ) относительно быстрый (высокий), примерно 1,2 л/мин, что эквивалентно 20-25% минутного сердечного выброса. Это требует поддержания высокого уровня (скорости) клубочковой фильтрации (СКФ) и ведет к очень низкой артериально-венозной разнице О2 (примерно 15 мл/л крови). В коре почек О2 потребляется (примерно 18 л/мин) для окислительного метаболизма жирных кислот и других веществ. Большая часть продуцируемого АТФ используется для обеспечения активного транспорта. В мозговом веществе почек метаболизм в основном анаэробный.
Около 90% почечного кровотока идет в кору почек. В расчете на грамм ткани примерно 5,1,75 и 0,5 мл/мин крови проходит через кору, внешний и внутренний слои мозгового вещества соответственно. Даже самый обедненный кровью внутренний слой мозгового вещества (всего 0,5 мл/мин) получает крови больше, чем большинство других органов.
Почки содержат два типа нефронов, которые различаются свойствами второй капиллярной сети (А).
- Нефроиы коры оснащены перитубулярными капиллярами и имеют короткие петли Генле.
- Юкстамедуллярные нефроиы расположены на границе коры и мозгового вещества. Их выносящие артериолы дают начало сравнительно длинным (s 40 мм) прямым артериолам, которые проходят через мозговое вещество. Прямые артериолы снабжают мозговое вещество почек и могут сопровождать длинные петли Генле юкстамедуллярных нефронов до самых вершин почечных сосочков. Их волосообразная форма важна для концентрирования мочи.
Любые изменения распределения крови в этих двух типах нефронов воздействуют на выведение NaCI. Антидиуретический гормон (АДГ) увеличивает скорость клубочковой фильтрации (СКФ) юкстамедуллярных нефронов.
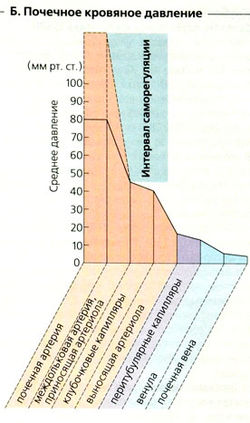
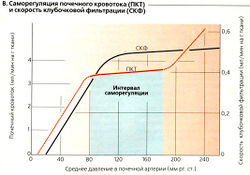
Благодаря саморегуляции почечного кровотока колебания кровяного давления в интервале 80-180 мм рт. ст. вызывают лишь небольшие изменения почечного плазмотока (ППТ) и скорости клубочковой фильтрации (СКФ) (даже в деиннервиро-ванной почке) (В). Сопротивление в междольковых артериях и приносящих артериолах, расположенных выше клубочков коры, автоматически выравнивается, когда меняется среднее кровяное давление (Б, В). Однако, если кровяное давление падает ниже 80 мм рт. ст., почечная циркуляция и фильтрация уменьшаются (В). ПКТ и СКФ могут регулироваться независимо друг от друга путем изменения сопротивления приносящих и выносящих артериол.
Неинвазивным методом можно определить ПКТ в том случае, если известен почечный плазмоток (ППТ) (обычно около 0,6 л/мин). ПКТ измеряют по равновесному количеству (согласно принципу Фика) внутривенно введенного контрастного вещества (например, п-аминогиппурата, ПАГ), которое должно почти полностью выводиться с мочой за время одного почечного цикла (ПАГ фильтруется и очень эффективно выводится). Выводимое количество ПАГ можно найти как разность между скоростью притока ПАГ в почки по артерии и скоростью венозного опока ПАГ из почек:
Количество вещества/время = (объем раствора/время) • концентрация [7.1]
(ППТ • РаПАГ) - (ППТ • РrvПАГ) = VU * UПАГ[7.2] или ППТ = VU • UПАГ/(РаПАГ - РrvПАГ) [7 3!
где РаПАГ - концентрация ПАГ в артериальной крови, РrvПАГ - концентрация ПАГ в венозной крови, UПАГ - концентрация ПАГ в моче, VU - скорость продукции мочи (в единицу времени); РrvПАГ составляет только 10% РаПАГ и в норме ее не измеряют напрямую, а оценивают как 0,9 клиренса ПАГ (= VU * UПАГ/0,9 • РаПАГ). Таким образом, ППТ = VU * UПАГ/0,9 • РаПАГ 17.4]
Эта формула верна только в том случае, если значение РаПАГ не очень высокое. Иначе секреция ПАГ выходит на насыщение, и клиренс ПАГ гораздо меньше, чем ППТ.
Почечный кровоток (ПКТ) получаем, вводя известное значение гематокрита (Hct) в следующее уравнение:
ПКТ = ППТ/(1 - Hct). [7.5]
А. Кровоток в почках
Б. Почечное кровяное давление
В. Саморегуляция почечного кровотока (ПКТ) и скорость клубочковой фильтрации (СКФ)
Рисунок 7.2. Почечная циркуляция Клубочковая фильтрация и клиренс
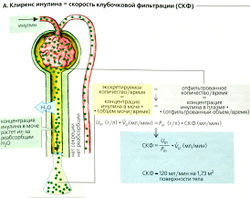
Скорость клубочковой фильтрации (СКФ) - общий объем жидкости, фильтруемый клубочками обеих почек за единицу времени. Обычно он составляет 120 мл/мин на 1,73 м2 поверхности тела, что эквивалентно 180 л/сутки. Соответственно объем внеклеточной жидкости всего тела (примерно 17 л) проходит через почечные канальцы около 10 раз в сутки. Около 99% СКФ возвращается во внеклеточное пространство за счет канальцевой реабсорбции. В среднем на экскрецию Н2О, таким образом, приходится около 1% от СКФ, а абсолютная экскреция Н2О (выход мочи/время = VU] составляет около 1-2 л в сутки.
СКФ составляет около 20% почечного плазмотока, ППТ. Фильтрационная фракция (ФФ) определяется как отношение СКФ/ППТ. Фракция фильтрации увеличивается под действием атриопептина, пептидного гормона, усиливающего сопротивление выносящих артериол (Re) и одновременно снижающего сопротивление приносящих артериол (Ra). Это повышает давление эффективной фильтрации в клубочковых капиллярах, при этом существенно не меняя общего сопротивления почечной циркуляции.
Эффективное фильтрационное давление (Реff) -это движущая сила фильтрации. Peff равно разности давлений в клубочковых капиллярах (Рсaр « 48 мм рт. ст.), в просвете боуменовой капсулы [Pbow~ 13 мм рт. ст.) и онкотического давления капиллярной крови (πсaр от 25 до 35 мм рт. ст.):
Рeff = Рcap - Pbow - πсaр (7.6]
На артериальном конце капилляров Peff- 48-13-25 = 10 мм рт. ст. По причине большой фильтрационной фракции концентрация белков в плазме и, следовательно, величина πсaр в клубочковых капиллярах увеличивается, а снижается. (Среднее эффективное фильтрационное давление Peff использовано в уравнении [7.7].) Таким образом, фильтрация прекращается (у дистального конца капилляров), когда πсaр увеличивается примерно до 35 мм рт. ст., снижая до нуля давление Peff (наступает фильтрационное равновесие).
СКФ является функцией (среднее для всех клубочков), площади фильтрации А (зависит от количества интактных клубочков) и гидравлической проводимости к клубочкового фильтра для воды*. Иногда используют коэффициент фильтрации Kf= А- к.
СКФ = Peff * Кf, [7.7]
к- это объем воды, фильтруемой через единицу площади в единицу времени при единичной разности давлений.
Для измерения СКФ в кровь вводят индикаторное вещество и определяют его содержание в плазме. Индикаторное вещество должно удовлетворять следующим требованиям:
- свободно фильтроваться почками;
- количество этого вещества не меняется из-за ресорбции или секреции в канальцах;
- не метаболизироваться в почках;
- не влиять на функцию почек.
Этим требованиям удовлетворяет инулин, вводимый внутривенно. Используют также эндогенный креатинин, в норме присутствующий в крови, хотя для этого индикатора существуют ограничения.
Количество индикатора, фильтрующегося в единицу времени (А), определяется как произведение его концентрации в плазме [Pin, в г/л или моль/л) на СКФ, в л/мин. За данное время в моче появляется такое же количество индикатора (условия 2 и 3, см. выше), которое находят как произведение V*U (л/мин) на концентрацию индикатора в моче (Uin в г/л или моль/л), т. е. Pin • СКФ =VU* Ujn, или
СКФ =VU*Uin/Pin [л/мин]. [7.8]
Выражение в правой части уравнения [7.8] называется клиренсом, вне зависимости от того, какое вещество изучается. Таким образом, клиренс инулина или клиренс креатинина характеризует СКФ. (Концентрация креатинина в плазме, Рсr, растет с уменьшением СКФ, однако креатинин не очень надежен для определения СКФ.)
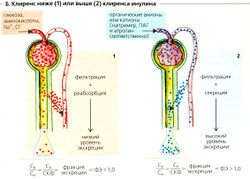
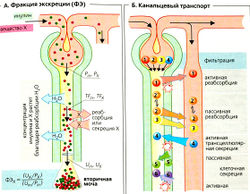
Клиренс равен абсолютно свободному (очищенному) объему плазмы, проходящему через почку в единицу времени. Фракция экскреции (ФЭ) определяется как отношение клиренса вещества X к клиренсу инулина [Cx/Cin). ФЭ показывает, какая доля фильтруемого количества вещества X была удалена через почки . Если вещество удаляется из канальца путем реабсорбции (например, Na+, Cl“, аминокислоты, глюкоза и т.д.; Б1), то ФЭ < 1, а если вещество подлежит фильтрации и секреции в канальцах, то его ФЭ > 1 (Б2). Для ПАГканальцевая секреция очень эффективна, и ФЭпaг = 5 (500%).
Абсолютный уровень реабсорбции и секреции свободно фильтруемого почками вещества X (ммоль/мин) определяется как разность между фильтруемым за определенное время количеством (СКФ • Рх) и экскретируемым количеством за то же время (VU • Ux), причем положительное число означает чистую реабсорбцию, а отрицательное - чистую секрецию. (Для инулина результат был бы равен 0.)
А. Клиренс инулина - скорость клубочковой фильтрации (СКФ)
Б. Клиренс ниже (1) или выше (2) клиренса инулина
Рисунок 7.3. Клубочковая фильтрация и клиренс Транспорт в нефроне
Фильтрация растворенных веществ. Клубочковый фильтрат также содержит в растворе небольшие молекулы из плазмы (ультрафильтрат). Клубочковый коэффициент просеивания (ККС) данного вещества (отношение концентрации в фильтрате к концентрации в плазме) - это мера гидравлической проницаемости клубочкового фильтра для этого вещества. Молекулы с радиусом r < 1,8 нм (молекулярная масса <10 000 Да) могут свободно проходить через фильтр (ККС »1,0), а молекулы с радиусом r > 4,4 нм (например, глобулины, молекулярная масса >80 000 Да) обычно не проходят (ККС = 0). Лишь часть молекул размером 1,8 нм < r < 4,4 нм способна пройти через фильтр (ККС от 0 до 1). Отрицательно заряженные частицы (например, альбумин: r = 3,4; ККС « 0,0003) хуже проникают через фильтр, чем нейтральные частицы того же радиуса, поскольку отрицательный заряд на стенках клубочкового фильтра отталкивает эти ионы. Если небольшие молекулы связаны с белками плазмы, то эта фракция практически не фильтруется.
Считается, что молекулы, захваченные клубочковым фильтром, элиминируются фагоцитами и клубочковыми подоцитами.
Канальцевый эпителий. Эпителиальные клетки, выстилающие почечные канальцы и собирательную трубочку, полярные. Так, их обращенная в просвет со стороны мочи (апикальная) мембрана значительно отличается от базолатеральной мембраны (со стороны крови). Апикальная мембрана проксимального канальца покрыта густой щеточной каемкой, которая значительно увеличивает контакт мембраны с канальцевой жидкостью (особенно проксимальных извитых канальцев). Базолатеральная мембрана этого сегмента канальцев увеличена за счет многочисленных отростков, которые, переплетаясь, образуют систему широких каналов - базолатеральный лабиринт, находящийся в близком контакте с внутриклеточными митохондриями, производящими АТФ, необходимый для работы Na+-К+-АТФазы в базолатеральной мембране (всех эпителиальных клеток). Большая площадь поверхности (около 100 м2) клеток проксимальных канальцев обеих почек необходима для реабсорбции большей части растворенных веществ в течение контактного времени в несколько секунд. Клеткам постпроксимальных канальцев микроворсинки очень нужны, так как количество реабсорбированных веществ резко снижается от проксимального к дистальному сегменту канальцев.
Проводимость этих двух мембран имеет решающее значение для трансцеллюлярного транспорта (реабсорбция, секреция), а герметичность плотных контактов определяют парацеллюлярную проводимость эпителия для воды и растворенных веществ, которые пересекают эпителий при помощи парацеллюлярного транспорта. Плотные контакты проксимальных канальцев относительно проницаемы для воды и небольших ионов на большом участке поверхности клеточной мембраны, делая эпителий хорошо оснащенным для пара- и трансцеллюлярного транспорта (Г, колонка 2). Тонкий сегмент петли Генле достаточно «протекаем», тогда как толстый сегмент восходящего колена и остальные канальцы, а также собирательная трубочка имеют «умеренно плотный» эпителий. На более плотном эпителии может развиться гораздо более высокий химический и электрический градиенты, чем на «протекающем» эпителии.
Измерения реабсорбции, секреции и экскреции. По концентрации данного вещества в моче нельзя определить, будет ли отфильтрованное клубочками вещество реабсорбировано или секретировано в канальцах и собирательной трубочке, и в какой степени. Причиной является тот факт, что его концентрация увеличивается из-за реабсорбции воды. Отношение концентраций инулина (или креатинина) в моче и в плазме, Uin/Pin, является мерой реабсорбции воды. Инулин и креатинин могут быть использованы в качестве индикаторов, поскольку они не реабсорбируются и не секретируются. Таким образом, изменение концентрации индикаторов по длине канальцев происходит только вследствие реабсорбции Н2О (А). Если Uin/Pin = 200, то концентрация инулина во вторичной моче в 200 раз выше, чем в исходном фильтрате. Это подразумевает, что фракция экскреции воды (ФЭH2O) составляет 1/200, или 0,005, или 0,5% от СКФ. Определение концентрации вещества X (свободно фильтруемого и, возможно, дополнительно секретируемого) в тех же образцах мочи или плазмы, в которых было измерено соотношение UJPjn, дает Ux/Px. Учитывая, что отношение Uin/Pin - это фракция экскреции вещества X, ФЭХ можно рассчитать по формуле (А и Г, в %, колонка 5):
ФЭХ= (Ux/Px)/(Uin/Pin)[7.9]
Уравнение 7.9 можно также вывести из отношения Cx/Cjn, упростив для VU. Фракция реабсорбции вещества X (ФРx) определяется как
ФРХ = 1-ФЭХ. [7.10]
г-
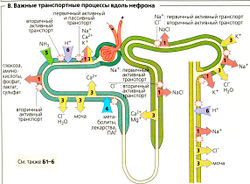
В. Важные транспортные процессы вдоль нефрона
Рисунок 7.4. Транспорт в нефроне I
Реабсорбция в различных сегментах канальцев. Концентрация вещества X (TFx) и инулина (TFin) в канальцевой жидкости может быть измерена при помощи микропункции (А). Эти величины можно использовать для вычисления нереабсорбируемой фракции (фракции доставки, ФД) свободно фильтруемого вещества X следующим образом:
ФД = (TFx/Px)/(TFin/Pin),
где Рх и Pin-соответствующие концентрации в плазме (более точно: в пересчете на воду, содержащуюся в плазме).
Фракция реабсорбции (ФР) до тестируемого участка может быть получена как 1 - ФД (Г, колонки 2 и 3, в %).
Реабсорбция и секреция различных веществ. Кроме H2O, многие неорганические ионы (Na+, Cl-, К+, Са2+, Мg2+) и органические вещества (например, HCO3, D-глюкоза, L-аминокислоты, мочевина, лактат, витамин С, пептиды и белки; В, Г) также подлежат канальцевой реабсорбции (Б1-3). Эндогенные продукты метаболизма (например, мочевина, глюкурониды, гиппураты, сульфаты) и чужеродные вещества (например, пенициллин, диуретики, ПАГ) поступают в мочу путем транс-целлюлярной секреции (Б4, В). Многие вещества, такие как аммиак (NH3) и Н+, сначала продуцируются клетками канальцев, а потом выходят в канальцы при клеточной секреции. NH3 входит в просвет канальцев путем пассивного транспорта (Б5), тогда как ионы Н+ секретируются путем активного транспорта (ББ).
Транспорт ионов Na+ и К+, осуществляемый Na+/К+-АТФазой базолатеральной мембраны канальцев и собирательной трубочки, служит своеобразным «мотором» для большинства этих транспортных процессов. Путем первичного активного транспорта, происходящего за счет прямого потребления АТФ, Na+/К+-АТФаза откачивает Na+ из клетки в кровь и К+ - в противоположном направлении. Это создает две движущие силы для транспорта многих веществ (включая Na+ и К+): первая - химический градиент Na+ ([Na+]o > [Na+]/) («/> - внутри клетки, «о» - из клетки) и вторая - мембранный потенциал ([K+]i > [К+]о; внутренняя сторона клетки заряжена отрицательно относительно внешней), т. е. существует электрический градиент, способствующий ионному транспорту.
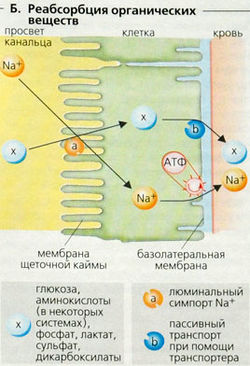
Трансцеллюлярный транспорт подразумевает, что вещество пересекает две мембраны, обычно по двум разным механизмам. Если вещество (D-глюкоза, ПАГ и т. д.) активно транспортируется через эпителиальный барьер (т. е. против электрохимического градиента), то по крайней мере
одна из двух стадий мембранного транспорта также должна быть активной.
Взаимодействие транспортеров. Процессы активного и пассивного транспорта обычно тесно взаимосвязаны. Активное поглощение растворенных веществ, таких как Na+ или D-глюкоза, например, приводит к образованию осмотического градиента, ведущего к пассивной абсорбции воды. Когда вода абсорбируется, некоторые растворенные вещества следуют за ней [захват растворенного вещества), тогда как другие субстраты внутри канальцев концентрируются. Последние (например, CI- или мочевина) затем возвращаются в кровь путем пассивной реабсорбции по градиенту концентрации. Электрогенный ионный транспорт и ионсопряженный транспорт могут деполяризовать или гиперполяризовать только люминальную или только базолатеральную мембраны клеток канальцев. Это вызывает трансэпителиальный потенциал, который в некоторых случаях служит движущей силой для парацеллюлярного ионного транспорта.
Поскольку неионизованные формы слабых электролитов более жирорастворимы, чем ионизованные, они способны лучше проникать через мембрану (неионная диффузия: Б2). Таким образом, pH мочи имеет большее влияние на пассивную реабсорбцию путем неионной диффузии. Размер молекул также влияет на диффузию: чем меньше молекула, тем больше коэффициент диффузии.
Рисунок 7.5. Транспорт в нефроне II
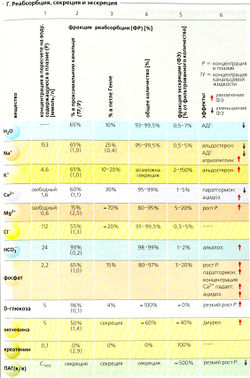
Г. Реабсорбция, секреция и экскреция Реабсорбция органических веществ
Фильтрационная нагрузка вещества - произведение концентрации этого вещества в плазме на скорость клубочковой фильтрации (СКФ). Поскольку СКФ высокая (примерно 180 л в сутки], каждые сутки в первичную мочу выходят огромные количества разных веществ (например, 160 г D-глюкозы в сутки).
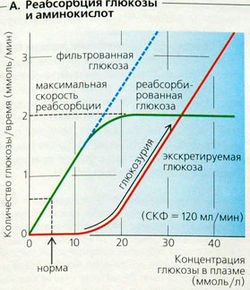
Фракция экскреции (ФЭ) D-глюкозы очень мала (» 0,4%). Практически полная ее реабсорбция достигается при помощи вторичного активного транспорта (симпорт Na+-глюкозы) в клеточной мембране с люминальной стороны канальца (Б). Примерно 95% этой активности проявляется в проксимальных канальцах.
Если концентрация глюкозы в плазме превышает 10-15 ммоль/л, как при сахарном диабете (норма
5 ммоль/л), то развивается глюкозурия, и концентрация глюкозы в моче растет (А). Реабсорбция глюкозы демонстрирует кинетику насыщения (кинетика Михаэлиса-Ментен). Приведенный выше пример иллюстрирует преренальную глюкозурию. Почечная глюкозурия может развиваться, если один из канальцевых транспортеров глюкозы имеет дефекты.
За реабсорбцию глюкозы отвечают переносчики (транспортеры) с низким сродством в клеточной мембране просвета извитых канальцев (транспортер Na+-глюкозы 2-го типа, SGLT2) и переносчики с высоким сродством в прямых канальцах (SGLT1). В обоих случаях это достигается за счет котранспорта D-глю-козы и Na+, при соотношении 1:1 в случае SGLT2 и 1:2 в случае SGLT1. Энергия для данного типа вторичного активного транспорта глюкозы поставляется электрохимическим градиентом Na+, направленным во внутреннее пространство клетки. Поскольку SGLT1 осуществляет котранспорт 2Na+ на одну молекулу глюкозы, градиент для этого транспортера в 2 раза больше градиента для SGLT2. Унипортер GLUT2 (транспортер глюкозы 2-го типа) со стороны кровотока облегчает пассивный транспорт аккумулированной внутриклеточной глюкозы из клетки [облегченная диффузия). D-галактоза также использует SGLT1-транспортер, тогда как D-фруктоза пассивно абсорбируется клетками канальцев (GLUT5).
Плазма содержит более 25 аминокислот, и ежедневно фильтруется около 70 г аминокислот. Аналогично D-глюкозе, большинство L-аминокислот реабсорбируется в клетках проксимальных канальцев путем Na+-сопряженного вторичного активного транспорта (Б). В проксимальных канальцах находятся по крайней мере 7 переносчиков аминокислот, и некоторые из них транспортируют одинаковые аминокислоты. Jmax и Км и, следовательно, растворимость и способность к реабсорбции варьируют в зависимости от типа аминокислоты и переносчика. Фракция экскреции большинства аминокислот составляет примерно 1% (от 0,1% для L-валина до 6% для L-гистидина).
Иногда развивается повышенная экскреция аминокислот с мочой (гипераминоацидурия). Предпочечна ипераминоацидурия происходит при повышении концентрации аминокислот в плазме (и при выходе реабсорбции на плато насыщения, как на А), а причиной почечной гипераминоацидурии является недостаточный транспорт. Такая дисфункция может быть специфической (например, цистинурия, когда повышенной экскреции подвергаются только L-цистеин, L-аргинин и L-лизин) или неспецифической (например, синдром Фанкони, когда повышенной экскреции подвергаются не только аминокислоты, но
также глюкоза, фосфаты, бикарбонаты и т. д.).
Некоторые вещества (лактат, сульфат, фосфат, дикарбоксилаты и т. д.) тоже реабсорбируются в проксимальных канальцах путем Na cимпорта, тогда как мочевина подлежит пассивной обратной диффузии.
И ураты, и оксалаты реабсорбируются и секретируются, причем для урата преобладает реабсорбция (ФЗ » 0,1), а для оксалата - секреция (ФЭ > 1). Если концентрация в моче этих слаборастворимых веществ поднимается выше нормы, то они начинают осаждаться (увеличивается риск образования мочевых камней). Подобным же образом повышенная экскреция цистеина может вести к образованию цистеиновых камней.
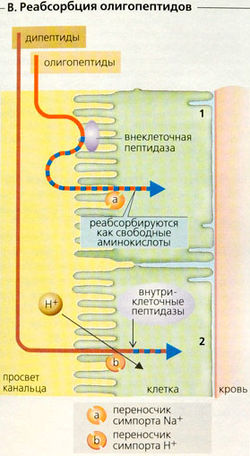
Олигопептиды, такие как глутатион и ангиотензин II, так быстро расщепляются люминальными пептидазами на щеточной каемке, что могут реабсорбироваться в качестве свободных аминокислот (В1). Дипептиды (например, карнозин), устойчивые к гидролизу в просвете канальца, должны абсорбироваться как интактные молекулы. Симпорт-переносчик (РерТ2), приводимый в действие направленным внутрь градиентом ионов Н+, транспортирует молекулы в клетку (третичный активный Н+-симпорт). Затем внутри клетки дипептиды гидролизуются (В2). Переносчик РерТ2 также используется некоторыми лекарствами и токсинами.
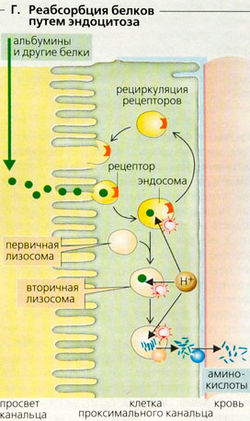
Белки. Хотя альбумин имеет низкий коэффициент фильтрации (0,0003), в сутки фильтруется 2400 мг альбумина при его концентрации в плазме 45 г/л (180 д/суг • 45 г/л • 0,0003 = 2400 мг/сут). При этом за сутки экскретируется только от 2 до 35 мг альбумина (ФЭ » 1%). В проксимальных канальцах альбумин, лизоцим, а1-микроглобулин, β2-микроглобулин и другие белки реабсорбируются путем рецепторопосредованного эндоцитоза и «перевариваются» лизосомами (Г).
Поскольку этот тип реабсорбции при нормальных фильтрационных нагрузках по белкам происходит почти на плато насыщения, повышенная концентрация белка в плазме или повышенный коэффициент фильтрации белка ведет к протеинурии.
25-ОН-холекальциферол, связанный в плазме и в клубочковом фильтрате с D-СБ (витамин D-связывающим белком), реабсорбируется (в комбинации с D-СБ) путем рецепторопосредованного эндоцитоза.
А. Реабсорбция глюкозы и аминокислот
В. Реабсорбция олигопептидов
- Б. Реабсорбция органических -веществ
(— Г. Реабсорбция белков путем эндоцитоза
Экскреция органических веществ Пища поставляет необходимые питательные вещества, но в ней есть и вредные компоненты. Организм обычно способен отсортировать их сразу же во время еды по запаху и вкусу, или, если они уже съедены, путем расщепления специфическими ферментами и с помощью абсорбирующих механизмов в кишечнике (например, D-глюкоза и (.-аминокислоты всасываются, а D-аминокислоты и L-глюкоза нет). Похожие механизмы работают и при выведении через печень (желчь - стул): полезные желчные кислоты почти полностью всасываются в кишечнике при помощи специальных транспортеров, тогда как отходы метаболизма, такие как билирубин, в основном удаляются с фекалиями. Подобным же образом, почки плохо реабсорбируют все бесполезные или вредные вещества (включая конечные продукты, например креатинин). Важные же вещества (такие как D-глюкоза и L-аминокислоты) реабсорбируются при помощи специальных транспортеров и, таким образом, избегают экскреции.
Печень и почки также способны модифицировать эндогенные отходы и инородные компоненты (ксенобиотики), лишая их токсичности (если они токсичны) и подготавливая их к быстрому выведению. В незаряженной форме или после ферментативного присоединения групп ОН или СООН эти вещества объединяются с глюкуроновой кислотой, сульфатом, ацетатом или глутатионом и формируют конъюгаты. Конъюгированные вещества затем секретируются в желчь и в просвет проксимальных канальцев (с дальнейшей метаболической обработкой или без таковой).
Канальцевая секреция
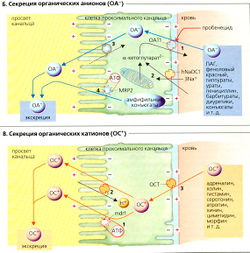
Проксимальные канальцы используют механизмы активного транспорта для секреции многочисленных отходов и ксенобиотиков. Это осуществляется при помощи переносчиков органических анионов (ОА-) и органических катионов (ОС+). Секреция этих веществ позволяет поднять их клиренс выше клиренса инулина и, таким образом, увеличить их фракцию экскреции (ФЭ) выше 1 (100%) для более эффективного удаления (А, ср. красную и синюю кривые). Секреция осуществляется переносчиками и, следовательно, подчиняется кинетике насыщения. В отличие от реабсорбируемых веществ, таких как D-глюкоза, фракция экскреции органических анионов и катионов снижается с ростом их концентрации в плазме (А, кривая секреции ПАГ достигает плато, а наклон кривой экскреции ПАГ снижается). Некоторые органические анионы (например, ураты и оксалаты) и катионы (например, холин) и секретируются, и реабсорбиру
ются (двунаправленный транспорт), что приводит к суммарной реабсорбции (ураты, холин) или секреции (оксалаты).
К секретируемым органическим анионам (OА~) относятся индикаторы, такие как ПАГ (л-аминогиппурат) и феноловый красный; эндогенные вещества, такие как ураты, оксалаты, гиппураты; лекарства: пенициллин G, барбитураты и многочисленные диуретики; а также конъюгированные вещества (см. выше), содержащие глюкуронат, сульфат или глутатион. Пробенецид, по причине большой аффинности к транспортным системам, является потенциальным ингибитором секреции 0А~.
Активная стадия секреции ОА- (Б) осуществляется через базолатеральную мембрану клеток проксимальных канальцев и аккумулирует в клетках органические анионы, чтобы преодолеть отрицательный внутренний потенциал. Мембрана имеет переносчик с широкой специфичностью (ОАТ1 - транспортер органических анионов 1-го типа), который транспортирует ОА- из крови в клетки канальцев в обмен на дикарбоксилат, например сукцинат2- или а-кетоглуторат2- (Б1). Последнее вещество происходит из клеточного метаболизма глутамина; переносчик Na+-дикарбоксилата у человека hNADC-1 также проводит дикарбоксилат (вместе с 3Na+) в клетку путем вторичного активного транспорта (Б2). Поэтому транспорт ОА- называется третичным активным транспортом. Выход ОА- в просвет канальца происходит пассивно (облегченная диффузия; БЗ). Для секреции амфифильных конъюгатов, таких как связанные с глутатионом липофильные токсины, также используется АТФ-зависимый конъюгатный насос (MRP2 = белок, отвечающий за мультимедикаментозную резистентность 2-го типа) в мембране просвета канальцев (Б4).
К секретируемым органическим катионам (ВС+) относятся эндогенные вещества (адреналин, холин, гистамин, серотонин и т. д.) и лекарственные вещества (атропин, морфин, хинин и т. д.).
В противоположность секреции ОА- активная стадия секреции OС+ происходит через люминальную мембрану клеток проксимальных канальцев (аккумуляция в просвете происходит после преодоления отрицательного мембранного потенциала внутри клетки). Мембрана содержит: (а) прямые АТФ-зависимые переносчики органических катионов (mdr1; первичный активный транспорт 0С+; В1); (б) мультиспецифический антипортер OС+/Н+ (третичный активный транспорт; В2). Катионы OС+ пассивно диффундируют из крови в клетку при помощи мультиспецифического транспортера органических катионов ГОСТ; ВЗ).
А. Секреция и экскреция л-аминогиппурата (ПАГ)
Рисунок 7.7. Экскреция органических веществ
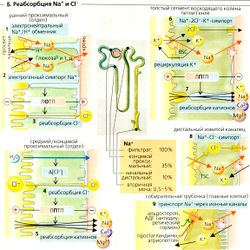
Реабсорбция Na+ и Cl-
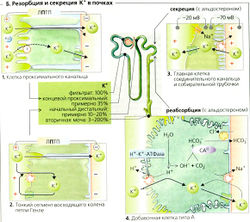
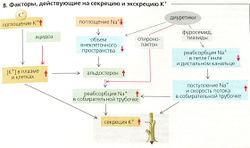
Примерно 99% фильтруемого Na+ реабсорбируется (—27 000 ммоль/сут), т. е. фракция экскреции Na+ (ФЭNa+) составляет около 1%. ФЭNa+ (от 0,5 до 5%) регулируется альдостероном, атриопептином и другими гормонами (Б9).
Участки реабсорбции Na+. Реабсорбция происходит во всех частях почечных канальцев и собирательной трубочки. Примерно 65% фильтруемого Na+ реабсорбируется в проксимальном канальце, при постоянной концентрации Na+ в просвете. Еще 25% реабсорбируются в петле Генле, где концентрация Na+ в просвете резко снижается. Дистальные извитые канальцы и собирательная трубочка также реабсорбируют Na+. Собирательная трубочка является участком тонкой гормональной регуляции экскреции Na+.
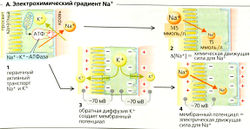
Механизмы реабсорбции Na+. №+-К+-АТФаза откачивает ионы Na+ из клетки, при этом проводя ионы К+ в клетку (А); таким образом создается химический градиент Na+ (А4). Обратная диффузия К+ (АЗ) ведет к формированию мембранного потенциала (А4). Суммарный результат -высокий электрохимический градиент Na+, который обеспечивает движущую силу для пассивного входа Na+ и имеет свои особенности в разных сегментах нефрона (Б).
- В проксимальных канальцах ионы Na+ пассивно диффундируют из просвета канальцев внутрь клеток посредством: (а) электронейтрального №+/Н+-обменника 3-го типа (NHE3), переносчика - Na+/H+-антипорта для электронейтрального обмена Na+ на Н+ (Б1); (б) различных переносчиков Na+-симпорта для реабсорбции D-глюкозы и т. д. (Б1). Поскольку большинство этих переносчиков сим-порта электрогенны, клеточная мембрана просвета канальцев поляризована и на ней образуется ранний проксимальный люмен-отрицательный трансэпителиальный потенциал (ЛОТП).
- В толстом сегменте восходящего колена (ТСВК) петли Генле (Б6) Na+ реабсорбируется при помощи буметанидчувствительного котранспортера BSC, Na+-K+ -2СГ-симпортера. Хотя BSC преимущественно электронейтрален, абсорбированный К+ рециркулирует назад в просвет канальца через К+-канал. Это гиперполяризует мембрану просвета канальца, что приводит к образованию на ней люмен-положительного трансэпителиального потенциала (ЛПТП).
- В дистальном извитом канальце (ДИК) (Б8) Na+ реабсорбируется при помощи триазидчувствительного котранспортера TSC, электронейтрального Ма+-С1--симпортера.
• В главных клетках соединительных канальцев и собирательной трубочки (Б9) Na+ выходит из просвета через Na+-каналы, активируемые альдостероном и антидиуретическим гормоном (АДГ) и ингибируемые простагландином и атриопептином.
Поскольку эти четыре стадии пассивного транспорта Na+ в люминальной мембране последовательно соединены с активным транспортом №+ в базолатеральной мембране (№+-К+-АТФаза), связанная с этим трансэпителиальная реабсорбция Na+ также происходит активно. Она составляет около 1/з от общей реабсорбции Na+ в проксимальных канальцах, и на 3 абсорбированных иона №+ потребляется 1 молекула АТФ. Остальные 2/3 от общей реабсорбции Na+ обусловлены пассивным и парацеллюлярным транспортом.
За этот процесс отвечают две движущие силы: (1) ЛПТП в средней и дальней части проксимальных канальцев (Б5) и петле Генле (Б7) проводит Na+ и другие катионы на эпителий со стороны кровотока; (2) захват растворителем: когда реабсорбируется вода, то растворенные вещества «захватываются» благодаря силе трения (как кусок древесины дрейфует вместе с потоком воды). Поскольку движущие силы (1) и (2) - непрямые результаты активности №+-К+-АТФазы, энергетический баланс возрастает примерно до 9 ионов Na+ на 1 молекулу АТФ в проксимальных канальцах (и до 5 Na+ на молекулу АТФ в остальных отделах почек).
На базолатеральной стороне ионы Na+ покидают клетку проксимального канальца при помощи №+-К+-АТФазы и переносчика, осуществляющего симпорт Na+—ЗHCO3. В последнем случае Na+ покидает клетку за счет третичного активного транспорта, тогда как вторичная активная секреция Н+ (на противоположной стороне клетки) приводит к внутриклеточной аккумуляции ионов HCO3.
Фракция экскреции CI (ФЗСl) колеблется от 0,5 до 5%. Примерно 50% всей реабсорбции Сl~ происходит в проксимальных канальцах. Ранний проксимальный ЛВТП проводит Cl через парацеллюляр-ные пространства из просвета канальца (БЗ). Реабсорбция CI- отстает по сравнению с реабсорбцией Na+ и Н2О, и концентрация CI- в просвете возрастает. В результате Cl начинает диффундировать парацеллюлярно по своему химическому градиенту вдоль средней и дальней части проксимального канальца (Б4), таким образом создавая ЛПТП (обращение потенциала, Б5). В тонком сегменте нисходящего колена (ТСНК) и дистальном извитом канальце (ДИК) Cl~ входит в клетку путем вторичного активного транспорта и выходит пассивно через активируемые АДГ базолатеральные С1"-каналы (Б6, 8).
Б. Реабсорбция Na+ и CI
А. Электрохимический градиент Na
Рисунок 7.8. Реабсорбция Na+ и С!~
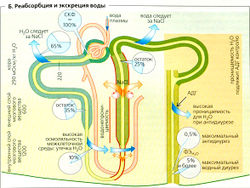
Реабсорбция воды.
Механизм концентрирования мочи Клубочковый фильтр пропускает около 180 л жидкости (плазмы) ежедневно (СКФ). По сравнению с этим количеством выход мочи в норме (VU) относительно мал (от 0,5 до 2 л/сут). Отклонения от нормы называются антидиурезом (низкая скорость VU) или диурезом (высокая скорость VU). Выход мочи выше уровня нормы называется полиурией, а ниже уровня нормы - олигоурией (< 0,5 л/сут) или анурией (< 0,1 л/сут). Осмоляльность плазмы и клубочкового фильтрата составляет около 290 мОсм/кг HgO (= Posm)', а осмоляльность вторичной мочи Wosm) колеблется от 50 (гипотоническая моча при увеличенном водном диурезе) до 1200 мОсм/кг НдО (гипертоническая моча с максимальной концентрацией). При водном диурезе происходит экскреция больших объемов воды без одновременной потери NaCI и других растворенных веществ, поэтому эта патология известна как «экскреция свободной воды» или «свободный водный клиренс» (СН2O). Это позволяет почке, например, нормализовать снижение осмоляльности плазмы. СН2O - объем воды, который теоретически может быть экстрагирован, чтобы моча достигла той же осмоляльности, что и плазма:
СН2O = VU(1 - Uosm/Posm). [7.11]
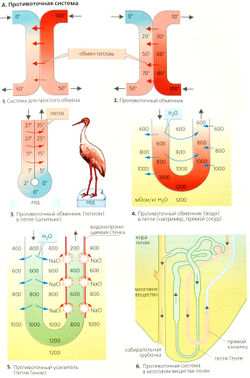
Системы противотока
Простой теплообменик (А1) состоит из двух трубок, в которых текут параллельные (в одном направлении) потоки воды, один холодный (О °С), а другой - горячий (100 °С). Благодаря теплообмену выходящая из обеих трубок вода будет иметь температуру около 50 °С, т. е. компенсируется начальный большой температурный градиент в 100 °С.
В противоточиом теплообменнике (А2) жидкость в трубках течет в противоположных направлениях. Поскольку градиент температуры присутствует вдоль всей длины трубок, теплообмен происходит также по всей длине трубок. В обмене могут участвовать также молекулы растворенных веществ, если стенки трубок проницаемы для них и если для данного вещества существует градиент концентрации.
Если теплообмен происходит в противоточной системе в трубке в виде петли (шпильки), перегиб которой находится в контакте со средой, а температура этой среды отличается от температуры внутри трубки теплообменника (лед, АЗ), жидкость, выходящая из трубки, скоро будет немного холоднее, чем входящая в трубку, поскольку тепло всегда передается от более теплого колена петли к более холодному.
Противоточный обмен воды в прямом сосуде в мозговом веществе почек (А6 и с. 156) происходит в том случае, если гипертоничность мозгового 170 вещества увеличивается по отношению к сосочкам
(см. ниже) и если прямой сосуд проницаем для воды. Часть воды диффундирует путем осмоса из нисходящего прямого сосуда к восходящему, таким образом обходя внутренний слой мозгового вещества (А4). Вблизи почечных сосочков концентрация всех компонентов крови возрастает благодаря экстракции воды. Осмоляльность плазмы в прямом канальце при этом непрерывно изменяется, стремясь к осмоляльности интерстиция, осмоляльность которого увеличивается по направлению к сосочкам. Ге-матокрит в прямом сосуде также возрастает. И наоборот, вещества, переходящие в кровь в мозговом веществе почек, диффундируют из восходящего прямого сосуда в нисходящий участок при условии, что стенки обоих сосудов проницаемы для них (например, для мочевины: В). Противоточный обмен в прямом сосуде обеспечивает необходимый приток крови к мозговому веществу почек, не изменяя в значительной степени высокой осмоляльности мозгового вещества и не ухудшая концентрационной емкости почек.
В противоточиом усилителе, таком как петля Гейле, градиент концентрации между двумя коленами поддерживается с затратой энергии (А5). Противоток усиливает относительно небольшой градиент во всех точках между коленами (локальный градиент —200 мОсм/кг НдО) до достаточно высокого градиента вдоль колена петли (—1000 мОсм/кг Н2О). Чем длиннее петля и чем выше градиент в одном колене, тем больше усиление градиента. Кроме того, он обратно пропорционален квадрату скорости потока в петле. Реабсорбция воды
Примерно 65% СКФ обусловлено реабсорбцией в проксимальных извитых канальцах (ПИК) (Б). Движущая сила этого процесса - реабсорбция растворенных веществ, особенно Na+ и Ch Это немного разбавляет мочу в канальце, но Н2О немедленно следует по этому осмотическому градиенту, поскольку ПИК «протекают». Реабсорбция воды происходит парацеллюлярно (через протекающие плотные контакты) или трансцеллюлярно, т. е. через водные каналы (аквапорины типа 1 = AQP1) в двух клеточных мембранах. Моча в ПИК, таким образом, остается практически изотонической. Онкотическое давление в перитубулярных капиллярах обеспечивает дополнительную движущую силу для реабсорбции воды. Чем больше воды фильтруется в клубочках, тем выше онкотическое давление. Таким образом, реабсорбция воды в проксимальных канальцах до определенной степени выравнивается в соответствии с клубочково-канальцевый равновесием (ККР).
171
Рисунок 7.9. Реабсорбция воды.
Механизм концентрирования мочи I
- А. Противоточная система -
Поскольку нисходящее колено петли Генле содержит аквапорины CAQP1), которые делают его проницаемым для воды, моча в нем в основном находится в осмотическом балансе с гипертоническим межклеточным пространством, которое становится все более гипертоническим при приближении к сосочкам (А5). Моча, таким образом, при продвижении в этом направлении становится все более концентрированной. В тонком сегменте нисходящего колена, которое мало проницаемо для солей, это приводит к увеличению концентрации Na+ и Ch. Большая часть воды из межклеточного пространства удаляется по прямому канальцу (Б). Поскольку тонкий и толстый сегменты восходящего колена петли Генле почти непроницаемы для воды, Na+ и Ch диффундируютпассивно (тонкий сегмент), но транспортируются активно (толстый сегмент) наружу, в межклеточную жидкость (Б). Вода не может быть удалена, и поэтому моча, выходящая из петли Генле, гипотонична.
Активная реабсорбция Na+ и Ch из тонкого сегмента восходящего колена петли Генле (ТСВК) создает локальный градиент (примерно 200 мОсм/кг H2O; А5) во всех точках между ТСВК нисходящей петли с одной стороны и внеклеточной жидкостью мозгового вещества почек - с другой. Поскольку высокая осмоляльность внеклеточной жидкости мозгового вещества почек является причиной, по которой вода экстрагируется из собирательной трубочки (см. ниже), активный транспорт NaCI является АТФ-зависимым «мотором» почечного механизма, концентрирующего мочу, и регулируется постоянной стимуляцией секреции АДГ.
По ходу дистальных извитых канальцев и в конце собирательной трубочки, где есть аквапорины и рецепторы АДГ типа V2 (см. ниже), жидкость в канальцах снова становится изотонической (в осмотическом равновесии с изотонической внеклеточной жидкостью коры почек), если присутствует АДГ, т. е. при антидиурезе. Хотя Na+ и Ch здесь все еще реабсорбируются, осмоляльность значительно не меняется, так как вода реабсорбируется (примерно 5% от СКФ) во внеклеточную жидкость под действием осмотического давления и осмоляльность канальцевой жидкости все больше определяет мочевина.
Конечная корректировка объема выводящейся мочи происходит в собирательной трубочке. В присутствии антидиуретического гормона (АДГ) (который связывается с базолатеральными Уд-рецепторами, названными так по названию гормона, АДГ = вазо-прессин), аквапорины (AQP2) люминальной мембраны главных клеток (в отсутствие аквапоринов водонепроницаемой) экстрагируют воду из мочи,
проходящей через все более гипертоническое мозговое вещество почек. Таким образом, Uosm возрастает и становится примерно в 4 раза выше, чем Posm Uosm/Posm = 4), что соответствует максимальному антидиурезу. Отсутствие АДГ приводит к водному диурезу, когда Uosm/Posm может упасть вплоть до < 0,3. К концу ТСВК Uosm может упасть даже ниже осмоляльности, поскольку реабсорбция Na+ и Ch продолжается в дистальном извитом канальце и собирательной трубочке, но вода вряд ли может за ними следовать.
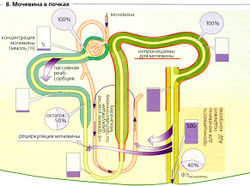
Мочевина также играет важную роль в формировании концентрированной мочи. Богатая белком диета приводит к увеличению образования мочевины, что увеличивает способность почек концентрировать мочу. Примерно 50% фильтрованной мочи покидает проксимальные канальцы путем диффузии (В). Поскольку нисходящее колено петли Генле, дистальный извитой каналец, а также кортикальный и внешний мозговой участки собирательной трубочки лишь незначительно проницаемы для мочи, ее концентрация увеличивается ниже этих частей нефрона ( В). АДГ может (при помощи Уд-рецепторов) вводить переносчики мочевины (транспортер мочевины 1-го типа, UT1) в люминальную мембрану, таким образом делая собирательную трубочку во внутреннем слое мозгового вещества проницаемой для мочевины. Мочевина теперь диффундирует назад в межклеточное пространство (при высокой осмоляльности половина приходится на мочевину) с помощью UT1 и затем с помощью UT2 транспортируется назад в нисходящее колено петли Генле, завершая рециркуляцию мочевины (В). Нереабсорбируемая фракция мочевины экскретируется: ФЭмочевины = 40%. Экскреция мочевины увеличивается при водном диурезе и снижается при антидиурезе, вероятно, по причине активации переносчика UT2.
Нарушения процесса концентрирования мочи в основном происходят (а) из-за очень высокого кровотока в мозговом веществе почек (вымывание Na+, Ch и мочевины); (б) при приеме осмотических диуретиков; (в) при приеме петлевых диуретиков; (г) дефиците секреции или неэффективности АДГ, как при центральном или нефрогенном несахарном диабете соответственно.
Б. Реабсорбция и экскреция воды
173
Рисунок 7.10. Реабсорбция воды.
Механизм концентрирования мочи II
- В. Мочевина в почках Гомеостаз жидкостей организма
Жизнь не может существовать без воды. Вода является начальным и конечным продуктом бесчисленных биохимических реакций. Она служит растворителем, транспортным средством, теплоизолятором, охладителем, а также имеет множество других функций. Вода присутствует в клетках в виде внутриклеточной жидкости, а также окружает клетки в составе внеклеточной жидкости. Она обеспечивает постоянство окружающей среды (внутренней среды) для клеток организма, чем похожа на среду первичного океана, окружавшего первые одноклеточные организмы.
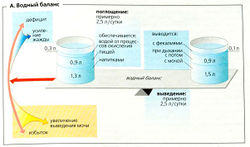
Объем циркулирующей жидкости в организме остается относительно постоянным, если должным образом поддерживается водный баланс (А). В среднем потребление жидкости составляет —2,5 л в сутки (в виде напитков, твердой пищи, а также продуктов метаболического окисления). Потребление жидкости должно быть достаточно высоким, чтобы компенсировать потери воды вследствие мочеиспускания, дыхания, испарения и дефекации. Средний дневной оборот воды составляет 2,5 л/70 кг (1/30 массы тела) у взрослых и 0,7 л/10 кг (1/10 массы тела) у младенцев. Таким образом, у младенцев водный баланс более подвержен отклонениям.
В организме могут быть значительные увеличения оборота воды, но в норме они должны адекватно компенсироваться. Потеря воды при дыхании происходит, например, в результате гипервентиляции на большой высоте и в результате испарения при высокой температуре окружающей среды (например, пешие прогулки на солнце или особые температурные условия на работе - металлургическое производство). И то и другое может приводить к потере нескольких литров воды в течение часа, что должно быть компенсировано путем соответственного увеличения потребления жидкостей (и соли). И наоборот, увеличенное потребление жидкостей приводит к увеличению объема экскретируемой мочи.
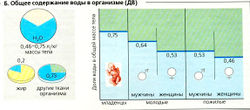
Содержание воды в организме. Доля воды (ДВ) составляет от 0,46 (46%) до 0,75 общей массы тела (МТ = 1) в зависимости от возраста и пола (Б). У младенцев ДВ составляет 0,75, у молодых мужчин (женщин) 0,64 (0,53), а у пожилых мужчин (женщин) всего 0,53 (0,46). Различия, связанные с полом (как и индивидуальные различия), определяются в основном разным содержанием жира в теле. У молодых взрослых людей в среднем доля воды в большинстве тканей составляет около 0,73 (ср. 0,2 в жировой ткани) (Б).
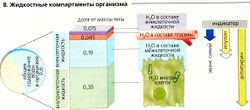
Жидкостные компартменты. У человека в среднем ДВ —0,6, причем около 3/s ДВ (0,35 МТ) - внутриклеточная жидкость, а другие 2/s ДВ (0,25 МТ) - внеклеточная жидкость. Внутриклеточная и внеклеточная жидкости разграничены плазматической мембра
ной клеток. Внеклеточная жидкость находится между клетками (межклеточная жидкость, интерстиций, 0,19 МТ), в составе крови (вода в составе плазмы, 0,045 МТ) и в «трансцеллюлярных» компартментах (0,015 МТ): плевральные, перитонеальные и перикардиальное пространства, полость спинномозгового канала и мозговых желудочков, камеры глаз и просвет кишечника, протоки почек и желез (В). Плазма крови отделена от окружающих тканей эндотелием, а эпителий отделяет интерстициальное пространство от трансцеллюлярных компартментов (В). По концентрации белка плазма существенно отличается от состава остальной внеклеточной жидкости. Более того, существует фундаментальная разница в ионном составе внеклеточной и внутриклеточной жидкостей (с. 99В). Поскольку ионы Na+ в основном находятся во внеклеточном пространстве, по общему содержанию Na+ в организме можно определить объем внеклеточной жидкости (с. 176).
Измерение объемов жидкостных компартментов. В клинической медицине объемы жидкостных компартментов тела обычно измеряют с использованием индикаторов методом разбавления. При условии что индикаторное вещество S, введенное в кровоток, проникает только в компартмент-мишень (В), объем У можно рассчитать по формуле
V[л] = S [моль]/Сs [моль/л], [7.12],
где С$ - концентрация индикатора S в компартменте-мишени (определяется по анализам крови). Объем внеклеточной жидкости обычно измеряется с использованием в качестве индикатора инулина или бромида натрия (он не входит в клетки), а ДВ - с использованием антипирина, тяжелой воды (DpO) или меченой НдО. Объем внутриклеточной жидкости примерно равен разности объемов распространения антипирина и инулина. Меченый альбумин или эванс синий, который полностью связывается белками плазмы, может быть использован для измерения объема плазмы. Объем крови можно найти как отношение объема плазмы к разности [1 - гематокрит], а межклеточный (интерстициальный) объем - как разность объемов внеклеточной жидкости и плазмы. (Так как после центрифугирования оказывается, что 0,1 объема плазмы приходится на эритроциты, при расчете общего объема крови следует брать не 1, а 0,91.) Объем крови также можно измерить при введении эритроцитов, содержащих радиоактивную метку 51 Сr; тогда объем плазмы получают, умножая объем крови на (0,91 - Hct).
г-
—А. Водный баланс В. Жидкостные компартменты организма
Рисунок 7.11. Водный баланс
- Б. Общее содержание воды в организме (ДВ)
Регуляция содержания солей и воды
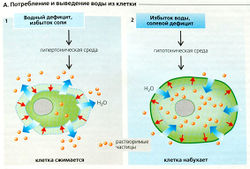
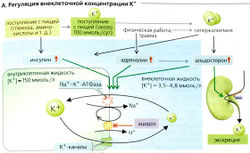
Осморегуляция. Осмоляльность большинства жидкостей тела составляет примерно 290 мОсм/кг Н2О, так что внутри- и внеклеточная жидкости (ICF и ECF) находятся в осмотическом равновесии. Любое увеличение осмоляльности внеклеточной жидкости, например из-за абсорбции NaCI или потери воды, приводит к оттоку жидкости из клеток (сжатие клеток, А1). Падение внеклеточного осмотического давления при поглощении или введении больших объемов воды или при потере Na+ (например, при дефиците альдо-стерона) приводит к тому, что вода из ECF устремляется в клетку (набухание клеток, А2). И то и другое представляют риск для нормального функционирования клетки, но клетка имеет механизмы защиты.
Плазматическая мембрана клетки содержит механорецепторы, которые участвуют в регуляции баланса потоков ионов и воды - например, выход К+ и Cl- при увеличении объема клетки и вход Na+, К+ и Ch при плазмолизе. Эти механизмы также контролируют баланс при увеличении объема клеток из-за усиленного поглощения Na+ и глюкозы в слизистой оболочке кишечника или из-за кратковременной гипоксии (со снижением активности К+-№+-АТФазы).
Клетки, физиологическая активность которых связана со значительными перепадами осмоляльности (например, в почках), также способны регулировать собственную осмоляльность с помощью образования/абсорбции или выведе-ния/ресорбции низкомолекулярных веществ, известных как органические осмолитики (например, бетаин, таурин, миоинозит, сорбит).
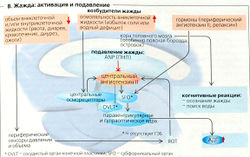
Осмоляльность внеклеточной жидкости должна точно регулироваться, чтобы защитить клетки от больших флуктуаций объема. Осморегуляция контролируется центральными осморецепторами (или осмосенсорами), находящимися в циркумвентрику-лярных органах (SF0 и 0VLT, см. далее). Колебания объема Н2О в ЖКТ регистрируются периферическими осмосенсорами в области воротной вены и передаются в гипоталамус по афферентным нейронам блуждающего нерва.
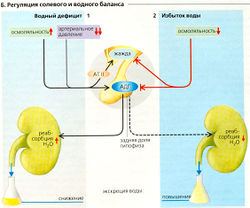
Водный дефицит (Б1). Общая потеря воды (ги-поволемия), например, из-за потоотделения, мочеиспускания или дыхания делает внеклеточную жидкость гипертоничной. Увеличение осмоляльности на 1-2% или более (= 3-6 мОсм/кг Н2О) достаточно для стимуляции секреции АДГ (антидиуретический гормон = вазопрессин) задней долей гипофиза (В1). АДГ снижает экскрецию Н2О с мочой
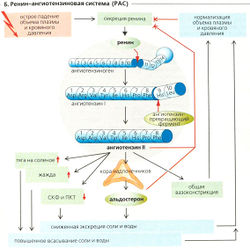
. Однако также необходимо поступление воды в организм извне. Сходным же образом гипертоническая спинномозговая жидкость (СМЖ) через осморецепторы в сосудистом органе конечной пластинки (0VLT) и субфорникальном органе гипоталамуса (SF0) стимулирует секрецию ангиотензина II (AT II), который вызывает гиперосмотическую жа-хгду (В). Изотоническая гиповолемия, например вследствие кровопотери или в результате гипонатриемии (Г1), также вызывает жажду (гиповолеми-ческая жажда, В), но относительный дефицит межклеточной жидкости в этом случае больше (>10%), чем относительное увеличение осмоляльности при гиперосмотической жажде (1-2%). Рецепторы гиповолемии в основном представлены предсердными сенсорами. Через афферентные тракты и ядро одиночного тракта (NTS) запускается секреция центрального AT II в SF0 (В, И), а через периферическую нервную систему и почечные бета1-адренорецепторы активируется периферическая ренин-ATII система (А4). Падение среднего кровяного давления ниже 85 мм рт. ст. обусловливает значительное повышение уровня секреции ренина непосредственно в почке. Как и центральный, периферический AT II может вызывать жажду и повышенный №+-аппетит, так как SF0 и 0VLT расположены за пределами ГЭБ.
Релаксин, пептидный гормон, синтезируемый желтым телом у беременных, связывается с рецепторами в SF0 и 0VLT. Он вызывает жажду и стимулирует секрецию АДГ. Несмотря на пониженную осмоляльность плазмы, которая могла бы подавлять жажду и секрецию АДГ в период беременности, релаксин обеспечивает нормальное или даже повышенное потребление жидкости в это время.
Жажда - субъективное ощущение и мотивация к поиску жидкостей и питью. Жажда - реакция организма на гиперосмоляльность или гиповолемию (более 0,5% массы тела - порог жажды), что стимулирует первичное питье. Первичное питье подавляет жажду до того, как осмоляльность полностью нормализуется. Такое досрочное снижение жажды является невероятно точным механизмом, так как связано с определением объема через афферентные сигналы от волюмо- и осморецепторов горла, ЖКТ и печени. Первичное питье, однако, является скорее исключением в условиях постоянной доступности жидкости, пригодной для питья. Обычно человек пьет, потому что у него пересохло во рту или во время еды, но может и без необходимости -например, по привычке или потому, что так принято. Такое повседневное питье называется вторичным питьем.
г А. Потребление и выведение воды из клетки
г- Б. Реляция солевого и водного баланса
В пожилом возрасте 30% людей 65-74 лет реже испытывают жажду, а 50% людей старше 80 лет пьют слишком мало жидкости. 0 возрастом способность к концентрированию мочи и секреции АДГ и альдостерона также понижается, что ведет к сопутствующему водному дефициту. Вследствие рассеянности и забывчивости потребление жидкости снижается, что порождает порочный круг. Некоторые пожилые люди стараются бороться с ночным и учащенным мочеиспусканием путем потребления меньшего количества жидкости, что также обезвоживает организм.
Избыток воды (Б2). Абсорбция гипотонической жидкости, включая, например, промывание желудка или введение раствора глюкозы (глюкоза быстро метаболизируется до СОд и НдО), снижает ос-моляльность внеклеточной жидкости. Этот сигнал ингибирует секрецию АДГ, что приводит к водному диурезу и нормализации осмоляльности плазмы менее чем за 1 час.
Водная интоксикация происходит, когда избыточные количества воды абсорбируются слишком быстро, что ведет к симптомам тошноты, рвоты и шоку. Данное состояние вызывается несвоевременным падением осмоляльности плазмы до того, как происходит адекватное ингибирование секреции АДГ.
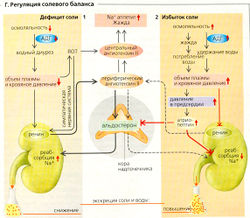
Регуляция объема. За сутки в организме всасывается примерно 8-15 г NaCI. Почки должны одновременно экскретировать такое же количество, чтобы сохранить количество Na+ в организме на постоянном уровне и обеспечить гомеостаз внеклеточной жидкости. Поскольку Na+ является основным внеклеточным ионом (баланс CI- поддерживается во вторую очередь), изменения содержания Na+ в организме ведут к изменению объема внеклеточной жидкости. Это регулируется в основном следующими факторами.
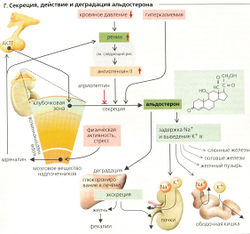
- Ренин-ангиотензиновая система (РАО AT II не только индуцирует жажду и солевой аппетит, но также снижает скорость клубочковой фильтрации и усиливает секрецию АДГ и альдостерона, что, в свою очередь, подавляет выведение Na+ (Г2) и, несмотря на потребление воды, устойчиво поддерживает солевой аппетит.
- Окситоцин, синтезируемый гипоталамусом нейромедиатор, ингибирует активность нейронов, которые поддерживают постоянный солевой аппетит, и посредством нервной регуляции повышает выведение NaCI.
- А триопептин (натрийуретический пептид предсердия, ANP или ПИП) - это пептидный гормон, секретируемый специальными клетками предсер
дия в ответ на увеличение объема внеклеточной жидкости и, следовательно, предсердного давления. ПНП подавляет жажду и понижает уровень секреции АДГ. Он способствует выведению Na+ почками путем увеличения фильтрационной фракции и ингибирует реабсорбцию Na+ в собирательной трубочке. ПНП, таким образом, функционирует как антагонист ренин-ангиотензиновой системы (РАС).
- АДГ. Секреция АДГ стимулируется путем: (а) увеличения осмоляльности плазмы и СМЖ\ (б) рефлекса Гаера-Генри, который запускается, когда волюморецепторы в предсердии предупреждают гипоталамус о снижении (>10%) объема внеклеточной жидкости (давления в предсердиях). AT II является ключевым фактором в данном процессе.
- Прессорный диурез, вызванный повышенным артериальным давлением, например, из-за увеличенного объема внеклеточной жидкости, приводит к повышенной экскреции Na+ и воды, таким образом снижая объем внеклеточной жидкости и кровяное давление. Эта система обратной связи считается основным механизмом долговременной регуляции кровяного давления.
Дефицит соли (Г1). Если гипонатриемия развивается в условиях нормального первичного содержания воды в организме, то осмоляльность крови и секреция АДГ снижаются, временно уменьшая выведение воды. Объем внеклеточной жидкости, объем плазмы и кровяное давление последовательно снижаются (И). Это, в свою очередь, активирует РАС, что вызывает гиповолемическую жажду из-за секреции AT II и индуцированного секрецией альдостерона удержания Na+ в результате. Удержание Na+ увеличивает осмоляльность плазмы, что ведет к секреции АДГ и в итоге к удержанию воды. Дополнительное потребление жидкостей в ответ на жажду также помогает нормализовать объем внеклеточной жидкости.
Избыток соли (Г2). Ненормально высокое содержание NaCI в организме, например, после потребления соленой жидкости ведет к возрастанию осмоляльности плазмы, удержанию воды организмом (жажда питье) и секреции АДГ. Таким образом, объем внеклеточной жидкости растет, и активность РАС сдерживается. Дополнительная секреция атриопептина, возможно, вместе с натрийуретическим гормоном с более долгим временем полужизни, чем у атриопептина (уабаина), ведет к увеличению выведения NaCI и Н2О и, следовательно, к нормализации объема внеклеточной жидкости.
г- В. Жажда: активация и подавление
— Г. Регуляция солевого баланса
179
Рисунок 7.13. Регуляция солей и воды II
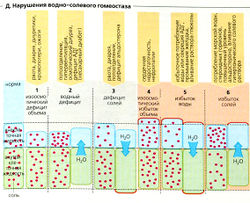
Если осмоляльность остается нормальной, нарушения солевого и водного гомеостаза (Д1,4) воздействуют только на объем внеклеточной жидкости. Когда осмоляльность внеклеточной жидкости возрастает (гиперосмоляльность) или снижается (гипоосмоляльность), вода во внеклеточных и внутриклеточных компартментах перераспределяется (Д2, 3, 5, 6). Основные причины этих нарушений перечислены в Д (оранжевый фон). Эффектами этих нарушений являются гиповолемия в случаях 1, 2 и 3, клеточный отек Iнабухание) при нарушениях 3 и 5 (например, отек мозга) и интерстициальный отек (задержка воды, легочный отек) при нарушениях 4, 5 и 6.
Диурез и диуретики
Увеличение выделения мочи свыше 1 мл/мин (диурез) может иметь следующие причины:
- Водный диурез: Снижение осмоляльности плазмы и/или увеличение объема крови ведут к уменьшению уровня АДГ и, следовательно, к удалению «свободной воды» . * •
- Осмотический диурез происходит, когда в почечные канальцы попадает активное вещество, нереабсорбируемое осмотически (например, маннит). Эти вещества удерживают воду в просвете канальца, после чего она выводится. Осмотический диурез может также иметь место в том случае, если концентрация реабсорбируемого вещества (например, глюкозы) превышает абсорбционную емкость канальцев, что приводит к гипергликемии. Глюкозурия при сахарном диабете, следовательно, сопровождается диурезом и вторичным увеличением жажды. Гипербикарбонатурия по этой же причине может приводить к осмотическому диурезу.
- Прессорный диурез развивается в том случае, если осмоляльность в мозговом веществе почки снижается при увеличении кровотока, что имеет место чаще всего при повышенном кровяном давлении.
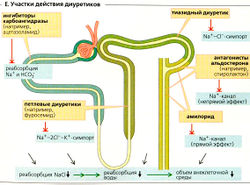
- Диуретики (Е) - это лекарства, индуцирующие диурез. Большинство из них (кроме осмотических диуретиков наподобие маннита) действует в основном путем ингибирования реабсорбции NaCI (салуретики) и уже потом путем снижения реабсорбции воды. Терапия диуретиками, например, при лечении отеков и повышенного давления вызывает понижение объема внеклеточной жидкости.
Несмотря на то что диуретики в основном ингибируют транспорт NaCI по всему телу, они имеют большую лочечную «специфичность», поскольку действуют из просвета канальцев, где становятся очень концентрированными бла
годаря секреции и реабсорбции воды в канальцах. Таким образом, дозировки, не вызывающие нежелательных системных эффектов, являются терапевтически эффективными в просвете канальцев.
Диуретики типа ингибиторов карбоангидразы (например, ацетазоламид, бензоламид) снижают обмен Na+/H+ и реабсорбцию HCOf в проксимальных канальцах. Степень развивающегося диуреза незначительна, поскольку дистальные сегменты канальцев реабсорбируют NaCI, не реабсорбируемый выше, а также потому, что происходит снижение СКФ благодаря канальцево-клубочковой обратной связи. В добавление к этому, повышенная экскреция HCO3 также ведет к нереспираторному (метаболическому) ацидозу. Следовательно, этот тип диуретиков используется только для пациентов с сопутствующим алкалозом.
Петлевые диуретики (например, фуросемид и буметанид) высокоэффективны. Они ингибируют буметанидчувствительный котранспортер BSC, №+-2К+-симпорт-переносчик в толстом сегменте восходящего колена (ТСВК) петли Генле. Это не только снижает реабсорбцию NaCI, но также блокирует «мотор» механизма концентрирования мочи. Поскольку положительный люминальный трансэпителиальный потенциал (ЛПТП) в ТСВК падает, парацеллюляр-ная реабсорбция Na+, Са2+ и Мg2+ также ингибируется. Так как количество нереабсорбируемого Na+, поступающего в собирательную трубочку, увеличивается, секреция К+ растет, одновременная потеря Н+ ведет к гипокалиемии и гипокалиемическому алкалозу.
Петлевые диуретики ингибируют BSC в плотном пятне, таким образом «обманывая» юкстагломерулярный аппарат (ЮГА), заставляя его «поверить», что в просвете канальцев нет больше NaCI. Затем СКФ увеличивается по механизму канальцево-клубочковой обратной связи, что, в свою очередь, вызывает диурез.
Триазидные диуретики ингибируют резорбцию в дистальных канальцах. Подобно петлевым диуретикам, они увеличивают реабсорбцию в нижних сегментах канальцев, что приводит к потерям К+ и Н+.
Калийсберегающие диуретики. Амилорид блокирует №+-каналы в главных клетках соединительных канальцев и собирательной трубочки, что ведет к уменьшению выделения К+. Антагонисты альдо-стерона (например, спиролактон), которые блокируют цитоплазматические рецепторы альдостерона, также оказывают калийсберегающий эффект.
г- Д. Нарушения водно-солевого гомеостаза
г- Е. Участки действия диуретиков
Рисунок 7.14. Регуляция солей и воды III
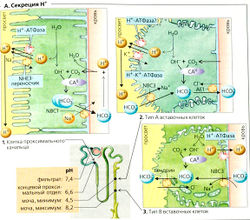
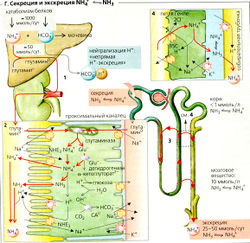
Почки и кислотно-основный баланс Основные функции почечной экскреции Н+ (А):
- реабсорбция отфильтрованного бикарбоната (Б),
- экскреция ионов Н+, измеряемая как титруемая кислотность (В];
- неионный транспорт NH^, т. е. в форме NH3 (Г1, 2).
1. Очень большие количества ионов Н+ секре-тируются в просвет проксимальных канальцев (А1) при помощи: (а) первичного активного транспорта посредством Н+-АТФазы\ (б) при помощи вторичного активного транспорта посредством злектронейтрального Na+-H+-антипортера (переносчика NHE3). pH в просвете снижается от 7,4 (фильтрат) до примерно 6,6. На каждый секре-тируемый ион Н+ один ион ОН- остается внутри клетки; ион ОН- реагирует с СОз - образуется HCO3 (что ускоряется карбоангидразой-ll, см. ниже). Ион HCOf покидает клетку и переходит в кровь, где связывает один ион Н+. Таким образом, каждый ион Н+, декретируемый в просвет (и экскретируемый), способствует удалению из организма одного иона Н+, за исключением тех случаев, когда секреция иона Н+ сопровождается секрецией NH3 (см. ниже).
2. В соединительных канальцах и собирательной трубочке (А2) вставочные клетки типа А декретируют ионы Н+ при помощи Н+-К+-АТФазы и Н+-АТФазы, что вызывает падение pH в просвете до 4,5. Остаточный 0Н~ в клетке реагирует с СОд с образованием HCOf, который высвобождается на базолатеральной мембране через анионные транспортеры АЕ1 (= SLC 4 AD (А2). При метаболическом алкалозе вставочные клетки типа В могут декретировать HCOf через пендрин (SLC 26 А4) (АЗ).
Карбоангидраза (КА) играет важную роль во всех случаях, когда ионы Н+ выходят с одной стороны клетки и/или ионы HCOf выходят с другой стороны, например, в клетках почечных канальцев, которые содержат КА" в цитоплазме и KAIV на наружной стороне люминальной мембраны (А, Б, Г), как в желудке, тонком кишечнике, протоке поджелудочной железы и эритроцитах, и т. д. КА катализирует реакцию
H2O + СO2 ⇆ Н+ + HCO3 .
Угольная кислота (Н2СО3) часто считается промежуточным продуктом этой реакции, но с КА, вероятно, соединяется ОН" (а не H2O). Поэтому, реакции Н2О ⇆ ОН" + Н+ и ОН" + СОз HCOf лежат в основе вышеупомянутой суммарной реакции.
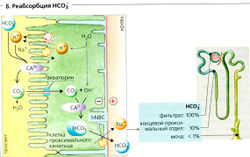
Реабсорбция HCOf (Б). Количество HCOf, фильтруемое каждый день, в 40 раз больше количества, присутствующего в крови. Следовательно, для поддержания кислотно-основного баланса ион HCOf должен быть реабсорбирован. Ионы Н+, секретируемые в просвет проксимальных извитых канальцев, реагируют примерно с 90% фильтруемого HCOf с образованием СO2 и H2O (Б). KAIV, закрепленная на мембране, катализирует эту реакцию. СОд диффундирует в клетку, возможно, с помощью аквапорина 1 (Б). КА" катализирует превращение СO2 + Н2О в Н+ + HCOf внутри клетки (Б). Ионы Н+ снова декретируются, тогда как ионы HCOf выходят через базолатеральную мембрану клетки посредством электрогенного переносчика (NBC1 = NBCel = SSCL4 А4, см. Б) - 1 Na+ в котранспорте с 3 HCO3 (и/или 1 HCO3 + 1СО3-?). Таким образом, HCOf транспортируется из просвета через мембрану в форме СO2 (движущая сила: A/fod и выходит из клетки через базолатеральную мембрану как HCOf (движущаяся сила - мембранный потенциал).
Гипокалиемия ведет к снижению мембранного потенциала (уравнение Нернста) и, таким образом, к увеличению базолатерального транспорта HCOf. Это приводит к увеличению секреции Н+ и, следовательно, к гипокалиемическому алкалозу.
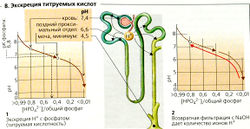
Выведение мочевой кислоты. Если потребление белков с пищей составляет 70 г в сутки , то после расщепления аминокислот ежедневно в организм поступает 190 ммоль Н+. HCI (из аргинина, лизина и гистидина), H2SO4 (из метионина и цистина), Н3РО4 и молочная кислота - вот главные источники ионов Н+. Это нелетучие кислоты, которые, в отличие от СO2, не удаляются при дыхании. Поскольку для распада органических анионов (глутамата, аспартата, лактата и т. д.) используется около 130 ммоль Н+ в сутки, общая продукция Н+ составляет около 60 (40-80) ммоль/сут. Хотя ионы и нейтрализуются в месте их образования, для регенерации буферных свойств они должны выводиться.
В экстремальных случаях pH мочи может возрастать примерно до 8 (высокий уровень экскреции HCO3) или падать до 4,5 (максимальная концентрация Н+ составляет 0,03 ммоль/л). При ежедневной экскреции около 1,5 л мочи почки выводят <1% производимых ионов Н+ в свободной форме.
Титруемые кислоты (80% фосфата, 20% мочевой кислоты, лимонная кислота и т. д.) составляют значительную фракцию (10-30 ммоль/л) выводимых Н+ (В1). Это количество ионов Н+ можно определить путем титрования мочи щелочью NaOH до pH плазмы (7,4) (В2). Примерно 80% фосфата (рКа = 6,8) в крови существует в форме НР04, тогда как в кислой моче почти весь фосфат присутствует как Н2РО4, т. е. секретируемые ионы Н+ нейтрализуются i фильтруемыми ионами НРО4. Нереабсорбированный фосфат (5-20% фильтруемого количества), следовательно, связывает ионы Н+, причем пример-
Рисунок 7.15. Почки и кислотно-основной баланс I
д Секреция Н+ Б. Реабсорбция HCO3.
но половина находится в проксимальных канальцах (pH 7.4 → 6.6). а остальные - в собирательной трубочке (pH 6,6 → 4.5) (В1). При ацидозе мобилизуется из костей и экскретируется повышенное количество фосфата. Результирующее увеличение выведения Н+ превосходит усиление образования NH4+, связанное с ацидозом (см. ниже).
Экскреция ионов аммония (NH4 ⇆ NH3 + Н+) составляет примерно 25-50 ммоль/сут при среднестатистической диете и эквивалентна расходу Н+. Таким образом, NH4+ является непрямой формой выведения Н+ (Г). NH4+ не является титруемой формой кислоты. В отличие от НРО4 + Н+⇆ Н2РО4, реакция NH3 + Н+ ⇆NH4+ не действует как буфер из-за высокого значения рКа ~ 9,2. Однако на каждый экскретируемый почками ион NH4+ один ион HCO3 запасается печенью. Это эквивалентно одному расходуемому иону Н+, поскольку один запасаемый ион HCO3 может связать один ион Н+ (и как следствие осуществить «непрямое» выведение Н+). При среднем потреблении белка с пищей метаболизм аминокислот приводит к образованию примерно эквимолярных количеств ионов HCO3 и NН4+ (примерно 700-1000 ммоль/сут). Печень утилизирует примерно 95% этих двух веществ, образуя мочевину (И): 2HCO3- + 2NH4+ ⇆ H2N-C-NH2 + С02 + ЗH2O О [7.131
Таким образом, на каждый ион NН4+, поступающий из печени в почки, потребляется и выводится с мочой один ион HCO3. Перед экспортом NH4+ в почки печень включает его в глутамат, что приводит к образованию глутамина, и только небольшая часть достигает почек в виде свободного NH4+. Высокие концентрации NH4+ NH3 токсичны.
В почках глугемин входит в клетки проксимальных канальцев при помощи №+-симпорта и расщепляется митохондриальной глутаминазой, образуя NH4+ и глутамат (Glu). Glu далее превращается глута-матдегидрогеназой в а-кетоглуторат с образованием второго иона NH4+ (Г2). NH4+ может достигнуть просвета канальцев двумя путями: (1) он диссоциирует внутри клетки с образованием NH3 и Н+, позволяя NH3 диффундировать (не по ионному механизму) в просвет, где он вновь соединяется с отдельно секретируемыми ионами Н+; (2) переносчик NHE3 секретирует NH4+ (вместо Н+). Как только ион NH4+ поступает в тонкий сегмент восходящего колена петли Генле (Г4), переносчик BSC реабсорбиру-ет NH4+ (вместо К+), так что тот остается в мозговом веществе почек. Рециркуляция ионов NH4+ через петлю Генле приводит к образованию очень высокой концентрации NH4+ ⇆ NH3 + Н+ в направлении почечных сосочков (ГЗ). Тогда как ионы Н+ активно
закачиваются в просвет собирательной трубочки и, возможно, NH3-транспортерами (гликопротеины RhB и RhC) (Я2, Г4), молекулы NH3 поступают сюда путем неионной диффузии (Г4). Градиент NH3, необходимый для осуществления этой диффузии, образуется благодаря тому, что очень низкое значение pH просвета (около 4,5) ведет к гораздо меньшей концентрации NH3 в просвете, чем в мозговом межклеточном пространстве, где pH выше примерно на две единицы, и концентрация NH3, следовательно, тоже выше, чем в просвете, примерно в 100 раз.
Нарушения кислотно-основного метаболизма. Когда развивается хронический нереспираторный ацидоз непочечной природы, экскреция возрастает по сравнению с нормальным уровнем в течение 1-2 дней примерно в 3 раза благодаря параллельному увеличению образования глутамина печенью (за счет мочевины) и активности почечной глутаминазы. Нереспираторный алкалоз только снижает почечную продукцию NH4+ и секрецию Н+. Это происходит вместе с увеличением фильтруемого HCO3 (повышенная концентрация в плазме), приводя к быстрому увеличению экскреции HCO3 и вслед за этим к осмотическому диурезу. Для компенсации респираторных нарушений важно, что повышенный (или пониженный) уровень Род, приводит к увеличенной (или уменьшенной) секреции Н+ и, следовательно, увеличенной (или уменьшенной] резорбции HCO3. Рецепторы CO2 и HCO3 на базолатеральной поверхности клетки регулируют этот процесс.
Почки также могут быть первичной причиной кислотноосновных нарушений (почечный ацидоз), при этом дефект может быть или генерализованным, или изолированным. При генерализованном дефекте, как например при почечной недостаточности, ацидоз развивается из-за снижения экскреции ионов Н+. При изолированном дефекте с нарушением проксимальной секреции ионов Н+ большие количества фильтруемого HCO3 не реабсорбируются, что ведет к проксимальному почечному канальцевому ацидозу. Когда ослабление выделения ионов Н+ почками происходит в собирательной трубочке (например, при нарушении функции гена АЕ1), моча больше не может закисляться (pH > Б, несмотря на ацидоз), и экскреция титруемых кислот и NH4+ закономерно ухудшается (дистальный почечный канальцевый ацидоз)
|— В. Экскреция титруемых кислот
Г. Секреция и экскреция NH4+ =NH3
Рисунок 7.16. Почки и кислотно-основной баланс II
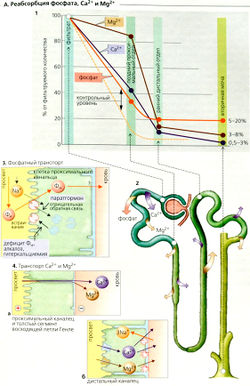
Реабсорбция и экскреция фосфата, Са2+ и Мg2+
Метаболизм фосфатов. Концентрация фосфатов в плазме обычно находится в диапазоне 0,8-1,4 ммоль/л. Каждый день фильтруется соответствующее количество неорганического фосфата Фн (НР042-⇆ Н2PO4-) (примерно 150-250 ммоль/суг), и большая его часть реабсорбируется. Фракция экскреции (А1), которая колеблется между 5 и 20%, необходима для поддержания баланса Фн, Н + и Са2+. Экскреция Фн возрастает при избытке Фн (повышенный уровень Фн в плазме) и падает при дефиците Фн. К фосфатурии и увеличению экскреции Н+ также приводит ацидоз (титруемая кислотность). Это происходит и при фосфатурии от других причин. Гипокальциемия и паратиреоидный гормон (паратгормон) тоже индуцируют увеличение экскреции Фн (АЗ).
Фн реабсорбируется в проксимальных канальцах (А2, 3). Мембрана их просвета содержит 3-й тип 3Na+-Фн-симпортера (NaPi-З). Этот переносчик связывает ионы НР042- и Н2РО4 и котранспортирует их путем вторичного активного транспорта.
Регуляция реабсорбции Фн. Дефицит Фн, алкалоз, ги-перкальциемия и низкий уровень паратгормона приводят к усиленному включению транспортера NaPi-З в мембрану просвета, тогда как избыток Фн, ацидоз, гипокальциемия и увеличенная секреция паратгормона приводят (по отрицательной обратной связи) к интернализации и последующему расщеплению NaPi-З в лизосомах (АЗ).
Метаболизм кальция. В отличие от метаболизма Na+ метаболизм кальция регулируется в основном путем абсорбции Са2+ в желудке и, во вторую очередь, путем почечной экскреции. Общий кальций плазмы (связанный кальций + ионизованный кальций) в среднем составляет 2,5 ммоль/л. Примерно 1,3 ммоль/л кальция присутствует как свободный, ионизованный Са?+, 0,2 ммоль/л образует комплексы с фосфатом, цитратом и т. д., а остальные 1 ммоль/л связаны с белками плазмы и, следовательно, не подлежат клубочковой фильтрации. Фракция экскреции Са2+ (ФЭСа в моче - 0,5-3% (А1).
Реабсорбция Са2+ происходит почти по всему нефрону (А1, 2). Реабсорбция фильтрованного Са2+ примерно на 60% происходит в проксимальных канальцах, на 30% - в толстом сегменте восходящего колена (ТСВК) петли Генле, и является парацеллюлярной, т. е. пассивной (А4а). В основном движущая сила для этого вида активности обеспечивается люмен-положительным трансэпителиальным потенциалом (ЛПТП). Поскольку реаб
сорбция Са2+ в ТСВК зависит от реабсорбции NaCI, петлевые диуретики ингибируют реабсорбцию Са2+. Всасывание Са2+ в ТСВК обеспечивает паратгормон, так же как и в дистальных извитых канальцах, где Са2+ реабсорбируется при помощи трансцеллюлярного активного транспорта (А4б). Таким образом, приток Са2+ в клетку является пассивным процессом и происходит при помощи Са2*-каналов просвета, а отток Са2+ - активный процесс и осуществляется посредством Са2+-АТФазы (первичный активный транспорт Са2+) и 3Na+-1Са2+-антипорта (вторичный активный транспорт Са2+). Ацидоз ингибирует реабсорбцию Са2+ неизвестными пока механизмами.
Мочевые камни обычно состоят из фосфата кальция или оксалата кальция. Когда увеличиваются концентрации Са2+, Фн или оксалата, может достигаться произведение растворимости фосфорных и оксалатных солей кальция; обычно же лиганды, образующие с кальцием комплексы (например, цитрат), и ингибиторы кристаллизации (например, нефрокальцин) допускают некоторую степень пересыщения. Образование камней может произойти при дефиците этих веществ, или если в моче присутствует очень высокая концентрация Са2+. Фн или оксалата (применимо ко всем трем при ярко выраженном антидиурезе).
Метаболизм магния и реабсорбция. Поскольку часть магния в плазме связана с белками (0,7-1,2 ммоль/л), концентрация магния в фильтрате составляет только 80% его концентрации в плазме. Фракция экскреции Мg2+ (ФЭмд) составляет 3-8% (А1,2). Однако в отличие от Са2+, только 15% фильтрованных ионов Мg2+ покидают проксимальные канальцы. Около 70% Мg2+ подлежит парацеллюлярной реабсорбции в ТСВК (А4). Другие 10% Мg2+ всасываются трансцеллюлярно в дистальных канальцах (А4б), вероятнее всего как Са2+ (см. ранее).
Экскреция Мдг+ стимулируется гипермагнезиемией, гиперкальцием ией, гиперволемией и петлевыми диуретиками, а ингибируется дефицитом Мg2+. Дефицит Са2+, дефицит объема, а также паратгормон и другие гормоны в основном оказывают влияние в ТСВК.
Почки содержат рецепторы для двухвалентных катионов, таких как Са2+ и Мg2+. При активации рецепторы в ТСВК ингибируют реабсорбцию NaCI, который, как и петлевые диуретики, уменьшает движущую силу парацеллюлярной резорбции катионов, таким образом уменьшая в норме активное всасывание Мg2+.
А. Реабсорбция фосфата, Са2+ и Мg2+ 1
Баланс калия
Потребление К+ с пищей составляет примерно 100 ммоль/сут (минимальное потребление 25 ммоль/сут). Примерно 90% К+ выводится с мочой и 10% - с фекалиями. Концентрация К+ в плазме крови в норме колеблется от 3,5 до 4,8 ммоль/л, тогда как внутриклеточная концентрация К+ может быть более чем в 30 раз выше (из-за активности №+-К+-АТФазы; А). Таким образом, около 98% из 3000 ммоль ионов К+ в организме присутствует в клетке. Хотя внеклеточная концентрация К+ составляет только 2% от общего К+ организма, она тем не менее очень важна, потому что (а) необходима для регуляции гомеостаза К+ и
(б) относительно небольшие изменения в клеточном К+ (приток или отток) могут вести к значительным изменениям в концентрации К+ в плазме (и связанному с этим риску сердечной аритмии). Регуляция гомеостаза К+, следовательно, подразумевает распределение К+ во внутриклеточных и внеклеточных компартментах и баланс выведения К+ и его потребления.
Срочная регуляция внеклеточной концентрации К+ достигается путем внутреннего смещения концентрации К+ между внеклеточной и внутриклеточной жидкостью (А). Этот относительно быстрый процесс предотвращает или смягчает опасные повышения внеклеточного К+ (гиперкалиемия) в тех случаях, когда присутствуют большие количества К+ из-за его потребления с пищей или внутриклеточного высвобождения К+ (например, при внезапном гемолизе). Данные сдвиги в концентрации К+ в основном подлежат гормональной регуляции. Инсулин, который выделяется после еды, стимулирует №+-К+-АТФазу и распределяет К+, поступивший с растительной или животной пищей, по клеткам тела. Данный тип регуляции используется также при гиперкалиемии, не связанной с питанием: сама по себе гиперкалиемия вызывает секрецию инсулина. Адреналин подобным же образом увеличивает потребление К+ клетками, которые задействованы при мышечной работе и при травме - двух причинах, ведущих к увеличению К+ в плазме крови. В обоих случаях повышенный уровень адреналина способствует поглощению К+ в этих и других клетках. Увеличение внутриклеточной концентрации К+ вызывает также альдостерон (см. далее).
Изменения pH тоже влияют на внутриклеточное и внеклеточное распространение К+ (А). Это происходит в основном по той причине, что широко распространенный Na+-К+-антипортер работает быстрее при алкалозе, чем при ацидозе (А). Следовательно, при ацидозе вход Na+ уменьшается, работа №+-К+-АТФазы замедляется и внеклеточ
ная концентрация К+ возрастает (особенно при нереспираторном ацидозе; на 0,6 ммоль/л на 0,1 единицы изменения pH). Алкалоз приводит к гипокалиемии.
Постоянная регуляция гомеостаза К+ в основном осуществляется почками (Б). К+ подлежит свободной клубочковой фильтрации, и большая часть фильтруемого К+ обычно реабсорбируется [общая реабсорбция). Экскретируемое количество в некоторых случаях может превышать фильтруемое (общая секреция, см. далее). Около 65% фильтрованного К+ обычно реабсорбируется ранее конца проксимальных канальцев, независимо от запасов К+. Это сравнимо с процентом реабсорбции Na+ и Н2О (Б1). Ионы К+ транспортируются в основном парацеллюлярно, т. е. пассивно. Движущими силами этого процесса являются захват растворенного вещества и положительный на люминальной стороне трансэпителиальный потенциал, ЛПТП (Б1) в среднем и конечном сегментах проксимальных канальцев. В петле Генле еще 15% фильтрованного К+ реабсорбируется парацеллюлярно и параэпителиально (Б2). В соединительных канальцах и собирательной трубочке можно определить количество экскретируемого К+. Затем, в зависимости от потребностей, большие или меньшие количества К+ или реабсорбируются, или секретируются. В экстремальных случаях в ответ на высокий уровень поглощения К+ фракционная экскреция К+ (ФЭk) может возрастать более чем на 100% или при дефиците К+ падать примерно на 3-5% (Б).
Клеточные механизмы почечного транспорта К+. Соединительные канальцы и собирательная трубочка содержат главные клетки (БЗ), которые реабсорбируют Na+ и секретируют К+. Аккумулированный внутриклеточный К+ может выходить из клеток через К+ -каналы с любой стороны клетки. Решающее значение для оттока К+ через мембрану имеет электрохимический градиент. Мембрана просвета главных клеток также содержит Na+-каналы, через которые Na+ входит в клетку. Это деполяризует мембрану просвета, потенциал на которой достигает примерно -20 мВ, в то время как базолатеральная мембрана поддерживает свой нормальный потенциал величиной примерно -70 мВ (БЗ). Движущая сила оттока К+ (Em - Ek), следовательно, выше на стороне просвета. Таким образом, К+ покидает клетку предпочтительно в направлении просвета [секреция). Это является основной причиной того, что секреция К+ сопряжена с всасыванием Na+, т. е. чем больше Na+ реабсорбируется главными клетками, тем больше секретируется К+.
Рисунок 7.18. Баланс калия I
А. Регуляция внеклеточной концентрации К+
Б. Резорбция и секреция К+ в почках -
Другая видимая причина заключается в том, что связанное с всасыванием увеличение внутриклеточной концентрации Na+ снижает движущую силу обмена 3Na+/Са2+ на базолатеральной мембране, что приводит к увеличению концентрации Са2+ в цитозоле. Это повышение действует как сигнал для более частого открывания К+-каналов просвета.
Добавочные клетки типа А (Б4) в дополнение к секреции ионов Н+ могут активно реабсорбировать К+. Для этой цели люминальная мембрана этих клеток, как и у париетальных (обкладочных) клеток желудка, содержит Н+/К+-АТФазу.
Факторы, влияющие на экскрецию К+ (В):
1. Увеличенное потребление К+ повышает внутриклеточную концентрацию К+ и его концентрацию в плазме крови, что, в свою очередь, увеличивает химическую движущую силу для секреции К+.
2. pH крови: внутриклеточная концентрация К+ в клетках почек увеличивается при алкалозе и падает при остром ацидозе. Это ведет к одновременному падению экскреции К+, которая опять возрастает при хроническом ацидозе. Причинами этого является то, что (а) ацидоз-зависимое ингибирование Na+-К+-АТФазы уменьшает проксимальную реабсорбцию Na+, что приводит к увеличенному дистальному оттоку мочи, и (б) результирующая гиперкалиемия стимулирует секрецию альдостерона (см. п. 4).
3. Если существует увеличенный отток мочи в соединительных канальцах и собирательной трубочке (например, по причине большой реабсорбции Na+, осмотического диуреза или других факторов, ингибирующих реабсорбцию Na+), то будут экскретироваться большие количества К+. Этим объясняется эффект потери калия при употреблении некоторых диуретиков. Причиной данного эффекта, возможно, является ограничение секреции К+ при определенной концентрации этого иона в просвете. Следовательно, чем больше сотношение объем/время, тем больше К+ удаляется со временем.
4. Альдостерон ведет к удержанию Na+, увеличению клеточного объема, умеренному усилению секреции Н+ (росту клеточного pH) и повышенной экскреции К+. Это также увеличивает количество молекул 1Na+-К+-АТФазы в клетках-мишенях и ведет к хроническому увеличению плотности митохондрий при адаптации к повышенному содержанию К+ (см. далее).
Клеточные механизмы эффектов альдостерона. Усиленное обратное всасывание достигается путем увеличения синтеза транспортных белков, называемых альдостерОН-ин-дуцируемыми белками. Этот генетически обусловленный эффект начинается примерно через 30-60 мин после введения или секреции альдостерона. Максимальный эффект
наступает через несколько часов. Альдостерон увеличивает реабсорбцию Na+, деполяризуя мембрану просвета (БЗ). Вслед за этим он увеличивает движущую силу секреции К+ и проводимость К+ путем увеличения pH клетки. Оба эти эффекта ведут к увеличению выведения К+. Кроме того, альдостерон имеет очень быстрый (от нескольких секунд до нескольких минут] не связанный с генетикой эффект на клеточную мембрану, физиологическая значимость которого еще должна быть исследована.
Емкость К+-выводящего механизма возрастает в ответ на длительное увеличение притока К+ (К+-адаптация) Даже когда работа почек нарушена, этот механизм в основном способен поддерживать баланс К+ в оставшихся интактных частях канальцевого аппарата. Взять на себя выведение более чем 1/3 общего количества К+ может также прямая кишка.
Минералокортико(стеро)иды. Альдостерон - зто наиболее распространенный минералокортикоидный гормон, синтезирующийся и секретирующийся в гломерулярной (клубочковой) зоне коры надпочечников (Г). Как и другие стероидные гормоны, альдостерон не хранится, а образуется при необходимости. Основная функция альдостерона состоит в регуляции транспорта Na+ и К+ в почках, желудке и других органах (Г). Секреция альдостерона возрастает в ответ на (а) падение объема крови и кровяного давления (опосредованное ангиотензином II) и (б) гиперкалиемию (Г). Синтез альдостерона ингибируется атриопептином.
Нормальная концентрация кортизола не влияет на рецепторы альдостерона только потому, что кортизол превращается в кортизон 11 бета-гидроксистероид-оксидоредуктазой в клетках-мишенях альдостерона.
Гиперальдостеронизм может быть либо первичным (секретирующие альдостерон опухоли в коре надпочечников, что наблюдается при синдроме Конна), либо вторичным (при уменьшении объема жидкости). Удержание Na+ приводит к большому объему внеклеточного пространства и повышенному кровяному давлению с одновременными потерями К+ и, как следствие, гипокалиемическому алкалозу. Когда более чем 90% коры надпочечников разрушено, например, по причине аутоиммунного воспаления надпочечников, метастазирующего рака или туберкулеза, развивается первичная хроническая недостаточность коры надпочечников (болезнь Аддисона). Дефицит альдостерона ведет к резкому увеличению экскреции Na+, что приводит к гиповолемии, гипотензии и удерживанию К+ (гиперкалиемии). Когда одновременно развивается также дефицит глюкокортикоидов, осложнения могут быть опасны для жизни, особенно при серьезных инфекциях и травмах. Если разрушена только одна железа, АКТГ вызывает гипертрофию другой.
г- В. Факторы, действующие на секрецию и экскрецию К+
Рисунок 7.19. Баланс калия II
Г. Секреция, действие и деградация альдостерона
Тубулогломерулярная обратная связь, ренин-ангиотензиновая система Юкстагломерулярный аппарат (ЮГА) состоит из (а) юкстагломерулярных клеток приносящей артериолы (включая ренинсодержащие и симпатически иннервируемые гранулярные клетки) и выносящей артериолы, (б) клеток плотного пятна толстого сегмента восходящего колена петли Генле и (в) юкстагломерулярных мезангиальных клеток (полкиссен, А) нефрона (А).
Функции ЮГА: (1) локальное проведение тубулогло-мерулярной обратной связи (механизм саморегуляции) в своем собственном нефроне при помощи ангиотензина II (ATII) и (2) системная продукция ангиотензина II как части ренин-ангиотензиновой системы (РАС).
Тубулогломерулярная обратная связь (механизм саморегуляции). Поскольку через почки ежедневно проходит в 10 раз больше жидкости, чем общий объем внеклеточной жидкости, выведение воды и соли должно точно соответствовать их поглощению. Резкие изменения в СКФ отдельного нефрона (СФН) и количества NaCI, фильтруемого в единицу времени, могут происходить по нескольким причинам. Повышение значения СФН ассоциируется с риском того, что дистальные механизмы реабсорбции NaCI перегружены, и слишком много NaCI и НгО будет потеряно с мочой. Заниженный показатель СФН означает, что слишком много NaCI и НдО удерживается. Степень реабсорбции NaCI и Н2О в проксимальных канальцах определяет, как быстро канальцевая моча проходит по петле Генле. Когда меньшее количество абсорбируется в верхней части, моча быстрее проходит по толстому сегменту восходящего колена петли, что приводит к уменьшению степени разбавления мочи и большей концентрации NaCI в плотном пятне, [NaCI]MD. Если величина [NaCI]MD становится слишком большой, гладкие мышцы стенки приносящей артериолы сокращаются, чтобы не изменилась СКФ через данный нефрон в течение 10 с, и наоборот (отрицательная обратная связь). Механизм регуляции неясен, но рецепторы ангиотензина II типа 1А (АТ1A) играют в этом ведущую роль.
Однако, если изменения [NaCI]MD обусловлены хроническими изменениями общего количества NaCI в организме и связанными с этим изменениями объема внеклеточной жидкости через механизм саморегуляции (обратной связи), нарушения зависимости СФН от [NaCI]MD могут иметь фатальные последствия. Поскольку увеличение в течение длительного времени объема внеклеточной жидкости уменьшает реабсорбцию NaCI в проксимальных канальцах, [NaCl]MD будет возрастать, приводя к снижению СКФ и дальнейшему увеличению объема внеклеточной жидкости. В обратной ситуации объем внеклеточной жидкости уменьшается. Для предотвращения таких эффектов зависимость [NaCl]MD/СФН может быть смещена в соответствующем направлении с помощью определенных веществ. Оксид азота (N0) смещает кривую при увеличении объема внеклеточной жидкости (увеличение СФН при прежнем значении [NaCI]MD), а (только локально эффективный) ангиотензин II сдвигает кривую в противоположном направлении при уменьшении объема.
Ренин-ангиотензиновая система (РАС). Если среднее артериальное давление в почках внезапно
падает ниже 90 мм рт. ст., почечные барорецепторы запускают высвобождение ренина, таким образом увеличивая общую концентрацию ренина в плазме. Ренин - это пептидаза, которая катализирует отщепление ангиотензина от субстрата ренина ангио-тензиногена (выделяемого печенью). Примерно через 30-60 мин после падения артериального давления ангиотензинпревращающий фермент (АПФ), который синтезируется в легких и других органах, отщепляет две аминокислоты от ангиотензина I с образованием ангиотензина II (Б).
Регуляция РАС (Б). Порог артериального давления для высвобождения ренина увеличивается при помощи а1-адренорецепторов, а базальная секреция ренина увеличивается при помощи бета1-адренорецепторов. Ангиотензин II и альдостерон являются наиболее важными эффекторами РАС. Ангиотензин II стимулирует высвобождение альдостерона корой надпочечников (см. далее). Оба гормона прямо (срочное действие) или косвенно (отложенное действие) ведут к новому увеличению артериального давления (Б), и высвобождение ренина, таким образом, снижается до нормы. Кроме того, оба гормона ингибируют высвобождение ренина (отрицательная обратная связь). * •
Если средний кровоток снижается только в одной почке (например, в результате стеноза поврежденной почечной артерии), то поврежденная почка начинает высвобождать больше ренина, что, в свою очередь, приводит к почечной гипертензии в остальной системе кровообращения.
Эффекты ангиотензина II. Помимо действия на миокард и кровеносные сосуды (в основном посредством АТд-рецепторов), ангиотензин II имеет следующие срочные или отложенные эффекты, опосредованные рецепторами АТ1 (А).
- Сосуды. Ангиотензин II имеет потенциальное вазоконст-рикторное и гипертензивное действие, что (посредством эндотелина) влияет на артериолы (срочное действие).
- ЦНС. Ангиотензин II оказывает действие на гипоталамус, что приводит (через циркуляторный центр) к вазоконст-рикции (быстрое действие). Он также увеличивает секрецию АДГ в гипоталамусе, что стимулирует жажду и потребность в соли (отложенное действие).
- Почки. Ангиотензин II играет основную роль в регуляции почечного кровообращения и СКФ путем сужения приносящих и/или выносящих артериол (отложенное действие, ср. саморегуляция). Он прямо стимулирует реабсорбцию Na+ в проксимальных канальцах (отложенное действие).
- Надпочечники. Ангиотензин II стимулирует синтез альдостерона в коре надпочечников (отложенное действие) и ведет к высвобождению адреналина в мозговом веществе надпочечников (срочное действие).