Механизм действия гормона роста — различия между версиями
Ponts (обсуждение | вклад) (→link= Проверенные форумы спортивной фармакологии) |
Sint (обсуждение | вклад) (→link= Проверенные форумы спортивной фармакологии) |
||
| Строка 14: | Строка 14: | ||
ИФР-I взаимодействует с мембранными рецепторами на поверхности клеток. Рецепторы ИФР-I близки к рецепторам [[инсулин]]а и представляют собой гетеротетрамеры с собственной тирозинкиназной активностью. Эти рецепторы присутствуют почти во всех тканях и имеют высокое сродство как к ИФР-I, так и к ИФР-II. Инсулин также может активировать рецепторы ИФР-I, но при этом у него сродство к рецептору примерно в 100 раз меньше, чем у ИФР. Рецептор ИФР-II локализуется в основном на внутриклеточных мембранах; это тот же самый рецептор, что и рецептор маннозо-6-фосфата, направляющий кислые гидролазы и другие маннозосодержащие гликопротеиды из аппарата Гольджи в лизосомы. Этот рецептор, видимо, активируется только ИФР-II. | ИФР-I взаимодействует с мембранными рецепторами на поверхности клеток. Рецепторы ИФР-I близки к рецепторам [[инсулин]]а и представляют собой гетеротетрамеры с собственной тирозинкиназной активностью. Эти рецепторы присутствуют почти во всех тканях и имеют высокое сродство как к ИФР-I, так и к ИФР-II. Инсулин также может активировать рецепторы ИФР-I, но при этом у него сродство к рецептору примерно в 100 раз меньше, чем у ИФР. Рецептор ИФР-II локализуется в основном на внутриклеточных мембранах; это тот же самый рецептор, что и рецептор маннозо-6-фосфата, направляющий кислые гидролазы и другие маннозосодержащие гликопротеиды из аппарата Гольджи в лизосомы. Этот рецептор, видимо, активируется только ИФР-II. | ||
| − | + | {{Ф|1=1}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
[[Категория:Фармакология]] | [[Категория:Фармакология]] | ||
Версия 23:50, 9 сентября 2016
Механизм действия гормона роста
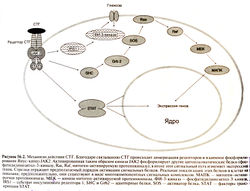
Действие соматотропного гормона обусловлено его связыванием с соответствующими рецепторами, что подтверждается наличием тяжелого поражения у гомозигот с мутацией гена рецептора СТГ (карликовость Ларона, вызванная резистентностью к СТГ). Рецепторы СТГ, имеющиеся почти во всех тканях, относятся к семейству мембранных рецепторов цитокинов и имеют структурное сходство с рецепторами пролактина, эритропоэтина и некоторыми рецепторами интерлейкинов (Finidori et al., 2000). Как и другие рецепторы цитокинов, рецептор СТГ имеет внеклеточный домен, связывающий гормон, один трансмембранный домен и внутриклеточный домен, обеспечивающий внутриклеточную передачу сигнала. Активация рецептора СТГ происходит при связывании одной молекулы СТГ с двумя одинаковыми рецепторами (de Vos et al., 1992). Образование такого димера ведет к сближению внутриклеточных доменов двух рецепторов, что, вероятно, необходимо для внутриклеточной передачи сигнала.
Строение рецептора СТГ было установлено путем клонирования и определения нуклеотидной последовательности кДНК соответствующего гена (Leung et al., 1987). Рецептор СТГ содержит 620 аминокислотных остатков, 260 из которых образуют внеклеточный домен, а 350 — внутриклеточный. Образование тройного комплекса СТГ с рецепторами начинается с высокоаффинного взаимодействия СТГ с одним рецептором, после чего другой участок СТГ связывается со вторым рецептором, но уже с меньшим сродством. Были синтезированы аналоги СТГ, у которых второй участок связывания с рецептором поврежден, поэтому они не приводят к димеризации рецепторов. Один из них, пегвисомант, обладает свойствами антагониста СТГ и изучается в качестве перспективного средства лечения акромегалии (Trainer et al., 2000).
Помимо полноценного рецептора СТГ были описаны и укороченные его формы. Так называемый СТГ-связывающий белок представляет собой внеклеточный домен рецептора, образующийся путем протеолитического отщепления. В экспериментах СТГ-связывающий белок замедлял клиренс СТГ и усиливал его активность in vitro, однако физиологическая роль этого белка остается неясной. Были также описаны мембраносвязанные фрагменты рецептора СТГ. Их роль не изучена; видимо, они образуются в результате альтернативного сплайсинга и составляют некоторую долю от общего числа рецепторов. Их наличие в культивируемых клетках снижало активность СТГ. Укороченные рецепторы СТГ были обнаружены у членов одной семьи с наследственной низкорослостью и резистентностью к СТГ (Ayling et al., 1997). Тот факт, что эти больные были гетерозиготны по мутантному гену, говорит в пользу доминантно-негативного характера мутации.
Рецептор СТГ не обладает собственной тирозинкиназной активностью, но его димер образует участки связывания с двумя молекулами JAK2 (цитоплазматической тирозинкиназой из семейства Янус-киназ). Сближение двух молекул JAK2 ведет к их взаимному фосфорилированию и активации, с последующим фосфорилированием остатков тирозина в цитоплазматических белках, обеспечивающих дальнейшую передачу сигнала (рис. 56.2). К этим белкам относятся факторы транскрипции STAT, адаптерный белок She (участвующий во внутриклеточной передаче сигнала через белок Ras и митоген-активируемые протеинкиназы), белки 1RS-1 и 1RS-2 (субстраты инсулинового рецептора, активирующие сигнальный путь с участием фосфатидилинозитол-3-киназы).
Усиление липолиза в липоцитах и глюконеогенеза в гепатоцитах происходит за счет прямого воздействия СТГ на клетки, тогда как анаболическое действие СТГ и его влияние на рост опосредуются секрецией ИФР-I и ИФР-II. Ceкреция ИФР-I в большей степени зависит от СТГ; кроме того, в постнатальном периоде ИФР-1 более активен, чем ИФР-II. Поэтому действие СТГ опосредовано главным образом ИФР-I. Источником ИФР-I крови служит в основном печень. ИФР-I, образующийся во многих других тканях, может оказывать паракринное и аутокринное действие на пролиферацию клеток. ИФР-1 связывается с рядом белков плазмы, которые не только участвуют в транспорте, но и могут опосредовать его влияние на клетки. Важная роль ИФР-I в действии СТГ подтверждается тем, что у людей с нарушением функции обоих аллелей гена ИФР-I наблюдается выраженная как внутриутробная, так и постнатальная задержка развития, резистентная к СТГ, но поддающаяся лечению рекомбинантным человеческим ИФР-I (Comacho-Hiibner et al., 1999).
ИФР-I взаимодействует с мембранными рецепторами на поверхности клеток. Рецепторы ИФР-I близки к рецепторам инсулина и представляют собой гетеротетрамеры с собственной тирозинкиназной активностью. Эти рецепторы присутствуют почти во всех тканях и имеют высокое сродство как к ИФР-I, так и к ИФР-II. Инсулин также может активировать рецепторы ИФР-I, но при этом у него сродство к рецептору примерно в 100 раз меньше, чем у ИФР. Рецептор ИФР-II локализуется в основном на внутриклеточных мембранах; это тот же самый рецептор, что и рецептор маннозо-6-фосфата, направляющий кислые гидролазы и другие маннозосодержащие гликопротеиды из аппарата Гольджи в лизосомы. Этот рецептор, видимо, активируется только ИФР-II.
Предупреждение
![]() Анаболические препараты могут применяться только по назначению врача и противопоказаны детям. Представленная информация не призывает к применению или распространению сильнодействующих веществ и нацелена исключительно на снижение риска осложнений и побочных эффектов.
Анаболические препараты могут применяться только по назначению врача и противопоказаны детям. Представленная информация не призывает к применению или распространению сильнодействующих веществ и нацелена исключительно на снижение риска осложнений и побочных эффектов.