Типы химических связей — различия между версиями
Dormiz (обсуждение | вклад) (Новая страница: «{{Шаблон:Наглядная фарма}} == Типы химических связей == Для того чтобы лекарство оказало ле…») |
Dormiz (обсуждение | вклад) (→Читайте также) |
||
| (не показана 1 промежуточная версия этого же участника) | |||
| Строка 11: | Строка 11: | ||
Общее электронное облако не образуется. Связывание обратимо и типично для фармакологических препаратов. Лекарство, как правило, образует в месте действия несколько связей различных типов (некоторые из них описаны далее). | Общее электронное облако не образуется. Связывание обратимо и типично для фармакологических препаратов. Лекарство, как правило, образует в месте действия несколько связей различных типов (некоторые из них описаны далее). | ||
| − | === | + | === Электростатическое притяжение === |
| − | Электростатическое притяжение === | ||
Положительные и отрицательные заряды притягиваются друг к другу. | Положительные и отрицательные заряды притягиваются друг к другу. | ||
| Строка 18: | Строка 17: | ||
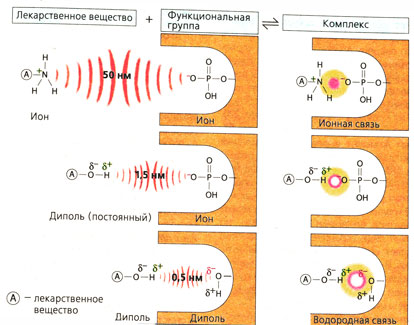
'''Ион-ионное взаимодействие'''. Ион — это частица с положительным (катион) или отрицательным (анион) зарядом, т. е. в простейшем случае в электронном облаке однозарядного иона не хватает одного электрона, чтобы образовался нейтральный атом, или появляется один лишний электрон. Притяжение между частицами с противоположным зарядом действует на большом расстоянии, поэтому лекарства, представляющие собой ионные соединения, легко притягиваются к месту связывания. Ионные связи характеризуются достаточно высокой прочностью среди других типов связей. | '''Ион-ионное взаимодействие'''. Ион — это частица с положительным (катион) или отрицательным (анион) зарядом, т. е. в простейшем случае в электронном облаке однозарядного иона не хватает одного электрона, чтобы образовался нейтральный атом, или появляется один лишний электрон. Притяжение между частицами с противоположным зарядом действует на большом расстоянии, поэтому лекарства, представляющие собой ионные соединения, легко притягиваются к месту связывания. Ионные связи характеризуются достаточно высокой прочностью среди других типов связей. | ||
| − | '''Диполь-ионное взаимодействие'''. Если электроны расположены на разном расстоянии от двух атомов, образующих связь, то на одном атоме локализуется частичный (дробный) отрицательный заряд, а на другом — частичный положительный заряд (8+). Такая молекула полярна, она имеет диполь. Любой заряженный конец молекулы может притягивать противоположно заряженный ион. | + | '''Диполь-ионное взаимодействие'''. Если электроны расположены на разном расстоянии от двух атомов, образующих связь, то на одном атоме локализуется частичный (дробный) отрицательный заряд(5-), а на другом — частичный положительный заряд (8+). Такая молекула полярна, она имеет диполь. Любой заряженный конец молекулы может притягивать противоположно заряженный ион. |
'''Диполь-дипольное взаимодействие''' -это электростатическое притяжение между частицами или частями молекулы, несущими противоположные частичные заряды. Если, например, в молекуле воды атом водорода, несущий частичный положительный заряд, взаимодействует с двумя атомами, несущими частичные отрицательные заряды, то возникает водородная связь. | '''Диполь-дипольное взаимодействие''' -это электростатическое притяжение между частицами или частями молекулы, несущими противоположные частичные заряды. Если, например, в молекуле воды атом водорода, несущий частичный положительный заряд, взаимодействует с двумя атомами, несущими частичные отрицательные заряды, то возникает водородная связь. | ||
| Строка 24: | Строка 23: | ||
=== Вандерваальсово взаимодействие === | === Вандерваальсово взаимодействие === | ||
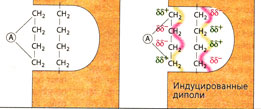
Вандерваальсово взаимодействие возникает между неполярными частями молекул, которые находятся очень близко друг от друга. Спонтанные отклонения от равномерного распределения электронов в одной молекуле (очень слабо выраженные диполи, 85) индуцируют соответствующие (противоположные по знаку заряда) изменения в соседней молекуле. Таким образом, вандерваапьсовы связи также являются формой электростатических взаимодействий в веществе, однако они относятся к слабым силам. | Вандерваальсово взаимодействие возникает между неполярными частями молекул, которые находятся очень близко друг от друга. Спонтанные отклонения от равномерного распределения электронов в одной молекуле (очень слабо выраженные диполи, 85) индуцируют соответствующие (противоположные по знаку заряда) изменения в соседней молекуле. Таким образом, вандерваапьсовы связи также являются формой электростатических взаимодействий в веществе, однако они относятся к слабым силам. | ||
| − | === | + | === Гидрофобное взаимодействие === |
| − | Гидрофобное взаимодействие === | ||
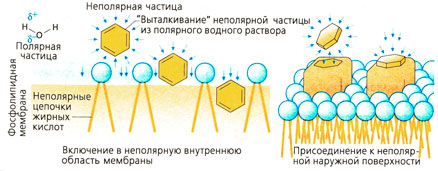
Притяжение между диполями воды настолько сильное, что неполярная, т. е. незаряженная частица практически не может встроиться между ними. Близко расположенные молекулы воды выталкивают неполярную частицу. В организме неполярные частицы расположены в основном в неполярных, не содержащих воду структурах, например, в клеточной мембране между цепочками жирных кислот или же около неполярной области рецептора. | Притяжение между диполями воды настолько сильное, что неполярная, т. е. незаряженная частица практически не может встроиться между ними. Близко расположенные молекулы воды выталкивают неполярную частицу. В организме неполярные частицы расположены в основном в неполярных, не содержащих воду структурах, например, в клеточной мембране между цепочками жирных кислот или же около неполярной области рецептора. | ||
| Строка 35: | Строка 33: | ||
*[[Взаимодействие лекарств с рецепторами]] | *[[Взаимодействие лекарств с рецепторами]] | ||
| − | |||
*[[Агонисты и антагонисты рецепторов]] | *[[Агонисты и антагонисты рецепторов]] | ||
*[[Энантиоселективность лекарственных веществ ]] | *[[Энантиоселективность лекарственных веществ ]] | ||
*[[Виды рецепторов фармакологических препаратов]] | *[[Виды рецепторов фармакологических препаратов]] | ||
Текущая версия на 19:19, 24 октября 2014
Источник: «Наглядная фармакология».
Автор: X. Люльман. Пер. с нем. Изд.: М.: Мир, 2008 г.
Содержание
Типы химических связей[править | править код]
Для того чтобы лекарство оказало лечебный эффект, оно должно обладать способностью вступать во взаимодействие с биологическими структурами организма.
Ковалентная связь[править | править код]
Два атома образуют ковалентную связь, когда каждый из них поставляет хотя бы по одному электрону в общее электронное облако. В структурной формуле химического соединения общая электронная пара обозначается чертой. Ковалентные связи прочные и лишь с трудом поддаются разрыву. Лекарственные вещества очень редко присоединяются с помощью ковалентных связей. Присоединившиеся с помощью таких связей вещества удерживаются в организме длительное время после введения, и лечение невозможно регулировать. Примерами являются алкилирующие цитостатики (с. 308) и органические фосфаты (с. 318). В процессе биотрансформации лекарств метаболиты могут также образовывать ковалентные связи (например, в реакции с глюкуроновой кислотой; с. 38).
Нековалентная связь[править | править код]
Общее электронное облако не образуется. Связывание обратимо и типично для фармакологических препаратов. Лекарство, как правило, образует в месте действия несколько связей различных типов (некоторые из них описаны далее).
Электростатическое притяжение[править | править код]
Положительные и отрицательные заряды притягиваются друг к другу.
Ион-ионное взаимодействие. Ион — это частица с положительным (катион) или отрицательным (анион) зарядом, т. е. в простейшем случае в электронном облаке однозарядного иона не хватает одного электрона, чтобы образовался нейтральный атом, или появляется один лишний электрон. Притяжение между частицами с противоположным зарядом действует на большом расстоянии, поэтому лекарства, представляющие собой ионные соединения, легко притягиваются к месту связывания. Ионные связи характеризуются достаточно высокой прочностью среди других типов связей.
Диполь-ионное взаимодействие. Если электроны расположены на разном расстоянии от двух атомов, образующих связь, то на одном атоме локализуется частичный (дробный) отрицательный заряд(5-), а на другом — частичный положительный заряд (8+). Такая молекула полярна, она имеет диполь. Любой заряженный конец молекулы может притягивать противоположно заряженный ион.
Диполь-дипольное взаимодействие -это электростатическое притяжение между частицами или частями молекулы, несущими противоположные частичные заряды. Если, например, в молекуле воды атом водорода, несущий частичный положительный заряд, взаимодействует с двумя атомами, несущими частичные отрицательные заряды, то возникает водородная связь.
Вандерваальсово взаимодействие[править | править код]
Вандерваальсово взаимодействие возникает между неполярными частями молекул, которые находятся очень близко друг от друга. Спонтанные отклонения от равномерного распределения электронов в одной молекуле (очень слабо выраженные диполи, 85) индуцируют соответствующие (противоположные по знаку заряда) изменения в соседней молекуле. Таким образом, вандерваапьсовы связи также являются формой электростатических взаимодействий в веществе, однако они относятся к слабым силам.
Гидрофобное взаимодействие[править | править код]
Притяжение между диполями воды настолько сильное, что неполярная, т. е. незаряженная частица практически не может встроиться между ними. Близко расположенные молекулы воды выталкивают неполярную частицу. В организме неполярные частицы расположены в основном в неполярных, не содержащих воду структурах, например, в клеточной мембране между цепочками жирных кислот или же около неполярной области рецептора.