Синтез и транспорт тиреоидных гормонов — различия между версиями
Zabava (обсуждение | вклад) (→Транспорт тиреоидных гормонов) |
Zabava (обсуждение | вклад) (→Транспорт тиреоидных гормонов) |
||
| Строка 55: | Строка 55: | ||
Связывание с белками плазмы защищает тиреоидные гормоны от метаболизма и экскреции, увеличивая Т1/2. Свободные гормоны составляют очень небольшую часть от общего количества тиреоидных гормонов — около 0,03% для Т4 и 0,3% для Т3 (Larsen et al., 1981). Из-за разного сродства Т3 и Т4 к белкам концентрации в плазме и Т|/2 этих гормонов отличаются в 10—100 раз. | Связывание с белками плазмы защищает тиреоидные гормоны от метаболизма и экскреции, увеличивая Т1/2. Свободные гормоны составляют очень небольшую часть от общего количества тиреоидных гормонов — около 0,03% для Т4 и 0,3% для Т3 (Larsen et al., 1981). Из-за разного сродства Т3 и Т4 к белкам концентрации в плазме и Т|/2 этих гормонов отличаются в 10—100 раз. | ||
| − | Важно помнить, что метаболической активностью обладают только свободные гормоны (Mendel, 1989). Поскольку тиреоидные гормоны в значительной мере связаны с белками плазмы, изменение концентрации этих белков или изменение сродства гормонов к белкам плазмы может очень сильно влиять на общий уровень тиреоидных гормонов в плазме. Связывание тиреоидных гормонов может значительно меняться при приеме ряда препаратов, некоторых патологических и физиологических состояниях. Например, прием эстрогенов или повышение их уровня при беременности может увеличивать как связывание тиреоидных гормонов с белками плазмы, так и количество этих белков (табл. 57.2). Однако гипофиз, регулируя уровни свободных гормонов, сводит изменения их концентраций к минимуму. О функции щитовидной железы трудно судить лишь по общему уровню Т3 и Т4 Принципы оценки функции щитовидной железы рассматриваются ниже. | + | Важно помнить, что метаболической активностью обладают только свободные гормоны (Mendel, 1989). Поскольку тиреоидные гормоны в значительной мере связаны с белками плазмы, изменение концентрации этих белков или изменение сродства гормонов к белкам плазмы может очень сильно влиять на общий уровень тиреоидных гормонов в плазме. Связывание тиреоидных гормонов может значительно меняться при приеме ряда препаратов, некоторых патологических и физиологических состояниях. Например, прием эстрогенов или повышение их уровня при беременности может увеличивать как связывание тиреоидных гормонов с белками плазмы, так и количество этих белков (табл. 57.2)[[Image:Gmt57_2.jpg|250px|thumb|right|Таблица 57.2. факторы, влияющие на связывание Т4 с тироксинсвязывающим глобулином.]]. Однако гипофиз, регулируя уровни свободных гормонов, сводит изменения их концентраций к минимуму. О функции щитовидной железы трудно судить лишь по общему уровню Т3 и Т4 Принципы оценки функции щитовидной железы рассматриваются ниже. |
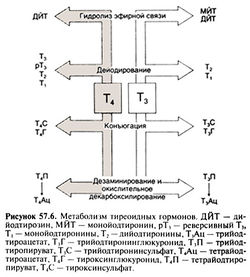
| − | === Элиминация тиреоидных гормонов === | + | === Элиминация тиреоидных гормонов ===[[Image:Gm57_6.jpg|250px|thumb|right|Рисунок 57.6. Метаболизм тиреоидных гормонов.]] |
Т4 элиминируется медленно, его Т|/2 составляет 6—8 сут. При тиреотоксикозе Т1/2 сокращается до 3—4 сут, а при гипотиреозе возрастает до 9—10 сут. Это обусловлено, видимо, изменением скорости метаболизма гормонов. При увеличении связывания Т4 с тироксинсвязывающим глобулином, например при беременности, элиминация гормона замедляется. При этом концентрация тироксин-связывающего глобулина возрастает за счет того, что под действием эстрогенов в нем повышается содержание сиаловых кислот, замедляющих его распад (Ain et al., 1987). При снижении связывания Т4 с белками элиминация гормона ускоряется. Так происходит, например, под действием ряда лекарственных средств (табл. 57.2). Т3 имеет меньшее сродство к белкам, поэтому его Т)/2 составляет всего около 1 сут. | Т4 элиминируется медленно, его Т|/2 составляет 6—8 сут. При тиреотоксикозе Т1/2 сокращается до 3—4 сут, а при гипотиреозе возрастает до 9—10 сут. Это обусловлено, видимо, изменением скорости метаболизма гормонов. При увеличении связывания Т4 с тироксинсвязывающим глобулином, например при беременности, элиминация гормона замедляется. При этом концентрация тироксин-связывающего глобулина возрастает за счет того, что под действием эстрогенов в нем повышается содержание сиаловых кислот, замедляющих его распад (Ain et al., 1987). При снижении связывания Т4 с белками элиминация гормона ускоряется. Так происходит, например, под действием ряда лекарственных средств (табл. 57.2). Т3 имеет меньшее сродство к белкам, поэтому его Т)/2 составляет всего около 1 сут. | ||
| Строка 63: | Строка 63: | ||
Кроме дейодирования, остальные реакции метаболизма тиреоидных гормонов протекают в основном в печени. Т4 и Т3 связываются в печени с глюкуроновой кислотой или сульфатом через гидроксильную группу внешнего кольца и выводятся с желчью. Тиреоидные гормоны участвуют в кишечно-печеночном кругообороте — в кишечнике конъюгированные гормоны гидролизуются и вновь всасываются. Часть конъюгированных гормонов достигает толстой кишки, после гидролиза они выделяются с калом в свободном виде. | Кроме дейодирования, остальные реакции метаболизма тиреоидных гормонов протекают в основном в печени. Т4 и Т3 связываются в печени с глюкуроновой кислотой или сульфатом через гидроксильную группу внешнего кольца и выводятся с желчью. Тиреоидные гормоны участвуют в кишечно-печеночном кругообороте — в кишечнике конъюгированные гормоны гидролизуются и вновь всасываются. Часть конъюгированных гормонов достигает толстой кишки, после гидролиза они выделяются с калом в свободном виде. | ||
| − | + | Как уже говорилось выше, основной путь метаболизма Т4 — дейодирование с образованием Т3 или реверсивного Т3. При дейодировании Т, и реверсивного Т3 образуются три разных дийодтиронина, которые дейодируются до двух монойодтиронинов (рис. 57.4) — неактивных метаболитов, которые в норме присутствуют в плазме. Помимо йодтиронинов в плазме содержатся моно- и дийодтирозин, образующиеся при гидролизе эфирной связи, связывающей два ароматических кольца. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | Как уже говорилось выше, основной путь метаболизма Т4 — дейодирование с образованием Т3 или реверсивного Т3. При дейодировании Т, и реверсивного Т3 образуются три разных дийодтиронина, которые дейодируются до двух монойодтиронинов (рис. 57.4) | ||
=== Регуляция функции щитовидной железы === | === Регуляция функции щитовидной железы === | ||
Еще в XIX веке было замечено, что при эндемическом зобе или после тиреоэктомии изменяется клеточное строение аденогипофиза. Классические эксперименты Кушинга (Cushing, 1912) и клинические наблюдения Симмондса (Simmonds, 1914) показали, что разрушение или заболевания гипофиза приводят к гипоплазии щитовидной железы. В конце концов было установлено, что тиреотропные клетки аденогипофиза секретируют ТТГ — гликопротеид, состоящий из двух субъединиц (а и р) и близкий по строению к гонадотропным гормонам. Структура ТТГ и других гликопротеидных гормонов обсуждается в гл. 56. Влияние тиреоидных гормонов или их отсутствия на клеточное строение аденогипофиза было известно давно, однако представление о регуляции секреции ТТГ тирео-идными гормонами по принципу отрицательной обратной связи сформировалосьтолько в начале 1940-х гг., когда стала понятна ведущая роль этого механизма в патогенезе зоба. ТТГ секретируется импульсно, интенсивность его секреции меняется в течение суток, достигая максимума в ночные часы во время сна. Секреция ТТГ точно регулируется гипоталамическим гормоном тиро-либерином и уровнем свободных тиреоидных гормонов в крови. Тиреоидные гормоны снижают секрецию ТТГ за счет подавления экспрессии генов как тиролиберина (WilberandXu, 1998),такиТТГ(Samuelsetal., 1988). Введение экзогенных тиреоидных гормонов приводит к угнетению функции и атрофии щитовидной железы. Снижение секреции тиреоидных гормонов вызывает компенсаторное повышение секреции ТТГ. Помимо прямого влияния на секрецию ТТГ тиреоидные гормоны снижают секрецию тиролиберина гипоталамусом и плотность рецепторов тиролиберина на тиреотропных клетках аденогипофиза. | Еще в XIX веке было замечено, что при эндемическом зобе или после тиреоэктомии изменяется клеточное строение аденогипофиза. Классические эксперименты Кушинга (Cushing, 1912) и клинические наблюдения Симмондса (Simmonds, 1914) показали, что разрушение или заболевания гипофиза приводят к гипоплазии щитовидной железы. В конце концов было установлено, что тиреотропные клетки аденогипофиза секретируют ТТГ — гликопротеид, состоящий из двух субъединиц (а и р) и близкий по строению к гонадотропным гормонам. Структура ТТГ и других гликопротеидных гормонов обсуждается в гл. 56. Влияние тиреоидных гормонов или их отсутствия на клеточное строение аденогипофиза было известно давно, однако представление о регуляции секреции ТТГ тирео-идными гормонами по принципу отрицательной обратной связи сформировалосьтолько в начале 1940-х гг., когда стала понятна ведущая роль этого механизма в патогенезе зоба. ТТГ секретируется импульсно, интенсивность его секреции меняется в течение суток, достигая максимума в ночные часы во время сна. Секреция ТТГ точно регулируется гипоталамическим гормоном тиро-либерином и уровнем свободных тиреоидных гормонов в крови. Тиреоидные гормоны снижают секрецию ТТГ за счет подавления экспрессии генов как тиролиберина (WilberandXu, 1998),такиТТГ(Samuelsetal., 1988). Введение экзогенных тиреоидных гормонов приводит к угнетению функции и атрофии щитовидной железы. Снижение секреции тиреоидных гормонов вызывает компенсаторное повышение секреции ТТГ. Помимо прямого влияния на секрецию ТТГ тиреоидные гормоны снижают секрецию тиролиберина гипоталамусом и плотность рецепторов тиролиберина на тиреотропных клетках аденогипофиза. | ||
| − | |||
| − | |||
==== Тиролиберин ==== | ==== Тиролиберин ==== | ||
Версия 17:31, 5 августа 2013
Синтез и транспорт тиреоидных гормонов
Процесс синтеза тиреоидных гормонов достаточно сложен и кажется крайне неэффективным. Тиреоидные гормоны синтезируются и хранятся в виде аминокислотных остатков в составе тиреоглобулина — белка, составляющего основу коллоида фолликулов щитовидной железы. Запасание гормонов в таких количествах свойственно только щитовидной железе, причем внеклеточно расположенный тиреоглобулин может составлять значительную ее часть. Тиреоглобулин состоит из двух, видимо одинаковых, субъединиц с молекулярной массой около 330 ООО каждая. Клонирование гена тиреоглобулина показало, что последний относится к тому же семейству сериновых гидролаз, что и, в частности, АХЭ (гл. 8).
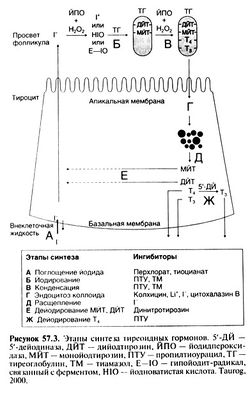
Синтез, хранение, секрецию и взаимопревращение тиреоидных гормонов можно разделить на 5 этапов: 1) поглощение йодида щитовидной железой, 2) окисление йодида и йодирование тирозиновых остатков тиреоглобулина, 3) конденсация остатков йодтирозина с образованием йодтиронинов, 4) расщепление тиреоглобулина и высвобождение в кровь Т4 и Т3, 5) превращение Т4 в Т3 как в щитовидной железе, так и в периферических тканях. Этот процесс схематически показан на рис. 57.3.
Поглощение йодида
Йод, поступающий с пищей, попадает в кровь в виде йодида. Обычно концентрация йодида в крови очень мала (0,2—0,4 мкг%, или 15—30 нмоль/л), но щитовидная железа активно захватывает его с помощью специфического мембранного белка — переносчика Na+-I" (Eskandari et al., 1997; Dai et al., 1996; Smanik et al., 1996). В результате концентрация йодида в тироцитах в 20—50 раз выше, чем в плазме, а при стимуляции железы — даже в 100 раз. Многие ионы, в частности тиоцианат и перхлорат, нарушают котранспорт Na+ и Г (рис. 57.3). ТТГ стимулирует перенос йодида. Кроме того, этот механизм подвержен саморегуляции: низкие запасы йода в железе увеличивают его захват, а введение йодида оказывает противоположное действие.
Нарушение дальнейшего метаболизма йодида антитиреоидными средствами дает возможность лучше изучить активное накопление йодида. Так, котранспорт Na+ и Г был выявлен помимо щитовидной железы и во многих других тканях: в слюнных железах, слизистой желудка, средней части тонкой кишки, сосудистых сплетениях желудочков мозга, коже, молочных железах и, возможно, в плаценте; во всех этих тканях внутриклеточная концентрация йодида выше, чем в плазме (Carrasco, 2000). Предполагается, что накопление йодида плацентой и молочной железой необходимо для обеспечения йодом плода и новорожденного. Зачем йодид накапливается в других тканях, не ясно. Таким образом, котранспорт Na+ и I не специфичен для щитовидной железы, и его наличие не объясняет, почему именно там происходит синтез тиреоидных гормонов.
Окисление и йодирование
Йодирование тирозина — частный случай галогенирования ароматического кольца, поэтому для этой реакции необходимы радикалы йода более высоких степеней окисления, чем йодид. Природа этих радикалов в течение многих лет была не известна. В 1984 г. было убедительно показано, что данную функцию выполняет гипойодит, входящий в состав йодноватистой кислоты или связанный с ферментом (Magnusson et al., 1984).
Окисление йодида до его активной формы катализируется гемсодержащим ферментом йодидпероксидазой, использующей перекись водорода в качестве окислителя (Taurog, 2000; Magnusson etal., 1987). Молекулярное клонирование позволило выяснить структуру йодидперок-сидазы человека, причем оказалось, что именно к ней вырабатываются аутоантитела при аутоиммунном поражении щитовидной железы (McLachlan and Rapoport, 1992). Йодидпероксидаза связана с мембраной и располагается в основном в апикальной части тироцитов. Она йодирует остатки тирозина (с образованием монойодти-розина и дийодтирозина) в молекуле тиреоглобулина непосредственно перед поступлением последнего в просвет фолликула. Считается, что перекись водорода образуется в непосредственной близости к месту использования; при этом происходит окисление НАДФН. Возможно, ТТГ стимулирует йодирование тиреоглобулина именно за счет увеличения продукции перекиси водорода. В пользу этой гипотезы свидетельствует то, что ТТГ увеличивает синтез ИФ3 и повышает внутриклеточную концентрацию кальция в тироцитах (Corda et al., 1985; Field et al., 1987; Laurent et al., 1987), а продукция перекиси водорода при увеличении внутриклеточной концентрации кальция усиливается (Takasu et al., 1987).
Образование Т4 и Т, из йодтирозинов
Следующий этап синтеза тиреоидных гормонов — это конденсация двух дийодтирозинов с образованием Т4 или конденсация дийодтирозина и монойодтирозина с образованием Т3. Эти окислительные реакции протекают, по-видимому, с участием той же йодидпероксидазы. При этом происходит перенос групп внутри тиреоглобулина; возможно, переносимой группой является йодтирозил в виде свободного радикала или положительно заряженного иона. Субстратом йодидпероксидазы могут быть и другие белки. но образование Т4 наиболее эффективно происходит из тиреоглобулина. Эго свидетельствует о важности пространственной структуры белка-субстрата для протекания реакции конденсации. Т4 образуется в основном в N-концевой области тиреоглобулина, тогда как Т3 — в С-конце вой области (Dunn et al., 1987). Относительная вкорость синтеза на разных концах молекулы тиреогло-[булина зависит от уровня ТТГ и количества доступного йодида. При низком уровне йодида образуется больше монойодтирозина, а значит, и Т3. Так. в экспериментах на крысах соотношение Т4 к Т, при недостатке йода пада-лос4:1 до l:3(Greeret al., 1968). ПосколькуТ3 по сравнению с Т4 обладает в 5 раз большей активностью, но содержит при этом на четверть меньше йода, умеренный недостаток последнего не сказывается значительно на обшей активности секретируемых тиреоидных гормонов. Хотя при дефиците йода образование монойодтирозина способствует повышению продукции Т3, в конце концов недостаток дийодтирозина может привести к нарушению синтеза обоих гормонов. Т3 в шитовидной железе образуется не только путем конденсации йодтирозинов, но и за счет дейодирования Т4 в положении 5' (Chanoine et al., 1993).
Секреция тиреоидных гормонов
Поскольку Т4 и Щ3 образуются и запасаются в составе тиреоглобулина, то про-теопиз — важная часть секреции этих гормонов. Для этого тиреоглобулин из просвета фолликула поглощается путем эндоцитоза апикальной поверхностью тироцитов. Поглощенный тиреоглобулин имеет вид мелких внутриклеточных капелек коллоида, которые впоследствии сливаются с лизосомами, содержащими протеазы. Считается, что гормоны высвобождаются только после полного распада тиреоглобулина на составляющие его аминокислоты. Это кажется весьма неэкономным, поскольку тиреоглобулин имеет молекулярную массу около 660 ООО, содержит приблизительно 300 углеводных и 5500 аминокислотных остатков, а при его разрушении высвобождается всего от двух до пяти молекул гормона. ТТГ, видимо, усиливает распад тиреоглобулина за счет активации некоторых лизосомальных цистеиновых эндопептидаз (Dunn and Dunn, 1988). Эндопептидазы избирательно расщепляют тиреоглобулин на несколько фрагментов, которые подвергаются действию экзопептидаз (Dunn and Dunn, 2000). Высвобождающиеся гормоны покидают клетку через базальную мембрану. При расщеплении тиреоглобулина образуется также некоторое количество моно- и дийодтирозина, но они обычно не покидают пределов железы, а метаболизируются здесь же, освобождая Йодид. В норме этот йодид опять полностью включается в белок, однако при выраженной активации протеолиза под действием ТТГ некоторая часть йодида попадает в кровоток вместе с минимальным количеством йодтирозинов.
Превращение Т4 в Т3 в периферических тканях
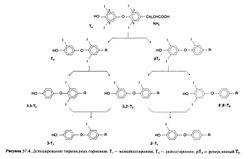
В норме образуется 70—90 мкг/сут Т4 и 15—30 мкг/сут Т}. Хотя часть Т, секретируется щитовидной железой, более 80% Т, крови образуется в результате дейодирования Т4 в периферических тканях (рис. 57.4)
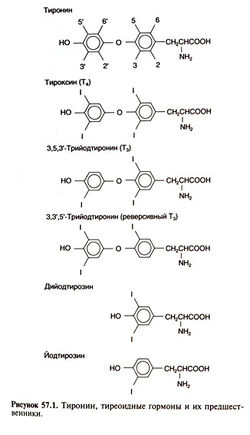
. В процессе дейодирования от Т4 отщепляется атом йода, находившийся в положении 5' внешнего кольца, при этом образуется более активный Т3. Вне щитовидной железы дейодирование происходит главным образом в печени. При лечении гипотиреоза левотироксином вдозах, необходимых для достижения нормального уровня Т4, уровень Т3 в плазме также нормализуется (Braverman etal., 1970). В большинство периферических тканей Т3 поступает из крови. Важным исключением является головной мозг, в частности гипоталамус, где Т3 в основном образуется на месте. При дейодировании Т4 в положении 5 образуется метаболически неактивный реверсивный Т3 (3,3',5'-трийодтиро-нин, рис. 57.1)
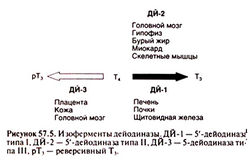
. В норме около 41% Т4 превращается в Т3, около 38% — в реверсивный Т3, а оставшиеся 21% мета-болизируются иначе, например конъюгируются в печени и выводятся с желчью. В норме концентрация Т4 в плазме составляет 4,5— 11 мкг%, а Т3 — примерно в 100 раз меньше (60—180 нг%). Превращение Т4 в Т3 осуществляет фермент 5'-дейодиназа. Существует два ее изофермента, экспрессирующихся в разных тканях и имеющих разные механизмы регуляции (рис. 57.5; Leonard and Visser, 1986). Так, 5'-дейодиназа типа I присутствует в печени, почках и щитовидной железе; с ее помощью образуется Т3 крови, используемый большинством периферических тканей. Помимо дейодирования в положении 5' 5'-дейодиназа типа 1 может осуществлять, хотя и в меньшей степени, дейодирование в положении 5. Активность этого фермента снижается под действием многих факторов (табл. 57.1), в том числе анти-тиреоидного препарата пропилтиоураципа. Снижение уровня Т3 в плазме при заболеваниях, не связанных с поражением щитовидной железы, вызвано ингибированием 5'-дейодиназы типа I (Farwell, 1999) и сниженным поступлением Т4 в клетки. При тиреотоксикозе активность 5'-дейодиназы типа I повышена, а при гипотиреозе — снижена. Молекулярное клонирование показало, что 5'-дейодиназа типа I представляет собой селенсодержащий белок с селеноцистином в активном центре (Berry et al., 1991; Berry and Larsen, 1992). Другой изофермент, 5'-дейодиназа типа II, присутствует в головном мозге, гипофизе, скелетных мышцах и миокарде, а у крыс еще и в буром жире. Она обеспечивает внутриклеточное образование Т3 в этих тканях (Visser et al., 1982; Bartha et al., 2000). Сродство 5'-дейодиназы типа II к субстрату на несколько порядков выше, чем у 5'-дейодиназы типа i (соответствующие константы Михаэлиса находятся в области наномолярных и микромолярных концентраций). Кроме того, пропилтиоурацил не ингибирует 5'-дейодиназу типа II. Ее активность зависит от уровня Т4: при гипотиреозе активность фермента возрастает, а при тиреотоксикозе — снижается (Leonard etal., 1981; Leonard and Koehrle, 2000). За счет этого регулируется выработка Т3 в головном мозге и гипофизе. Был клонирован ген 5'-дейодиназы типа II из кожи лягушки (Davey et al., 1995) и тканей млекопитающих (Croteau et al., 1996; Salvatore et al., 1996). Исследования показали что 5'-дейодиназа типа II относится к селенсодержащим белкам (St. Germain and Galton, 1997), хотя некоторые авторы высказывали сомнения в этом (Leonard et al., 1999; Leonard et al., 2000).
Факторы, снижающие активность 5'-дейодиназы типа I
- Тяжелые заболевания
- Низкокалорийное питание (особенно бедное углеводами)
- Истощение
- Глюкокортикоиды
- Бета-адреноблокаторы (например, высокие дозы пропранолола)
- Йодсодержашие рентгеноконтрастные вещества (например, иопановая кислота и натриевая соль иоподовой кислоты)
- Амиодарон
- Пропилтиоурацил
- Жирные кислоты
- Внутриутробный период и период новорожденности
- Дефицит селена
Кроме 5'-дейодиназ существует 5-дейодиназа (тип III), которая отщепляет йод от внутреннего кольца Т4. Это основной фермент, инактивирующий Т3. Он присутствует в плаценте, коже и головном мозге. Клонирование гена 5-дейодиназы показало, что так же, как и 5'-дейодиназа типа I, она относится к селенсодержащим белкам (Croteau et al., 1995).
Транспорт тиреоидных гормонов
Йод присутствует в крови в нескольких формах: 95% йода входит в состав органических соединений, а 5% представлено йодидом. Из йода органических соединений 90—95% входит в состав Т4 и лишь 5% — в состав Т3. Тиреоидные гормоны прочно, но не ковалентно связываются с особыми белками плазмы.
Тироксинсвязывающий глобулин — основной переносчик тиреоидных гормонов. Это кислый гликопротеид с молекулярной массой около 63 000. Одна молекула тироксинсвязывающего глобулина связывает одну молекулу Т3 или Т4; при этом Т4 связывается очень прочно (константа ассоциации, КА, около Ю10 л/моль), а Т3 — намного слабее. Другой переносчик — транстиретин, или тироксинсвязывающий преальбумин, — связывает только Т4. Концентрация транстиретина в крови выше, чем концентрация тироксинсвязывающего глобулина. Транстиретин связывает Т4 с КА около 107 л/моль. Транстиретин состоит из четырех, по-видимому одинаковых, субъединиц, но при этом имеет только один участок связывания Т4. При насыщении упомянутых переносчиков Т4 может связываться с альбумином, хотя и с меньшим сродством. Количественно это связывание оценить трудно, как и его физиологическое значение. Однако при увеличении сродства альбумина к Т4 (Ruiz et al., 1982) в результате точечной мутации гена альбумина (Tang et al., 1999; Sunthomt-hepvarakul et al., 1994) возникает синдром семейной дисальбуминемической гипертироксинемии, наследуемый по аутосомно-доминантному типу. Т4 связывается также с апопротеинами ЛПВП2 и ЛПВП3, но значение этого пока не выяснено (Benevenga et al., 1992).
Связывание с белками плазмы защищает тиреоидные гормоны от метаболизма и экскреции, увеличивая Т1/2. Свободные гормоны составляют очень небольшую часть от общего количества тиреоидных гормонов — около 0,03% для Т4 и 0,3% для Т3 (Larsen et al., 1981). Из-за разного сродства Т3 и Т4 к белкам концентрации в плазме и Т|/2 этих гормонов отличаются в 10—100 раз.
Важно помнить, что метаболической активностью обладают только свободные гормоны (Mendel, 1989). Поскольку тиреоидные гормоны в значительной мере связаны с белками плазмы, изменение концентрации этих белков или изменение сродства гормонов к белкам плазмы может очень сильно влиять на общий уровень тиреоидных гормонов в плазме. Связывание тиреоидных гормонов может значительно меняться при приеме ряда препаратов, некоторых патологических и физиологических состояниях. Например, прием эстрогенов или повышение их уровня при беременности может увеличивать как связывание тиреоидных гормонов с белками плазмы, так и количество этих белков (табл. 57.2)
. Однако гипофиз, регулируя уровни свободных гормонов, сводит изменения их концентраций к минимуму. О функции щитовидной железы трудно судить лишь по общему уровню Т3 и Т4 Принципы оценки функции щитовидной железы рассматриваются ниже. === Элиминация тиреоидных гормонов ===
Т4 элиминируется медленно, его Т|/2 составляет 6—8 сут. При тиреотоксикозе Т1/2 сокращается до 3—4 сут, а при гипотиреозе возрастает до 9—10 сут. Это обусловлено, видимо, изменением скорости метаболизма гормонов. При увеличении связывания Т4 с тироксинсвязывающим глобулином, например при беременности, элиминация гормона замедляется. При этом концентрация тироксин-связывающего глобулина возрастает за счет того, что под действием эстрогенов в нем повышается содержание сиаловых кислот, замедляющих его распад (Ain et al., 1987). При снижении связывания Т4 с белками элиминация гормона ускоряется. Так происходит, например, под действием ряда лекарственных средств (табл. 57.2). Т3 имеет меньшее сродство к белкам, поэтому его Т)/2 составляет всего около 1 сут.
Кроме дейодирования, остальные реакции метаболизма тиреоидных гормонов протекают в основном в печени. Т4 и Т3 связываются в печени с глюкуроновой кислотой или сульфатом через гидроксильную группу внешнего кольца и выводятся с желчью. Тиреоидные гормоны участвуют в кишечно-печеночном кругообороте — в кишечнике конъюгированные гормоны гидролизуются и вновь всасываются. Часть конъюгированных гормонов достигает толстой кишки, после гидролиза они выделяются с калом в свободном виде.
Как уже говорилось выше, основной путь метаболизма Т4 — дейодирование с образованием Т3 или реверсивного Т3. При дейодировании Т, и реверсивного Т3 образуются три разных дийодтиронина, которые дейодируются до двух монойодтиронинов (рис. 57.4) — неактивных метаболитов, которые в норме присутствуют в плазме. Помимо йодтиронинов в плазме содержатся моно- и дийодтирозин, образующиеся при гидролизе эфирной связи, связывающей два ароматических кольца.
Регуляция функции щитовидной железы
Еще в XIX веке было замечено, что при эндемическом зобе или после тиреоэктомии изменяется клеточное строение аденогипофиза. Классические эксперименты Кушинга (Cushing, 1912) и клинические наблюдения Симмондса (Simmonds, 1914) показали, что разрушение или заболевания гипофиза приводят к гипоплазии щитовидной железы. В конце концов было установлено, что тиреотропные клетки аденогипофиза секретируют ТТГ — гликопротеид, состоящий из двух субъединиц (а и р) и близкий по строению к гонадотропным гормонам. Структура ТТГ и других гликопротеидных гормонов обсуждается в гл. 56. Влияние тиреоидных гормонов или их отсутствия на клеточное строение аденогипофиза было известно давно, однако представление о регуляции секреции ТТГ тирео-идными гормонами по принципу отрицательной обратной связи сформировалосьтолько в начале 1940-х гг., когда стала понятна ведущая роль этого механизма в патогенезе зоба. ТТГ секретируется импульсно, интенсивность его секреции меняется в течение суток, достигая максимума в ночные часы во время сна. Секреция ТТГ точно регулируется гипоталамическим гормоном тиро-либерином и уровнем свободных тиреоидных гормонов в крови. Тиреоидные гормоны снижают секрецию ТТГ за счет подавления экспрессии генов как тиролиберина (WilberandXu, 1998),такиТТГ(Samuelsetal., 1988). Введение экзогенных тиреоидных гормонов приводит к угнетению функции и атрофии щитовидной железы. Снижение секреции тиреоидных гормонов вызывает компенсаторное повышение секреции ТТГ. Помимо прямого влияния на секрецию ТТГ тиреоидные гормоны снижают секрецию тиролиберина гипоталамусом и плотность рецепторов тиролиберина на тиреотропных клетках аденогипофиза.
Тиролиберин
Тиролиберин стимулирует как синтез а- и β-субъединиц ТТГ, так и высвобождение ранее синтезированного ТТГ из секреторных гранул. Соматостатин, дофамин и экзогенные глюкокортикоиды подавляют секрецию ТТГ, стимулированную тиролиберином.
Тиролиберин представляет собой трипептид L-пирог-лутамил-Ь-гистидил-Ь-пролинамид, в котором обе концевые группы (карбоксильная и аминогруппа) модифицированы. Он образуется из предшественника, который содержит шесть копий прогормона, ограниченных с каждой стороны парами диаминомонокарбоновых аминокислот. Тиролиберин синтезируется в гипоталамусе и через воротную систему гипофиза достигает тиреотропных клеток. Рецепторы тиролиберина относятся к рецепторам, сопряженным с G-белками. При их активации стимулируется гидролиз ФИФ2 и активируется про-теинкиназа С (Gershengom, 1986). Конечным результатом стимуляции рецепторов является усиление синтеза и секреции ТТГ.
Тиролиберин синтезируется также в других областях ЦНС: в коре головного мозга, в структурах, прилегающих к желудочкам мозга, нейрогипофизе, шишковидном теле, спинном мозге. Учитывая, что тиролиберин при этом локализуется в нервных окончаниях, можно предположить, что за пределами гипоталамуса он служит медиатором или нейромодулятором. При введении животным тиролиберин оказывает опосредованное ЦНС влияние на поведение, терморегуляцию, вегетативную нервную систему и сердечно-сосудистую систему, в том числе увеличивает АД и ЧСС. Помимо ЦНС тиролиберин был обнаружен в островковых клетках поджелудочной железы, сердце, яичках и некоторых отделах ЖКТ. Однако его функция в этих органах не известна. Есть данные об эффективности интратекального и в/в введения тиролиберина при депрессиях, не поддающихся обычному лечению (Callahan etal., 1997; Marangelletal., 1997).
Действие ТТГ на щитовидную железу
При введении ТТГ животным сперва наблюдается усиление секреции тиреоидных гормонов, которое заметно уже через несколько минут. В последующем стимулируются все стадии синтеза и секреции: захват и окисление йодида, йодирование тирозина и синтез йодтиронинов, эндоцитоз и про-теолиз тиреоглобулина. Увеличивается васкуляризация железы, отмечается гипертрофия и гиперплазия эпителия фолликулов. Все эти изменения опосредованы рецептором ТТГ на мембране тироцитов.
Рецептор ТТГ относится к рецепторам, сопряженным с G-белками, он близок по структуре к рецепторам ЛГ и ФСГ (гл. 56; Parmentier et al., 1989; Vassart and Dumont, 1992; Nagayama and Rapoport, 1992). Наиболее важные участки этих рецепторов имеют сходную аминокислотную последовательность. Кроме того, все рецепторы содержат крупные внеклеточные домены, взаимодействующие с гормонами.
При связывании ТТГ с рецептором происходит активация аденилатциклазы и возрастает уровень внутриклеточного цАМФ. Более высокие концентрации ТТГактивируют фосфолипазу С, в результате чего усиливается гидролиз ФИФ2, возрастает внутриклеточная концентрация кальция и активируется протеинкиназа С (Manley et al., 1988; Van Sande et al., 1990). У человека в реализации эффектов ТТГ, видимо, участвуют и аденилатцикла-за, и фосфолипаза С, тогда как у других видов все эффекты, возможно, опосредованы только аденилатциклазой (Vassart and Dumont, 1992).
Описано большое число мутаций гена рецептора ТТГ, нарушающих функцию щитовидной железы (Tonacchera et al., 1996b). Как новые, так и унаследованные мутации этого гена могут приводить к врожденному тиреотоксикозу и гиперплазии щитовидной железы (Корр et al., 1995; Tonacchera et al., 1996a). Соматические мутации гена рецептора ТТГ могут лежать в основе токсических аденом щитовидной железы (Paschke et al., 1994b). Наконец, мутации этого гена могут вызывать резистентность к ТТГ (Sunthomthepvarakui et al., 1995), хотя этот синдром был описан и в семьях, где не было обнаружено дефектов ни самого ТТГ, ни его рецептора (Xie et al., 1997).
Потребление йода и функция щитовидной железы
Понятно, что для синтеза тиреоидных гормонов необходимо поступление достаточных количеств йода; если йода не хватает, синтез тиреоидных гормонов снижается, в ответ возрастает секреция ТТГ, и происходит гиперплазия щитовидной железы. У величение размеров и активности щитовидной железы ведет к более эффективному извлечению йодида из крови. Трансмембранный градиент йодида в тироцитах может возрастать в десять раз по сравнению с нормой, что обеспечивает синтез достаточного количества гормонов при легком и умеренном дефиците йода. Однако при более тяжелом дефиците у взрослых развивается гипотиреоз, а у детей — кретинизм.
В некоторых районах земного шара из-за недостатка йода распространен нетоксический зоб (Delange et al.,1993). Обширные территории с недостатком йода в воде и пище находятся в Центральной и Южной Америке, Африке, Европе, на Дальнем Востоке и в Китае. Суточная потребность в йоде составляет 1—2 мкг/кг. В США норма суточной потребности составляет 40—120 мкг для детей и 150 мкг для взрослых; при беременности и лактации эта величина выше на 25 и 50 мкг соответственно (табл. XIII.1). В овощах, мясе и птице содержание йода минимально, а в рыбе и молочных продуктах его довольно много (табл. 57.3; Braverman, 1997). Обычно питьевая вода йода почти не содержит.
Йод используется для лечения нетоксического зоба уже более 150 лет. Однако широко применяться йод стал после успешного опыта профилактики нетоксического зоба у школьников г. Акрон, шт. Огайо (Marine and Kimball, 1917). С тех пор такую профилактику стали использовать в эндемичных по зобу районах во всем мире.
Наиболее простой метод широкомасштабной профилактики дефицита йода—добавление йодида или йодата в поваренную соль; в настоящее время предпочтение отдают именно йодату. В некоторых странах по закону йодируется вся соль; в других, в том числе в США, йодированная соль продается наравне с обычной. В США йодированная соль содержит 100 мкг йода на 1 гсоли. В целом население США потребляет достаточное количество йода, однако за последние 20 лет потребление йода заметно снизилось (Hollowell et al., 1998). Помимо йодирования соли для широкомасштабной профилактики назначают йодированное масло внутрь или в/м (Elnagar et al., 1995), а также йодируют питьевую воду, системы орошения (Сао et al., 1994b) и животные корма.