N-холинорецепторы — различия между версиями
Febor (обсуждение | вклад) |
Zabava (обсуждение | вклад) (→Строение N-холинорецепторов) |
||
| Строка 9: | Строка 9: | ||
=== Строение N-холинорецепторов === | === Строение N-холинорецепторов === | ||
| + | [[Image:Gud_9_1.jpg|300px|thumb|right|Рисунок 9.1. Строение N-холинорецептора. ]] | ||
| − | N-холинорецепторы электрических органов и скелетных мышц представляют собой пентамерные структуры, образованные четырьмя типами субъединиц ( | + | N-холинорецепторы электрических органов и скелетных мышц представляют собой пентамерные структуры, образованные четырьмя типами субъединиц (α; β; γ либо ε; δ) в соотношении α<sub>2</sub>βγδ (в эмбриональных или денервированных мышцах) или α<sub>2</sub>βεδ (в иннервированных мышцах взрослых особей). Степень гомологии аминокислотных последовательностей между разными типами субъединиц достигает 40%, что позволяет предположить их общее происхождение (Numa etal., 1983). |
N-холинорецепторы стали классической моделью для изучения ионотропных рецепторов (хемочувствительных каналов, рецепторов-каналов). К этой группе принадлежат также рецепторы тормозных аминокислотных медиаторов (ГАМК и глицина), 5-НТ3-рецепторы и некоторые другие. Все они представляют собой пентамеры, состоящие из гомологичных субъединиц с молекулярной массой порядка 40 000—60 000 каждая. Внеклеточные домены каждой субъединицы состоят из 210 N-конце-вых аминокислот. Затем следуют 4 трансмембранных домена, причем на участок между 3-м и 4-м доменами приходится почти вся внутриклеточная часть субъединицы (рис. 9.1). | N-холинорецепторы стали классической моделью для изучения ионотропных рецепторов (хемочувствительных каналов, рецепторов-каналов). К этой группе принадлежат также рецепторы тормозных аминокислотных медиаторов (ГАМК и глицина), 5-НТ3-рецепторы и некоторые другие. Все они представляют собой пентамеры, состоящие из гомологичных субъединиц с молекулярной массой порядка 40 000—60 000 каждая. Внеклеточные домены каждой субъединицы состоят из 210 N-конце-вых аминокислот. Затем следуют 4 трансмембранных домена, причем на участок между 3-м и 4-м доменами приходится почти вся внутриклеточная часть субъединицы (рис. 9.1). | ||
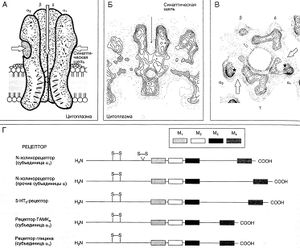
| − | + | '''''Описание к рис. 9.1.''' Строение N-холинорецептора. А. Схема рецептора, воссозданная на основании данных, представленных на Б и В. Продольный срез; субъединица у удалена; остальные четыре субъединицы (две а, р и 6) образуют канал с широкой входной частью и сужением в глубине мембраны. Внутреннюю стенку канала образуют слегка выпуклые а-спиральные структуры вторых трансмембранных доменов (М, на Г) всех пяти субъединиц. Участки связывания лиганда (указаны белыми стрелками) располагаются на стыках субъединиц ау и аб (последний прикрыт субъединицей а). Б. Карта электронной плотности молекул рецептора (продольный срез). Стрелками указаны вход в канал и участок связывания лиганда. Область повышенной электронной плотности с цитоплазматической стороны рецептора соответствует связанному с этим рецептором якорному белку. В. Такая же карта, но для поперечного среза (30 ангстрем над поверхностью мембраны). Стрелками указаны предполагаемые пути подхода лиганда к участкам связывания (звездочки). Г. Линейная структура субъединиц разнш рецепторов, связанных с каналами. Видно значительное сходство между разными субъединицами. В каждом случае внеклеточный домен состоит из 210 N-концевых аминокислот, затем следуют 4 гидрофобных трансмембранных домена (М,—М4) и небольшая С-концевая внеклеточная последовательность. Домен М:, формирующий внутреннюю стенку канала, имеет а-спиральную структуру. У всех субьединш имеется дисульфидный мостик между аминокислотами в положениях 128 и 142, а у субъединиц а — еще и между Цис|И и Цис . Umwin. 1993.'' | |
Все 5 субъединиц, каждая из которых имеет внеклеточную и внутриклеточную части, соединяются наподобие лепестков тюльпана, образуя круговую структуру с порой — каналом (Unwin, 1993; Karlin and Akabas, 1995; Changeux and Edelstein, 1998). Сам рецептор представляет собой асимметричный белковый комплекс с размерами 14 х 8 нм и молекулярной массой около 250 ООО. Его внеклеточная часть значительно больше внутриклеточной. В области постсинаптической мембраны (в нервно-мышечном синапсе, на вентральной поверхности электрических органов) N-холинорецепторы располагаются равномерно и с очень высокой плотностью (10 000/мкм2). Эго позвалило реконструировать их строение на основании электронной микроскопии с высоким разрешением — 10 ангстрем и менее (Unwin, 1993; Miyazawa et al., 1999) (рис. 9.1). | Все 5 субъединиц, каждая из которых имеет внеклеточную и внутриклеточную части, соединяются наподобие лепестков тюльпана, образуя круговую структуру с порой — каналом (Unwin, 1993; Karlin and Akabas, 1995; Changeux and Edelstein, 1998). Сам рецептор представляет собой асимметричный белковый комплекс с размерами 14 х 8 нм и молекулярной массой около 250 ООО. Его внеклеточная часть значительно больше внутриклеточной. В области постсинаптической мембраны (в нервно-мышечном синапсе, на вентральной поверхности электрических органов) N-холинорецепторы располагаются равномерно и с очень высокой плотностью (10 000/мкм2). Эго позвалило реконструировать их строение на основании электронной микроскопии с высоким разрешением — 10 ангстрем и менее (Unwin, 1993; Miyazawa et al., 1999) (рис. 9.1). | ||
| − | Участки связывания лигандов располагаются в области стыков субъединиц. В N-холинорецепторе имеются 5 таких стыков, однако в скелетных мышцах только 2 из них ( | + | Участки связывания лигандов располагаются в области стыков субъединиц. В N-холинорецепторе имеются 5 таких стыков, однако в скелетных мышцах только 2 из них (αγ и αδ) образуют участки связывания. Специфичность по отношению к лигандам определяется обеими субъединицами, участвующими образовании такого участка (Taylor et al., 2000). Связывание стимуляторов, обратимых конкурентных блокаторов и а-нейротоксинов носит взаимоисключающий характер — видимо зоны их присоединения перекрываются. |
Измерения электропроводимости связанных с N-холинорецепторами каналов показали, что скорость движения ионов по ним (5-107 с ') слишком высока для того, чтобы это движение можно было объяснить работой переносчика—очевидно, ионы движутся по открытому каналу простой диффузией. Вызванные стимуляторами изменения ионных потоков (входящий ток натрия, в меньшей степени — кальция) оказались обусловленными открыванием канала, непосредственно образованного белковым комплексом N-холинорецептора. Выяснилось, что внутренняя стенка этого канала формируется вторыми трансмембранными доменами всех пяти субъединиц. Участок связывания лигандов тесно связан с каналом; в скелетной мышце одновременное присоединение двух молекул стимулятора приводит к быстрому конформационному изменению и открыванию канала. Подробно свойства канала были изучены в электрофизиологических опытах с локальной фиксацией — методикой, позволяющей регистрировать открывание и закрывание одиночных ионных каналов (Sakmann, 1992). | Измерения электропроводимости связанных с N-холинорецепторами каналов показали, что скорость движения ионов по ним (5-107 с ') слишком высока для того, чтобы это движение можно было объяснить работой переносчика—очевидно, ионы движутся по открытому каналу простой диффузией. Вызванные стимуляторами изменения ионных потоков (входящий ток натрия, в меньшей степени — кальция) оказались обусловленными открыванием канала, непосредственно образованного белковым комплексом N-холинорецептора. Выяснилось, что внутренняя стенка этого канала формируется вторыми трансмембранными доменами всех пяти субъединиц. Участок связывания лигандов тесно связан с каналом; в скелетной мышце одновременное присоединение двух молекул стимулятора приводит к быстрому конформационному изменению и открыванию канала. Подробно свойства канала были изучены в электрофизиологических опытах с локальной фиксацией — методикой, позволяющей регистрировать открывание и закрывание одиночных ионных каналов (Sakmann, 1992). | ||
| − | Были выявлены гены, кодирующие субъединицы N-холино-рецепторов высших позвоночных, — сначала в скелетных мышцах, а затем в нейронах. Оказалось, что нейрональные N-холинорецепторы (в вегетативных ганглиях и ЦНС) также представляют собой пентамеры из 1—3 типов субъединиц. В скелетных мышцах имеется только по одному подтипу субъединиц | + | Были выявлены гены, кодирующие субъединицы N-холино-рецепторов высших позвоночных, — сначала в скелетных мышцах, а затем в нейронах. Оказалось, что нейрональные N-холинорецепторы (в вегетативных ганглиях и ЦНС) также представляют собой пентамеры из 1—3 типов субъединиц. В скелетных мышцах имеется только по одному подтипу субъединиц α (α1 и β1), а в нейронах — 8 подтипов субъединиц а (α2—α9) и 3 подтипа субъединиц β (β2—β4). Не все сочетания этих субъединиц образуют функционирующие рецепторы, но тем не менее число рецепторов слишком велико для того, чтобы их можно было различать на основании избирательного связывания лигандов. Различия в избирательной проницаемости связанных с рецепторами каналов для Na+ и Са могут свидетельствовать о том, что некоторые подтипы N-холинорецепторов могут участвовать не только в быстрой передаче сигналов через синапс, но выполнять также некие другие функции. Недавно было показано, что некоторые врожденные миастенические синдромы обусловлены мутациями субъединиц мышечных N-холинорецепторов, а некоторые варианты эпилепсии — мутациями субъединиц нейрональных N-холинорецепторов (Engel et al., 1998; Lindstrom, 2000). |
Версия 12:43, 5 апреля 2014
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
N-холинорецепторы
Активация N-холинорецепторов ацетилхолином в скелетных мышцах вызывает потенциал концевой пластинки, а в вегетативных постганглионарных нейронах — ВПСП. Общие сведения об этих рецепторах приведены в Холинергические рецепторы и синапсы. После первых работ по изучению механизмов действия кураре и никотина, проведенных более 100 лет назад, N-холинорецепторы стали классической моделью для изучения рецепторов вообще. За последние 30 лет были выделены и охарактеризованы сначала периферические, а затем и центральные N-холинорецепторы; это стало возможным благодаря обнаружению и активному использованию естественных стимуляторов и блокаторов данных рецепторов. Эти работы стали одной из вех в развитии молекулярной фармакологии.
Чрезвычайно богатый источник N-холинорецепторов — это электрические органы некоторых рыб, в частности электрического ската (Torpedo marmorata). Эмбриологически электрические органы происходят из той же закладки, что и мышцы, однако на долю мембраны, несущей N-холинорецепторы, приходится 30—40% площади поверхности этих органов (в скелетных мышцах позвоночных постсинаптическая мембрана занимает менее 0,1% площади поверхности мышечного волокна). Было обнаружено, что а-нейротоксины аспидовых, в частности крайта Bungarus multicinctus (Chang and Lee, 1963) и индийской кобры Naja naja, вызывают почти необратимую блокаду нервно-мышечного проведения; это дало возможность использовать их в качестве маркеров для выявления N-холинорецепторов. Эти токсины представляют собой пептиды с молекулярной массой порядка 7000. Впервые идентификация N-холинорецептора in vitro с помощью меченого а-нейротоксина была предпринята Шанже и сотр. в 1970-х гг. (Changeux and Edelstein, 1998). Альфа-нейротоксины обладают чрезвычайно высоким сродством к N-холинорецептору, а их комплекс с этим рецептором диссоциирует крайне медленно, но все же ковалентные связи между токсином и рецептором не образуются. И in vivo, и in vitro а-нейротоксины по своим свойствам сходны с высокоаффинными блокаторами. Поскольку в управлении движениями у морских и наземных позвоночных участвует холинергическая передача, в процессе эволюции возникли множество естественных N-холиноблокаторов (пептидов, терпенов, алкалоидов), позволяющих их владельцам либо убивать жертву, либо самим спасаться от хищников.
Выделение в чистом виде N-холинорецептора электрического ската позволило получить кДНК, кодирующую каждую из его субъединиц. Это, в свою очередь, дало возможность клонировать гены множества подтипов этих субъединиц, имеющихся в нейронах и мышцах млекопитающих (Numa et al., 1983). С помощью одновременной экспрессии в различных сочетаниях генов, кодирующих разные подтипы субъединиц, с последующим изучением сродства полученного рецептора к лигандам и электрофизиологических реакций на его активацию блокаторами было исследовано соотношение между строением N-холинорецепторов и их функциональными свойствами (Lindstrom, 2000; Karlin and Akabas, 1995; Paterson and Nordberg, 2000).
Строение N-холинорецепторов
N-холинорецепторы электрических органов и скелетных мышц представляют собой пентамерные структуры, образованные четырьмя типами субъединиц (α; β; γ либо ε; δ) в соотношении α2βγδ (в эмбриональных или денервированных мышцах) или α2βεδ (в иннервированных мышцах взрослых особей). Степень гомологии аминокислотных последовательностей между разными типами субъединиц достигает 40%, что позволяет предположить их общее происхождение (Numa etal., 1983).
N-холинорецепторы стали классической моделью для изучения ионотропных рецепторов (хемочувствительных каналов, рецепторов-каналов). К этой группе принадлежат также рецепторы тормозных аминокислотных медиаторов (ГАМК и глицина), 5-НТ3-рецепторы и некоторые другие. Все они представляют собой пентамеры, состоящие из гомологичных субъединиц с молекулярной массой порядка 40 000—60 000 каждая. Внеклеточные домены каждой субъединицы состоят из 210 N-конце-вых аминокислот. Затем следуют 4 трансмембранных домена, причем на участок между 3-м и 4-м доменами приходится почти вся внутриклеточная часть субъединицы (рис. 9.1).
Описание к рис. 9.1. Строение N-холинорецептора. А. Схема рецептора, воссозданная на основании данных, представленных на Б и В. Продольный срез; субъединица у удалена; остальные четыре субъединицы (две а, р и 6) образуют канал с широкой входной частью и сужением в глубине мембраны. Внутреннюю стенку канала образуют слегка выпуклые а-спиральные структуры вторых трансмембранных доменов (М, на Г) всех пяти субъединиц. Участки связывания лиганда (указаны белыми стрелками) располагаются на стыках субъединиц ау и аб (последний прикрыт субъединицей а). Б. Карта электронной плотности молекул рецептора (продольный срез). Стрелками указаны вход в канал и участок связывания лиганда. Область повышенной электронной плотности с цитоплазматической стороны рецептора соответствует связанному с этим рецептором якорному белку. В. Такая же карта, но для поперечного среза (30 ангстрем над поверхностью мембраны). Стрелками указаны предполагаемые пути подхода лиганда к участкам связывания (звездочки). Г. Линейная структура субъединиц разнш рецепторов, связанных с каналами. Видно значительное сходство между разными субъединицами. В каждом случае внеклеточный домен состоит из 210 N-концевых аминокислот, затем следуют 4 гидрофобных трансмембранных домена (М,—М4) и небольшая С-концевая внеклеточная последовательность. Домен М:, формирующий внутреннюю стенку канала, имеет а-спиральную структуру. У всех субьединш имеется дисульфидный мостик между аминокислотами в положениях 128 и 142, а у субъединиц а — еще и между Цис|И и Цис . Umwin. 1993.
Все 5 субъединиц, каждая из которых имеет внеклеточную и внутриклеточную части, соединяются наподобие лепестков тюльпана, образуя круговую структуру с порой — каналом (Unwin, 1993; Karlin and Akabas, 1995; Changeux and Edelstein, 1998). Сам рецептор представляет собой асимметричный белковый комплекс с размерами 14 х 8 нм и молекулярной массой около 250 ООО. Его внеклеточная часть значительно больше внутриклеточной. В области постсинаптической мембраны (в нервно-мышечном синапсе, на вентральной поверхности электрических органов) N-холинорецепторы располагаются равномерно и с очень высокой плотностью (10 000/мкм2). Эго позвалило реконструировать их строение на основании электронной микроскопии с высоким разрешением — 10 ангстрем и менее (Unwin, 1993; Miyazawa et al., 1999) (рис. 9.1).
Участки связывания лигандов располагаются в области стыков субъединиц. В N-холинорецепторе имеются 5 таких стыков, однако в скелетных мышцах только 2 из них (αγ и αδ) образуют участки связывания. Специфичность по отношению к лигандам определяется обеими субъединицами, участвующими образовании такого участка (Taylor et al., 2000). Связывание стимуляторов, обратимых конкурентных блокаторов и а-нейротоксинов носит взаимоисключающий характер — видимо зоны их присоединения перекрываются.
Измерения электропроводимости связанных с N-холинорецепторами каналов показали, что скорость движения ионов по ним (5-107 с ') слишком высока для того, чтобы это движение можно было объяснить работой переносчика—очевидно, ионы движутся по открытому каналу простой диффузией. Вызванные стимуляторами изменения ионных потоков (входящий ток натрия, в меньшей степени — кальция) оказались обусловленными открыванием канала, непосредственно образованного белковым комплексом N-холинорецептора. Выяснилось, что внутренняя стенка этого канала формируется вторыми трансмембранными доменами всех пяти субъединиц. Участок связывания лигандов тесно связан с каналом; в скелетной мышце одновременное присоединение двух молекул стимулятора приводит к быстрому конформационному изменению и открыванию канала. Подробно свойства канала были изучены в электрофизиологических опытах с локальной фиксацией — методикой, позволяющей регистрировать открывание и закрывание одиночных ионных каналов (Sakmann, 1992).
Были выявлены гены, кодирующие субъединицы N-холино-рецепторов высших позвоночных, — сначала в скелетных мышцах, а затем в нейронах. Оказалось, что нейрональные N-холинорецепторы (в вегетативных ганглиях и ЦНС) также представляют собой пентамеры из 1—3 типов субъединиц. В скелетных мышцах имеется только по одному подтипу субъединиц α (α1 и β1), а в нейронах — 8 подтипов субъединиц а (α2—α9) и 3 подтипа субъединиц β (β2—β4). Не все сочетания этих субъединиц образуют функционирующие рецепторы, но тем не менее число рецепторов слишком велико для того, чтобы их можно было различать на основании избирательного связывания лигандов. Различия в избирательной проницаемости связанных с рецепторами каналов для Na+ и Са могут свидетельствовать о том, что некоторые подтипы N-холинорецепторов могут участвовать не только в быстрой передаче сигналов через синапс, но выполнять также некие другие функции. Недавно было показано, что некоторые врожденные миастенические синдромы обусловлены мутациями субъединиц мышечных N-холинорецепторов, а некоторые варианты эпилепсии — мутациями субъединиц нейрональных N-холинорецепторов (Engel et al., 1998; Lindstrom, 2000).