Препараты для лечения психозов (нейролептики) — различия между версиями
Zabava (обсуждение | вклад) (→Нейролептики) |
Sw986 (обсуждение | вклад) |
||
| Строка 121: | Строка 121: | ||
В отношении большинства нейролептиков справедливо правило: чем сильнее препарат стимулирует секрецию пролактина, тем выше его антипсихотическая активность, и наоборот (Sachar, 1978). Клозапин и кветиапин представляют собой исключения — они почти не влияют на уровень пролактина (Arvanitis etal., 1997; Sachar, 1978); оланзапин повышает этот уровень лишь кратковременно незначительно (Tollefson and Kuntz, 1999). Рисперидон, наоборот, необычно резко повышает секрецию пролактина (Grant and Fitton, 1994). Следует отметить, что повышение секреции пролактина начинается уже при приеме нейролептиков в низких дозах, недостаточных для достижения антипсихотического эффекта, что, возможно, отражает отсутствие гематоэнцефалического барьера в аденогипофизе. Этот эффект почти не ослабевает со временем, оставаясь неизменным даже спустя годы после начала лечения. Вместе с тем после прекращения приема нейролептиков он быстро исчезает (Bitton and Schneider, 1992). С усилением секреции пролактина, видимо, связаны нагрубание молочных желез и галакторея, время от времени наблюдающиеся при приеме нейролептиков, в том числе и у мужчин (при использовании высоких доз). Поскольку обычно нейролептики назначаются на длительный срок и, следовательно, вызывают хроническую гиперпролактинемию, предполагалось, что они могут повышать риск рака молочной железы. Хотя результаты клинических исследований не подтвердили этих опасений (Dickson and Glazer, 1999; Mortensen, 1994), нейролептики, равно как и другие стимуляторы секреции пролактина, не должны назначаться больным раком молочной железы, особенно при наличии метастазов. Некоторые нейролептики подавляют секрецию гонадотропных гормонов, эстрогенов и прогестерона, что, возможно, способствует развитию аменореи. | В отношении большинства нейролептиков справедливо правило: чем сильнее препарат стимулирует секрецию пролактина, тем выше его антипсихотическая активность, и наоборот (Sachar, 1978). Клозапин и кветиапин представляют собой исключения — они почти не влияют на уровень пролактина (Arvanitis etal., 1997; Sachar, 1978); оланзапин повышает этот уровень лишь кратковременно незначительно (Tollefson and Kuntz, 1999). Рисперидон, наоборот, необычно резко повышает секрецию пролактина (Grant and Fitton, 1994). Следует отметить, что повышение секреции пролактина начинается уже при приеме нейролептиков в низких дозах, недостаточных для достижения антипсихотического эффекта, что, возможно, отражает отсутствие гематоэнцефалического барьера в аденогипофизе. Этот эффект почти не ослабевает со временем, оставаясь неизменным даже спустя годы после начала лечения. Вместе с тем после прекращения приема нейролептиков он быстро исчезает (Bitton and Schneider, 1992). С усилением секреции пролактина, видимо, связаны нагрубание молочных желез и галакторея, время от времени наблюдающиеся при приеме нейролептиков, в том числе и у мужчин (при использовании высоких доз). Поскольку обычно нейролептики назначаются на длительный срок и, следовательно, вызывают хроническую гиперпролактинемию, предполагалось, что они могут повышать риск рака молочной железы. Хотя результаты клинических исследований не подтвердили этих опасений (Dickson and Glazer, 1999; Mortensen, 1994), нейролептики, равно как и другие стимуляторы секреции пролактина, не должны назначаться больным раком молочной железы, особенно при наличии метастазов. Некоторые нейролептики подавляют секрецию гонадотропных гормонов, эстрогенов и прогестерона, что, возможно, способствует развитию аменореи. | ||
| − | Влияние нейролептиков на другие нейроэндокринные функции гипоталамуса изучено гораздо слабее. Известно, что они подавляют высвобождение СТГ и, возможно, снижают секрецию кортиколиберина в ответ на стресс. Несмотря на подавление секреции СТГ, нейролептики малоэффективны при акромегалии и, видимо, не тормозят рост и развитие ребенка. Хлорпромазин может снижать секрецию АДГ и | + | Влияние нейролептиков на другие нейроэндокринные функции гипоталамуса изучено гораздо слабее. Известно, что они подавляют высвобождение СТГ и, возможно, снижают секрецию кортиколиберина в ответ на стресс. Несмотря на подавление секреции СТГ, нейролептики малоэффективны при акромегалии и, видимо, не тормозят рост и развитие ребенка. Хлорпромазин может снижать секрецию АДГ и [[окситоцин]]а. Большинство нейролептиков — в особенности клозапин, другие препараты с низкой активностью и оланзапин — вызывают усиление аппетита и прибавку в весе. Кроме того, хлорпромазин может подавлять выброс инсулина и нарушать толерантность к глюкозе, что иногда имеет клиническое значение (Erie et al., 1977). Наконец, некоторые атипичные нейролептики (прежде всего клозапин, оланзапин и кветиапин), по-видимому, повышают риск инсулинонезависимого сахарного диабета, причем этот эффект не может быть полностью объяснен лишь прибавкой в весе (Wirs-hingetal., 1998). |
Помимо нейроэндокринных эффектов, вероятно, ряд вегетативных побочных эффектов нейролептиков также обусловлен их действием на гипоталамус. Важный пример — развивающаяся при приеме хлорпромазина и других нейролептиков пойкилотермия, то есть нарушение терморегуляции, при котором в зависимости от температуры окружающей среды у больного может наблюдаться гипо- или гипертермия. Клозапин иногда вызывает гипертермию. | Помимо нейроэндокринных эффектов, вероятно, ряд вегетативных побочных эффектов нейролептиков также обусловлен их действием на гипоталамус. Важный пример — развивающаяся при приеме хлорпромазина и других нейролептиков пойкилотермия, то есть нарушение терморегуляции, при котором в зависимости от температуры окружающей среды у больного может наблюдаться гипо- или гипертермия. Клозапин иногда вызывает гипертермию. | ||
Версия 15:44, 15 июня 2014
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Медикаментозное лечение психозов и мании
К антипсихотическим средствам, или нейролептикам, относятся трициклические соединения (фенотиазины, тиоксантены, дибензазепины), замещенные бензамиды, бутирофеноны и некоторые другие препараты. Почти все нейролептики блокируют D2-рецепторы, подавляя дофаминергическую передачу в переднем мозге. Кроме того, некоторые из них взаимодействуют с Dr, D4~, 5-НТ2А и 5-НТ2с-рецепторами, а также с а-адренорецепторами. Нейролептики — сравнительно липофильные препараты. Они метаболизируются преимущественно микросомальными ферментами печени; некоторые из них обладают достаточно сложной кинетикой элиминации.
Нейролептики используются для симптоматического лечения как эндогенных, так и соматогенных психозов; при этом они удобны для клинического применения и достаточно безопасны. Они различаются по силе антипсихотического действия и характеру побочных эффектов. Так, большинство нейролептиков с сильным антипсихотическим действием часто вызывают экстрапирамидные побочные эффекты, в то время как относительно слабые нейролептики оказывают выраженное седативное действие и значительно влияют на вегетативные функции, в частности, вызывая артериальную гипотонию. Неврологические побочные эффекты типичных нейролептиков включают острую дистонию, акатизию, нейролептический паркинсонизм и поздние нейролептические гиперкинезы. Некоторые нейролептики, включая клозапин, оланзапин, кветиапин ирисперидон, в низких дозах почти не вызывают экстрапирамидных побочных эффектов и потому называются атипичными.
Обычно при острых психозах нейролептики назначаются в суточной дозе, соответствующей 10—20мг фторфеназина или галоперидола (что позволяет достичь сывороточной концентрации примерно 5—20 нг/мл или З00-600мг хлорпромазина. Более высокие дозы, как правило, не дают дополнительного лечебного эффекта, в то время как вероятность
серьезных побочных эффектов возрастает. Длительное поддерживающее лечение обычно проводится более низкими дозами нейролептиков. Толерантность к антипсихотическому действию этих препаратов почти не развивается.
Лечение маниакально-депрессивного психоза и других маниакальных состояний в течение нескольких десятилетий основывалось на назначении карбоната или цитрата лития. Терапевтический диапазон лития узок, что делает необходимым постоянное слежение за его сывороточной концентрацией. Для снятия маниакального возбуждения особенно сопровождающегося психотическими симптомами, нередко используются нейролептики, а также мощные транквилизаторыбензодиазепины (гл. 17). В качестве альтернативы лечению литием или дополнения к нему иногда используются экспериментальные подходы — назначение противосудорожных средств, таких, как карбамазепин или вальпроат натрия (гл. 21).
Средства, применяемые при психозах
Для симптоматического лечения психозов используются несколько классов нейролептиков. Наиболее часто нейролептики применяются при шизофрении, в маниакальной фазе маниакально-депрессивного психоза, при других эндогенных психозах и прочих состояниях, сопровождающихся выраженным возбуждением и нарушениями мышления. Иногда их назначают при тяжелой психотической депрессии (в качестве альтернативы электросудорожной терапии), а также при соматогенных психозах.
Нейролептики включают фенотиазины, структурно сходные с ними тиоксантены и дибензазепины; бутирофеноны (фенилбутилпиперидины) и дифенилбутилпиперидины; производные индола; соединения прочих групп. Поскольку, несмотря на различия в химической структуре, фармакологические свойства всех этих препаратов во многом сходны, в дальнейшем они рассматриваются как единая группа. Особое внимание уделено хлорпромазину, как первому представителю группы фенотиазинов и тиоксантенов, а также галоперидолу — первому бутирофенону.
После внедрения в 1950-х гг. нейролептиков в клиническую практику был накоплен огромный опыт применения этих препаратов. Они произвели настоящую революцию в психиатрии и медицине в целом, и значение их невозможно переоценить. В то же время следует отметить, что нейролептики первого поколения («типичные нейролептики») почти всегда вызывают экстрапирамидные побочные эффекты. Новые, так называемые атипичные нейролептики реже вызывают экстрапирамидные нарушения, однако также не лишены побочных эффектов. Например, некоторые из них вызывают артериальную гипотонию, эпилептические припадки, прибавку в весе, гипергликемию и гиперпролактинемию.
Нейролептики
При лечении психических расстройств в мире используются несколько десятков нейролептиков. Кроме того, ряд препаратов, структурно родственных нейролептикам, применяются преимущественно для лечения других состояний, например в качестве Н1блокаторов и противорвотных средств. Следует отметить, что в последнее
время в некоторых странах, особенно в США, термин нейролептики стал использоваться только в отношении тех препаратов, которые оказывают выраженное блокирующее действие на D2-рецепторы и, соответственно, часто вызывают экстрапирамидные побочные эффекты. Препараты, редко вызывающие эти эффекты, в США называют атипичными антипсихотическими средствами (атипичными нейролептиками). К ним относятся клозапин, оланзапин и кветиапин; аналогичными свойствами обладает рисперидон в низких дозах (Blin, 1999; Markowitz etal., 1999).
Историческая справка
История создания нейролептиков подробно описывается в ряде монографий (Swazey, 1974; Caldwell, 1978). В начале 1950-х гг. было обнаружено, что экстракт рауво-льфии обладает некоторым антипсихотическим действием. Затем аналогичные свойства были выявлены у очищенного активного алкалоида раувольфии резерпина, впоследствии искусственно синтезированного Вудвордом. Хотя резерпин и сходные соединения, истощающие запасы моноаминов в нейронах, в высоких дозах могут оказывать антипсихотическое действие, назначение таких доз часто приводит к развитию тяжелых побочных эффектов, включая артериальную гипотонию, понос, сонливость, общую слабость и депрессию. Поэтому резерпин нашел применение в основном лишь в качестве гипотензивного средства (гл. 33).
Производные фенотиазина были синтезированы в конце XIX века в Европе при разработке анилиновых красителей, таких, как метиленовый синий. В конце 1930-х гг. было обнаружено, что одно из этих производных, прометазин, обладает антигистаминным и седативным эффектами. Однако попытка использовать прометазин и другие Н1блокаторы для снятия возбуждения у психически больных, предпринятая в 1940-х гг., не увенчалась успехом.
Одновременно с этим было обнаружено, что прометазин усиливает снотворное действие барбитуратов у грызунов. В результате он начал использоваться в анестезиологии как средство, потенцирующее общую анестезию и смягчающее вегетативные реакции (Laborit et al., 1952). Это стимулировало поиск других производных фенотиазина с аналогичными свойствами, и в результате в 1949—1950 гг. Шарпантье синтезировал хлорпромазин. Вскоре Лабори и сотр. описали способность этого вещества потенцировать действие средств для общей анестезии и вызывать «искусственную гибернацию» (искусственный сон с гипотермией). Не приводя к потере сознания, хлорпромазин вызывал психомоторную заторможенность и сонливость. Несколько позднее такое действие получило название атарактического, или нейролептического.
Первую попытку лечения психически больных хлорпромазином предприняли в Париже в 1951—1952 гг. Парер и Сигвапьд (Swazey, 1974). В 1952 г. Делей и Деникер показали, что хлорпромазин не только подавляет возбуждение и тревогу, но и улучшает течение психозов. В 1954 г. Леманн и Ханрахен в Монреале, а затем Уинкелман в Филадельфии впервые на американском континенте использовали хлорпромазин для лечения психомоторного возбуждения, мании и шизофрении (Swazey, 1974). Клинические исследования вскоре подтвердили эффективность хлорпромазина при различных психозах.
Химические свойства
Структурно-функциональная зависимость (см. также Baldessarini, 1985; Neumeyer and Booth, 2001). Трициклическое ядро фенотиазинов состоит из двух боковых бензольных колец, соединенных посредством атомов серы и азота (табл. 20.1). Тиоксантены отличаются от фенотиазинов тем, что вместо атома азота в положении 10 содержат атом углерода, соединенный двойной связью с боковой цепью.
Введение в положение 2 акцепторных групп повышает эффективность фенотиазинов и других трициклических нейролептиков (например, хлорпромазина по сравнению с промазином). Характер заместителей в положении 10 также влияет на фармакологические свойства препарата. Как видно из табл. 20.1, в зависимости от этих заместителей фенотиазины могут быть разделены на три подгруппы. Фенотиазины с алифатической боковой цепью включают хлорпромазин и трифторпромазин. Эти препараты обладают относительно слабой активностью (но не клинической эффективностью). К препаратам, имеющим в положении 10 пиперидиновое кольцо, относятся тиоридазин и мезоридазин. Они несколько реже вызывают экстрапирамидные побочные эффекты, возможно, благодаря выраженному центральному М-холиноблокнруюшему действию. Фенотиазины с пиперазиновым ядром в боковой цепи, такие, как фторфеназин и трифторперазин — высокоактивные соединения Большинство этих препаратов, обладающих относительно слабым М-холиноблокирующим действием, часто вызывают экстрапирамидальные побочные эффекты. Вместе с тем у них менее выражены седативный эффект и влияние на вегетативную нервную систему, в связи с чем сонливость и артериальная гипотония обычно развиваются лишь при приеме очень высоких доз. Для некоторых пиперазиновых фенотиазинов существуют препараты длительного действия, полученные путем этерификации свободной гидроксильной группы остатком длинноцепочечной жирной кислоты. Эти препараты характеризуются высокой липофильностью, замедленным всасыванием и гидролизом. В США получили распространение деканоаты фторфеназина и галоперидола, а также энантат фторфеназина. В других странах используются еще несколько нейролептиков длительного действия.
Тиоксантены также могут иметь алифатическую или пиперазиновую боковую цепь. Пример алифатического тиоксантена — хлорпротиксен, по химической структуре очень близкий хлорпромазину. К пиперазиновым тиоксантенам относятся клопентиксол, флупентиксол, пифлутиксол и тиотиксен. Все они -мощные, высокоэффективные нейролептики, хотя в США из этих препаратов используется только тиотиксен. Поскольку у тиоксантенов атом углерода в положении 10 центрального кольца соединяется двойной связью с боковой цепью, у них имеются цис- и транс-изомеры; цис-изомеры более активны.
Все фенотиазины и тиоксантены, обладающие антипсихотическими свойствами, характеризуются наличием последовательности из трех атомов углерода между атомом углерода в положении 10 центрального кольца и первым атомом азота боковой цепи; кроме того, все они — третичные амины. У фенотиазинов же, использующихся в качестве Н 1-блокаторов (например, прометазина), а также у фенотиазинов с выраженными М-холиноблокирующими свойствами (например, профенамина, диэтазина) эта последовательность составляет лишь два атома углерода. N-деалкилирование боковой цепи, происходящее в процессе метаболизма, а также увеличение размера заместителей у атома азота снижают антипсихотическую активность.
К трицикпическим нейролептикам относятся также дибензазепины — препараты, содержащие семичленное центральное кольцо. Из них в США применяются локсапин (производное дибензоксазепина) и, клозапин (производное дибензодиазепина) (табл. 20.1). Локсапин и его аналоги (клотиапин, метиапин, зотепин и другие) — типичные нейролептики, мощные блокаторы дофаминовых рецепторов. В положении 2, в непосредственной близости от атомов азота боковой цепи, они имеют группу-акцептор электронов.
У препаратов, структурно родственных клозапину, при трициклическом ядре может вовсе не быть заместителей (например, у кветиапина — производного дибензотиазепина) либо может иметься метильная группа (у оланзапина — производного тиенобензодиазепина) или отрицательно заряженная группа в положении 8, удаленная от атомов азота боковой цепи (например, у клозапина и флуперлапина) (табл. 20.1). Помимо дофаминовых рецепторов эти препараты в большей или меньшей степени обладают сродством и к другим рецепторам (а1- и а2-адренорецепторам, М-холинорецепторам, 5-НТ2а- и 5-НТ2с-рецепторам, Н1рецепторам). Многие из них — эффективные нейролептики. В частности, клозапин нередко помогает хроническим больным, нечувствительным к обычным нейролептикам. Подробнее о фармакологических свойствах клозапина см. Baldessarini and Frankenburg (1991), WagstafF and Bryson (1995), Worrell et al. (2000).
Создание клозапина послужило мощным стимулом к разработке новых, более безопасных препаратов с низким риском эк-страпирамидных побочных эффектов. В результате был синтезирован ряд атипичных нейролептиков, фармакологически несколько сходных с клозапином. К ним относятся упоминавшиеся выше оланзапин и кветиапин, а также смешанный блокатор дофаминовых и серотониновых рецепторов рисперидон (производное бензизоксазола; табл. 20.1) (Owens and Risch, 1998; Wad-dington and Casey, 2000).
Типичный нейролептик из группы бутирофенонов (фенилбутилпиперидинов) — галоперидол (Janssen, 1974). К экспериментальным фенилбутилпиперидинам, содержащим гетероциклические заместители, относятся спипероны. Родственный галоперидолу дроперидол — нейролептик с очень коротким Т1/2 и выраженным седативным действием; он используется почти исключительно в анестезиологической практике (гл. 14) и лишь изредка — при неотложных состояниях в психиатрии. Другая группа родственных бутирофенонам соединений — дифенилбутилпиперидины, включающие флуспирилен, пенфлуридол и пимоэид (табл. 20.1; Neumeyer and Booth, 2001). Все они — мощные нейролептики длительного действия. В США разрешен к применению только пимозид для лечения синдрома Жиль де ла Туретта (множественных, в том числе голосовых, тиков), хотя он также обладает выраженным антипсихотическим действием.
Антипсихотическим действием обладают и некоторые другие гетероциклические соединения, однако они недостаточно изучены для того, чтобы делать какие-либо выводы относительно соотношения их структуры с активностью (Neumeyer and Booth, 2001). К ним относятся производные индола, в частности молиндон (табл. 20.1) и оксипертин. Другое экспериментальное соединение — мощный блокатор дофаминовых рецепторов бутакламол, он имеет пентациклическую структуру, включающую дибензазепиновое ядро. Структурно и фармакологически он более сходен с локсапином, чем с клозапином. Его активный (правовращающий) и неактивный изомеры использовались для изучения пространственной структуры участков связывания нейролептиков с дофаминовыми рецепторами.
Рисперидон (табл. 20.1) — мощный блокатор 5-НТ2-, D2- и Н|-рецепторов. Хотя клозапин и рисперидон действуют на одни и те же типы рецепторов, рисперидон гораздо активнее блокирует D2-рецепторы и, в противоположность клозапину, может вызывать экстрапирамидные симптомы и выраженную гиперпролактинемию. Тем не менее рисперидону свойственна «дозозависимая атипичность»; иначе говоря, он редко вызывает экстрапирамидные побочные эффекты при приеме в умеренных дозах (6 мг/cyr и менее).
Замещенные бензамиды — растущая группа нейролептиков; их молекулы обладают пространственной симметрией. Сюда относятся противорвотные средства метоклопрамид и цизаприд, блокирующие D2- и 5-НТ3-рецепторы. Некоторые бензамиды, подобно бутирофенонам и их аналогам, относительно избирательно блокируют D2-рецепторы и обладают антипсихотическим действием. Экспериментальные препараты данной группы включают эпидеприд, этиклоприд, немонаприд, раклоприд, ремоксиприд и сультоприд; кроме того, сульпирид нашел клиническое применение в ряде стран, преимущественно в качестве транквилизатора.
Фармакологические свойства
Нейролептики объединяются общностью многих фармакологических свойств и показаний (Baldessarini, 1985; Marder, 1998; Owens and Risch, 1998). Хлорпромазин и галоперидол нередко рассматриваются как «эталонные» нейролептики, с которыми сравниваются новые препараты. Многие нейролептики с относительно небольшой активностью, в частности хлорпромазин, обладают мощным седативным эффектом. Он особенно ярко проявляется в начале лечения; затем к нему обычно формируется толерантность. У больных с очень сильным возбуждением седативный эффект может быть менее заметен. Несмотря на седативное действие, нейролептики обычно не применяются для лечения тревожных расстройств. В первую очередь это связано с тем, что они обладают множеством побочных эффектов на ЦНС и вегетативную нервную систему; из-за этих эффектов они иногда могут парадоксально провоцировать тревогу и двигательное беспокойство (акатизию), а при длительном применении — поздние нейролептические гиперкинезы.
Термин нейролептики был предложен для того, чтобы противопоставить влияния на поведение экспериментальных животных и человека хлорпромазина и резерпина, с одной стороны, и прочих средств с седативным действием — с другой. Действие нейролептиков включает подавление спонтанных движений и сложных форм поведения при сохранении спинальных рефлексов и безусловнорефлекторных реакций избегания на болевые раздражители. У человека нейролептики вызывают ощущение безразличия, безынициативность и притупление эмоций, в силу чего в прошлом, до открытия их уникального антипсихотического действия, эти препараты называли «транквилизаторами». В начале лечения нейролептиками у больных нередко отмечаются замедление реакции и сонливость. Несмотря на это, больные могут вполне адекватно реагировать на внешние раздражители, поддерживать разговор и ориентироваться в окружающей обстановке. При назначении обычных доз нейролептиков не наблюдается атаксии, нарушений координации движений и дизартрии. Как правило, вскоре после начала приема этих препаратов возбуждение угасает, ослабевают агрессивность и импульсивное поведение; замкнутые и апатичные больные иногда становятся более общительными. Затем постепенно (обычно на протяжении нескольких дней) исчезают собственно психотические симптомы: галлюцинации, бред, дезорганизация мышления и речи. В ходе лечения обычно развиваются характерные неврологические побочные эффекты (гипокинезия, легкое повышение мышечного тонуса, тремор, акатизия), напоминающие симптомы паркинсонизма.
Хотя в прошлом термин нейролепсия охватывал весь вышеописанный синдром, а понятие «нейролептик» до настоящего времени используется как синоним антипсихотического средства, в последние годы под нейролепсией все чаще понимают лишь неврологические побочные эффекты этих препаратов (например, паркинсонизм). Поскольку все используемые в США антипсихотические препараты, за исключением клозапина и, возможно, оланзапина и кветиапина, могут вызывать двигательные расстройства, по отношению к ним допустимо применять термин нейролептики. Вместе с тем в США термин антипсихотические средства все же считается предпочтительным как более емкий, особенно после внедрения атипичных препаратов — клозапина, оланзапина и кветиапина.
Простые формы поведения. Влияние различных нейролептиков на поведение экспериментальных животных и человека во многом сходно (Fielding and Lai, 1978). В умеренных дозах эти средства подавляют условнорефлекторную деятельность, но не влияют на спинальные рефлексы. Под действием нейролептиков у животных угнетается исследовательское поведение, а реакции на различные раздражители возникают реже, становятся более слабыми и замедленными. Вместе с тем способность различать раздражители сохраняется. Избирательно подавляются условнорефлекторные реакции избегания, в то время как безусловные реакции избегания остаются интактными. Подавляется самораздражение (при этой методике в так называемые центры удовольствия — богатые моноаминами области медиального пучка переднего мозга-вживляются электроды, и животному предоставляется возможность стимулировать эти центры, самостоятельно нажимая на рычаг), хотя сама по себе способность нажимать на рычаг сохраняется. Нейролептики блокируют активирующее действие внешних раздражителей и психоактивных веществ (прежде всего психостимуляторов и дофаминергических средств). Пищевое поведение также подавляется. После введения большинства нейролептиков апоморфин и другие дофаминергические средства перестают вызывать рвоту, двигательное возбуждение и агрессивность. В высоких дозах большинство нейролептиков вызывают каталепсию — состояние полной обездвиженности, при котором животному можно придавать различные вычурные позы, сохраняющиеся длительное время. Тонус мышц повышается; обычно наблюдается птоз. Животные становятся безразличными к большинству раздражителей, хотя реакция на болезненные и вредные воздействия сохраняется. В то же время при достаточной стимуляции и мотивации животные способны воспроизвести большинство условнорефлекторных реакций, образованных до введения нейролептиков. Даже очень высокие дозы большинства нейролептиков не вызывают кому, а смерть наступает лишь после введения огромной дозы препаратов.
Движения. Почти все нейролептики снижают спонтанную двигательную активность у человека и животных. Несмотря на это, у человека они нередко вызывают акатизию — крайне неприятное состояние, характеризующееся беспокойством и непреодолимым желанием двигаться. Акатизия не имеет прямых аналогов в поведении животных. Наблюдающаяся у животных каталепсия напоминает кататонию, развивающуюся при ряде психозов, неврологических заболеваний и нарушений обмена веществ. Однако у психически больных под действием нейролептиков кататония не только не развивается, но и нередко исчезает одновременно с другими психотическими симптомами. Вместе с тем могут наблюдаться мышечная скованность и гипокинезия, внешне напоминающие кататонию. Эти явления особенно часты при приеме высоких доз мощных нейролептиков; они проходят после отмены нейролептика или назначения антипаркинсонических средств (Fielding and Lai, 1978; Janssen andVanBever, 1978). Теории возникновения экстрапирамидных побочных эффектов, их симптоматика, профилактика и лечение разбираются ниже.
Сон. Влияние нейролептиков на сон изменчиво, однако, как правило, под их влиянием сон у больных с психозами и манией нормализуется. Существует параллелизм между выраженностью седативного (но не антипсихотического) эффекта нейролептиков и их способностью продлевать и усиливать действие наркотических анальгетиков и снотворных. Соответственно, мощные нейролептики, обладающие слабым седативным эффектом, не потенцируют снотворное действие других препаратов.
Условные рефлексы. Хлорпромазин и другие нейролептики угнетают образование условнорефлекторных реакций избегания. Так, под их действием животные перестают реагировать на условный сигнал, предупреждающий о начале болевого раздражения электрическим током. При введении небольшой дозы животные, игнорируя предупреждающий сигнал, все же перемещаются в безопасное место экспериментальной камеры после включения тока. Эта безусловная реакция нарушается только под влиянием высоких доз нейролептиков, вызывающих атаксию или сон. Напротив, снотворные, транквилизаторы и средства для общей анестезии подавляют условнорефлекторные и безусловнорефлекторные реакции избегания примерно в равной степени. Несмотря на то что нейролептики вызывают заторможенность, они могут угнетать и пассивные реакции избегания, требующие неподвижности.
Поскольку у многих нейролептиков способность подавлять условнорефлекторные реакции избегания хорошо соотносится с клинической эффективностью, вышеописанные эксперименты имеют большое значение для испытания новых препаратов. Однако, несмотря на практическую значимость подобных тестов и возможность количественной оценки их результатов, они не привнесли почти ничего нового в понимание сущности антипсихотического действия. Так, влияние нейролептиков на условнорефлекторные реакции избегания ослабевает при длительном приеме этих препаратов, а также при назначении М-холиноблокаторов, между тем антипсихотическое действие при этом сохраняется. Более того, тесная взаимосвязь между способностью типичных нейролептиков подавлять условнорефлекторные реакции избегания и блокировать поведенческие эффекты дофаминергических средств (таких, как апоморфин или амфетамины) заставила предположить, что вышеописанные тесты применимы лишь по отношению к типичным нейролептикам (мощным блокаторам дофаминовых рецепторов, вызывающим экстрапирамидные и прочие неврологические побочные эффекты). Оказалось, что и атипичные нейролептики (такие, как клозапин и оланзапин) способны не только подавлять условнорефлекторные реакции избегания, но и блокировать действие дофаминергических средств (Fielding and Lai, 1978; Janssen and Van Bever, 1978; Amt and Skarsfeldt, 1998).
Высшие психические функции. Нейролептики нарушают внимание и скорость двигательных реакций, что выявляется с помощью таких тестов, как слежение за вращающимся объектом и тест постукивания (количество ударов пальцем за 30 с). Эти препараты лишь в небольшой степени нарушают выполнение символьно-цифрового теста Векслера, в большей степени оценивающего интеллектуальные функции. Более того, большинство нейролептиков способны улучшать когнитивные функции у больных с психозами. Барбитураты, напротив, в большей степени нарушают выполнение символьно-цифрового теста Векслера, чем тестов на внимание.
Различные отделы ЦНС. Действие нейролептиков проявляется на всех уровнях нервной системы. Хотя наши знания о природе антипсихотического действия и ряда неврологических побочных эффектов этих препаратов остаются неполными, теории, основывающиеся на их способности блокировать дофаминовые рецепторы в базальных ядрах и лимбической системе, подкреплены большим количеством данных.
Кора головного мозга. Поскольку психоз всегда включает нарушение высших психических функций, в том числе и мышления, влияние нейролептиков на кору головного мозга представляет большой интерес. Нейролептики взаимодействуют с окончаниями дофаминергических нейронов в префронтальных и глубоких височных (связанных с лимбической системой) областях коры. В данных областях нейролептики почти не вызывают адаптивных изменений метаболизма дофамина, которые могли бы свидетельствовать о развитии толерантности (Bunney et al., 1987).
Порог судорожной готовности. Многие нейролептики снижают порог судорожной готовности и вызывают изменения ЭЭГ, характерные для эпилепсии. Этот эффект особенно свойственен клозапину и алифатическим фенотиазинам (например, хлорпромазину) и гораздо менее характерен для высокоактивных нейролептиков из группы пиперазиновых фенотиазинов и тиоксантенов (особенно фторфеназина и тиотиксена), а также для рисперидона (Itil, 1978; Baldessarini and Frankenbuig, 1991). Влияние бутирофенонов на порог судорожной готовности изменчиво и непредсказуемо, в то время как молиндон почти не оказывает эпнлептогенного действия. Клозапин и оланзапин вызывают изменения ЭЭГ чаще, чем большинство высокоактивных нейролептиков, включая рисперидон (Centorrino et al., 2001). У лиц, не страдающих эпилепсией, риск припадков прямо зависит от дозы клозапина (Baldessarini and Frankenburg, 1991). Нелеченная эпилепсия, алкогольный абстинентный синдром, отмена барбитуратов и транквилизаторов — противопоказания к назначению фенотиазинов и тиоксантенов с низкой активностью, а также клозапина. В крайнем случае эти препараты следует назначать с предельной осторожностью. В то же время у больных эпилепсией, получающих противосудорожные средства (гл. 21), можно использовать большинство нейролептиков. В таких случаях особенно показаны пиперазины и новые препараты — кветиапин и рисперидон. При этом дозы нейролептика не должны быть слишком высокими, а повышать их следует постепенно.
Базальные ядра. Как отмечалось выше, большинство нейролептиков вызывают выраженные экстрапирамидные побочные эффекты. В связи с этим их действие на базальные ядра — хвостатое ядро, скорлупу, бледный шар и другие, играющие важнейшую роль в управлении движениями и позой, — всегда вызывало большой интерес. Известно, что главную роль в патогенезе болезни Паркинсона играет дефицит дофамина в системе базальных ядер.
То, что нейролептики блокируют дофаминовые рецепторы и вызывают неврологические побочные эффекты, удивительно похожие на проявления болезни Паркинсона, привело к предположению, согласно которому в основе развития этих побочных эффектов лежит подавление дофаминергической передачи (Carlsson, 1990).
Гипотеза, в соответствии с которой подавление дофаминергической передачи в переднем мозге млекопитающих ответственно за развитие неврологического, а возможно, и антипсихотического действия нейролептиков, основывается на том, что нейролептики закономерно повышают концентрацию метаболитов дофамина, в то время как их влияние на метаболизм других медиаторов изменчиво. Важность влияния нейролептиков на обмен дофамина подчеркивается и гистохимическими исследованиями, в которых была выявлена высокая концентрация дофаминергических нервных волокон в путях, соединяющих средний мозг и базальные ядра (прежде всего в нигростриарном пути), а также в гипоталамусе (гл. 12). Другие дофаминергические нейроны идут из ядер покрышки среднего мозга в лимбические структуры, а также в области височной и префронтальной коры, связанные с лимбической системой. Из этих наблюдений выросла несколько упрощенная, но тем не менее заманчивая гипотеза: экстрапирамидные побочные эффекты нейролептиков связаны с блокадой дофаминергической передачи в базальных ядрах, а их антипсихотический эффект — с аналогичным действием в лимбической, мезокортикальной и гипоталамической системах.
Блокада дофаминовых рецепторов — важный компонент действия нейролептиков (Carlsson, 1990). Вскоре после введения нейролептики (в противоположность химически сходным, но не оказывающим антипсихотического действия веществам) повышают образование метаболитов дофамина, скорость превращения тирозина в ДОФА и его метаболиты, а также электрическую активность дофаминергических нейронов в среднем мозге. Эти явления, по-видимому, отражают адаптивный ответ нервной системы на подавление дофаминергической передачи в переднем мозге.
Имеются и другие наблюдения, свидетельствующие в пользу дофаминовой гипотезы. Так, небольшие дозы типичных нейролептиков блокируют поведенческие и нейроэндокринные эффекты дофаминергических препаратов при внутримозговом введении или системном назначении последних. Например, апоморфин, под действием которого крысы начинают стереотипно грызть различные предметы, теряет свое действие на фоне введения нейролептиков. Многие типичные нейролептики (за исключением бутирофенонов, их аналогов и замещенных бензамидов) блокируют действие дофаминергических средств на аденилатциклазу, сопряженную с D1 -рецепторами, в переднем мозге (рис. 20.1). Однако атипичные нейролептики, такие, как клозапин и кветиапин, препятствуют действию дофаминергических препаратов лишь в незначительной степени (Campbell et al., 1991). Ранние эффекты типичных нейролептиков включают блокаду D2-рецепторов и стимуляцию электрической и метаболической активности дофаминергических нейронов, но затем эти реакции сменяются снижением активности, особенно в базальных ядрах (Bunney et al., 1987). Динамика этих адаптивных процессов коррелирует с постепенным развитием гипокинезии на фоне лечения нейролептиками (Tarsy et al., 2001).
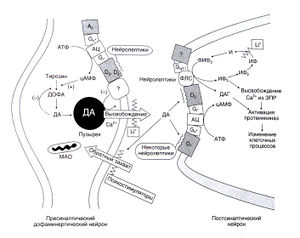
Описание к рис. 20.1. Механизмы действия нейролептиков и лития. В утолщениях, расположенных по ходу конечных разветвлений дофами-| нергических волокон, идущих из среднего мозга в передний, тирозин под действием тирозингидроксилазы окисляется до ДОФА. I Эго лимитирующая реакция синтеза катехоламинов. Затем ДОФА декарбоксилируется декарбоксилазой ароматических L-амино-: кислот с образованием дофамина, который запасается в пузырьках. Деполяризация в присутствии ионов Са2+ приводит к высвобо-j вдению (экзоцитозу) дофамина; этот процесс подавляется литием. Выделившийся дофамин взаимодействует с постсинаптиче-скими D,- и Dj-рецепторами (и со структурно сходными, но менее распространенными другими Di-подобными и Б2-подобными рецепторами), а также с пресинаптическими D2- и 03-ауторецепторами. Инактивация дофамина осуществляется в основном путем его активного транспорта в пресинаптическое волокно (обратного захвата) с последующим дезаминированием митохондри-; альной МАО; этот активный транспорт подавляется многими психостимуляторами. Стимуляция постсинаптических Эгрецепторов приводит к опосредованной белками G, активации аденилатциклазы; последняя превращает АТФ в цАМФ. Напротив, стимуляция D2-рецепторов приводит к опосредованному белками G| ингибированию аденилатциклазы. Кроме того, активация D2-pецепторов сопровождается открыванием связанных с ними калиевых каналов, подавлением медленного кальциевого тока и стимуляцией фосфолипазы С (возможно, посредством (βу-субъединиц, высвобождающихся при активации Gi-белков; см. гл. 2). Фосфо-липаза С превращает ФИФ2 в ИФ) и ДАГ; это, в свою очередь, оказывает вторичный эффект на активность внутриклеточного кальция и протеинкиназ. Литий подавляет инозитолмонофосфатазу, превращающую инозитолфосфат в инозитол. Как литий, так и мльпроевая кислота могут влиять на содержание и функцию G-белков, на протеинкиназы и некоторые клеточные (в том числе внутриядерные) регуляторные факторы. Активация D2-ауторецепторов приводит к подавлению синтеза дофамина, снижению ; фосфорилирования тирозингидроксилазы, а также подавлению высвобождения дофамина (возможно, путем влияния на кальциевые и калиевые токи). Напротив, пресинаптические пуриновые А2-рецепторы активируют аденилатциклазу и, посредством I цАМФ, стимулируют тирозингидроксилазу. Почти все нейролептики блокируют как постсинаптические, так и пресинаптические Dj-рецепторы; некоторые блокируют также Di-рецепторы (табл. 20.2). В начале лечения нейролептиками дофаминергические нейроны активируются и начинают высвобождать больше дофамина. Затем, на фоне продолжительного приема препаратов, про-! дукция и высвобождение дофамина снижаются, но блокада дофаминовых рецепторов сохраняется. АЦ — аденилатциклаза, ДА — дофамин, И — инозитол, ИФ — инозитолфосфат, ИФ2 — инозитолдифосфат, ФЛС — фосфолипаза С, ЭПР — эндоплазматиче-I скийретикулум.
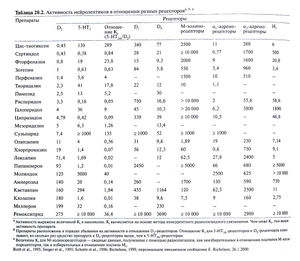
Для более подробного изучения механизма действия нейролептиков изучалось их связывание с различными типами дофаминовых рецепторов (табл. 20.2 и рис. 20.1, а также Civelli et al., 1993; Baldessarini and Tarazi, 1996; Neve and Neve, 1997). Клиническая эффективность большинства нейролептиков коррелирует с их сродством к 02-рецепторам in vitro (гл. 12). Эта взаимосвязь несколько затушевывается тем, что разные нейролептики в разной степени накапливаются в мозговой ткани (Tsune-izumi et al., 1992; Cohen et al., 1992). Тем не менее несомненно, почти все эффективные нейролептики (важные исключения — клозапин и кветиапин) имеют высокое сродство к D2-рецепторам. Нейролептики, активные в отношении D1-рецепторов(это, в первую очередь, тиоксантены и фенотиазины), одновременно блокируют D2- и другие D2-подобные рецепторы (Sokoloff et al., 1990; Van Tol et al., 1991; Baldessarini and Tarazi, 1996; Tarazi and Baldessarini, 1999). Бутирофеноны и их аналоги (например, галоперидол, пимозид, N-метилспиперон), так же как и замещенные бензамиды (например, сульпирид, этиклоприд, немонаприд, раклоприд, ремоксиприд), — относительно избирательные блокаторы D2- и D3-рецепторов, обладающие различным сродством к D4-рецепторам. Физиологические и клинические последствия избирательной блокады D1 и D5-рецепторов не известны. Экспериментальные дибензазепины, обладающие такими свойствами (например, SCH-23390 и SCH-39166, или экопипам), по-видимому, оказывают лишь слабое антипсихотическое действие (Daly and Waddington, 1992; Kebabianetal., 1997).
Атипичные нейролептики, такие, как клозапин и другие дибензазепины, редко вызывающие экстрапирамидные побочные эффекты, имеют низкое сродство к D2-рецепторам. Вместе с тем они, как и многие другие нейролептики, активно блокируют а1адренорецепторы (Baldessarini et al., 1992). С одной стороны, это действие может вносить вклад в развитие седативного и гипотензивного эффектов, с другой — отвечать за некоторые полезные психотропные свойства. Следует отметить, однако, что психотропные свойства центральных а-адреноблокаторов изучены плохо. Многие нейролептики, в первую очередь клозапин, оланзапин, кветиапин, рисперидон, а также некоторые экспериментальные препараты блокируют 5-НТ2А-рецепторы (Chouinardetal., 1993; Leysenetal., 1994; гл. 11). Именно комбинация умеренного сродства к различным типам центральных рецепторов (включая М-холинорецепторы и Н1-рецепторы), вероятно, определяет уникальные фармакологические свойства атипичного нейролептика клозапина (Baldessarini and Frankenburg, 1991). Клозапин обладает также умеренной избирательностью в отношении D4-рецепторов (по сравнению с остальными подтипами дофаминовых рецепторов). Плотность этих рецепторов, локализующихся в основном в коре головного мозга и лимбической системе, повышается при длительном приеме уозапина и других нейролептиков, как типичных, так и атипичных. Возможно, блокада этих рецепторов вносит вклад в антипсихотическое действие. Вместе с тем показано, что избирательные блокаторы D4-рецепторов, равно как и смешанные блокаторы D4- и 5-НТ2А-рецепторов, при лечении психозов неэффективны (Baldessarini, 1997; Kramer et al., 1997; Tarazi and Baldessarini, 1999; Truffinet et al., 1999).
Лимбическая система. Аксоны дофаминергических нейронов среднего мозга заканчиваются в ядрах прозрачной перегородки, обонятельном бугорке, миндалевидном теле и других структурах, расположенных в лобных и височных долях головного мозга. Рассмотренная выше дофаминовая гипотеза стимулировала интерес исследователей к мезолимбической и мезокортикальной дофаминергическим системам, предположительно ответственным за некоторые элементы антипсихотического действия нейролептиков. Теории происхождения эндогенных психозов, таких, как шизофрения, на протяжении многих лет пытались связать развитие этих расстройств с аномалиями лимбической системы. Непрямым подтверждением этих теорий служат многочисленные случаи «природных экспериментов» — развития психозов при органических повреждениях височных долей и других участков лимбической системы.
Обнаружение того факта, что D3- и D4-рецепторы преимущественно локализуются в лимбических отделах ЦНС, стимулировало поиск препаратов, избирательных в отношении этих рецепторов. Предполагалось, что такие препараты могут оказывать антипсихотическое действие, не вызывая при этом выраженных экстрапирамидных побочных эффектов. Пока этот поиск не увенчался успехом (Kebabian et al., 1997; Kramer et al., 1997; Lahti et al., 1998; Tarazi and Baldessarini, 1999). Более того, было обнаружено, что длительное введение крысам как типичных, так и атипичных нейролептиков не изменяет плотности D3-рецепторов в переднем мозге, в то время как плотность D2- и D4-рецепторов увеличивается (Tarazi et al., 1997). На этом основании было высказано предположение, что D3-рецепторы не играют существенной роли в антипсихотическом действии нейролептиков. Возможно, это связано с высоким сродством D3-рецепторов к эндогенному дофамину, затрудняющим взаимодействие рецептора с молекулой нейролептика (Levant, 1997).
Многие данные, полученные для дофаминергической системы базальных ядер, пытались перенести на соответствующие мезолимбические и мезокортикальные системы. Ряд важных эффектов нейролептиков, включая связывание с дофаминовыми рецепторами, в базальных ядрах и лимбической системе сходны. Вместе с тем экстрапирамидный и антипсихотический компоненты действия нейролептиков во многом различаются. Например, некоторые острые экстрапирамидные эффекты нейролептиков ослабевают или полностью исчезают со временем (либо при назначении М-холиноблокаторов); антипсихотическое же действие этих препаратов не меняется. Дофаминергические системы разных отделов переднего мозга различаются как в функциональном отношении, так и по адаптивным реакциям, развивающимся после введения препаратов (Bunney et al., 1987; Moore, 1987; Sulserand Robinson, 1978; Wolf and Roth, 1987). Так, М-холиноблокаторы подавляют вызванное введением нейролептиков компенсаторное усиление обмена дофамина только в базальных ядрах, но не в богатых дофаминергическими окончаниями областях лимбической системы. Более того, толерантность к усилению обмена дофамина развивается в лимбической системе в гораздо меньшей степени, чем в базальных ядрах (Carlsson, 1990).
Связывание нейролептиков с основными типами рецепторов головного мозга человека in vivo. Степень связывания нейролептиков с дофаминовыми, а также некоторыми другими рецепторами головного мозга может быть оценена in vivo с помощью позитронно-эмиссионной томографии. Этот метод не только подтверждает результаты лабораторных проб, оценивающих связывание нейролептиков с рецепторами (табл. 20.2), но и в известной степени позволяет предсказать клиническую эффективность, терапевтические дозы и риск экстрапирамидных побочных эффектов тех или иных препаратов — даже в отсутствие законченных клинических испытаний (Farde et al., 1995; Waddin-gton and Casey, 2000). Так, связывание более чем с 75% D2- и других D2-подобных рецепторов в базальных ядрах ассоциируется с высоким риском острых экстрапирамидных побочных эффектов и часто наблюдается при введении терапевтических доз типичных нейролептиков (Farde et al., 1995). Напротив, клозапин в терапевтических дозах обычно связывается лишь с 40— 50% 02-рецепторов, но одновременно — с 70—90% корковых 5-НТ2-рецепторов (Kapur et al., 1999; Nordstrom et al., 1995).
В данном отношении с клозапином сходен лишь один нейролептик—кветиапин, который связывается с 40—50% D2-рецеп торов и с 50—70% 5-НТ2-рецепторов (Gefvert et al., 1998). Оланзапин и рисперидон активно связываются как с корковыми 5-НТ2-рецепторами (80—100%), так и с D2-рецепторами (обычно 50—90%) (Farde etal., 1995; Nordstrom etal., 1998; Kapur etal.,1999). Оланзапин обладает более выраженным, чем рисперидон, М-холиноблокирующим действием; возможно, именно поэтому оланзапин реже вызывает острые экстрапирамидные побочные эффекты (табл. 20.1 и 20.2).
Гипоталамус и эндокринная система. Помимо антипсихотического и экстрапирамидного эффектов, частично обусловленных, как предполагается, блокадой дофаминовых рецепторов, нейролептики могут вызывать эндокринные сдвиги. Последние обусловлены влиянием нейролептиков на гипоталамус и гипофиз также, по-видимому, опосредованным блокадой дофаминовых рецепторов.
Самый важный эндокринологический побочный эффект большинства нейролептиков — это усиление секреции пролактина. Этот эффект, вероятно, обусловлен блокадой D2-рецепторов, расположенных на лактотропных клетках аденогипофиза. Дофамин образуется в нейронах ядер воронки, затем по тубероинфундибулярному пути поступает в воронку гипоталамуса и секретируется в воротную систему гипофиза. В гипофизе дофамин связывается с D2-рецепторами, подавляя секрецию пролактина (Ben-Jonathan, 1985; см. также гл. 56).
В отношении большинства нейролептиков справедливо правило: чем сильнее препарат стимулирует секрецию пролактина, тем выше его антипсихотическая активность, и наоборот (Sachar, 1978). Клозапин и кветиапин представляют собой исключения — они почти не влияют на уровень пролактина (Arvanitis etal., 1997; Sachar, 1978); оланзапин повышает этот уровень лишь кратковременно незначительно (Tollefson and Kuntz, 1999). Рисперидон, наоборот, необычно резко повышает секрецию пролактина (Grant and Fitton, 1994). Следует отметить, что повышение секреции пролактина начинается уже при приеме нейролептиков в низких дозах, недостаточных для достижения антипсихотического эффекта, что, возможно, отражает отсутствие гематоэнцефалического барьера в аденогипофизе. Этот эффект почти не ослабевает со временем, оставаясь неизменным даже спустя годы после начала лечения. Вместе с тем после прекращения приема нейролептиков он быстро исчезает (Bitton and Schneider, 1992). С усилением секреции пролактина, видимо, связаны нагрубание молочных желез и галакторея, время от времени наблюдающиеся при приеме нейролептиков, в том числе и у мужчин (при использовании высоких доз). Поскольку обычно нейролептики назначаются на длительный срок и, следовательно, вызывают хроническую гиперпролактинемию, предполагалось, что они могут повышать риск рака молочной железы. Хотя результаты клинических исследований не подтвердили этих опасений (Dickson and Glazer, 1999; Mortensen, 1994), нейролептики, равно как и другие стимуляторы секреции пролактина, не должны назначаться больным раком молочной железы, особенно при наличии метастазов. Некоторые нейролептики подавляют секрецию гонадотропных гормонов, эстрогенов и прогестерона, что, возможно, способствует развитию аменореи.
Влияние нейролептиков на другие нейроэндокринные функции гипоталамуса изучено гораздо слабее. Известно, что они подавляют высвобождение СТГ и, возможно, снижают секрецию кортиколиберина в ответ на стресс. Несмотря на подавление секреции СТГ, нейролептики малоэффективны при акромегалии и, видимо, не тормозят рост и развитие ребенка. Хлорпромазин может снижать секрецию АДГ и окситоцина. Большинство нейролептиков — в особенности клозапин, другие препараты с низкой активностью и оланзапин — вызывают усиление аппетита и прибавку в весе. Кроме того, хлорпромазин может подавлять выброс инсулина и нарушать толерантность к глюкозе, что иногда имеет клиническое значение (Erie et al., 1977). Наконец, некоторые атипичные нейролептики (прежде всего клозапин, оланзапин и кветиапин), по-видимому, повышают риск инсулинонезависимого сахарного диабета, причем этот эффект не может быть полностью объяснен лишь прибавкой в весе (Wirs-hingetal., 1998).
Помимо нейроэндокринных эффектов, вероятно, ряд вегетативных побочных эффектов нейролептиков также обусловлен их действием на гипоталамус. Важный пример — развивающаяся при приеме хлорпромазина и других нейролептиков пойкилотермия, то есть нарушение терморегуляции, при котором в зависимости от температуры окружающей среды у больного может наблюдаться гипо- или гипертермия. Клозапин иногда вызывает гипертермию.
Ствол головного мозга. Терапевтические дозы нейролептиков обычно не влияют на дыхание. Однако стволовые и гипотала мические сосудодвигательные рефлексы подавляются уже сравнительно небольшими дозами хлорпромазина. Этот эффект реализуется на различных уровнях рефлекторной дуги, а его конечным результатом является снижение АД. Даже при тяжелой острой передозировке (например, при попытке самоубийства) нейролептики обычно не вызывают опасной для жизни комы или угнетения дыхания и сердечной деятельности, поэтому они относительно безопасны. Так, для снятия возбуждения при делирии галоперидол успешно назначался в дозах свыше 500 мг/сут в/в (Tesar et al., 1985).
Рвотный центр. Большинство нейролептиков блокируют рвотное действие апоморфина и некоторых алкалоидов спорыньи — веществ, взаимодействующих с дофаминовыми рецепторами хеморецепторной триггерной зоны продолговатого мозга. Противорвотное действие присуще даже низким дозам большинства нейролептиков. Хотя нейролептики не предотвращают рвоту, вызванную различными, в том числе фармакологическими, воздействиями на узловатый ганглий или рецепторы ЖКТ, некоторые из них (мощные пиперазины и бутирофеноны) иногда помогают подавить тошноту вестибулярного происхождения.
Вегетативная нервная система. Нейролептики способны взаимодействовать со многими типами рецепторов, включая З-НТ2A-, Н1 - и а-адренорецепторы, в силу чего их влияние на вегетативную нервную систему сложно и плохо предсказуемо. .Хлорпромазин, клозапин и тиорилазин обладают особенно сильным а-адреноблокируюшим действием. Мощные нейролептики, такие, как пиперазиновые фенотиазины (например, фторфена-зин и трифгорперазин), галоперидол и рисперидон. блокируют а-адренорецепторы лишь в незначительной степени.
М-холиноблокируюшее действие нейролептиков относительно невелико; вместе с тем при приеме хлорпромазина нередко возникает нечеткость зрения, видимо, обусловленная блокадой М-холинорепепторов ресничной мышцы. Хлорпромазин часто вызывает миоз — возможно, за счет а-адреноблокирующего действия. Другие фенотиазины могут вызывать мидриаз; он особенно часто возникает при приеме клозапина и тиоридазина — сравнительно сильных М-холиноблокаторов. Хлорпромазин может вызывать запор, снижать секрецию желудочного сока и подавлять моторику желудка. Клозапин иногда вызывает слюнотечение (очевидно, за счет нарушений глотания и иных механизмов удаления слюны) и выраженные нарушения моторики кишечника (Rabmowitz et al., 1996; Theret et al., 1995). Подавление слюно- и потоотделения — также следствие М-холиноблокирующего действия нейролептиков. Острая задержка мочи при приеме нейролептиков — явление нечастое, однако она может наблюдаться у мужчин с простатизмом. Мощные нейролептики, включая галоперидол и рисперидон, обладают слабым М-холиноблокирующим действием. Фенотиазины не нарушают эрекции, но могут угнетать эякуляцию. По не вполне ясным причинам особенно часто этот эффект наблюдается при приеме тиоридазина, из-за чего бальные иногда отказываются от препарата. Эта особенность тиоридазина лишь частично может быть связана с блокадой а-адренорецепторов, поскольку, например, хлорпромазин обладает более сильным а-адреноблокирующим действием по сравнению с тиоридазином. но нарушение эякуляции тем не менее вызывает реже.
Выделительная система и электролитный баланс. У людей и у животных хлорпромазин может оказывать слабое мочегонное действие, предположительно связанное с угнетением секреции АДГ, подавлением реабсорбции воды и электролитов в результате прямого действия на почечные канальцы или обоими этими эффектами. Небольшое снижение АД под действием хлорпромазина не вызывает существенных изменений клубочковой фильтрации; почечный кровоток даже несколько усиливается. Показано, что клозапин, вероятно за счет своего центрального действия, облегчает состояние больных с первичной полидипсией, иногда сопровождающейся гипонатриемией. Сердечно-сосудистая система. Действие хлорпромазина на сердечно-сосудистую систему сложно. Оно складывается из нескольких компонентов; прямого действия препарата на сердце и сосуды и непрямого действия, опосредованного ЦНС и вегетативными рефлексами. Хлорпромазин и другие нейролептики с низкой активностью, а также некоторые атипичные нейролептики могут вызвать ортостатическую (преимущественно систолическую) гипотонию. Обычно в течение нескольких недель к гипотензивному эффекту вырабатывается толерантность. Вместе с тем умеренная ортостатическая гипотонии может сохраняться неопределенно долго, особенно у пожилых больных (Ray et al., 1987).
Хлорпромазин и другие фенотиазины с низкой активностью обладают прямым отрицательным инотропным и хинидиноподобным эффектами. Они вызывают характерные изменения ЭКГ: удлинение интервалов QT и PQ, снижение зубца Т, депрессию сегмента ST. Тиорилазин особенно часто вызывает изменения интервала QT и зубца Т; в исключительно редких случаях под действием препарата может развиться желудочковая аритмия и даже наступить внезапная смерть. Все эти эффекты гораздо менее свойственны высокоактивным нейролептикам.
Клозапин изредка вызывает миокардит (на ранних стазмп лечения) к дилаташюнную кардиоыио патио (в более позаиие сроки) (Killian etai.. 1999).
Прочие эффекты. Помимо дофаминергической системы нейролептики взаимодействуют и с другими центральными медиа-торными системами, что может иметь значение для атипетпо-тического действия и иных фармакологических эффектов. Так. многие нейролептики усиливают халинергическую передачу, особенно в базальных ядрах. Возможно, это обусловлено блокадой ингибирующих дофаминовых гетерорецепторов холинер-гических нейронов. Кроме того, как отмечалось выше, нейролептики оказывают центральное М-халиноблокирующее действие: чем сильнее оно выражено, тем меньше вероятность развитая экстрапирамидных побочных эффектов (Snyder and Yama-mura, 1977). Хлорпромазин и другие нейролептики с низкой активностью. включая клозапин. блокируют Н,-рецепторы. что, вероятно, частично обусловливает седативный эффект. Нейролептики могут также блокировать 5- НТ^-рецепторы переднего мозга. Клиническое значение этого остается неясным, однако известно, что клозапин представляет собой довольно мощный и относительно избирательный блокатор З-НТтд-рецепторов. Многие новые нейролептики, такие, как рисперидон, оланзапин. кветиапин, сертиндсш и шшразидон, были синтезированы в том числе для того, чтобы воспроизвести этот компонент действия клозапина (Ichikawa and Meltzer, 1999; Meltzerand Nash, 1991). Фармакокинетика. Всасывание многих нейролептиков изменчиво и непредсказуемо, особенно при приеме внутрь, даже в жидких лекарственных формах. В/м введение увеличивает биодоступность препаратов в 4—10 раз. Нейролептики легко растворяются в жирах, связываются с белками и клеточными мембранами и накапливаются в головном мозге, легких и других тканях с богатым кровоснабжением. Кроме того, они проходят через плаценту и могут поступать в молоко. Удалить эти препараты из организма с помощью гемодиализа почти невозможно (обычно в этом также нет необходимости).
Обычно Т1/2 нейролептиков составляет 20—40 ч, однако элиминация некоторых препаратов, особенно бути-рофенонов и их аналогов, может быть сложной и замедленной (Cohen et al., 1992). После однократного приема действие нейролептика продолжается обычно не менее суток, в связи с чем после развития толерантности к побочным эффектам больной может принимать всю суточную дозу за один раз. Элиминация препаратов из липидных депо, прежде всего из ЦНС, может происходить медленнее, чем из крови, однако подробно этот вопрос не изучался (Sedvall, 1992). Метаболиты некоторых нейролептиков продолжают выделяться с мочой на протяжении нескольких месяцев после отмены препаратов. То, что обострение психоза обычно развивается лишь спустя длительное время после прекращения лечения, возможно, связано с замедленной элиминацией нейролептиков. Существуют препараты этерифицированных форм нейролептиков для в/м введения, всасывание и элиминация которых значительно замедлены по сравнению с их аналогами для приема внутрь. Например, Т|/2 фторфеназина гидрохлорида при приеме внутрь равен примерно 20 ч, в то время какТ|/2 вводимого в/м фторфеназина деканоата составляет 7—10 сут, а после продолжительного лечения полное его выведение с нормализацией уровня пролак-тина может потребовать 6—8 мес (Sampath et al., 1992).
Основные пути метаболизма нейролептиков — окисление микросомальными ферментами печени и конъюгация. Их гидрофильные метаболиты выделяются с мочой и, в некоторой степени, с желчью. Большинство окисленных метаболитов нейролептиков биологически
неактивны, однако существуют и важные исключения Прежде всего 7-гидроксихлорпромазин. мезоридазин. некоторые N-деметилированные метаболиты фенотиа-ЗИНов и 9-гидроксирисперидон). Активные метаболиты, саоной стороны, вносят вклад в действие препарата, с другой — нарушают взаимосвязь между сывороточной кондантрапией исходного вещества и клинической эффективностью. Нейролептики с низкой активностью моги незначительно ускорять свой собственный печеноч-щй метаболизм; видимо, поэтому сывороточная концентрация хлорпромазина и других фенотиазинов снимется спустя несколько недель лечения постоянными ядами. Другое возможное объяснение данного феномена — нарушение моторики ЖКТ под действием нейролептиков. Метаболизм и выведение нейролептиков залашены у плода, грудных детей и пожилых, однако у дегей более старшего возраста метаболизм этих препаратов, наоборот, ускорен по сравнению со взрослыми (Kut-cher, 1997).
Бисдоступность некоторых нейролептиков несколько увеличивается ори использовании жидких лекарственных форм. Максимальная сывороточная концентрация хлорпромазина и других фенотиазинов достигается за 2—4 ч после приема внутрь. В/м введение этих препаратов позволяет избежать метаболизма
9 печени (и, возможно, в кишечнике) при первом прохожие-щи; в результате сывороточная концентрация препарата начинает определять:я уже спустя 15—30 мин. При переходе от приема внутрь к парентеральному введению биодоступность хлорпромазина может увеличиваться десятикратно, однако дозы обычно уменьшают лишь в 3—4 раза. Всасывание хлорпромази-и в ЖКТ может непредсказуемо меняться в зависимости от приема пиши и, видимо, снижается под действием антацидов. Одновременное назначение антипаркинсонических М-холи-воблокаторов, вероятно, существенно не влияет на всасывание нейролептиков (Simpson et al., 1980). Хлорпромазин и другие нейролептики легко связываются с клеточными мембранами и белками плазмы. Обычно с альбумином связывается более 85% препарата. Концентрация некоторых нейролептиков (например, галоперидола) в головном мозге может быть в 10 раз выше, тем в крови (Tsuneizumi et al., 1992), а их объем распределения достигает 20 л/кг.
Снижение сывороточной концентрации хлорпромазина включает две фазы: быструю фазу распределения (Т1//2 около 2 ч) и более медленную фазу выведения (Т1/2 около 30 ч), причем их длительность в разных исследованиях широко различается. Тщ хлорпромазина для головного мозга не известен, но может быть определен в будущем с помощью позитронно-эмиссионной томографии (Sedvall, 1992). Приблизительные Т1/2 основных нейролептиков приведены в табл. 20.3.
Попытки связать сывороточную концентрацию хлорпромазина или его метаболитов с клиническим эффектом не увенчались успехом (Baldessarini et al., 1988; Cooper et al., 1976). Было обнаружено, что у разных больных сывороточные концентрации хлорпромазина могут значительно (по крайней мере десятикратно) различаться. Хотя, по-видимому, сывороточная концентрация ниже 30 нг/мл недостаточна для получения нужного антипсихотического эффекта, а уровни свыше 750 нг/мл токсичны (Rivera-Calimlim and Hershey, 1984), оптимальный в клиническом отношении диапазон концентраций хлорпромазина до сих пор не определен.
У человека в существенных концентрациях обнаруживаются по крайней мере 10—12 метаболитов хлорпромазина (Morselli, 1977). Количественно из них наиболее значимы норг-хлорпро-мазин (лишенный двух метальных групп), хлорфенотиазин (лишенный всей боковой цепи), метокси- и гидроксилированные производные, а также глюкурониды гидроксилированных производных. В моче преобладают 7-гидроксилированные и N-де-алкилированные (нор^) метаболиты и их глюкурониды. Хлорпромазин и другие фенотиазииы метабодизируются в основном изоферментом IID6 автохрома Р450.
По фармакокинетике и метаболизму тиоридазин и фгорфе-назин сходны с хлор промази ном. однако выраженное М-холи-ноблокирующее действие тиоридазина на кишечник может влиять на всасывание препарата. Основные метаболиты тиорида-зина и фторфеназина включают гидроксилированные по кольцевым структурам, N-деметилированные и S-окисленные соединения (Neumeyerand Booth, 2001). Сывороточная концентрация тиоридазина может бьлъ довольно высокой (сотни нг/мл). видимо, за счет его относительно выраженной гидрофильно-сти. Значительная часть тиоридазина превращается в активный метаболит мезоридазин, использующийся в качестве отдельного препарата и, вероятно, вносящий существенный вклад в антипсихотическое действие тиоридазина.
Метаболизм тиоксантенов сходен с метаболизмом фенотиазинов, однако тиоксантекы часто образуют сульфоксиды и редко — соединения, гидроксилированные по кольцевым структурам. Пиперазиновые фенотиазииы и тиоксантены метаболизи-руются примерно так же, как и хлорпромазин, оанако у них видоизменяется и само пиперазиновое кольцо.
Выведение из крови галоперидола и родственных ему соединений не описывается одной экспоненциальной функцией. Их Т1/2 увеличивается со временем, причем конечный Тщ очень велик, он составляет примерно 1 нед (Cohen et al., 1992). Галоперидол и другие бутирофеноны метабодизируются в основном путем N-деалкилирования; образующиеся в результате неактивные соединения могут связываться с глюкуроновой кислотой. Почти все метаболиты галоперидола биологически неактивны. Возможно, исключение составляет гидроксилированное производное, образующееся путем восстановления кето-группы; это соединение может быть вновь окислено с образованием галоперидола (Korpi et al., 1983). Другое производное галоперидола, возможно, обладающее нейротоксичностью, — замещенный фенилпиперидин, химически сходный с вызывающим паркинсонизм 1-метил-4-фенил-1,2,3,6-тетрагидропиридином (МФТП). При посмертных исследованиях в мозговой ткани лиц, принимавших галоперидол, были обнаружены наномолярные концентрации этого вещества (Eyles et al., 1997; CastagnoJi et aJ., 1999). В клинической практике сывороточная концентрация галоперидола обычно составляет 5—20 нг/мл, что, согласно данным позитронно-эмиссионной томографии, соответствует связыванию 80—90% D2-рецепторов в базальных ядрах (Baldessarini et al., 1988; Wolkin et al., 1989).
Как правило, максимальная сывороточная концентрация клозапина (100—770 нг/мл) достигается спустя 2,5 ч после однократного приема внутрь 200 мг препарата. Обычные сывороточные концентрации клозапина в клинической практике — около 300—500 нг/мл. Клозапин преимущественно метаболизируется изоферментом IIIA4 цитохрома Р450 путем деметилирования, гидроксилирования и N-окисления с образованием неактивных производных, которые затем выводятся с калом и мочой. Т1/2 клозапина изменяется в зависимости от дозы и частоты приема, в среднем составляя 12 ч (табл. 20.3).
Рисперидон хорошо всасывается. Он метаболизируется в печени, преимущественно изоферментом IID6 цитохрома Р450 с образованием основного метаболита — 9-гидроксирисперидона. Поскольку это соединение и сам рисперидон примерно одинаково активны, клиническая эффективность препарата отражает действие обоих веществ. После приема внутрь максимальные сывороточные концентрации рисперидона и 9-гидроксирисперидона достигаются спустя 1 и 3 ч соответственно. Средний T1/2 обоих соединений составляет примерно 22 ч (табл. 20.3).
Оланзапин также хорошо всасывается, однако при приеме внутрь около 40% принятой дозы метаболизируется, не достигнув системного кровотока. Максимальная сывороточная концентрация оланзапина достигается спустя 6 ч после приема внутрь, а его Т1/2 составляет 20—54 ч (табл. 20.3). Основные метаболиты оланзапина неактивны и быстро выводятся из организма. К ним относятся 10-N-глюкурониды и 4'-деметилиро-ванные производные, образующиеся преимущественно с участием изофермента IA2, а также, в гораздо меньшей степени, изофермента IID6 цитохрома Р450 (United States Pharmacopoeia, 2000).
После приема внутрь кветиапин легко всасывается, достигая максимальной сывороточной концентрации через 1,5 ч; его Т1/2 составляет в среднем 6 ч (табл. 20.3). Препарат быстро метаболизируется печеночным изоферментом IIIA4 цитохрома Р450 с образованием неактивных сульфоксидов и кислотных производных, быстро выводимых из организма (United States Pharmacopoeia, 2000).
Толерантность и физическая зависимость. Нейролептики не вызывают пристрастия. Вместе с тем при приеме нейролептиков все же может формироваться легкая физическая зависимость, выражающаяся в развитии бессонницы и общего недомогания спустя несколько дней после резкой отмены препаратов.
На протяжении нескольких дней или недель к седативному эффекту нейролептиков обычно развивается толерантность. Развитие толерантности к нейролептикам, в том числе перекрестной, может быть продемонстрировано в поведенческих и биохимических исследованиях на животных, в первую очередь путем изучения блокады дофаминовых рецепторов в базальных ядрах (Baldessarini and Tarsy, 1979). Эта форма толерантности может быть менее выражена в лимбических и корковых областях переднего мозга. Одним из признаков формирования толерантности в дофаминергических системах головного мозга служит их сенсибилизация, развивающаяся, видимо, вследствие длительной блокады дофаминовых рецепторов. Эта сенсибилизация, вероятно, лежит в основе развития гиперкинезов (хорео-атетоза) при резкой отмене нейролептиков, особенно после длительного лечения высокими дозами высокоактивных препаратов (Baldessarini et al., 1980).
Хотя к некоторым эффектам нейролептиков может развиваться перекрестная толерантность, быстрая смена одного препарата другим при использовании высоких доз нередко приводит к нежелательным последствиям: чрезмерному седативному действию, артериальной гипотонии и другим вегетативным реакциям, а также острым экстрапирамидным расстройствам. При резкой отмене нейролептиков обострение психического заболевания наступает быстрее, чем при постепенной отмене (Viguera et al., 1997). Резкая отмена клозапина особенно часто приводит к обострениям, причем такие обострения плохо поддаются лечению другими нейролептиками (Baldessarini etal., 1997). Препараты и дозы. В мире используется большое количество нейролептиков. В табл. 20.1 приведены только те из них, которые в настоящее время применяются в США для лечения психозов.
Мы не рассматриваем здесь такие препараты, как резерпин, другие алкалоиды спорыньи и промазин, обладающие очень слабым антипсихотическим действием и редко использующиеся в современной психиатрии. Прохлорперазин — также слабый нейролептик, который к тому же часто вызывает острые экстрапирамидные реакции. Поэтому он редко применяется для лечения психозов, но иногда (в небольших дозах) используется в качестве противорвотного средства. Тиэтилперазин, разрешенный к применению только как противорвотное средство, — мощный блокатор дофаминовых рецепторов. По многим параметрам он сходен с нейролептиками и, возможно, в высоких дозах мог бы использоваться для лечения психозов (Rotrosen et al., 1978). Ряд других нейролептиков — тиоксантенов, бутирофенонов, дифенилбутилпиперидинов, замещенных бензамидов и препаратов длительного действия — применяются за пределами США.
Побочные эффекты
Нейролептики —довольно безопасные препараты с широким терапевтическим диапазоном. Большинство фенотиазинов и галоперидол имеют уплощенную кривую доза—эффект, что также позволяет использовать широкий диапазон доз. Хотя были описаны единичные случаи смерти от передозировки нейролептиков, их вероятность очень мала при доступности медицинской помощи и в отсутствие одновременного отравления алкоголем или другими веществами. В исследованиях на животных показано, что терапевтический индекс тиоридазина и хлорпромазина ниже, чем у высокоактивных нейролептиков (Janssen and Van Bever, 1978). Известны случаи, когда взрослые больные выживали после одномоментного приема до 10 г хлорпромазина. Смертельные исходы после передозировки галоперидола не известны, хотя этот препарат может вызывать опасные для жизни состояния: злокачественный нейролептический синдром и острую дистонию, иногда сопровождающуюся ларингоспазмом и нарушением дыхания.
Побочные эффекты нейролептиков во многом определяются их действием на сердечно-сосудистую, эндокринную, вегетативную нервную систему и ЦНС. Опасные побочные эффекты, включающие эпилептические припадки, агранулоцитоз, кардиотоксическое действие и пигментную дегенерацию сетчатки, встречаются редко (см. ниже).
Терапевтические дозы фенотиазинов могут вызывать дурноту, сердцебиение, а также побочные эффекты, связанные с М-холиноблокирующим действием: заложенность носа, сухость во рту, нечеткость зрения, запор, задержку мочи у мужчин с простатизмом. Из серьезных сердечно-сосудистых побочных эффектов наиболее часто встречается ортостатическая гипотония, иногда приводящая к обморокам и падениям. Чаще всего она развивается при приеме алифатических фенотиазинов и атипичных нейролептиков. Высокоактивные типичные нейролептики вызывают этот побочный эффект реже.
Неврологические побочные эффекты. Почти все нейролептики вызывают различные неврологические расстройства, прежде всего экстрапирамидные. Особенно часто эти побочные эффекты возникают при применении высокоактивных нейролептиков (пиперазиновых фенотиазинов и бутирофенонов). Клозапин, кветиапин, оланзапин, тиоридазин и низкие дозы рисперидона вызывают их существенно реже. Неврологические эффекты нейролептиков подробно описаны в обзорах Baldessarini and Tarsy, 1979; Baldessarini etal., 1980; Baldessarini, 1984; Baldessarini et al., 1990; Kane et al., 1992; Tarsy et al., 2001.
Неврологические расстройства, развивающиеся под действием нейролептиков, разделяются на шесть синдромов. Четыре из них (острая дистония, акатизия, паркинсонизм и редко встречающийся злокачественный нейролептический синдром) обычно развиваются в начале лечения, а два других (поздние нейролептические гиперкинезы, или поздняя дискинезия, и редко встречающийся периоральный тремор) — лишь на поздних его этапах. Типичные проявления каждого синдрома и общие указания по их лечению приведены в табл. 20.4.
Острая дистония обычно развивается в первые дни лечения, чаще при приеме высокоактивных нейролептиков, и проявляется непроизвольными сокращениями лицевых мышц, спастической кривошеей и окулогирными кризами. Внешне эти проявления могут напоминать истерические реакции вплоть до псевдоприпадков, однако, в отличие от последних, быстро проходят после парентерального введения антипаркинсонических М-холиноблокаторов. Прием последних внутрь может использоваться для профилактики острой дистонии, особенно у
молодых мужчин, принимающих высокоактивные нейролептики (Arana et al., 1988). Хотя острая дистония легко поддается лечению, она субъективно крайне мучительна для больного. При этом расстройстве было описано несколько случаев внезапной смерти, возможно, связанных с асфиксией при переходе дистонии на глоточные, гортанные и другие мышцы.
Акатизия — это гнетущее чувство дискомфорта, часто локализуемое в ногах и сопровождающееся непреодолимой потребностью совершать различные нецеленаправленные движения. Больные встают, беспрерывно ходят по комнате и абсолютно не способны усидеть на месте. Нередко акатизия ошибочно расценивается как психотическое возбуждение; дифференциальный диагноз в таких случаях чрезвычайно важен: при психотическом возбуждении дозу нейролептика надо повышать, а при ака-тизии, напротив, снижать либо заменять препарат (акатизия обычно плохо поддается лечению антипаркинсоническими средствами). Иногда помогают транквилизаторы или умеренные дозы пропранолола (Lipinski et al., 1984). Это распространенное состояние часто не распознается и вынуждает больного отказаться от лечения.
Нейролептический паркинсонизм часто неотличим от болезни Паркинсона. Его распространенность различна в разных возрастных группах. Синдром обычно развивается постепенно, на протяжении нескольких дней или недель и проявляется, в частности, заторможенностью произвольных движений (гипокинезией), резким обеднением мимики, снижением объема движений (особенно в руках), повышением мышечного тонуса и тремором в покое, чаще в кистях. Может наблюдаться типичный тремор типа «катания пилюль», хотя при нейролептическом паркинсонизме он встречается реже, чем при болезни Паркинсона. Паркинсонизм с присущими ему бедностью мимики и двигательной заторможенностью может быть ошибочно принят за депрессию. Лечится это состояние либо антипаркинсоническими М-холиноблокаторами, либо амантадином (гл. 22); стимуляторы дофаминовых рецепторов и леводофа не используются, поскольку могут привести к усилению возбуждения и углублению психоза. Иногда психозы развиваются при болезни Паркинсона; они могут быть как проявлением самого заболевания, так и реакцией на лечение дофаминергическими препаратами (гл. 22). В таких случаях рекомендуют клозапин и, возможно, кветиапин, так как при их приеме меньше вероятность усугубления неврологических симптомов (Menza et al., 1999; Parkinson Study Group, 1999).
Таблица 20.4. Неврологические побочные эффекты типичных нейролептиков
|
Синдром |
Симптомы |
Период Максимального риска |
Предполагаемый механизм развития |
Лечение |
|
Острая дистония |
Спазмы мышц языка, лица, шеи, спины; может напоминать эпилептический припадок; необходимо отличать от истерической реакции |
1—5-й день |
Не известен |
Антипаркинсонические средства используются в диагностических и лечебных целях |
|
Акатизия |
Двигательное беспокойство; необходимо отличать от пароксизма тревоги или психотического возбуждения |
5—60-й день |
Не известен |
Снижение дозы или смена препарата; могут быть полезны антипаркинсонические средства, бензодиазепины или пропранолол |
|
Паркинсонизм |
Гипокинезия, мышечная скованность, маскообразное лицо, шаркающая походка, тремор |
5—30-й день; может возобновляться даже после однократного приема |
Блокада дофаминовых рецепторов |
Антипаркинсонические средства |
|
Злокачественный нейролептический синдром |
Кататония, нарушение сознания, лихорадка, нестабильное АД, миоглобинемия; возможен смертельный исход |
Первые недели; может сохраняться несколько дней после отмены нейролептика |
Вероятно,отчасти связан с блокадой дофаминовых рецепторов |
Экстренная отмена нейролептика; иногда помогают дантролен или бромокриптинг; антипаркинсонические средства неэффективны |
|
Периоральный тремор (синдром кролика) |
Периоральный тремор (возможно, поздний вариант паркинсонизма) |
Спустя несколько месяцев или лет лечения |
Не известен |
Часто помогают антипаркинсонические средства |
|
Поздние нейролептические гиперки-незы |
Гиперкинезы мышц лица, в особенности периоральной области; распространенный хореоатетоз и (или) дистония |
Спустя несколько месяцев или лет лечения (ухудшается при отмене нейролептиков) |
Предположительно, усиление дофаминер-гической передачи |
Важнейшую роль играет профилактика; лечения нет |
|
При острой дистонии, как полагают, эффективны многие препараты. Чаще всего используются дифенгидрамин, 25 или 50 мг в/м, или бензатропин, 1 или 2 мг в/м или в/в медленно. Вслед за этим тот же самый препарат назначается внутрь на период от нескольких дней до нескольких недель. Подробнее об антипаркинсонических средствах см. в тексте этой главы и в гл. 22. Пропранолол нередко эффективен в относительно небольших дозах (20—80 мг/сут). Бетарадреноблокаторы менее эффективны. Несмотря на эффективность дантролена, при этом расстройстве не обнаружено нарушений кальциевого транспорта в скелетных мышцах. На фоне продолжающегося действия нейролептиков могут переноситься высокие дозы бромокриптина (10—40 мг/сут). | ||||
Злокачественный нейролептический синдром — редкое состояние, напоминающее крайне тяжелый вариант паркинсонизма. Оно проявляется изменчивыми по интенсивности грубым тремором и кататоническими симптомами, вегетативной нестабильностью (колебаниями пульса и АД, гипертермией), нарушением сознания, подъемом уровня КФК в крови и иногда миоглобинемией. В самых тяжелых случаях этот синдром может сохраняться более недели после отмены нейролептика. Поскольку смертность при злокачественном нейролептическом синдроме велика (более 10%), он требует экстренного медицинского вмешательства. Синдром может развиться при приеме разных нейролептиков, но чаще всего — при использовании больших доз высокоактивных препаратов,
У особенно при парентеральном введении. Лечение состоит прежде всего в немедленной отмене нейролептика и симптоматических мероприятиях. Специфическое лечение обычно неэффективно; иногда помогают дантролен и стимулятор дофаминовых рецепторов бромокриптин (Addonizioetal., 1987; Pearlman, 1986). Дантролен эффективен при злокачественной гипертермии, иногда развивающейся под действием некоторых средств для общей анестезии. Однако, несмотря на внешнее сходство с этим состоянием, злокачественный нейролептический синдром, по-видимому, не связан с нарушением транспорта кальция в скелетных мышцах.
Периоральный тремор редкое двигательное расстройство, иногда развивающееся на фоне длительного лечения нейролептиками. Его называют также синдромом кролика (Jus et al., 1974) в связи с тем, что тремор напоминает движения губ кролика. Иногда он рассматривается как один из поздних нейролептических гиперкинезов, однако под последними чаще понимают двигательные расстройства другого типа — хореоатетоз и дистонию. По своим характеристикам периоральный тремор более сходен с паркинсонизмом, представляя собой тремор с частотой 5—7 Гц, проходящий после отмены нейролептика или назначения М-холиноблокаторов.
Поздние нейролептические гиперкинезы (поздняя дискинезия) — неврологический синдром (или синдромы), развивающийся при длительном приеме нейролептиков. Чаще он наблюдается у пожилых; его риск при аффективных расстройствах, видимо, выше, чем при шизофрении. Средняя распространенность этого состояния среди молодых больных с хроническими психическими расстройствами составляет 15—25%, заболеваемость — 3—5% в год; частота спонтанных ремиссий, даже при продолжающемся приеме нейролептиков, лишь немного ниже. Клозапин вызывает это состояние гораздо реже; данных о новых атипичных нейролептиках пока недостаточно (Tarsy et al., 2001). Поздние нейролептические гиперкинезы — это стереотипные, повторяющиеся, безболезненные, непроизвольные, быстрые хореиформные (напоминающие тики) движения туловища, конечностей и мимической мускулатуры, особенно рта (гримасы), языка и век (моргание и зажмуривание). Отмечаются также более медленные, червеобразные движения (атетоз) и торсионно-деформирующие гиперкинезы с замиранием в вычурных позах; последние чаще встречаются у молодых мужчин и могут приводить к выраженной инвалидизации. Кроме того, выделяется группа, по-видимому, взаимосвязанных расстройств, проявляющихся преимущественно дистонией и акатизией. Все вышеописанные расстройства имеют волнообразное течение; они усиливаются при волнении и исчезают во сне (что характерно и для многих других экстрапирамидных расстройств).
Иногда состояние больных можно облегчить, назначив высокоактивный нейролептик или средство, истощающее запасы дофамина (резерпин, тетрабеназин). Однако такое лечение проводится лишь в самых тяжелых случаях, особенно сопровождающихся резистентной психотической симптоматикой. В некоторых случаях, особенно при наличии в клинической картине дистоний, помогает замена типичного нейролептика на клозапин. После отмены нейролептиков гиперкинезы иногда продолжаются неопределенно долго; чаще, однако, они постепенно (в течение нескольких месяцев) ослабевают и могут проходить полностью, особенно у молодых больных (Gardos et al., 1994; Morgenstem and Glazer, 1993; Smith and Baldessarini, 1980). Антипаркинсонические средства при поздних нейролептических гиперкинезах обычно малоэффективны и даже могут вызывать их усиление, что справедливо и в отношении других форм хореоатетоза, например болезни Гентингтона. В целом лечение поздних нейролептических гиперкинезов пока недостаточно разработано (Adleret al., 1999; Soares and McGrath, 1999).
При поздних нейролептических гиперкинезах не выявляется признаков органического поражения ЦНС, и патогенез этих состояний все еще остается загадкой. Предполагается, что он включает компенсаторное усиление дофаминергической передачи в базальных ядрах, в том числе увеличение плотности и чувствительности D2- и других D2-подобных рецепторов, в ответ на длительное лечение нейролептиками (Baldessarini and Tarsy, 1979; Tarazi etal., 1997). Эта гипотеза подтверждается тем, что поздние нейролептические гиперкинезы реагируют на лекарственные средства аналогично другим хореоатетозам (в частности, болезни Гентингтона), но отлично от болезни Паркинсона и паркинсонизма (гл. 22). Так, блокаторы дофаминовых рецепторов смягчают проявления как болезни Гентингтона, так и поздних нейролептических гиперкинезов, в то время как стимуляторы этих рецепторов отрицательно влияют на оба эти состояния. В противоположность паркинсонизму, поздние нейролептические гиперкинезы обычно усиливаются под действием М-холиноблокаторов; вместе с тем холинергические средства при этом расстройстве, как правило, неэффективны. Поскольку обычно сенсибилизация дофаминовых рецепторов сохраняется лишь несколько недель после отмены блокаторов этих рецепторов, скорее всего, она играет роль в развитии только тех форм поздних нейролептических гиперкинезов, при которых наблюдается быстрая ремиссия. Эти формы объединяются названием преходящие поздние нейролептические гиперкинезы. Подробнее о теоретических и клинических аспектах данной проблемы см. в Baldessarini and Tarsy (1979), Baldessarini et al. (1980), Kane et al. (1992).
Предотвращение неврологических побочных эффектов нейролептиков — важная задача, для успешного решения которой необходимо следовать определенным правилам. Прежде всего не рекомендуется в профилактических целях назначать антипаркинсонические средства всем больным, принимающим нейролептики. Такой подход лишь усложняет лечение, повышает его стоимость и увеличивает, а не уменьшает вероятность развития побочных эффектов. Назначение антипаркинсонических средств оправдано лишь при уже развившихся экстрапирамидных расстройствах и только при тех их формах, которые хорошо поддаются подобному лечению. Следует помнить, что острая дистония обычно наблюдается лишь в начале лечения нейролептиками, в то время как паркинсонизм и акатизия могут существовать длительно и, соответственно, требовать продолжительной коррекции. Разумное, сдержанное использование нейролептиков у больных хроническими и рецидивирующими психозами, несомненно, снижает риск поздних нейролептических гиперкинезов. Очевидно, что самый лучший метод профилактики неврологических побочных эффектов нейролептиков — это снижение дозы препаратов, однако такой подход не всегда приемлем при резистентных психозах. Поэтому при длительном лечении рекомендуется назначать минимальную эффективную дозу нейролептика и отменять препарат при наличии достаточных клинических оснований или при его неэффективности. Клозапин, кветиапин и другие новые нейролептики, редко вызывающие экстрапирамидные побочные эффекты, предпочтительны для ряда больных, особенно при сочетании хронического психоза с поздними нейролептическими гиперкинезами (Baldessarini and Frankenburg, 1991). Желтуха. Первые случаи желтухи на фоне нейролептиков были описаны вскоре после внедрения в клиническую практику хлорпромазина. Обычно она возникает на 2—4-й неделе лечения, протекает легко и редко сопровождается зудом. Поскольку желтуха сопровождается эозинофилией и эозинофильной инфильтрацией печени, а ее возникновение не зависит от дозы, предполагается, что она обусловлена аллергической реакцией. При повторных назначениях хлорпромазина может развиться десенсибилизация, поэтому желтуха возобновляется не всегда. Если психическое состояние больного с вызванной нейролептиками желтухой требует продолжения лечения, желательно использовать небольшие дозы высокоактивного нейролептика из другой химической группы.
Гематологические побочные эффекты. Легкий лейкоцитоз, лейкопения и эозинофилия могут наблюдаться при приеме различных нейролептиков, особенно клозапина и, реже, фенотиазинов с низкой активностью. Служит ли лейкопения на фоне приема фенотиазинов предвестником агранулоцитоза, в каждом конкретном случае сказать трудно. Это тяжелое, но редкое осложнение развивается не более чем у 1 из 10 ООО больных, принимающих хлорпромазин или другой нейролептике низкой активностью (за исключением клозапина). Обычно оно возникает в течение первых 8—12 нед лечения (Alviret al., 1993).
Угнетение кроветворения или, реже, агранулоцитоз отмечаются преимущественно при лечении клозапином. Развитие этого осложнения не зависит от дозы, а его распространенность при приеме клозапина в течение нескольких месяцев составляет около 1%. Поэтому клозапин можно использовать только при тщательном наблюдении. Поскольку агранулоцитоз может развиться внезапно, появление лихорадки, общего недомогания или признаков инфекции дыхательных путей у больного, принимающего нейролептики, служит абсолютным показанием для экстренного общего анализа крови. Риск агранулоцитоза при лечении клозапином может быть значительно снижен, хотя и не устранен, путем частого определения лейкоцитарной формулы.
Метаболические нарушения. Прибавка в весе и осложнения ожирения часто наблюдаются при длительном лечении большинством нейролептиков и нормотимиков. Из новых нейролептиков прибавку в весе чаще всего вызывают клозапин и оланзапин и реже — рисперидон и кветиапин (Allison et al., 1999). С ожирением связано развитие или утяжеление инсулинонезависимого сахарного диабета, артериальной гипертонии и гиперлипопротеидемии. Отдаленные последствия этих осложнений еще до конца не оценены (Gaulin et al., 1999; Wirshing et al.,1998). У некоторых больных с патологическим ожирением может отмечаться обструкция верхних дыхательных путей, особенно во сне.
Дерматологические побочные эффекты. Эти эффекты нередко отмечаются при приеме фенотиазинов. Так, крапивница и дерматит развиваются примерно у 5% больных, принимающих хлорпромазин. Выделяют несколько типов дерматологических побочных эффектов нейролептиков. Крапивница, пятнистопапулезная, геморрагическая сыпь, а также отеки обусловлены аллергической реакцией и обычно развиваются между 1-й и 8-й неделями лечения. После отмены препарата сыпь проходит и не всегда возобновляется при его повторном назначении. Аллергический контактный дерматит наблюдается у медицинского персонала, непосредственно работающего с хлорпромазином, и иногда сочетается с перекрестной чувствительностью к другим фенотиазинам. Может развиваться фотосенсибилизация, порой приводящая к тяжелым солнечным ожогам. Еще один дерматологический побочный эффект — голубовато-серое окрашивание кожи, наблюдающееся при длительном приеме фенотиазинов с низкой активностью в больших дозах, — при современном лечении встречается редко.
Офтальмологические побочные эффекты. При длительном приеме хлорпромазина нередко развивается поверхностная кератопатия; кроме того, в роговице и хрусталике могут отмечаться очаги помутнения. Обычно эти очаги самопроизвольно, хотя и медленно, исчезают после отмены препарата. Иногда, особенно на фоне приема высоких (свыше 1000 мг/сут) доз тиоридазина, отмечается пигментная дегенерация сетчатки. В связи с этим не рекомендуется назначать тиоридазин в дозе более 800 мг/сут.
Лекарственные взаимодействия
Фенотиазины и тиоксантены, особенно с низкой активностью, взаимодействуют со многими препаратами. Иногда это может иметь важное клиническое значение (DeVane and Nemeroff, 2000; Goff and Baldessarini, 1993). Хлорпромазин изначально был внедрен именно в качестве препарата, потенцирующего действие средств для общей анестезии. Нейролептики значительно усиливают также некоторые эффекты транквилизаторов, снотворных, наркотических анальгетиков, Н1блокаторов, алкоголя и средств от простуды. Так, хлорпромазин усиливает вызванный морфином миоз, углубляет седативное и, возможно, обезболивающее действие морфина. Кроме того, хлорпромазин значительно усиливает угнетающее действие петидина и, вероятно, других наркотических анальгетиков на дыхание.
Естественно, нейролептики ослабляют действие дофаминергических средств и леводофы.
Нейролептики могут также взаимодействовать со средствами для лечения сердечно-сосудистых заболеваний. Так, хлорпромазин и некоторые другие нейролептики, равно как и их N-деметилированные метаболиты, способны подавлять гипотензивное действие гуанетидина, вероятно, блокируя его захват симпатическими окончаниями. Более активные нейролептики, а также молиндон реже вызывают этот эффект. Как отмечалось выше, фенотиазииы с низкой активностью могут вызывать или усиливать ортостатическую гипотонию, вероятно, за счет блокады а-адренорецепторов. Таким образом, взаимодействия между фенотиазинами и гипотензивными средствами могут быть непредсказуемы.
Тиоридазин, пимозид, а также экспериментальные нейролептики сертиндол и ципразидон могут оказывать хинидиноподобное действие, угнетая сократимость и проводимость миокарда, удлиняя реполяризацию и увеличивая риск тахиаритмий. Это действие может ослаблять положительный инотропный эффект сердечных гликозидов. М-холиноблокирующее действие клозапина и тиоридазина иногда приводит к тахикардии, а также усиливает периферические и центральные (спутанность, делирий) эффекты других М-холиноблокаторов, например трициклических антидепрессантов и антипаркинсонических средств.
Снотворные и противосудорожные средства (например, карбамазепин, фенобарбитал, фенитоин, но не вальпроевая кислота), повышающие активность микросомальных ферментов печени, могут усиливать метаболизм нейролептиков, что иногда имеет важное клиническое значение. Ингибиторы обратного захвата серотонина, включая флуоксетин (гл. 19), напротив, конкурируют с нейролептиками за связывание с микросомальными ферментами и могут повышать концентрацию нейролептиков в крови (Goff and Baldessarini, 1993).