Энантиоселективность лекарственных веществ — различия между версиями
Dormiz (обсуждение | вклад) (Новая страница: « == Энантиоселективность лекарственных веществ == {{Шаблон:Наглядная фарма}} Многие лекарс…») |
(нет различий)
|
Версия 19:41, 24 октября 2014
Энантиоселективность лекарственных веществ
Источник: «Наглядная фармакология».
Автор: X. Люльман. Пер. с нем. Изд.: М.: Мир, 2008 г.
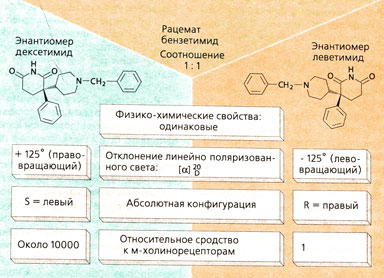
Многие лекарства представляют собой рацемическую смесь двух оптически активных изомеров (например, β-блокаторы, нестероидные противовоспалительные препараты, холинолитик бензетимид) (А). Рацемическая смесь, или рацемат, состоит из двух соединений одинакового состава, но разного молекулярного строения: структурные формулы этих соединений соотносятся друг с другом как предмет и его зеркальное отображение или как правая и левая рука; они не совпадают при наложении друг на друга; эти соединения называют хиральными соединениями или энантиомерами. Такие структуры образуют, как правило, соединения, имеющие атом углерода с четырьмя разными заместителями (асимметрический центр). Энантиомеры — особый тип стереоизомеров. Стереоизомеры, не являющиеся зеркальными изомерами, называются диастереомерами (например, эхинидин и хинин).
Расстояние между атомами в молекулах энантиомеров (но не диастереомбров) одинаковое. Поэтому энантиомеры проявляют одинаковые физико-химические свойства (например, растворимость, температура плавления), и при химическом синтезе образуются сразу оба энантиомера в одинаковом количестве. В природе под действием ферментов чаще всего образуется только один из энантиомеров.
Растворы двух энантиомеров поворачивают луч линейно поляризованного света в противоположные стороны: право- или левовращающая формы, которые обозначают d (или [+]-форма) и «/» (или [-]-форма). Направление вращения света характеризует пространственную структуру энантиомера. Для описания абсолютной конфигурации молекулы применяется R/S-номенклатура. По аналогии с D- или L-структурой глицероальдегида для некоторых соединений используется также D/L-номенклатура.
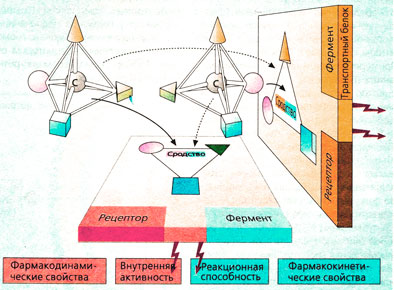
При связывании в организме один из энантиомеров лекарственного вещества может оказаться предпочтительнее в реакциях присоединения, поскольку его структура более удобна для контакта с рецептором (энантиоселективность).
Энантиоселективность определяет сродство. Если рецептор имеет несколько центров связывания для трех веществ (шар, конус, пирамида и куб на рис. Б), расположенных асимметрично вокруг атома углерода С, то, как правило, из двух энантиомеров связывается тот, который образует прочную связь. Так, например, дексетим имеет в 10 000 раз большее сродство к мускариновым рецепторам, чем леветимид, а (-),Э-пропранолол обладает в 100 раз большим сродством к β-рецепторам, чем (+), R-форма.
Энантиоселективность определяет внутреннюю активность. Взаимодействие с рецептором определяет эффективность препарата и зависит от наличия внутренней активности вещества, а также от его агонистической или антагонистической активности. Например, в рацемате добутамина (-)-энантиомер действует как агонист а-адренорецепторов, тогда как (+)-форма — как антагонист.
Инверсия энантиоселективности по отношению к другому рецептору. Энантиомер, имеющий конфигурацию, не подходящую для связывания с одним рецептором, может активно взаимодействовать с другим типом рецептора. (+)-Энантиомер добутамина имеет сродство к β-рецепторам в 10 раз выше, чем (-)-энантиомер; при этом оба являются агонистами. Зато (-)-форма имеет выраженное сродство к а-адренорецепторам.
Взаимодействие с ферментами и транспортными белками также энантиоселективно. Энантиомеры проявляют в этих взаимодействиях разное сродство и реакционную способность.
Заключение. Энантиомеры, присутствующие в рацемате, различаются по фармакодинамическим и фармакокинетическим свойствам и представляют собой два различных вещества.