Эстрогены - строение, синтез, действие
Источник:
Клиническая фармакология по Гудману и Гилману, том 4.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Эстрогены
Строение
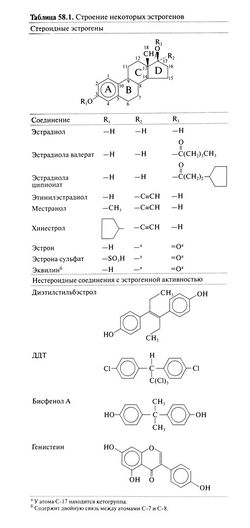
Свойствами эстрогенов обладают ряд стероидных и нестероидных соединений (табл. 58.1, рис. 58.1)
. Наиболее активный эстроген в организме человека — эстрадиол, за ним следуют эстрон и эстриол. Все они относятся к С18-стероидам и содержат гидроксигруппу у атома С-3 (в бензольном кольце А) и β-гидроксигруппу или кетогруппу у атома С-17 (в кольце D). Избирательность и высокое сродство эстрогенов к рецепторам определяются бензольным кольцом: алкильные радикалы у этого кольца (кольца А) обычно нарушают связывание с рецепторами, а радикалы у колец С и D могут и не влиять на связывание. Этиниловый радикал уС-17 препятствует инактивации эстрогенов при первом прохождении через печень и резко увеличивает их активность при приеме внутрь. Исследование структурно-функциональной зависимости эстрогенов позволило создать модель рецепторного домена эстрогеновых рецепторов (Anstead et al., 1997). Установлена и кристаллическая структура комплексов рецепторов с лигандами (Brzozow-ski et al., 1997).
Одним из первых нестероидных эстрогенов был диэтилстильбэстрол (табл. 58.1), транс-изомер которого по структуре напоминает эстрадиол. В большинстве проб диэтилстильбэстрол по активности соответствует эстрадиолу, однако эффективен при приеме внутрь и имеет больший ТСейчас диэтилстильбэстрол используется редко, но раньше, когда получение природных эстрогенов в достаточном количестве еще не было отработано, появление этого недорогого препарата, активного при приеме внутрь, стало важной вехой в клинической эндокринологии (Dodds et al., 1938)
Нестероидные вещества с эстрогенной и антиэстрогенной активностью, включая флавоны, изофлавоны (генистеин) и куместаны, содержатся в различных растениях и грибах. Такими свойствами обладают и синтетические вещества — пестициды (ДДТ), пластификаторы (бисфенол А), полихлорированные дифенилы и другие технические соединения. Многие из этих полициклических веществ содержат бензольный фрагмент, напоминающий кольцо А стероидов. Хотя сродство подобных веществ к эстрогеновым рецепторам невелико, ввиду многочисленности, способности к накоплению в жировой ткани и устойчивости в окружающей среде эти вещества могут быть токсичны для человека и животных (Makela et al., 1999). Существуют препараты (как отпускаемые по рецептам, так и безрецептурные), содержащие вещества растительного происхождения со свойствами эстрогенов (фитоэстрогены). Сообщалось, что фитоэстрогены (например, генистеин) относительно избирательны в отношении эстрогеновых β-рецепторов (Kuiper et al., 1998); этот вопрос сейчас изучается.
Биосинтез
Непосредственными предшественниками эстрогенов у человека служат андростендион и тестостерон (рис. 58.1), кольцо А которых подвергается ароматизации под действием ароматазы (изофермента XIX цитохрома Р450). На первом этапе гидроксилируется метальная группа С-19, соединенная с С-10 андрогенов; после повторного гидроксилирования гидро-ксиметильная группа С-19 отщепляется. Последующее гидроксилирование атома С-2 дает нестойкое промежуточное соединение, которое перестраивается с образованием бензольного кольца с гидроксигруппой у С-3. Всего в реакции ароматизации расходуются 3 молекулы кислорода и 3 молекулы НАДФН (Simpson etal., 1994).
Ароматаза — это трансмембранный гликопротеид, для ее работы нужен флавопротеид НАДФН-оксидаза. Оба фермента связаны с эндоплазматическим ретикулумом и содержатся в гранулезных клетках яичников, клетках Сертоли и Лейдига (в яичках), синцитиотрофобласте, строме жировой ткани, костях, различных отделах головного мозга, а также в эмбрионе до имплантации (Simpson etal., 1999).
Основным источником эстрогенов у женщин детородного возраста служат яичники. Они выделяют главным образом эстрадиол, синтезируемый в гранулезных клетках из андрогенов, образующихся в текоцитах. Ароматазу активируют ЛГ и ФСГ, действующие через мембранные рецепторы и повышающие внутриклеточную концентрацию цАМФ. Одновременно возрастает активность 20,22-десмолазы и усиливается транспорт холестерина (предшественника всех стероидных гормонов) в митохондрии клеток, синтезирующих стероиды. Яичники содержат 17β-гидроксистероиддегидрогеназутипа 1, которая восстанавливает андростендион и эстрон соответственно в тестостерон и эстрадиол. В печени другой изофермент (17β-гидросистероиддегидрогеназа типа 2) окисляет эстрадиол крови в эстрон (Peltoketo et al., 1999), оба эти гормона затем превращаются в эстриол (рис. 58.1). Все три эстрогена выводятся с мочой в свободном виде, а также в форме глюкуронидов и сульфатов. У женщин в постменопаузе основным источником эстрогенов становятся строма жировой ткани и другие периферические ткани, где выделяемый корой надпочечников дегидроэпиандростерон превращается в эстрон. У мужчин эстрогены синтезируются в яичках, но ббльшая часть этих гормонов, по-видимому, образуется в периферических тканях путем ароматизации андрогенов (андростендиона и дегидроэпиандростерона). Таким образом, концентрация эстрогенов отчасти регулируется количеством андрогенов-предшественников (Mendelson and Simpson, 1987).
Часто полагают, что действие эстрогенов обусловлено только циркулирующими в крови гормонами, однако большое значение может иметь и их местное образование (Simpson et al., 1999).
Рисунок 58.1. Биосинтез эстрогенов. Зβ-ГСДГ — Зβ-гидроксистероидцегидрогеназа, 17β-ГСДГ — 17β-гидроксистероиддегидроге-наза, 16а-Г — 16а-гидроксилаза.
Например, эстрогены могут синтезироваться из андрогенов под действием ароматазы или за счет гидролиза конъюгатов эстрогенов. Местный синтез эстрогенов играет важную роль в патогенезе некоторых болезней, например рака молочной железы, поскольку эти опухоли содержат ароматазу и гидролитические ферменты. Кроме того, эстрогены образуются из андрогенов при участии ароматазы в ЦНС и других тканях, оказывая местное воздействие: в яичках — на сперматогенез, в костях — на плотность.
Большое количество эстрогенов вырабатывает плацента, где дегидроэпиандростерон плода и его 16а-гидроксилиро-ванное производное превращаются в эстрон и эстриол; благодаря этому моча беременных женщин служит источником эстрогенов. Беременная кобыла выделяет эстрогены в количестве более 100 мг/сут. Больше эстрогенов выделяют только жеребцы, которые, несмотря на их половую принадлежность, экскретируют больше эстрогенов, чем остальные живые существа.
Физиологические эффекты
Развитие
Эстрогены играют ведущую роль в половом созревании девочек и развитии женских вторичных половых признаков. Они напрямую стимулируют рост и развитие влагалища, матки и маточных труб. Вместе с другими гормонами эстрогены вызывают увеличение молочных желез за счет ускорения роста протоков, развития стромы и накопления жировой клетчатки. Посредством неясных пока механизмов эстрогены изменяют форму скелета и телосложение, ускоряют рост длинных трубчатых костей в пубертатном периоде и затем вызывают закрытие эпифизарных зон роста. Наконец, эстрогены отвечают за лобковое и подмышечное оволосение, пигментацию кожи половых органов, а также усиление пигментации сосков и околососковых кружков после I триместра беременности.
Половое развитие женщины прежде всего определяется эстрогенами, но некоторая роль принадлежит и андрогенам (гл. 59). Тестостерон и андростендион в норме содержатся в крови, оттекающей от яичников. Они способствуют половому созреванию у девочек, что проявляется ускорением роста, завершением лобкового и подмышечного оволосения и появлением угрей из-за разрастания сальных желез и усиления их секреции.
Лишь недавно выяснилось, что эстрогены играют важную роль и в развитии мужчин. Их дефицит у мальчиков не задерживает половое созревание, но препятствует нормальному пубертатному ускорению роста; в то же время замедляется закрытие эпифизарных зон роста, и в результате рост продолжается и у взрослых. Кроме того, дефицит эстрогенов у мужчин ведет к повышению секреции ЛГ и ФСГ, макроорхии, избытку тестостерона, а иногда также к изменению углеводного и жирового обмена и к нарушению способности к оплодотворению (Grumbach and Auc-hus, 1999).
Нейроэндокринная регуляция менструального цикла
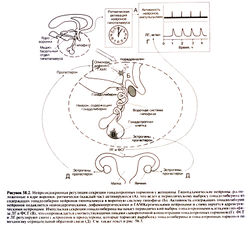
Менструальный цикл контролируется гипоталамо-гипофизарно-гонадной системой (рис. 58.2)
. Ритмическая активация нейронов гипоталамуса сопровождается выбросом гонадолиберина в воротную систему гипофиза (гл. 56). Гонадолиберин стимулирует рецепторы на гонадотропных клетках аденогипофиза, вызывая секрецию гонадотропных гормонов — ЛГ и ФСГ. Последние отвечают за рост и созревание фолликулов, а также за выработку в яичниках эстрогенов и прогестагенов. которые обеспечивают отрицательную обратную связь на уровне гипофиза и гипоталамуса.
Благодаря ритмической активации нейронов гипоталамуса секреция гонадолиберина, а также Л Г и ФСГ происходит импульсно (рис. 58.2) (Knobil. 1981; Wilson et al.. 1984). Для поддержания менструального цикла необходима именно импульсная секреция гормонов, поскольку постоянная инфузия гонадолиберина вызывает прекращение выброса Л Г и ФСГ, уменьшение синтеза эстрогенов и прогестерона, что приводит к аменорее (гл. 56).
Не ясно, какие именно клетки обладают свойством ритмической активации — сами нейроны, содержащие гонадолиберин, или другие нейроны, образующие синаптические контакты с первыми. Анатомически источник импульсов находится в ядре воронки, где максимальна концентрация нейронов, содержащих гонадолиберин. Ритмическая активация ядра воронки не требует влияний от других отделов головного мозга. Нейронов, содержащих гонадолиберин, в гипоталамусе относительно мало, и они не образуют явной нейронной сети. Остается неясным, как небольшому числу клеток, разбросанных по ядру воронки, удается синхронизировать выработку нервных импульсов. Большинство таких клеток не имеют эстрогеновых или прогестероновых рецепторов, но с этими клетками образуют синапсы опиоидергические. катехоламинергические и ГАМКер-гические нейроны, несущие рецепторы стероидных гормонов (рис. 58.2).
До пубертатного возраста ритмической активации нейронов в гипоталамусе не происходит, гонадотропные гормоны не выделяются и менструальный цикл отсутствует. Затем неизвестные механизмы активируют импульсную секрецию гонадолиберина, создавая характерные для менструального цикла изменения концентраций ЛГ, ФСГ, эстрадиола и прогестерона.
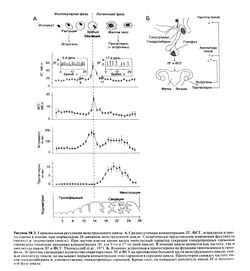
На рис. 58.3,
А представлены изменения средних концентраций ЛГ, ФСГ, эстрадиола и прогестерона в плазме на протяжении менструального цикла. На том же рисунке подробно показан ритмический характер секреции гонадотропных гормонов. Как следует из рисунка, средняя концентрация ЛГ в фолликулярной и лютеиновой фазах примерно одинакова, но частота и амплитуда пиков ЛГ значительно разнятся, что связано со сложной системой положительных и отрицательных обратных связей (Hotchkiss and Knobil, 1994).
В начале фолликулярной фазы резко усиливается активность нейронов гипоталамуса, и они начинают выделять гонадолиберин с частотой примерно 1 раз в час. Это вызывает импульсную секрецию ЛГ и, в особенности, ФСГ, который стимулирует созревание фолликула и секрецию им эстрогенов. В это время эстрогены оказывают на гипофиз ингибирующее влияние. Соответственно, с повышением концентрации эстрогенов секреция Л Г и ФСГ (то есть амплитуда пиков) снижается, и уровень гонадотропных гормонов постепенно падает (рис. 58.3). Уменьшению концентрации ФСГ способствует и ингибин, вырабатываемый в яичниках и также обеспечивающий отрицательную обратную связь (гл. 56).
В середине цикла на первый план выступают другие регуляторные механизмы. В это время концентрация эстрадиола в плазме примерно в течение 36 ч превышает пороговый уровень 150—200 пг/мл. Подобное стойкое повышение концентрации уже не подавляет секрецию гонадотропных гормонов, но на короткое время стимулирует гипофиз, вызывая предовуляторное усиление секреции ЛГ и ФСГ. Это связано с изменением чувствительности гипофиза к гонадолиберину. Однако пока не ясно, оказывают ли эстрогены стимулирующее действие на нейроны гипоталамуса у человека, что во многом объяснило бы усиленный выброс гонадолиберина в середине менструального цикла.
Амплитуда пиков ЛГ зависит прежде всего от концентрации эстрогенов и прогестерона, однако частоту пиков регулирует лишь прогестерон, который снижает частоту ритмической активации нейронов гипоталамуса. Таким образом, половые гормоны по механизму отрицательной обратной связи обеспечивают относительно частую секрецию небольших количеств ЛГ во время фолликулярной фазы менструального цикла и более редкую, но и более мошную секрецию ЛГ в лютеиновой фазе.
У мужчин выброс гонадолиберина также происходит импульсно, что вызывает импульсную секрецию ЛГ, необходимую для нормальной выработки тестостерона клетками Лейдига в яичках. Тестостерон регулирует работу гипоталамо-гипофизарно-гонадной системы на уровне гипоталамуса и гипофиза по механизму отрицательной обратной связи, во многом за счет образования эстрогенов путем ароматизации. Экзогенные эстрогены снижают концентрации ЛГ и тестостерона, тогда как бтокаторы эстрогеновых рецепторов (например, кломифен) повышают концентрацию ЛГ в сыворотке — эту пробу применяют для оценки гормональных нарушений у мужчин.
Выброс ЛГ и ФСГ в середине менструального цикла через 1—2 сут вызывает разрыв фолликула и овуляцию Из фолликула развивается желтое тело, которое во 2-й половине цикла под влиянием ЛГ вырабатывает большое количество прогестерона и эстрогенов. Если не происходит зачатия, через несколько суток оно дегенерирует, концентрация гормонов падает и начинается менструация. Таким образом, длительность лютеиновой фазы ограничена 14 сут функционирования желтого тела. Когда концентрация половых гормонов снижается, нейроны гипоталамуса переходят к ритму секреции, характерному для фолликулярной фазы, и начинается новый менструальный цикл.
Повышение концентрации прогестерона во время лютеиновой фазы влияет как на частоту, так и на амплитуду пиков ЛГ. Прогестерон снижает частоту ритмической активации нейронов гипоталамуса и, соответственно, частоту импульсной секреции гонадолиберина и ЛГ. Кроме того, прогестерон устраняет ингибирующее действие эстрогенов на гипоталамус и повышает амплитуду пиков ЛГ.
При овариэктомии и в постменопаузе синтез ЛГ и ФСГ усиливается, и они выделяются с мочой. Определение Л Г в моче и плазме — важная проба, помогающая оценить функцию гипофиза и эффективность заместительной терапии эстрогенами, на фоне которой концентрация ЛГ падает. Концентрация ФСГ при этом также снижается, но не до нормы, так как яичники не выделяют ингибин (гл. 56). Соответственно, определение ФСГ не позволяет следить за эффектом заместительной терапии.
Секреция и действие гонадотропных гормонов обсуждаются также в Гонадотропные гормоны.
Половые органы
Циклические колебания концентрации эстрогенов и прогестерона отражаются на состоянии маточных труб, тела и шейки матки, а также влагалища. Изменения направлены на подготовку матки к имплантации эмбриона после оплодотворения яйцеклетки, причем для наступления беременности важна своевременность этих изменений. Если беременность не наступила, возникает менструация.
Тело матки состоит из трех оболочек: внутренней слизистой (эндометрия), средней мышечной (миометрия) и наружной серозной. Миометрий образован гладкими мышцами, обеспечивающими сокращения матки. Основные же изменения при менструальном цикле затрагивают эндометрий, отторжение которого и проявляется менструацией (рис. 58.3).
Эндометрий состоит из эпителиального слоя и стромы. Эпителиальный слой представляет собой однослойный цилиндрический эпителий, включающий бокаловидные и реснитчатые клетки и образующий многочисленные железы, которые проходят через строму, достигая миометрия. Дистально эпителий эндометрия переходит в эпителий шейки матки, образующий слизь; проксимально — в эпителий маточных труб. В норме оплодотворение происходит в маточной трубе, и наступление беременности зависит от координации процессов овуляции, транспорта оплодотворенной яйцеклетки по трубе и подготовки эндометрия к имплантации.
Строма эндометрия — богатая клетками соединительная ткань. В ней преобладают фибробласты, но содержится и значительное число макрофагов, лимфоцитов и других постоянных к мигрирующих клеток. Строма содержит также различные сосуды, которые претерпевают циклические изменения на протяжении менструального цикла.
Началом менструального цикла условно считают менструацию. Во время фолликулярной фазы под действием эстрогенов начинается регенерация эндометрия. Они стимулируют рост и дифференцировку клеток: появляются многочисленные митозы, эндометрий утолщается, происходят характерные изменения желез и сосудов. Эти и последующие эффекты эстрогенов и прогестерона во многом связывают с усилением синтеза пептидных факторов роста, оказывающих ауто- и паракринное действие, и их рецепторов. Большую роль во влиянии эстрогенов на эндометрий и другие ткани играет усиление синтезе прогестероновых рецепторов, что позволяет клеткам реагировать на этот гормон во 2-й половине менструального цикла.
В лютеиновой фазе выработка прогестерона резко возрастает благодаря его секреции желтым телом; концентрация эстрогенов также остается повышенной. Прогестерон подавляет митогенное действие эстрогенов на эндометрий, стимулируя дифференцировку клеток. Он повышает секреторную активность эпителия, необходимую для имплантации эмбриона и его роста, и вызывает характерное для лютеиновой фазы разрастанне сосудов эндометрия. Таким образом, прогестерон нужен дм подготовки к имплантации и для последующих изменений, происходящих в месте имплантации (децидуальной реакция). Время, когда эндометрий готов для имплантации, достаточно ограничено — по большинству оценок, от 19—20-гого 24-го дня менструального цикла. Поскольку состояние эндометрия регулируется эстрогенами и прогестагенам и, действие некоторых контрацептивов, содержащих эти гормоны, отчасти объясняется формированием невосприимчивости эндометрия к имплантации. Если беременность не наступает, желтое тело без постоянной стимуляции ЛГ дегенерирует, а концентрация эстрогенов и прогестерона падают. В отсутствие гормональной поддержки эндометрий отторгается — происходит менструация (рис. 58.3).
В случае имплантации ХГ, образуемый вначале трофобластом, а затем плацентой (гл. 56), стимулирует рецепторы ЛГ в желтом теле, поддерживая синтез эстрогенов и прогестерона на ранних этапах беременности. В дальнейшем основным источником эстрогенов и прогестерона становится плацента.
В маточных трубах эстрогены стимулируют пролиферацию и дифференцировку эпителия, прогестерон же тормозит эти процессы. Кроме того, эстрогены усиливают, а прогестерон ослабляет перистальтику труб, что влияет на скорость попадания яйцеклетки в матку. Эстрогены повышают содержание воды в шеечной слизи, что облегчает проникновение сперматозоидов; действие прогестерона, как правило, противоположное. Эстрогены способствуют ритмическим сокращениям миометрия, тогда как прогестерон их подавляет. Перечисленные процессы имеют большое физиологическое значение и в известной мере объясняют контрацептивный эффект эстрогенов и прогестагенов.
Обмен веществ
Эстрогены оказывают большое влияние на обмен веществ у животных и человека. Не всегда ясно, связан ли наблюдаемый эффект с прямым действием на ту или иную ткань или опосредован изменениями в других органах. Впрочем, многие экстрагенитальные ткани (кости, эндотелий, печень, ЦНС, миокард) содержат небольшое количество эстрогеновых рецепторов, посредством которых эстрогены могут напрямую регулировать обмен веществ в них. Особое значение для понимания фармакодинамики эстрогенов имеет их влияние на отдельные стороны минерального, жирового, углеводного и белкового обмена.
Издавна известно, что эстрогены увеличивают массу костной ткани (Riggs and Melton, 1992). Под действием остеокластов и остеобластов в участках, называемых единицами костного обновления, происходит непрерывное разрушение и воссоздание костной ткани (гл. 62). В возрасте 18—40 лет масса костной ткани не меняется за счет баланса между этими процессами, но в дальнейшем преобладает резорбция костей. Остеокласты и остеобласты содержат эстрогеновые, андрогеновые и проге стероновые рецепторы. Эстрогены напрямую активируют остеобласты, усиливая синтез коллагена I типа, остеокальцина, остеопонтина, остеонектина, щелочной фосфитазы и других белков, характерных для зрелых остеобластов. Однако основная роль эстрогенов состоит в уменьшении числа и активности остеокластов. Во многом это обусловлено нарушением выработки остеобластами и клетками стромы цитокинов, стимулирующих остеокласты (ИЛ-1. ИЛ-6 и ФНОа), и увеличением синтеза ИФР-1, белка — регулятора морфогенеза костей типа 6 и трансформирующего фактора роста β, которые препятствуют резорбции кости (Spelsberg et al., 1999). Кроме того, эстрогены способствуют выработке остеобластами остеопротегерина — растворимого белка из семейства ФИО. Действуя как ложный рецептор, он препятствует связыванию фактора дифференцировки остеокластов (RAN К-л и ганда) с рецептором RANK (Receptor for Activating NFkB — рецептор, активирующий фактор транскрипции NFkB) и нарушает дифференцировку предшественников остеокластов (Hofbaueret al.,2000). Наконец, эстрогены напрямую уменьшают число остеокластов, ускоряя их апоптоз. Эстрогены влияют на рост костей и закрытие эпифизарных зон роста как у женщин, так и у мужчин. На важную роль эстрогенов в развитии скелета у мужчин указывают: 1) наличие остеопороза, открытых эпифизарных зон роста, ускоренного обмена в костной ткани и сниженного костного возраста при дефекте эстрогеновых рецепторов (Smith et al., 1994) и 2) наблюдение, что идиопатический остеопороз у мужчин сопровождается снижением синтеза эстрогеновых а-рецепторов в остеобластах и остеоцитах (Braidman et al., 2000).
Эстрогены регулируют липидный обмен. Особенно важно их влияние на концентрации липопротеидов и триглицеридов в крови (Lobo, 1991; Walsh et al., 1994). В целом эстрогены несколько повышают концентрацию триглицеридов и снижают концентрацию общего холестерина. Однако наиболее важным считается повышение концентрации ЛПВП при снижении концентрации ЛПНП и липопротеида(а) (гл. 36). Такое изменение соотношения ЛПВП и ЛПНП — благоприятное побочное действие заместительной терапии эстрогенами у женщин в постменопаузе. Поскольку гепатоциты содержат эстрогеновые рецепторы, влияние эстрогенов на обмен липопротеидов отчасти может быть обусловлено прямым действием на печень. Впрочем, нельзя исключить и другие механизмы. Кроме того, эстрогены изменяют состав желчи, усиливая выведение холестерина и задерживая желчные кислоты; в результате желчь насыщается холестерином. Очевидно, этим объясняется появление желчных камней у некоторых женщин, получающих эстрогены.
Монотерапия эстрогенами несколько снижает концентрации глюкозы и инсулина натощак (Barrett-Connor and Laakso, 1990), но едва ли эстрогены существенно влияют на углеводный обмен. Ранние испытания пероральных контрацептивов (содержавших более высокие дозы эстрогенов и прогестагенов, чем современные препараты) показали, что эти препараты могут нарушать толерантность к глюкозе, но с каким из компонентов были связаны эти изменения, осталось неясным.
Эстрогены влияют на концентрацию многих белков в плазме, особенно факторов свертывания и переносчиков гормонов: обычно повышаются концентрации транскортина, тироксинсвязывающего глобулина и глобулина, связывающего половые гормоны (последний переносит андрогены и эстрогены).
Эстрогены регулируют ряд метаболических путей, важных для сердечно-сосудистой системы, включая обмен липопротеидов и синтез белков плазмы в печени (Mendelsohn and Karas, 1999). Под действием эстрогенов несколько возрастают концентрации факторов VII и XII, при этом снижаются концентрации протеинов С и S и антитромбина III. Одновременно изменяется и фибринолиз: по данным нескольких испытаний, при приеме эстрогенов или эстрогенов в сочетании с прогестагенами у женщин снижается концентрация антиактиватора плазминогена 1, что способствует фибринолизу (Koh et al., 1997). Таким образом, эстрогены активируют как свертывание крови, так и фибринолиз, и нарушение соотношения между этими противоположными эффектами чревато осложнениями. В достаточно высоких концентрациях эстрогены проявляют антиоксидан-тные свойства и могут препятствовать окислению ЛПНП, ингибируя супероксиддисмутазу (Sack et al., 1994). Длительный прием эстрогенов приводит к снижению концентраций ренина, АПФ и эндотелина-1 в плазме, а также экспрессии ангиотензиновых рецепторов типа 1. Действуя на сосудистую стенку, эстрогены уже через несколько минут усиливают синтез окиси азота, в дальнейшем возрастает синтез индуцируемой NO-синтазы и простациклина. Все эти изменения способствуют расширению сосудов. Кроме того, эстрогены стимулируют рост эндотелия и тормозят рост гладкомышечных клеток сосудов.
Фармакокинетика
Эстрогены применяют внутрь, парентерально, накожно и местно. Их структурные формулы приведены в табл. 58.1. Благодаря липофильности эстрогены обычно хорошо всасываются. Разработано множество препаратов для приема внутрь. Водные и масляные растворы эфиров эстрадиола и эстрона применяют в/м, их вводят с интервалами от нескольких суток до месяца. Из пластырей эстрадиол непрерывно всасывается через кожу, пластырь меняют 1—2 раза в неделю (иногда к эстрадиолу добавляют нор-этистерона ацетат). Существуют также препараты для интравагинального применения.
Часто эстрогены назначают внутрь, к ним относятся эстрадиол, конъюгированные эстрогены, эфиры эстрона и других эстрогенов, а также этинилэстрадиол. Сам эстрадиол используют редко из-за его быстрой инактивации в печени. Создан препарат мелкодисперсного эстрадиола, всасывание которого ускорено за счет большой поверхности, но из-за низкой биодоступности его нужно назначать в больших дозах (Fotherby, 1996). Часто используют этинилэстрадиал внутрь (в виде монотерапии и вместе с прогестагенами в составе пероральных контрацептивов); этиниловый радикал уС-17 замедляет его инактивацию в печени. Указанные препараты быстро и обычно полностью всасываются из ЖКТ. Для приема внутрь широко назначают конъюгированные эстрогены (смесь сульфатных эфиров эстрона, эк-вилина и других природных эстрогенов), этерифицированные эстрогены и смеси конъюгированных эстрогенов растительного происхождения. Эти препараты гидролизуются ферментами дистальных отделов ЖКТ, причем заряженные сульфатные группы отщепляются, обеспечивая всасывание самих эстрогенов. Препарат для приема внутрь эстропипат содержит сульфатный эфир эстрона и пиперазин: сульфатная группа делает его растворимым, а пиперазин стабилизирует. Активность эстрогенов для приема внутрь колеблется в широких пределах, в основном из-за различий в метаболизме; так, этинилэстрадиол намного активнее конъюгированных эстрогенов.
Нередко утверждается, что некоторые пищевые продукты, особенно из сои, приносят такую же пользу, как и эстрогены. Такие продукты могут содержать изофлавоны (в частности, генистенн; табл. 58.1), куместаны и лигнаны, которые в экспериментах показали эстрогенную активность, хотя и намного меньшую, чем у эстрадиола. В принципе, эти вещества способны оказывать ощутимое эстрогенное действие, однако эффективность их приема в обычных дозах не проверялась в клинических испытаниях. Кроме фитоэстрогенов многие из этих продуктов содержат другие вещества, которые могут оказывать разнообразное действие (Makela etal., 1999; Tham etal., 1998).
Пластыри с эстрадиолом обеспечивают медленное непрерывное поступление гормона и более постоянную сывороточную концентрацию, чем прием препарата внутрь. Кроме того, такая лекарственная форма не создает высокой концентрации препарата в воротной системе печени, что объясняет меньшее влияние на липидный обмен (см. ниже; Walsh et al., 1994).
Растворенные в масле эфиры эстрогенов хорошо всасываются при в/м введении. Полярность арильных и алкильных эфиров эстрадиола уменьшается по мере увеличения размера заместителя, параллельно падает скорость всасывания их из масляных растворов и растет продолжительность действия. Всасывание эстрадиола в виде валерата или ципионата может продолжаться несколько недель после однократного в/м введения. Кроме того, в/м вводят суспензии, содержащие эстрон или сочетание эфиров эстрогенов (главным образом сульфаты эстрона и эквилина).
Разработаны препараты эстрадиола и конъюгированных эстрогенов для интравагинального применения. Они действуют место, но могут оказывать и системный эффект, так как значительная часть препаратов всасывается (Rigg et al., 1978). Влагалищные кольца с эстрадиолом выделяют гормон в течение 3 мес.
В плазме значительная часть эстрогенов связана с белками. Для эстрадиола и других природных эстрогенов это прежде всего глобулин, связывающий половые гормоны, и в меньшей степени — альбумин. Напротив, этинилэстрадиол связывается прежде всего с альбумином. Благодаря липофильности и небольшим размерам свободные эстрогены легко покидают плазму и распределяются в тканях.
Метаболизм эстрадиола зависит от фазы менструального цикла и возраста (пре- или постменопауза). Гормон быстро инактивируется в печени, и его Т1/2 измеряется минутами. 17р-гидроксистероиддегидрогеназа превращает большую часть эстрадиола в эстрон, из которого путем гидроксилирования в положении 16а и восстановления кетогруппы у атома С-17 образуется эстриол — основной метаболит эстрадиола, выделяемый с мочой. С мочой выводятся также сульфаты и глюкуронилы эстрогенов. Небольшое количество эстрона и эстрадиола окисляется в 2-гидроксилированные производные под действием изоферментов IIIA (в печени) и 1А(в других тканях) цитохрома Р450 и в меньшей степени — в 4-гидроксил иро ванные производные под действием изофермента IB1 цитохрома Р450 (вне печени). Основную часть 2- и 4-гидроксилированных производных инактивирует КОМТ, но небольшое количество под действием микросомальных ферментов и пероксидаз может превращаться в хиноны и семихиноны, способные присоединяться к ДНК и катализировать образование активных форм кислорода, окисляющих азотистые основания ДНК (Liehr, 2000). Кроме того, эстрогены претерпевают кишечно-печеночный кругооборот: в печени образуются их сульфаты и глюкурониды, которые выделяются с желчью, гидролизуются в кишечнике и снова всасываются.
Этинил эстрадиол выводится намного медленнее эстрадиола за счет уменьшенного метаболизма в печени; по разным данным, Т1/2 этинил эстрадиола составляет 13—27 ч. В отличие от эстрадиола, основной путь метаболизма этинил эстрадиола — гидроксилирование атома С-2 с последующим образованием метиловых эфиров у атомов С-2 и С-3. Местранол — полусинтетический эстроген, входящий в некоторые пероральные контрацептивы, — это метиловый эфир этинилэстрадиола. В печени он быстро деметилируется до активного метаболита, этинил-эстрадиола.
Определение эстрогенов и их метаболитов в плазме и моче делается с разными целями. В середине нормального менструального цикла экскреция эстрогенов достигает 25—100 мкг/сут, второй подъем во время лютеиновой фазы более длительный, но менее выраженный (10—80 мкг/сут). В постменопаузе экскреция эстрогенов составляет 5—10 мкг/сут, причем они образуются главным образом вне яичников из андрогенов. Нормальный показатель у мужчин составляет 5—25 мкг/сут, что примерно соответствует экскреции эстрогенов с мочой у женщине первую неделю менструального цикла. Моча детей младшего возраста не содержит эстрогенов. В I триместре беременности основным источником выделяемых с мочой эстрогенов становится плацента; их экскреция постоянно возрастает, достигая к родам примерно 30 мг/сут. Раньше для оценки состояния плаценты и плода регулярно определяли экскрецию эстрогенов, но с появлением современных методов диагностики необходимость в этом отпала.