Ингибиторы ацетилхолинэстеразы (АХЭ)
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
ИНГИБИТОРЫ АХЭ
Здесь рассматриваются средства, эффект которых обусловлен увеличением времени существования ацетилхолина в синаптической щели. Эти средства ингибируют АХЭ — фермент, локализующийся в синапсах и отвечающий за быстрый ферментативный гидролиз ацетилхолина. Ингибиторы АХЭ применяются в офтальмологии (в частности, при глаукоме), а также как средства для повышения сократительной активности ЖКТ и мочевого пузыря и усиления мышечных сокращений при миастении. Те из препаратов, которые проникают через гематоэнцефалический барьер, пытаются использовать при болезни Альцгеймера (гл. 22). Ингибиторы АХЭ применяются также в качестве инсектицидов и боевых отравляющих веществ. При отравлении этими соединениями используют холиноблокаторы (для подавления действия накапливающегося в избытке ацетилхолина) и реактиваторы АХЭ. Средства, действующие на М- и N-холинорецепторы, рассматриваются в главах 7 и 9 соответственно.
Роль АХЭ в инактивации выделяющегося в синаптическую щель ацетилхолина рассматривалась в гл. 6. Ингибиторы АХЭ, подавляя активность этого фермента, приводят к накоплению ацетилхолина в синаптической щели. Таким образом, их действие в конечном счете сводится к чрезмерной стимуляции периферических и центральных холинорецепторов. Поскольку рецепторы эти чрезвычайно распространены в организме, не удивительно, что именно ингибиторы АХЭ широко используются в качестве инсектицидов, а также боевых отравляющих веществ — нервно-паралитических газов. Некоторые из них применяются и как лекарственные средства; те же, которые проникают через гематоэнцефалический барьер, используются или проходят клинические испытания при болезни Альцгеймера (гл. 22).
До Второй мировой войны были известны только обратимые ингибиторы АХЭ, самым распространенным из которых является физостигмин. Незадолго до войны и во время нее исследователем из И. Г. Фарбениндустри Шрадером были получены так называемые фосфорорганические соединения, которые сначала использовали в качестве инсектицидов, а затем — как боевые отравляющие вещества. Их высокая токсичность была обусловлена необратимой, а следовательно, длительной инактивацией АХЭ. Поскольку в конечном счете механизм действия всех ингибиторов АХЭ одинаков, мы сначала рассмотрим все эти вещества как единую группу. Взаимодействия ингибиторов АХЭ с другими препаратами в области вегетативных и нервно-мышечных синапсов рассматриваются в гл. 7 и 9.
Историческая справка
Физостигмин, или эзерин, — это алкалоид, получаемый из высушенных зрелых семян физостигмы ядовитой (Physostigma venenosum), называемых калабарскими бобами, орехами эзере, судными орехами и пр. Это многолетнее растение, встречающееся в тропических странах Западной Африки, когда-то использовалось местными племенами для шаманского суда.
В 1840 г. британский военный врач Дэниел привез калабарские бобы в Англию, и их фармакологические свойства были исследованы Кристиосоном (1855), Фрейзером (1863) и Аргайлом Робертсоном (1863). В чистом виде действующий алкалоид был выделен в 1864 г. Иобстом и Гессе, которые и предложили название «физостигмин». В качестве лекарственного средства его впервые использовал в 1877 г. Лакер для лечения глаукомы (основное показание к применению ингибиторов АХЭ и в наше время). Интересные факты из истории изучения физостигмина содержатся в обзорах Karczmar (1970) и Holmstedt (1972).
После того как Стедманом и сотр. была раскрыта связь между структурой физостигмина и его активностью (Stedman, 1929а, Ь), начались исследования ряда других карбаматов, и с 1931 г. стали применять неостигмин для стимуляции перистальтики ЖКТ. Вскоре оказалось, что он оказывает хороший эффект при миастении.
Первое сообщение о синтезе высокотоксичного фосфорорганического ингибитора АХЭ — тетраэтилпирофосфата — было опубликовано Клермоном уже в 1854 г. Самое удивительное в этом сообщении то, что автор вообще смог его опубликовать: он описывает вкус полученного им вещества, а ведь нескольких капель хватило бы для смертельного отравления. Современный этап в исследовании фосфорорганических соединений был открыт сообщением Ланге и Крюгера (1932) о синтезе диметил- и диэтилфторфосфатов. Описанные авторами ощущение удушья и нечеткость зрения, вызываемые этими веществами, видимо, и натолкнули Шрадера на мысль исследовать их инсектицидную активность.
Получив более 2000 соединений, Шрадер определил, какие особенности химической структуры ответственны за инсектицидную активность — и, как выяснилось в дальнейшем, за ингибирование АХЭ (Gallo and Lawryk, 1991). Одно из первых таких соединений — фосфоротиоат паратион — в дальнейшем стало самым распространенным инсектицидом данной группы. Широко применяемый в настоящее время фосфородитиоат малатион также содержит тионфосфорную связь. Непосредственно перед Второй мировой войной и во время нее Шрадер со своими сотрудниками занимался получением боевых отравляющих веществ. При этом в обстановке высокой секретности были получены крайне ядовитые газы — зарин, зоман и табун. Впрочем, в странах антифашистской коалиции также разрабатывались такие вещества, и тоже на основании работ Ланге и Крюгера. В США и Великобритании был лучше всего изучен диизопропилфторфосфат, полученный МакКомби и Саундерсом в 1946 г.
В 1950-х гг. были синтезированы ароматические карбаматы, являющиеся мощными ингибиторами АХЭ и обладающие высокой избирательной токсичностью в отношении насекомых (Ecobichon, 2000).
Структура АХЭ
АХЭ существует в двух формах — гомомерных олигомеров (мономеров, димеров, тетрамеров) из каталитических субъединиц и гетеромерных комплексов из каталитических и структурных субъединиц (Massoulie, 2000; Taylor et al., 2000). Гомомерные формы могут быть свободно растворенными в цитоплазме (видимо, эти молекулы в дальнейшем секретируются), а также связанными с наружной поверхностью клеточной мембраны через собственные гидрофобные аминокислотные последовательности или через присоединенный гликофосфолипид. Гетеромерный комплекс, широко представленный в межнейронных синапсах, образован тетрамером из каталитических субъединиц, связанным дисульфидным мостиком со структурной субъединицей с молекулярной массой 20 000, присоединенной, в свою очередь, к липидам наружной поверхности клеточной мембраны. С постсинаптической мембраной нервно-мышечного синапса связан другой гетеромерный комплекс Он также образован тетрамерами из каталитических субъединиц, связанными дисульфидными мостиками со структуру субъединицей, но последняя сходна по структуре с коллагеном, образована, как и он, тремя нитями (к ним и присоединяются тетрамеры из каталитических субъединиц), а ее молеку. лярная масса равна 1 000 000.
Методами молекулярного клонирования показано, что АХЭ разных позвоночных кодируется одним геном (Schumachera al., 1986; Taylor et al., 2000). Вариантов же АХЭ (то есть продуктов этого гена) много, что объясняется альтернативным сплайсингом мРНК. Эти варианты различаются только строении С-концевого фрагмента; участок же, обеспечивающий каталитическую активность, одинаков. Поэтому у всех позвоночнш АХЭ должна обладать одинаковым сродством к субстратами ингибиторам.
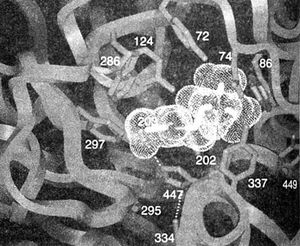
Описание к рис. 8.1. Активный центр АХЭ млекопитающих. Связанный с АХЭ ацетилхолин изображен облаковидной структурой, размеры которой соответствуют атомным радиусам. Приведена кристаллическая структура активного центра АХЭ мыши. Видны боковые цепи 1) каталитической триады (Сер203, Гис447, и Глу 334), пунктиром изображены водородные связи, 2) ацильного кармана (Фен 295 и Фен297), 3)холинового участка (Трп86, Глу202 и Тир337), 4)периферического анионного участка (Трп286, Тир72, Тир124 и Асп74). Тир337 и Тир449 удалены от активного центра,однако они, видимо, участвуют в стабилизации связи с некоторыми лигандами. Каталитическая триада, ацильный карман и холиновый участок располагаются на дне каталитического кармана, а периферический анионный участок - у входа в него. Глубина каталитического кармана, расположенного в центре каталитической субъединицы АХЭ, составляет 18-20 ангстрем.
Другой (хотя и близкий по структуре) ген кодирует псевдохолинэстеразу. Последняя образуется в печени, а содержится в основном в плазме (Lockridge et al., 1987). Холинэстеразы относятся к суперсемейству белков, для которых характерен общие структурный мотив из β-слоев, окруженных а-спиралями; этот мотив называется а,β-гидролазной складкой (Cygleret al., 1993). В это суперсемейство входят также некоторые другие эстеразы, отсутствующие в ЦНС гидролазы и, как ни странно, белки 6с гидролазной активности (например, тиреоглобулин и белки семейства нейролигина; Taylor et al., 2000).
При реконструкции трехмерной структуры АХЭ видно, что активный центр располагается почти строго в центре каждой каталитической субъединицы на дне узкого кармана глубиной около 20 ангстрем (каталитического кармана) (Sussman et aL, 1991; Bourne etal.. 1995). Здесь находится «каталитическая триада» — Сер , Гис447 и Глу334 (рис. 8.1). Механизм ее активности такой же, как у других гидролаз, — гидроксильная группа серина приобретает высокую нуклеофильность благодаря системе с переносом заряда, образованной карбоксильной группой глутамата, имидазольной — гистидина и гидроксильной — серина (рис. 8.2, А).
В процессе гидролиза сложноэфирной связи ацетилхолина, молекула которого имеет вид треугольника, между ним и активным центром вначале образуется промежуточное соединение тетраэдрической структуры (рис. 8.2, Б). Затем оно распадается, и остается ацетилированный фермент и свободный холин (рис. 8.2, В). Ацетилированный фермент быстро гидролизуется с образованием активного фермента и остатка уксусной кислоты (рис. 8.2, Г; см. также Froede and Wilson, 1971; Rosenberry, 1975). АХЭ — это один из самых быстродействующих известных ферментов. Одна его молекула способна расщеплять 6 х 105 молекул ацетилхолина в 1 мин (то есть одну молекулу ацетилхолина в 150 мкс).
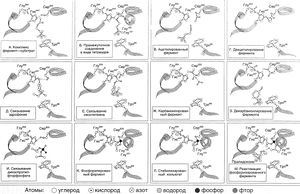
Описание к рис. 8.2. Этапы гидролиза ацетилхолина ,ингибирования и реакции АХЭ. А. Связывание ацетилхолина. Б. Атака ацетилхолина сериновой гидроскильной группой с образованием промежуточного соединения тетраэдрической структуры. В. Отщепление холина и образование ацетилхолинового фермента. Г. Гидролитическое деацетилирование фермента. Д. Связывание с активным центром обратимого ингибитора АХЭ эдрофония. Е. Связывание с активным центром неостигмина. Ж. Образование карбамоилированного ( в данном случае - диметилкарбомоилированного ) фермента. З. Гидролиз карбомоилированного фермента. И. Связывание с активным центром диизопропилфторфосфата. К. Образование фосфорилированного (в данном случае - диизопропилфторфосфорилированного ) фермента. Л. Образование стабилизированного конъюгата ( в данном случае - изопропилфосфорилированного фермента ). М. Атака фосфорилированного фермента пралидоксимом.
Механизм действия
Молекулярные механизмы действия всех трех групп (см. ниже) ингибиторов АХЭ приведены на рис. 8.2, Д—М.
Ингибиторы АХЭ связываются с тремя доменами этого фермента: ацильным карманом активного центра, холиновым участком активного центра и периферическим анионным участком (Taylor and Radic, 1994; Reiner and Radic, 2000). Эти же три домена и определяют различия в специфичности между АХЭ и псеадохолинэстеразой. Обратимые ингибиторы АХЭ типа эдрофония и такрина связываются с холиновым участком (в области Трп86 и Глу202) (Silman and Sussman, 2000) (рис. 8.2, Д). Действие эдрофония на АХЭ непродолжительно, поскольку опосредованная электростатическими взаимодействиями связь между четвертичной аммониевой группой ингибитора и активным центром фермента быстро распадается. Существуют обратимые ингибиторы АХЭ этой группы, обладающие более высоким сродством к активному центру АХЭ, например донепезил.
Другие обратимые ингибиторы АХЭ, например пропидий и пептидные токсины фасцикулины, связываются с периферическим анионным участком этого фермента, расположенным у входа в каталитический карман (см. выше). Основные составляющие этого участка — Трп286, Тир72 и Тир124 (рис. 8.1).
Карбаматы (физостигмин, неостигмин и др.) гидролизуются АХЭ, но гораздо медленнее ацетилхолина. Как четвертичное аммониевое основание неостигмин, так и третичный амин физостигмин при физиологических значениях pH существуют преимущественно в виде катионов, а пространственная структура их молекулы сходна с таковой ацетилхолина (рис. 8.2, Е— Ж). Поэтому они конкурируют с ацетилхолином за связывание с АХЭ, и после этого связывания происходит карбамоилирование фермента по Сер ; при этом карбамоильная группа располагается в ацильном кармане, образованном Фен и Фен247. Карбамоилированная АХЭ значительно стабильнее ацетилированной: Т^ диметилкарбамоилированной АХЭ (рис. 8.2, Ж) составляет 15—30 мин. Таким образом, АХЭ достаточно надолго переходит в карбамоилированную форму, и гидролиз ацетилхолина прекращается. Продолжительность действия карбаматов in vivo равна 3—4 ч.
Фосфорорганические соединения (например, диизопропилфторфосфат) образуют очень стабильный комплекс с АХЭ, фосфорилируя Сер 3 (рис. 8.2, И—Л). Это фосфорилирование во многом сходно с первым этапом гидролиза ацетилхолина (см. выше и рис. 8.2, Б): фосфорорганические соединения имеют тетраэдрическую структуру (как промежуточное соединение, образующееся при гидролизе ацетилхолина), а их фосфорильный кислород также связывается с оксианионным участком активного центра. Если алкильная группа в алкоксильном радикале ингибитора представлена этилом или метилом, то через несколько часов возможна спонтанная реактивация фосфорилированной АХЭ. Если же это вторичная (как в случае диизопропилфторфосфата) или третичная алкильная группа, то образуется еще более стабильная фосфорилированная АХЭ, и активность фермента обычно восстанавливается лишь в результате синтеза новых его молекул. Более того, в результате отщепления от атома фосфора одной алкоксильной группы фосфорилированная АХЭ дополнительно стабилизируется (рис. 8.2, Л; см. также Aldridge, 1976).
Из всего этого видно, что термины обратимые и необратимые ингибиторы АХЭ, обычно применяемые соответственно по отношению к карбаматам и фосфорорганическим соединениям, относительны и отражают лишь скорость декарбамоилирования или дефосфорилирования модифицированного фермента. Вещества обеих групп, как и ацетилхолин, ковалентно связываются с АХЭ. Механизмы влияния на эффекторные органы. Действие ингибиторов АХЭ обусловлено тем, что под их влиянием в холинергических синапсах не происходит гидролиза ацетилхолина, он накапливается, и реакции на выделяющийся из пресинаптических окончаний ацетилхолин усиливаются. Этим объясняются почти все эффекты данных веществ, вводимых в умеренных дозах. Так, миоз — типичная реакция на закапывание в глаздиизопропилфторфосфата — не наблюдается после денервации зрачка, при которой устраняется источник эндогенного ацетилхолина. Последствия накопления ацетилхолина в нервно-мышечных синапсах несколько сложнее (см. ниже).
Третичные и особенно четвертичные амины иногда оказывают и некоторые дополнительные эффекты. Так, влияние неостигмина на спинной мозг и скелетные мышцы складывается из антихолинэстеразного действия и прямой стимуляции холинорецепторов.
Химические свойства
Структурно-функциональная зависимость. Этот вопрос подробно рассматривался в предыдущих изданиях данной книги. Здесь мы рассмотрим лишь некоторые, наиболее важные из ингибиторов АХЭ.
Нековалентные ингибиторы АХЭ. Все препараты данной группы образуют обратимую нековалентную связь с АХЭ, различаются же они по сродству к этому ферменту и фармакокинетическим свойствам. Эдрофоний — это четвертичное аммониевое основание, действующее только в области периферических синапсов и обладающее умеренным сродством к АХЭ. Объем его распределения невелик, и он быстро выводится почками — поэтому и действие его сравнительно кратковременно. Такрин и донепезил обладают более высокими сродством к АХЭ и жирорастворимостью. Благодаря этому они, с одной стороны, проникают через гематоэнцефалический барьер и действуют на центральные синапсы, с другой — действуют продолжительнее.
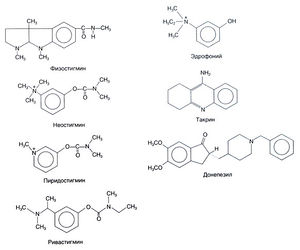
Карбаматы. Препараты этой группы приведены на рис. 8.3. Стедман (Stedman, 1929, а, b) показал, что свойства физостигмина обусловлены метилкарбамоильной группой фенолового эфира. Неостигмин — это четвертичное аммониевое основание, обладающее такой же или большей активностью и большей стабильностью. Близкое по строению вещество пиридостигмин применяют при миастении.
Усиление антихолинэстеразной активности и пролонгация действия препаратов могут быть достигнуты за счет объединения в одной молекуле нескольких четвертичных аммониевых групп. Примером может служить офтальмологическое средство демекарий, представляющее собой две молекулы неостигмина, соединенные метиленовой цепью из 10 метильных групп. Вторая четвертичная аммониевая группа соединяется с отрицательно заряженной группой Асп у входа в каталитический карман и делает более стабильной связь ингибитора с АХЭ. Карбамоилированные соединения обладают высокой жирорастворимостью; поэтому они легко проникают через гематоэнцефалический барьер и характеризуются большим Т1/2. Препарат этой группы ривастигмин одобрен ФДА к применению при болезни Альцгеймера (Corey-Bloom et al., 1998; Giacobini, 2000; см. также гл. 22).
Механизмы действия карбаматных инсектицидов карбарила, пропоксура и альдикарбате же. Симптомы отравления такие как при действии фосфорорганических соединений (Baron,Ecobichon, 2000). Карбарил очень плохо всасывается через кожу и поэтому в некоторых странах используется для уничтожения головных вшей. Карбаматные инсектициды (а также карбаматные фунгициды дитиокарбаматы) часто входят в состав средств для опрыскивания садовых растений.
Фосфорорганические соединения. Общая формула веществ этой группы приведена в табл. 8.1. В качестве радикалов R, и R2 могут выступать алкильная, алкоксильная, арилоксильная, амидная сульфгидрильная и другие группы, а в качестве уходящей группы Х-галогенидная, цианидная, тиоцианатная, фосфатная, тиохолиновая, карбоксильная, фенокси- или тиофенокси-группа. Подробные сведения об этих соединениях содержатся в статье Gallo and Lawryk (1991).
Диизопропилфторфосфат вызывает почти необратимую инактивацию АХЭ и других эстераз, связываясь с серином активного центра фермента. Благодаря его высокой жирорастворимости и летучести и низкой молекулярной массе он легко всасывается из легких и через кожу и проникает через гематоэнцефалический барьер.
Нервно-паралитические газы табун, зарин и зоман — одни из самых сильных отравляющих веществ; их летальная доза составляет доли миллиграмма. Эти средства тайно употреблялись во время военных действий и террористических актов (Nozaki andAikawa, 1995).
Благодаря стабильности в водных растворах и низкой летучести широкую популярность в качестве инсектицида снискал паратион. Впрочем, из-за риска острых и хронических отравлений в США и других странах он сейчас в сельском хозяйстве употребляется реже, а в качестве бытовых и садовых средств его заменили менее токсичные вещества. In vitro паратион не действует на АХЭ, так как его активность обусловлена метаболитом параоксоном. Этот метаболит образуется путем замены серы на кислород. У млекопитающих эта реакция протекает преимущественно под действием печеночных монооксигеназ, а у насекомых другими путями, но обычно еще более эффективно. Возможно, на долю паратиона приходится больше отравлений, в том числе смертельных, чем на долю какого-либо другого фосфорорганического ингибитора АХЭ. Значительно реже используется его диметиловое производное метил паратион. В сельском хозяйстве и в качестве бытовых и садовых средств широко применяются и другие тиофосфорные соединения — диазинон, хлорпирифос и т.д. Впрочем, из-за хронического токсического действия, обнаруженного у новорожденных животных, использование хлорпирифоса сейчас ограничено; диазинон же с 2001 г. в США не используется в качестве бытового инсектицида, а с 2005 г. не будет применяться вовсе.
Малатион также превращается в активный метаболит — малаоксон — путем замены серы на кислород. Этот инсектицид инактивируется посредством гидролиза сложноэфирной связи под действием карбоксилэстераз, и именно активность этих ферментов определяет видовую устойчивость к малатиону. У млекопитающих и птиц данная реакция протекает значительно быстрее, чем у насекомых (Costa et al., 1987). В последние годы малатион использовался для опрыскивания с воздуха в достаточно густонаселенных средиземноморских районах для уничтожения плодовых мушек (вредителей цитрусовых) и комаров, переносящих опасные вирусы (например, лихорадки Западного Нила). Острые отравления возможны только при попытках самоубийства или отравления (Bardin et al., 1994): смертельная доза у млекопитающих составляет около 1 г/кг. С поверхности сухой кожи всасывается менее 10% вещества, и поэтому малатион используется при педикулезе (гл. 65).
Из фосфорорганических соединений с четвертичными аммониевыми группами применяется только эхотиофат — в качестве офтальмологического средства. Молекула этого вещества несет положительный заряд, и поэтому оно нелетучее и не проникает через кожу.
Метрифонат — это низкомолекулярное фосфорорганическое соединение, спонтанно превращающееся в активное производное диметил 2,2-дихлорвинилфосфат(дихлорфос). И метрифонат, и дихлорфос легко проникают через гематоэнцефалический барьер и поэтому ингибируют АХЭ в ЦНС. Метрифонат был разработан для лечения шистосомоза (гл. 42), но в связи со способностью проникать через гематоэнцефалический барьер и низкой токсичностью он сейчас проходит клинические испытания при болезни Альцгеймера (Cummings et al., 1999).
Фармакологические свойства
Фармакодинамика. Эффекты ингибиторов АХЭ обычно можно предсказать, зная распределение холинергических нервов, выраженность холинергических влияний на разные органы и реакции этих органов на ацетилхолин (гл. 6). В целом эти эффекты могут быть следующими: 1) стимуляция М-холинорецепторов вегетативных органов (мускариноподобное действие), 2) стимуляция N-холинорецепторов, сопровождающаяся сначала возбуждением, а затем торможением вегетативных ганглиев и скелетных мышц (никотиноподобное действие), 3) стимуляция холинорецепторов ЦНС, сопровождающаяся возбуждением нейронов (иногда с последующим торможением). Токсические дозы ингибиторов АХЭ вызывают все или почти эти эффекты (см. ниже). Что же касается меньших, в частности терапевтических, доз, то здесь играют роль несколько дополнительных факторов. Так, соединения с четвертичной аммониевой группой с трудом проникают через биологические мембраны, и поэтому они плохо всасываются из ЖКТ и через кожу и не проходят через гематоэнцефалический барьер. Эффекты же их в нервно-мышечных синапсах, напротив, ярко выражены, причем они обусловлены не только антихолинэстеразным действием, но и прямой стимуляцией холинорецепторов. На вегетативные ганглии и внутренние органы они действуют слабее. Жирорастворимые вещества хорошо всасываются в ЖКТ, действуют как в периферических, так и в центральных холинергических синапсах и в течение долгого времени сохраняются в жировой ткани. Жирорастворимые фосфорорганические соединения, кроме того, проникают через кожу, а летучие — через легкие (Storm et al., 2000).
Эффекты ингибиторов АХЭ на внутренние органы и ЦНС (где имеются преимущественно М-холинорецепторы) блокируются атропином. Кроме того, атропин уменьшает возбуждающее действие ингибиторов АХЭ в вегетативных ганглиях, так как в передаче возбуждения в них участвуют не только N-, но и М-холинорецепторы (гл. 9).
Точки приложения ингибиторов АХЭ в терапевтических дозах— это ЦНС, глаза, ЖКТ и нервно-мышечные синапсы. Влияние на другие органы имеет значение для отравлений этими веществами.
Глаза. При попадании в глаза ингибиторы АХЭ вызывают гиперемию конъюнктив, сокращение сфинктера зрачка и ресничной мышцы (и, следовательно, сужение зрачков и спазм аккомодации). Сужение зрачков развивается уже через несколько минут и может сохраняться несколько часов или суток. Несмотря на то что оно может быть значительным (вплоть до точечных зрачков), под действием света зрачки обычно сужаются еще больше. Спазм аккомодации, как правило, проходит раньше. Под действием ингибиторов АХЭ улучшается отток водянистой влаги, и поэтому они применяются при повышенном внутриглазном давлении (гл. 66).
ЖКТ. У человека неостигмин усиливает моторику желудка и секрецию соляной кислоты. После двусторонней ваготомии влияния на моторику резко уменьшаются. Этот препарат усиливает также сокращения нижней трети пищевода, что иногда приносит ощутимое облегчение больным с ахалазией и расширением пищевода.
Неостигмин повышает также моторику тонкой и толстой, и особенно ободочной, кишки. Это может приводить к устранению атонии кишечника, возникающей на фоне приема М-холиноблокаторов и после хирургических вмешательств, повышению частоты и амплитуды перистальтических волн и, следовательно, ускорению продвижения кишечного содержимого. Действие ингибиторов АХЭ на кишечник, видимо, складывается из влияний непосредственно на гладкие мышцы и на нейроны межмышечного сплетения (то есть обусловлено накоплением ацетилхолина, выделяющегося окончаниями пре- и постганглионарных нейронов).
Скелетные мышцы. Большинство влияний ингибиторов АХЭ на скелетные мышцы можно объяснить их основным — антихолинэстеразным — действием в области нервно-мышечных синапсов. Однако есть убедительные данные о том, что неостигмин и другие ингибиторы АХЭ с четвертичной аммониевой группой оказывают на скелетные мышцы и прямой эффект. Так, введение неостигмина в артерии хронически денервированных или предварительно обработанных диизопропилфторфосфатом мышц немедленно приводит к сокращению последних; физостигмин же такого действия не оказывает.
В норме количество ацетилхолина, высвобождающееся в ответ на один потенциал действия в окончании мотонейрона, достаточно для того, чтобы вызвать сверхпо-роговый потенциал концевой пластинки и потенциал действия в мышце. Выделившийся ацетилхолин разрушается АХЭ примерно за 200 мкс — это меньше, чем длительность потенциала концевой пластинки и даже рефрактерный период мышечного потенциала действия. Таким образом, каждый нервный импульс вызывает один потенциал действия в мышце. Под действием ингибиторов АХЭ время пребывания ацетилхолина в синаптической щели возрастает, и ацетилхолин повторно активирует постсинаптические рецепторы. В результате потенциал концевой пластинки удлиняется, и отдельные потенциалы сливаются. При этом утрачивается точное соответствие между пре- и постсинаптическими потенциалами действия и возникают асинхронные сокращения и фибрилляция мышечных волокон. Если доза ингибитора АХЭ достаточно велика, то в постсинаптической мембране возникает постоянная деполяризация, а это приводит к блокаде проведения возбуждения (гл. 9). Длительно пребывающий в синаптической щели ацетилхолин может вызвать деполяризацию нервного окончания вплоть до возникновения в нем потенциала действия; последний антидромно распространяется до области ветвления аксона, а затем снова (ортодромно) к мышце. Это приводит к фасцикуляциям — сокращениям отдельных двигательных единиц.
Ингибиторы АХЭ устраняют эффекты недеполяризующих миорелаксантов (гл. 9). В отношении деполяризующих миорелаксантов (например, неостигмин в отношении суксаметония хлорида) ингибиторы АХЭ неэффективны: и те, и другие вызывают блокаду проведения, обусловленную деполяризацией постсинаптической мембраны.
Прочие органы. Холинергические волокна иннервируют трахеобронхиальные, слезные, потовые, слюнные, желудочные (G-клетки пилорического отдела и обкладочные клетки) железы, поджелудочную железу (ацинозные клетки) и кишечные крипты (либеркюновы железы). В низких дозах ингибиторы АХЭ увеличивают секрецию всех этих желез в ответ на нервные воздействия, а в высоких — еще и базальную секрецию.
Ингибиторы АХЭ усиливают сокращения гладких мышц бронхиол и мочеточников, а в последних вызывают также учащение перистальтических волн.
Влияние ингибиторов АХЭ на сердечно-сосудистую систему сложно, так как обусловлено усилением эффектов ацетилхолина, выделяющегося как из преганглионарных, так и из постганглионарных волокон. Действие на сердце высвобождающегося из постганглионарных парасимпатических волокон ацетилхолина приводит к брадикардии и, как следствие, к падению сердечного выброса. В высоких дозах ингибиторы АХЭ обычно вызывают падение АД — как правило, из-за влияния на сосудодвигательный центр продолговатого мозга.
Ингибиторы АХЭ усиливают действие на сердце блуждающих нервов. Это приводит к укорочению рефрактерного периода предсердий и удлинению рефрактерного периода и замедлению проведения в синусовом и АВ-узлах. Накопление ацетилхолина, высвобождающегося из преганглионарных волокон, приводит к стимуляции N-холинорецепторов (при действии больших доз ингибиторов АХЭ наступает блокада проведения в ганглии из-за стойкой деполяризации постсинаптических нейронов). Возбуждение постганглионарных парасимпатических нейронов приводит к еще большему снижению сердечного выброса, а постганглионарных симпатических нейронов — наоборот. На центральном уровне накопление ацетилхолина приводит к возбуждению (при действии больших доз ингибиторов АХЭ — сменяющемуся торможением) сосудодвигательного и сердечного центров продолговатого мозга. На все эти влияния накладывается реакция на гипоксию, возникающую из-за бронхоспазма и усиления секреции трахеобронхиальных желез. Гипоксия приводит к повышению симпатического тонуса и выбросу адреналина из надпочечников; этот выброс усиливается также из-за прямого действия ацетилхолина на клетки мозгового вещества. Не удивительно, что при тяжелом отравлении ингибиторами АХЭ ЧСС нередко бывает повышенной. Возможно, гипоксия играет основную роль в угнетении ЦНС, возникающем под действием высоких доз ингибиторов АХЭ. Меньшие дозы, напротив, вызывают возбуждение, которое частично снимается атропином (хотя и не столь эффективно, как реакции на стимуляцию периферических М-холинорецепторов).
Фармакокинетика. Физостигмин легко всасывается из ЖКТ, подкожной клетчатки и с поверхности слизистых. Закапывание физостигмина в глаз может привести к системным эффектам, если только не принять меры по предупреждению его всасывания со слизистой носа и глотки (надавливание на внутренний угол глаза). При парентеральном введении физостигмин почти полностью элиминируется за 2 ч. Основной путь элиминации — гидролиз эстеразами плазмы; почечное выведение играет незначительную роль.
Неостигмин и пиридостигмин из ЖКТ всасываются плохо, и поэтому при приеме внутрь необходимы гораздо большие дозы, чем при парентеральном введении. Так, доза неостигмина при парентеральном введении составляет 0,5—2 мг, а при приеме внутрь для достижения того же эффекта необходимо 15—30 мг или даже больше. Неостигмин и пиридостигмин разрушаются эстеразами плазмы, и их метаболиты — четвертичные спирты и другие — выводятся с мочой. Т1/2 этих препаратов составляй 1—2 ч (Cohan et al., 1976).
Наиболее токсичные фосфорорганические соединения — это жидкости с высокой жирорастворимостыо,а многие даже при высоком давлении пребывают в газообразном состоянии. Менее летучие вещества (например паратион и малатион) используют в качестве сельскохозяйственных инсектицидов. Их распыляют в виде аэрозолей или дустов; в последнем случае они адсорбируют на мелкодисперсных инерционных частицах. Все эти вещества быстро всасываются с поверхности слизистых и влажной кожи, из легких и ЖКТ (Storm et al., 2000). Большинство фосфорорганических соединений гидролизуются эстеразами плазмы и печени, и продукты гидролиза удаляются почками. С другой стороны, печеночные монооксигеназы, связанные с цитохромом Р450, превращают неактивные фосфоротиоаты, содержащие тионфосфорную связь, в активные метаболиты путем замены связанной с фосфором серы на кислород (см. выше). Эти же монооксигеназы участвуют и в инактивации некоторых фосфорорганических соединений.
Гидролиз фосфорорганических соединений осуществляется ферментами двух семейств — карбоксил эстеразами (алиэстеразами, эстеразами В) и арил эстеразами (параоксоназами, эсгеразами А). Эти ферменты содержатся в плазме и печени и отвечают за элиминацию многих фосфорорганических ингибиторов АХЭ (параоксона, диизопропилфторфосфата, тетраэтилпирофосфата, хлорпирифоса, хлорпирифос-оксона, табуна, зарина, малатиона и др.). Их действие заключается в расщеплении связи между атомом фосфора и уходящей группой, в результате высвобождаются нуклеофильные заместители (фторид, цианид и др.) и образуются нетоксичные продукты. Арил-эстеразы — это металлоферменты, не сходные по структуре с холинэстеразами и, видимо, не образующие с фосфороргамическими соединениями стабильных промежуточных продуктов. Они связаны с ЛПВП и, возможно, предупреждают окисление эндогенных липидов (La Du et al., 1999). У этих ферментов обнаружен генетический полиморфизм, проявляющийся заменой Apr1 2 на глицин, что приводит к изменению их специфичности по отношению к разным фосфорорганическим соединениям (Furlong et al., 2000). Среди животных существуют выраженные межвидовые различия в активности арилэстераз. У молодых животных активность и арилэстераз, и карбоксилэстераз ниже; это может объяснять как высокую чувствительность к фосфорорганическим соединениям новорожденных животных, так и возрастные особенности реагирования человека на эти вещества (Padilla et al., 2000).
В свою очередь, фосфорорганические соединения могут необратимо подавлять активность карбоксилэстераз печени и плазмы, а также псевдохолинэстеразы (Lockridge and Masson, 2000). Это может играть защитную роль: связывая часть фосфорорганических соединений, данные ферменты снижают их токсическое действие на ЦНС. Кроме того, карбоксилэстеразы гидролизуют и тем самым инактивируют малатион и другие фосфорорганические соединения, содержащие сложноэфирную связь. Поскольку же, как говорилось, фосфорорганические соединения ингибируют карбоксилазы, разные фосфорорганические инсектициды могут действовать синергично, вызывая тяжелые отравления.
Применение
Хотя ингибиторы АХЭ могут применяться при самых различных состояниях, связанных с нарушениями периферической нервной системы, их используют в основном в следующих четырех ситуациях: 1) при паралитической кишечной непроходимости и атонии мочевого пузыря, 2) при глаукоме, 3) при миастении, 4) для декураризации (гл. 9). Гидрофобные ингибиторы АХЭ длительного действия оказывают некоторый (очень умеренный) эффект при болезни Альцгеймера. Физостигмин, напротив, обладает кратковременным действием, и благодаря этому его применяют при отравлении атропином и другими средствами с М-холиноблокирующим действием. Кроме того, он используется при атаксии Фридрейха и других наследственных атаксиях. Эдрофоний можно назначать для купирования приступов наджелудочковой тахикардии.
Препараты. Здесь перечислены только те ингибиторы АХЭ и реактиваторы холинэстераз, которые применяются в США. Дозы и пути введения — см. в следующих разделах.
Физостигмина салицилат выпускается в виде раствора для инъекций и глазных капель; физостигмина сульфат — в виде глазной мази; пиридостигмин — в виде препаратов для приема внутрь и раствора для инъекций; неостигмина бромид — в виде таблеток; неостигмина метилсульфат — в виде раствора для инъекций; амбеноний — в виде таблеток; эдрофоний — в виде раствора для инъекций. Для применения при болезни Альцгеймера одобрены такрин, донепезил, ривастигмин и галантамин. Единственный выпускаемый в США реактиватор холинэстераз — это пралидоксим (в виде раствора для инъекций).
Паралитическая кишечная непроходимость и атония мочевого пузыря. В обоих случаях чаше всего из ингибиторов АХЭ используют неостигмин. Применяют также М-холиностимуляторы (гл. 7).
Неостигмин назначают при метеоризме и острой паралитической кишечной непроходимости самого разного происхождения (Ponec etal., 1999). При послеоперационной паралитической кишечной непроходимости обычно вводят 0,5 мг неостигмина метилсульфата п/к; введение повторяют по мере необходимости. Перистальтика обычно появляется через 10—30 мин (при приеме 15—30 мг неостигмина бромида внутрь — через 2—4 ч). При назначении неостигмина обычно вводят газоотводную трубку, а для облегчения дефекации могут понадобиться клизмы. Неостигмин противопоказан при обструкции кишечника или мочевых путей, перитоните, подозрении на нежизнеспособность участка кишечника, а также в тех случаях, когда причиной паралитической непроходимости является воспалительное заболевание кишечника.
При послеоперационной атонии мочевого пузыря неостигмин уменьшает боль при мочеиспускании и сокращает время между операцией и восстановлением самопроизвольного мочеиспускания. Дозы и режим введения те же, что при паралитической кишечной непроходимости.
Глаукома и другие глазные болезни. Глаукома — это синдром, для которого характерно прежде всего повышенное внутриглазное давление. Если оно достаточно выражено и держится постоянно, то возможно повреждение диска зрительного нерва, чреватое необратимой слепотой. Глаукома бывает первичной, вторичной и врожденной; ингибиторы АХЭ наиболее эффективны при первичной и некоторых формах вторичной (например, возникшей после удаления хрусталика) глаукомы. Врожденная глаукома обычно поддается только оперативному лечению. Глаукома подразделяется на закрытоугольную и открытоугольную. Это деление, как следует из названия, основано на состоянии угла передней камеры глаза — области, где осуществляется отток водянистой влаги.
Закрытоугольная глаукома — это почти всегда экстренное состояние. Сам по себе приступ снимается лекарственными средствами, но в дальнейшем необходимо хирургическое лечение (например, иридэктомия). Напротив, открытоугольная глаукома развивается исподволь, постепенно и обычно не поддается хирургическому лечению; при ней необходимо поддерживать нормальное внутриглазное давление с помощью лекарственных средств.
Поскольку М-холиностимуляторы и ингибиторы АХЭ вызывают спазм аккомодации, их закапывание в глаза сопровождается временной нечеткостью зрения при взгляде вдаль и снижением бокового зрения. При длительном применении данных препаратов эти неприятные явления уменьшаются, но все же в настоящее время главными средствами при открытоугольной глаукоме стали β-адреноблокаторы, препараты простагланди-нов и ингибиторы карбоангидразы, вовсе лишенные данных побочных эффектов (Alward, 1998; см. также гл. 66). Ингибиторы АХЭ длительного действия (эхотиофат) даже при местном применении вызывают системные эффекты. Кроме того, есть данные, что лечение далеко зашедшей глаукомы эхотиофатом может приводить к катаракте (Alward, 1998).
Ингибиторы АХЭ применяются и при других глазных болезнях, например аккомодационном косоглазии и глазной форме миастении. Есть сообщения о том, что физостигмин в малых дозах уменьшает боль и нечеткость зрения при синдроме Холмса—Эйди — состоянии, обусловленном дисфункцией ресничной мышцы (предположительно, из-за местной дегенерации нервных волокон). Наконец, ингибиторы АХЭ короткого действия могут назначаться в чередовании со средствами, расширяющими зрачок (например, атропином), для разрыва спаек между радужкой и хрусталиком или радужкой и роговицей. Подробнее о применении ингибиторов АХЭ в офтальмологии см. Офтальмологические средства (препараты).
Миастения. Эго заболевание, обусловленное нарушением нервно-мышечной передачи, характеризуется выраженной слабостью и утомляемостью скелетных мыши и протекает с частыми обострениями и ремиссиями (подробнее см., например. в статье Drachman, 1994). Жолли в 1895 г. (Jolly, 1895) отметил сходство между проявлениями миастении и при знаками отравления кураре у экспериментальных животных и предложил использовать для лечения миастении физостигмин (уже тогда было известно, что физостигмин — это антагонист кураре). Однако лишь спустя 40 лет это предложение стало воплотиться в жизнь (Walker, 1934).
Как уже говорилось, миастения обусловлена нарушением нервно-мышечной передачи. У здоровых лиц при раздражении двигательного нерва с частотой 25 Гц наблюдаются незатухающие электрические и механические ответы мышцы — иными словами, существует значительный запас надежности проведения в нервно-мышечном синапсе. У больных же с миастенией реакция на такое раздражение сначала нормальная, но затем она довольно быстро уменьшается. Именно поэтому они способны лишь на кратковременные мышечные усилия.
В течение долгого времени шли споры о том, поражены ли при миастении пресинаптические окончания или постсинаптические структуры. Лишь в 1973 г. Патрик и Линдстрем (Patrick and Lindstrom, 1973) показали, что при иммунизации кроликов выделенными у электрического угря N-холинорецепто-рами у них постепенно развиваются такие же мышечная слабость и дыхательные расстройства, как у больных миастенией. Кроме того, у таких кроликов также наблюдались постепенное снижение ответа на ритмическую электростимуляиию двигательного нерва, повышенная чувствительность к кураре, а также симптоматическое и электрофизиологическое улучшение в ответ на введение ингибиторов АХЭ. И хотя такая экспериментальная миастения несколько отличается от миастении у человека, данные Патрика и Линдстрема послужили толчком к исследованиям, направленным на выяснение роли аутоиммунной реакции на холинорецепторы в патогенезе этого заболевания. Вскоре у больных были обнаружены антитела к холинореиенто-рам (Almon et al., 1974). В настоящее время эти антитела выявляются у 90% больных, хотя их титр не коррелирует с тяжестью заболевания (Drachmanetal., 1982; Drachman, 1994; Lindstrom, 2000).
Итак, миастения обусловлена аутоиммунной реакцией, вызванной антителами к N-холинорецеп горам. В результате ускоряется разрушение N-холинорецепторов (Drachman et al., 1982) и снижается их плотность, определяемая методом связывания с а- нейротоксином (Fambrough et al., 1973) или электрофизиологическим измерением чувствительности к ацетилхолину (Drachman, 1994). В синаптической щели появляются иммунные комплексы и выраженные структурные изменения; последние, видимо, обусловлены опосредованным комплементом лизисом складок постсинаптической мембраны. С миастенией сходно другое заболевание, также сопровождающееся нарушением нервно-мышечной передачи, — синдром Итона—Ламберта. Оно обусловлено антителами к пресинаптическим кальциевым каналам, необходимым для высвобождения ацетилхолина (Lang etal., 1998).
Примерно у 10% больных с симптомами миастении имеется не аутоиммунное нарушение, а тот или иной врожденный миастенический синдром. Изучение биохимии и генетики этих расстройств показало, что они обусловлены мутациями гена N-холинорецептора. При таких мутациях нарушается сродство N-холинорецептора к ацетилхолину или кинетика связанного с этим рецептором натриевого канала (Engel et al., 1998). Другие мутации поражают АХЭ нервно-мышечных синапсов, содержатую коллагеноподобную хвостовую структуру (Ohno et al., 2000). Как и следовало ожидать, при большинстве врожденных миастенических синдромов ингибиторы АХЭ неэффективны. Диагностика. Обычно диагноз миастении можно установить на основании анамнеза и клинической картины, но часто требуется дифференциальная диагностика с некоторыми невротическими, инфекционными, эндокринными, врожденными, пара-неопластическими состояниями, а также дегенеративными нервно-мышечными болезнями. Только при миастении ингибиторы АХЭ вызывают резкое улучшение. Для подтверждения диагноза проводят пробу с эдрофонием: вначале быстро вводят 2 мг эдрофония в/в, а если эффекта нет, вводят дополнительно 8 мг в/в. Положительным результатом считается кратковременное повышение мышечной силы, но без фасцикуляций языка, | возникающих при этой пробе у здоровых людей.
Передозировка ингибиторов АХЭ может вызвать так называемый холинергический криз. Это состояние проявляется резким усугублением мышечной слабости из-за стойкой деполяризации постсинаптической мембраны скелетных мышц, а также мускариновыми эффектами. Слабость при холинергическом кризе можно принять за результат недостаточной дозировки ингибиторов АХЭ. Совершенно очевидно, что различать эти два состояния чрезвычайно важно — в первом случае ингибиторы АХЭ отменяют, во втором — дозу их увеличивают. Для этого можно крайне осторожно — используя только дозу в 2 мг и имея под рукой все необходимое для ИВЛ — провести пробу с эдрофонием: усугубление слабости свидетельствует о холинергическом кризе, улучшение — о недостаточной дозировке ингибиторов АХЭ. При тяжелых мускариновых эффектах срочно вводят атропин в дозе 0,4—0,6 мги более в/в (подробнее см. в статьях Osserman et al., 1972; Drachman, 1994). Для подтверждения диагноза миастении сейчас широко используют определение антител к холинорецепторам в плазме и биоптатах мышц.
Лечение. Применяют 3 основных ингибитора АХЭ — пиридостигмин, неостигмин и амбеноний. Все они уменьшают затухание мышечного ответа на ритмическую электростимуляцию двигательного нерва благодаря накоплению ацетилхолина в синаптической щели.
После того как диагноз миастении установлен, эмпирически подбирают однократную дозу ингибитора АХЭ. Критериями служат показатели кистевой динамометрии, жизненной емкости легких и ряд других параметров мышечной силы. Вначале регистрируют исходные значения всех этих показателей, затем дают внутрь 30—60 мг пиридостигмина, или 7,5— 15 мг неостигмина, или 2,5—5 мг амбенония и далее через короткие промежутки времени повторяют регистрацию — вплоть до возвращения показателей к исходным значениям. Через час или больше снова повторяют весь цикл, но с увеличенной в 1,5 раза дозой препарата. Так продолжают до тех пор, пока не будет найдена оптимальная доза.
Для того чтобы поддерживать приемлемый уровень мышечной силы, интервал между приемами неостигмина обычно составляет 2—4 ч, пиридостигмина — 3—6 ч, амбенония — 3—8 ч. Однако дозировка от одного дня к другому может меняться: так, дозу и частоту приема следует повышать при физических или эмоциональных нагрузках, инфекционных заболеваниях и во время менструации. Кроме того, приходится приспосабливаться к характерным для миастении непредсказуемым ремиссиям и обострениям. Больных обязательно должен регулярно обследовать врач, но они и сами должны уметь изменять дозировку в соответствии с меняющимися потребностями. Есть таблетки пиридостигмина замедленного действия по 180 мг; из них 60 мг высвобождаются сразу, а 120 мг — в течение нескольких часов. Такой препарат позволяет увеличить интервалы между приемами до 6—8 ч, но его предпочтительнее принимать только на ночь. Мускариновые эффекты (в частности, реакции со стороны сердечно-сосудистой системы и ЖКТ) обычно устраняются атропином и другими М-холиноблокаторами (гл. 7). В тоже время эти препараты могут замаскировать проявления передозировки ингибиторов АХЭ. У большинства больных развивается привыкание к мускариновым эффектам, и поэтому необходимость в М-холиноблокаторах отпадает. Многие лекарственные средства, в частности некоторые миорелаксанты, антибиотики и местные анестетики, влияют на нервно-мышечное проведение (гл. 9), и поэтому назначение их больным миастенией требует тщательной коррекции дозы ингибиторов АХЭ и других мер предосторожности.
В лечении миастении важны и другие методы. В контролируемых исследованиях показано, что у значительного числа больных наступает улучшение под действием глюкокортикоидов, однако при длительном применении эти вещества часто вызывают побочные эффекты (гл. 60). Для того чтобы свести их к минимуму, прибегают к постепенному снижению поддерживающей дозы и приему препаратов короткого действия через сутки. В начале лечения глюкокортикоидами мышечная слабость усугубляется, однако если курс продолжать, состояние больного улучшается, и дозы ингибиторов АХЭ можно снизить (Drachman, 1994). В запущенных случаях бывают эффективны иммунодепрессанты, например азатиоприн и циклоспорин.
Если миастения сочетается с тимомой или ингибиторы АХЭ и глюкокортикоиды недостаточно эффективны, показана тимэктомия. В каждом случае надо тщательно взвесить достоинства и недостатки операции и консервативного лечения. Поскольку, с одной стороны, в тимусе имеются миодные клеткис N-холинорецепторами, а с другой — у большинства больных миастенией выявляется патология тимуса, не исключено, что он играет некую роль в запуске заболевания. Кроме того, в тимусе присутствуют аутореактивные Т-хелперы. Однако в поддержании миастении тимус, видимо, не участвует.
Поскольку миастения — это аутоиммунное заболевание, то в случаях, когда тимэктомия и лечение ингибиторами АХЭ с глюкокортикоидами не приносят удовлетворительного результата, иногда оказываются эффективными плазмаферез и нормальный иммуноглобулин для в/в введения (Drachman, 1994,1996). Повышение мышечной силы в таких случаях коррелирует с падением титра антител к холинорецепторам.
Профилактика отравлений нервно-паралитическими газами. В опытах на животных показано, что предварительное введение пиридостигмина снижает частоту тяжелых осложнений и смертность при отравлении нервно-паралитическими газами. Особенно это касается таких средств, как зоман, быстро образующих стабилизированный конъюгат. Впервые пиридостигмии был применен в массовых масштабах у человека в 1990 г. во время операции в Персидском заливе — тогда были основания опасаться атаки с использованием нервно-паралитических газов. Участникам операции выдавали по 30 мг пиридостигмина каждые 8 ч; побочные эффекты наблюдались в 1 % случаев, но к отказу от приема пиридостигмина они приводили менее чем в 0,1% (Keeler et al., 1991). В дальнейшем у некоторых из ветеранов кампании, принимавших пиридостигмии, развился так называемый синдром «Бури в пустыне», проявляющийся нарушением когнитивных функций, атаксией, спутанностью сознания, нервно-мышечными нарушениями, увеличением лимфоузлов, слабостью, недержанием мочи и кала (Haley et al., 1997; The Iowa Persian Gulf Group Study, 1997). Некоторые считают, что этот синдром вызывается непосредственно пиридостигмином, однако у принимающих этот препарат больных миастенией подобных осложнений нет. Поэтому гораздо более вероятно, что причиной синдрома служит сочетание пиридостигмина, продуктов горения фосфорорганических соёдинений и инсектицидов-репеллентов. Кроме того, порой его довольно трудно отличить от посттравматического стрессового расстройства, нередко развивающегося у участников боевых действий.
Отравление средствами с М-холиноблокирующим действием. Этим действием обладают не только атропин и другие М-холиноблокаторы, но и ряд других препаратов — фенотиазины, Н1-блокаторы, трициклические антидепрессанты. Физостигмин ослабляет антихолинергический синдром (в том числе центральные проявления), вызванный передозировкой этих веществ или чрезмерной реакцией на них (Nillson, 1982). В то же время он не влияет на другие побочные эффекты фенотиазинов и трициклических антидепрессантов — нарушения внутрижелудочковой проводимости и желудочковую экстрасистолию. Кроме того, физостигмин может спровоцировать эпилептические припадки, и риск этого осложнения всегда необходимо учитывать при назначении физостигмина — тем более что его положительный эффект обычно скромный. Вначале вводят 2 мг физостигмина в/в или в/м; при необходимости введение повторяют. Будучи третичным амином, физостигмин проникает через гематоэнцефалический барьер. Применение ингибиторов АХЭ для декураризации обсуждается в гл. 9.
Болезнь Альцгеймера. При болезни Альцгеймера происходит гибель холинергических нейронов, в частности в базальном ядре Мейнерта, посылающем импульсацию в кору головного мозга (Markesbery, 1998). В связи с этим предпринимались попытки повысить концентрацию ацетилхолина в пораженных структурах (Mayeux and Sano, 1999), то есть использовать такой же подход, как при других дегенеративных заболеваниях ЦНС (гл. 22). В 1993 г. ФДА одобрило применение при легких и умеренных формах болезни Альцгеймера такрина (тетрагидроаминоакридина), однако из-за гепатотоксичности и необходимости постоянного слежения за биохимическими показателями функции печени его применение ограничено. Примерно у 30% больных, принимающих в течение 3 мес такрин в низких дозах, активность АлАТ в 3 раза превышала норму; после отмены препарата у 90% биохимические показатели функции печени нормализо-вывались. Другие побочные эффекты такрина такие же, как у прочих ингибиторов АХЭ.
Недавно был одобрен для клинического применения доне-пезил. Его эффективность была доказана во многих клинических испытаниях, большинство которых включали сотни больных (Dooley and Lamb, 2000). Препарат назначали в дозе 5—10 мг/сут внутрь, а срок наблюдения составлял 21—81 нед. Было показано, что донепезил вызывает улучшение когнитивных функций и общего состояния. Кроме того, он замедлял прогрессирование заболевания. Побочные эффекты в основном обусловлены усилением холинергических воздействий; самые частые из побочных эффектов — тошнота, рвота и понос. В целом же при приеме 1 раз в сутки препарат переносится хорошо. Обычно назначают 5 мг на ночь в течение 4—6 нед; если эта доза не вызывает побочных эффектов, ее увеличивают до 10 мг/сут.
Еще один препарат, недавно утвержденный для клинического применения в США и в Европе, — ривастигмин. Он представляет собой карбаматный ингибитор АХЭ длительного действия. Клинических испытаний ривастигмина пока немного, но, видимо, его эффективность, переносимость и побочные эффекты такие же, как у донепезила (Corey-Bloom et al., 1998; Giacobini, 2000). В двух испытаниях еще одного карбамата — эптастигмина — были выявлены гематологические побочные эффекты, в связи с чем испытания были прекращены. Наконец, ФДА был одобрен при болезни Альцгеймера га-лантамин. Его побочные эффекты такие же, как у донепезила и ривастигмина.
При разработке новых препаратов для применения при болезни Альцгеймера стремятся к тому, чтобы у них было наибольшее соотношение между центральным и периферическим действием. Исследуются сочетания ингибиторов АХЭ с избирательными М-холиноблокаторами и М-холиностимуляторами, а также всех этих препаратов со средствами, способными замедлить прогрессирование дегенеративных процессов в ЦНС.
Литература
- Almon, R.R., Andrew, C.G., and Appel, S.H. Serum globulin in myasthenia gravis: inhibition of a-bungarotoxin binding to acetylcholine receptors. Science, 1974, 186:55—57.
- Argyll-Robertson, D. The Calabar bean as a new agent in ophthalmic practice. Edinb. Med. J., 1863, 8:815-820.
- Boume, Y., Marchot, P., and Taylor, P. Acetylcholinesterase inhibition by fasciculin: crystal structure of the complex. Cell, 1995,83:493—506.
- Christioson, R. On the properties of the ordeal bean of Old Calabar. Mon. J. Med. (Lond.), 1855,20:193-204.
- Fambrough, D.M., Drachman, D.B., and Satyamurti, S. Neuromuscular junction in myasthenia gravis: decreased acetylcholine receptors. Science, 1973, 182:293-295.
- Fleisher, J.H.,and Harris, L.W. Dealkylation as a mechanism for aging of cholinesterase after poisoning with pinacolyl methylphosphonofluo-ridate. Biochem. Pharmacol., 1965, 14:641—650.
- Fraser, T.R. On the characters, actions and therapeutical uses of the ordeal bean of Calabar (Physostigma venenosum, Balfour). Edinb. Med. J., 1863,9:36-56, 123-132,235-248.
- Keeler, J.R., Hurst, C.G., and Dunn, M.A. Pyridostigmine used as a nerve agent pretreatment under wartime conditions. JAMA, 1991, 266: 693-695.
- Lockridge, O., Bartels, C.F., Vaughan, T.A., Wong, C.K., Norton, S.E., and Johnson, L.L. Complete amino acid sequence of human serum cholinesterase. J. Biol Chem., 1987,262:549—557.
- Patrick, J., and Lindstrom, J. Autoimmune response to acetylcholine receptor. Science, 1973, 180:871—872.
- Ponec, R.J., Saunders, M.D., and Kimmey, M.B. Neostigmine for the treatment of acute colonic pseudoobstruction. N. Engl. J. Med., 1999, 341:137-141.
- Schluep, М., Wilcox, N.. Vincent, A., Dhoot, G.K., and Newson-Davis, J. Acetylcholine receptors in human thymic myoid cells in situ: an immunohistological study. Ann. Neurol., 1987, 22:212—222.