Метаболизм лекарственных средств
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Метаболизм лекарственных средств[править | править код]
Жирорастворимые лекарственные средства, которые легко проникают через биологические мембраны и быстро достигают ткани-мишени, с трудом выводятся из организма. Значительная часть препарата, профильтровавшегося в почечных клубочках, при прохождении через канальцы реабсорбируется обратно в кровь. Поэтому обычно в неизмененном виде с мочой выводится лишь небольшое количество лекарственного средства. Чтобы удалить лекарственные средства и другие чужеродные вещества из организма, необходимо превратить их в более гидрофильные метаболиты. Как правило, в процессе метаболизма образуются полярные неактивные вещества, которые легко выводятся из организма. Однако некоторые метаболиты биологически активны, а иногда и токсичны. В ходе многих биохимических реакций помимо неактивных метаболитов лекарственных средств образуются биологически активные эндогенные вещества. Описанные ниже общие принципы метаболизма лекарственных средств применимы к любым экзогенным и некоторым эндогенным веществам (стероидные гормоны, витамины, жирные кислоты).
Фазы метаболизма лекарственных средств[править | править код]
Выделяют две фазы метаболизма лекарственных средств. В ходе I фазы к молекуле лекарственного средства присоединяется функциональная группа (либо эта группа становится доступной в результате химических превращений). Продукты I фазы обычно неактивны, но некоторые из них обладают столь же выраженным или более мощным действием, а изредка даже приобретают новые фармакологические свойства. Иногда лекарственное средство вводят в виде неактивного предшественника, который в организме быстро превращается в активный метаболит (как правило, путем гидролиза эфирных или амидных связей). Это позволяет обеспечить более полную доставку препарата к ткани-мишени. Продукты I фазы метаболизма выводятся с мочой или взаимодействуют с эндогенными соединениями, образуя водорастворимые метаболиты.
В ходе II фазы образуется ковалентная связь между функциональной группой лекарственного средства или его метаболита и эндогенными соединениями (глюкуроновая кислота, сульфат, ацетат, глутатион, аминокислоты). Продукты II фазы — полярные и, как правило, неактивные соединения, которые быстро выводятся с мочой или калом. Иногда во II фазе образуются активные метаболиты (например, глюкуронид морфина обладает более сильным обезболивающим действием, чем сам морфин).
Локализация метаболических реакций[править | править код]
Химические превращения лекарственных средств обычно происходят под действием ферментов. Важнейший орган, отвечающий за метаболизм лекарственных средств, — это печень, хотя ферментные системы, участвующие в реакциях метаболизма, присутствуют почти в любой ткани. В значительной степени препараты метаболизируются в ЖКТ, почках и легких. После приема внутрь и ректального введения некоторые лекарственные средства инактивируются в кишечном эпителии или печени и лишь затем поступают в системный кровоток, что существенно снижает их биодоступность. Химические превращения лекарственных средств происходят главным образом в эндоплазматическом ретикулуме и цитозоле, а также в митохондриях, ядре и клеточной мембране. При фракционном центрифугировании гомогенатов тканей эндоплазматический ретикулум разрушается, и обломки мембран образуют мелкие гранулы — так называемые микросомы. Поэтому ферменты эндоплазматического ретику-лума часто называют микросомальными ферментами. Реакции I фазы метаболизма катализируются в основном ферментами эндоплазматического ретикулума, а реакции II фазы — цитозольными ферментами. Лекарственные средства, которые претерпели химическую трансформацию в эндоплазматическом ретикулуме, нередко конъюгируются здесь же или в цитозоле той же клетки.
Монооксигеназы, связанные с цитохромом Р450[править | править код]
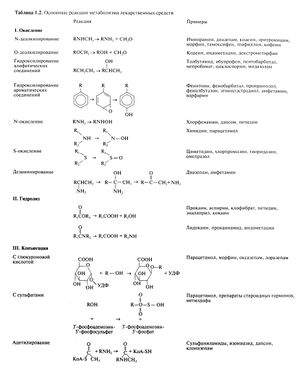
Эти ферменты встречаются почти у всех живых организмов и представляют собой суперсемейство гем-тиолатных белков. Они участвуют в метаболизме многочисленных, разнообразных по химической структуре эндогенных и экзогенных соединений, в том числе лекарственных средств. Как правило, данные ферменты служат конечным звеном в цепи переносчиков электронов, катализируя включение в субстрат одного атома кислорода, в то время как другой атом кислорода восстанавливается до воды. В печени ферментная система, состоящая из НАДФН-цитохром Р450-редуктазы и цитохрома Р450, локализуется в мембране гладкого эндоплазматического ретикулума. Электроны переносятся от НАДФН с помощью НАДФН-цитохром Р450-редуктазы. Цитохром Р450 катализирует разнообразные химические реакции, в том числе гидроксилирование алифатических и ароматических соединений, N-, О- и S-деалкилирование, N-окисление, N-гидроксилирование, сульфоокисление, дезаминирование, дегалогенирование, десульфирование (табл. 1.2). Монооксигеназы, связанные с цитохромом Р450, катализируют также некоторые восстановительные реакции (обычно при недостатке кислорода).
Из 1000 известных на сегодняшний день изоферментов цитохрома Р450 у человека встречается 50. По сходству аминокислотных последовательностей они делятся на 17 семейств и множество подсемейств. Семейство обозначается первой цифрой в названии изофермента, подсемейство — следующей за ней буквой, отдельный изофермент внутри подсемейства — последней цифрой (например, IIIA4). Изоферменты, аминокислотные последовательности которых сходны более чем на 40%, относятся к одному семейству. Внутри семейства выделяют подсемейства; аминокислотные последовательности членов одного подсемейства сходны более чем на 55%. В метаболизме лекарственных средств участвуют 8—10 изоферментов I, II и III семейств. Остальные изоферменты катализируют реакции синтеза и распада стероидных гормонов, жирных кислот, витаминов и других эндогенных соединений. Каждый изофермент обладает определенной субстратной специфичностью, но многие из них действуют на одни и те же субстраты. Таким образом, в метаболизме лекарственного средства могут участвовать два и более изофермента цитохрома Р450, а также другие ферменты. В результате образуется множество первичных и вторичных метаболитов. На каждый изофермент цитохрома Р450 действуют определенные ингибиторы и индукторы (см. ниже). Кроме того, катализируемые этими ферментами реакции часто регио- и стереоспецифичны. Последнее свойство важно в тех случаях, когда лекарственное средство представляет собой рацемическую смесь, а оптические изомеры обладают разной фармакологической активностью.
Вклад разных изоферментов цитохрома Р450 в метаболизм лекарственных средств представлен на рис. 1.3. Примерно 50% всех препаратов метаболизируются сходными по структуре изоферментами IIIА4 и IIIА5. Изоферменты подсемейства IIIА присутствуют не только в печени, но и в кишечном эпителии и почках. Показано, что биодоступность многих лекарственных средств снижается как при первом прохождении через печень, так и в ходе метаболических реакций, протекающих под действием этих ферментов в энтероцитах. Важную роль в метаболизме лекарственных средств играют также подсемейство IIС и изофермент IID6. Роль изоферментов IA1, IA2, IIA6, IIB1, IIE1 не столь важна, зато они катализируют превращение многих химических веществ в канцерогенные метаболиты и, следовательно, влияют на предрасположенность к злокачественным новообразованиям (например, к раку легкого у курильщиков).
Некоторые лекарственные средства метаболизируются под действием других окислительных ферментов (дегидрогеназ, флавинсодержащих монооксигеназ), но роль этих ферментов в целом невелика.
Гидролитические ферменты[править | править код]
Реакции, катализируемые основными гидролитическими ферментами, представлены в табл. 1.2. В эндоплазматическом ретикулуме гепатоцитов, энтероцитов и клеток других тканей обнаружен ряд неспецифичных эстераз и амидаз. Образующиеся в результате гидролиза эфиров и амидов спирты и амины участвуют затем в реакциях конъюгации. В эндоплазматическом ретикулуме клеток почти всех тканей в непосредственной близости от цитохрома Р450 локализуется эпоксидгидролаза. Считается, что она отвечает за детоксикацию высокоактивных продуктов окисления ароматических углеводородов. Эти продукты образуются при участии цитохрома Р450. В результате гидролиза они превращаются в неактивные гидрофильные m/транс-дигидродиолы. Протеазы и пептидазы участвуют в метаболизме полипептидных препаратов. Эти ферменты присутствуют во многих тканях, поэтому для того, чтобы доставить полипептидные препараты в ткани-мишени, необходимо ингибировать указанные ферменты или придать устойчивость к ним.
Конъюгация[править | править код]
Реакции конъюгации катализируются трансферазами. Самая важная реакция — конъюгация с глюкуроновой кислотой, протекающая под действием глюкуронилтрансфераз (рис. 1.3). Для того чтобы вступить в реакцию конъюгации, лекарственные средства должны предварительно перейти в соответствующую форму (ароматических и алифатических спиртов, карбоновых кислот, аминов); в эти реакции вступают также экзогенные и эндогенные соединения со свободными сульфгидрильными группами. В результате образуются О-, N- и S-глюкурониды. В виде глюкуронидов экскретируются и эндогенные вещества — стероидные гормоны, билирубин, желчные кислоты и жирорастворимые витамины. Благодаря гидрофильности глюкурониды легко выводятся с мочой и желчью. Большинство реакций II фазы метаболизма происходят в цитозоле, но глюкуронилтрансферазы относятся к микросомальным ферментам, поэтому продукты протекающей в микросомах I фазы метаболизма здесь же подвергаются конъюгации. Помимо печени глюкуронилтрансферазы присутствуют в кишечном эпителии, почках и коже. У человека выявлено 15 глюкуронилтрансфераз, которые разделены на два семейства. Внутри семейства сходство аминокислотных последовательностей превышает 50%. Изоферменты 1А кодируются одним геном и образуются в результате альтернативного сплайсинга. Ген содержит 12 промоторов и, соответственно, 12 разных первых экзонов. Изоферменты различаются по 1-му экзону, а экзоны со 2-го по 5-й — общие для всех изоферментов. Семейство 2 содержит 3 подсемейства: 2А, 2В и 2С. Субстратная специфичность отдельных глюкуронилтрансфераз в значительной степени перекрывается, поэтому один и тот же метаболит может образовываться под действием разных изоферментов. Существенна также реакция конъюгации с сульфатом. В цитозоле под действием сульфотрансфераз сульфогруппа переносится с активированного З'-фосфоаденозин-5'-фосфосульфата на гидроксильную группу фенолов и алифатических спиртов. Таким образом, лекарственные средства и их метаболиты, содержащие гидроксильную группу, могут образовывать как глюкурониды, так и сульфаты. В ацетилировании аминов, гидразинов и препаратов, содержащих сульфонамидную группу, участвуют ариламин-N-ацетилтрансфераза 1 и ариламин-N-ацетилтрансфераза 2. В отличие от других продуктов конъюгации, ацетилированные метаболиты обычно хуже растворимы в воде, чем исходные препараты, поэтому во избежание кристаллурии необходимо поддерживать высокий диурез.
Описание к рис. 1.3. Вклад отдельных ферментов в метаболизм лекарственных средств. Размер каждого сектора отражает вклад отдельного фермента I (слева) или II (справа) фазы метаболизма (по данным литературы). Ферменты, чьи гены имеют аллельные варианты, кодирующие функционально активные белки, отмечены звездочкой. В метаболизме одного лекарственного средства нередко участвуют несколько ферментов. Буквенно-цифровые обозначения слева соответствуют изоферментам цитохрома Р450.
Факторы, влияющие на метаболизм лекарственных средств[править | править код]
Поскольку метаболизм лекарственных средств подвержен широким индивидуальным колебаниям, скорость элиминации препарата и другие показатели, влияющие на его сывороточную концентрацию, тоже сильно разнятся. Это одна из основных причин, по которой у разных больных одна и та же доза вызывает разную реакцию. Поэтому индивидуальные различия в метаболизме лекарственных средств необходимо учитывать при подборе дозы. Влияние генетических факторов, экзогенных веществ и патологических состояний на метаболизм разных лекарственных средств неодинаково.
Генетические факторы[править | править код]
Благодаря достижениям молекулярной биологии показано, что большинство белков, в том числе ферментов, катализирующих метаболизм лекарственных средств, характеризуются значительным генетическим разнообразием. Растет число ферментов, для которых выявлен полиморфизм: при этом аллельные варианты гена кодируют ферменты с разной каталитической активностью — сниженной, полностью отсутствующей, а в случае дупликации гена — повышенной. Аллельные варианты обычно наследуются аутосомно-рецессивно. Распространенность аллельных вариантов часто зависит от расы. Определение этих вариантов с помощью фено- и генотипирования, возможно, будет играть важную роль в индивидуальном подборе дозы, особенно при узком терапевтическом диапазоне. Появляется все больше данных о том, что генетические различия в активности ферментов, участвующих в метаболизме лекарственных средств, обусловливают предрасположенность ко многим заболеваниям, вызванным действием экзогенных веществ (например, злокачественным новообразованиям).
Различия в скорости метаболизма лекарственных средств могут быть вызваны полиморфизмом некоторых изоферментов цитохрома Р450. Яркий пример тому — изофермент IID6. Описано около 70 аллельных вариантов гена, отличающихся одним нуклеотидом, а также другие аллельные варианты. Многие аллели кодируют неактивные формы фермента. Существуют также формы со сниженной и с повышенной (в результате дупликации генов) активностью. По этому признаку различают лиц с низкой (аутосомно-рецессивный признак), промежуточной, высокой и очень высокой активностью изофермента IID6. Некоторые аллельные варианты встречаются редко, другие распространены довольно широко, причем распространенность того или иного варианта зависит от расы. Например, гомозиготность по рецессивному признаку (низкая активность фермента) среди европейцев встречается у 5—10%, а среди выходцев из Юго-Восточной Азии —лишь у 1—2%. Изофермент 1ID6 участвует в метаболизме более чем 65 распространенных лекарственных средств, в том числе трициклических антидепрессантов, ингибиторов обратного захвата серотонина, некоторых антиаритмических средств и наркотических анальгетиков, β-адреноблокаторов. У лиц с низкой активностью изофермента IID6 выше риск побочных реакций на лекарственные средства, элиминируемые преимущественно путем метаболизма с участием этого изофермента. Напротив, у лиц с очень высокой активностью изофермента IID6 обычные дозы могут оказаться неэффективными, а в тех случаях, когда под его действием образуются активные метаболиты (например, морфин из кодеина), напротив, вызовут усиленный эффект. Низкая активность фермента может быть следствием не только генетических факторов, но и лекарственных взаимодействий. Так, хинидин и ингибиторы обратного захвата серотонина ингибируют изофермент IID6, имитируя генетически обусловленное снижение активности фермента (так называемая фенокопия).
Изофермент IIC9 катализирует метаболизм 16 распространенных лекарственных средств, включая варфарин и фенитоин, — оба препарата обладают узким терапевтическим диапазоном. При двух наиболее часто встречающихся мутациях синтезируется фермент с низкой активностью (5—12% нормы). Поэтому больным с мутантным аллелем, в особенности гомозиготам, требуются более низкие дозы варфарина по сравнению с гомозиготами по нормальному аллелю. При наличии мутантного аллеля определить начальную дозу варфарина трудно, повышен риск кровотечений. У больных с мутантным аллелем повышен и риск побочных эффектов фенитоина. Изоферменту IIС 19 тоже свойственен полиморфизм. Обнаружено 8 аллельных вариантов, которые кодируют неактивную форму этого фермента. Среди белых лица с низкой активностью изофермента IIC19 составляют около 3%, а среди выходцев из Юго-Восточной Азии — 13—23%. Изофермент IIC19 участвует в метаболизме примерно 18 лекарственных средств, в том числе ингибиторов Н+,К+-АТФазы омепразола и лансопразола. У гомозигот по нормальному аллелю эффективность омепразола в дозе 20 мг/сут в сочетании с амоксициллином (обычный курс для уничтожения Helicobacter pylori) значительно снижена. У лиц с низкой активностью фермента (гомозигот по мутантному аллелю) полного искоренения инфекции, напротив, удается достичь в 100% случаев. Такая разница обусловлена различиями в степени снижения секреции соляной кислоты. Активность изоферментов подсемейства IIIА тоже подвержена значительным (десятикратным) индивидуальным колебаниям, но полиморфизма соответствующего гена не обнаружено. Возможно, эти колебания обусловлены различиями в пока не установленных регуляторных факторах. Генетическим разнообразием отличается и дигидро-пиримидиндегидрогеназа — основной фермент метаболизма фторурацила. У 1—3% больных со злокачественными новообразованиями активность этого фермента снижена, и фторурацил может вызвать тяжелые побочные эффекты.
Генетическую природу индивидуальных различий в активности ферментов впервые подтвердили около 50 лет назад, когда был обнаружен полиморфизм ферментов, катализирующих реакции конъюгации, в частности ариламин-N-ацетилтранс-феразы 2. Последняя участвует в метаболизме примерно 16 распространенных лекарственных средств, в том числе изониазида, прокаинамида, дапсона, гидралазина, кофеина. Обнаружено 15 аллельных вариантов гена. Некоторые мутации не влияют на активность фермента, другие приводят к снижению или полной потере активности. Частота разных аллелей сильно колеблется. Так, лиц с низкой активностью ариламин-N-ацетил-трансферазы 2 (то есть с низкой активностью ацетилирующих ферментов) среди темнокожих и белых американцев насчитывается около 50%, среди выходцев из Северной Европы — 60— 70%, а среди выходцев из Юго-Восточной Азии — всего 5—10%. Предполагается, что активность ацетилирующих ферментов влияет на предрасположенность к некоторым заболеваниям, вызванным действием экзогенных веществ (рак мочевого пузыря, рак толстой кишки), хотя прямых доказательств тому пока нет. Развитию таких заболеваний, возможно, способствуют также генетически обусловленные различия в активности глутатионтрансфераз. Тиопурин-S-метилтрансфераза — основной фермент метаболизма меркаптопурина, активного метаболита азатиоприна. У гомозигот по аллелю, кодирующему неактивную форму фермента (0,3—1% населения), обычные дозы азатиоприна вызывают тяжелую панцитопению. Таким больным дозу нужно снижать до 10—15% обычной.
Экзогенные вещества[править | править код]
На активность многих ферментов, отвечающих за метаболизм лекарственных средств, влияют экзогенные вещества — другие лекарственные средства (в таком случае наблюдаются лекарственные взаимодействия), компоненты пищи и т.д. Повышение активности ферментов называется индукцией, а снижение — ингибированием. Влияние экзогенных веществ — важная причина индивидуальных колебаний скорости метаболизма лекарственных средств.
Ингибиторы ферментов[править | править код]
При ингибировании ферментов, участвующих в метаболизме лекарственного средства, увеличивается сывороточная концентрация препарата, усиливается и удлиняется терапевтическое действие, повышается риск побочных эффектов, а сывороточная концентрация метаболитов снижается. Эти изменения возникают внезапно и быстро, особенно если препарат интенсивно метаболизируется и обладает узким терапевтическим диапазоном. Многие вещества избирательно подавляют активность отдельных изоферментов цитохрома Р450. Зная, какие изоферменты метаболизируют тот или иной препарат, можно понять и предсказать, в каких случаях его метаболизм будет тормозиться (в частности, при лекарственных взаимодействиях). Один из механизмов ингибирования — конкуренция субстратов за активный центр фермента. Степень ингибирования при этом зависит от соотношения концентраций субстратов и их сродства к ферменту. Если вещество образует прочный комплекс с железом гема, входящего в состав цитохрома Р450 (циметидин, кетоконазол), или разрушает гем (норэтистерон, этинилэстрадиол), ингибирование необратимо. Распространенный механизм ингибирования ферментов II фазы метаболизма — дефицит кофакторов.
Важный и широко распространенный механизм торможения метаболизма лекарственных средств — ингибирование изоферментов подсемейства IIIA, в большом количестве присутствующих в кишечном эпителии. При их ингибировании биодоступность лекарственных средств, которые интенсивно метаболизируются в кишечнике, существенно возрастает, хотя в печени активность этих изоферментов может быть сохранена. К мощным ингибиторам изоферментов подсемейства IIIA относятся противогрибковые средства (кетоконазол, итраконазол), ингибиторы протеазы ВИЧ (особенно ритонавир), некоторые макродиды (эритромицин и кларитромицин). Такое же действие оказывают ряд антагонистов кальция (дилтиазем, никардипин, верапамил) и грейпфруты. Многие ингибиторы изоферментов подсемейства IIIA нарушают также транспортную функцию Р-гликопротеида, уменьшая элиминацию лекарственных веществ, даже если последние не подвергаются интенсивному метаболизму (например, хинидин и многие другие лекарственные средства снижают элиминацию дигоксина). Таким образом, в основе лекарственного взаимодействия с ингибиторами изоферментов подсемейства IIIA лежат два механизма. Хинидин и ингибиторы обратного захвата серотонина ингибируют изофермент IID6, имитируя наследственное снижение активности фермента. Некоторые препараты ингибируют изоферменты цитохрома Р450 менее избирательно. Амиодарон, циметидин (но не ранитидин), пароксетин и флуоксетин снижают активность нескольких изоферментов. Лекарственные средства могут ингибировать и другие ферменты I фазы метаболизма. Так, вальпроевая кислота — мощный ингибитор микросомальной эпок-сидгидролазы. Аллопуринол снижает активность ксантиноксидазы, резко увеличивая токсичность меркаптопурина.
Индукторы ферментов[править | править код]
Повышение активности ферментов, отвечающих за метаболизм лекарственных средств, как правило, происходит при длительном воздействии индуктора и обусловлено усилением транскрипции кодирующих ферменты генов. Возможна также стабилизация фермента, препятствующая его расщеплению (это основной механизм индукции изофермента IIE1). Действие индукторов, в отличие от ингибиторов, проявляется не сразу. Индукция ферментов сопровождается ускорением метаболизма лекарственного средства (в том числе в кишечнике и при первом прохождении через печень). В результате снижается сывороточная концентрация препарата, укорачивается и ослабевает его действие. Если же в ходе метаболизма образуются активные или токсичные метаболиты, терапевтические и побочные эффекты, напротив, усиливаются. Иногда лекарственное средство ускоряет не только метаболизм других препаратов, но и собственный метаболизм (например, карбамазепин). Чтобы сохранить терапевтический эффект, зачастую приходится увеличивать дозу, особенно при выраженном ускорении метаболизма препарата. Женщинам, получающим рифампицин, не рекомендуется пользоваться пероральными контрацептивами, так как их эффективность при этом существенно снижается. Особенно опасна отмена индуктора: если дозу лекарственного средства не снизить, его сывороточная концентрация увеличится и возрастет риск побочных эффектов.
Как правило, индукторы избирательно повышают активность отдельных изоферментов цитохрома Р450 или их подсемейств, но одновременно могут действовать и на многие другие ферменты. Входящие в состав табачного дыма, загрязнителей воздуха и жаренной на углях пиши полициклические ароматические углеводороды значительно повышают активность изоферментов подсемейства IA в печени и других органах. Полициклические ароматические углеводороды активируют внутриклеточные рецепторы ароматических углеводородов. В ядре активированный рецептор образует комплекс с другим регуляторным белком — ядерным переносчиком AhR. Этот комплекс служит фактором транскрипции, усиливающим экспрессию подсемейства изоферментов IA. Одновременно усиливается экспрессия ферментов II фазы метаболизма (глюкуронилтрансфераз, глу-татионтрансфераз, НАДФН:хинон редуктазы). Сходным образом (при участии рецептора NR112) происходит индукция изоферментов подсемейства IIIА. Индукторами могут быть самые разнообразные вещества, в том числе лекарственные средства (барбитураты, другие противосудорожные средства, рифампицин, рифабутин, некоторые глюкокортикоиды и даже фитопрепараты, такие, как зверобой). Перечисленные лекарственные средства могут повышать активность и других изоферментов цитохрома P4S0. Например, рифампицин и карбамазепин индуцируют изоферменты IA2, IIC9, НС 19. При алкоголизме возрастает активность изофермента IIE1, который катализирует образование гепатотоксичного метаболита парацетамола N-ацетил -n-бензохинонимина, поэтому риск токсического воздействия парацетамола на печень возрастает.
Патологические состояния[править | править код]
Метаболизм лекарственных средств нарушается при заболеваниях печени (гепатите, алкоголизме, билиарном циррозе, жировой дистрофии, печеночноклеточном раке), так как именно там преимущественно локализуются осуществляющие этот метаболизм ферменты. Степень нарушения метаболизма обычно зависит от тяжести поражения гепатоцитов, но, к сожалению, плохо коррелирует с биохимическими показателями функции печени. Так, даже при тяжелом циррозе печени активность ферментов снижается лишь до 30—50% нормы, но биодоступность препаратов, которые интенсивно метаболизируются при первом прохождении через печень, может возрастать в 2—4 раза. В результате увеличения биодоступности и замедления элиминации усиливается как терапевтическое, так и побочное действие препарата. Видимо, активность изоферментов цитохрома Р450 страдает в большей степени, чем активность ферментов II фазы метаболизма (таких, как глюкуронилтрансферазы).
При тяжелой сердечной недостаточности и шоке нарушается кровоснабжение печени и замедляется метаболизм лекарственных средств. Так, метаболизм лидокаина снижается почти в 2 раза. В той же степени уменьшается и объем распределения препарата, поэтому насыщающая и поддерживающая дозы лидокаина должны быть меньше.
Возраст и пол[править | править код]
Изоферменты цитохрома Р450 и, в меньшей степени, ферменты II фазы метаболизма появляются уже в ранние сроки внутриутробного развития, но их активность у новорожденных ниже, чем у взрослых. Со 2—4-й недели жизни активность ферментов I и II фазы метаболизма начинает постепенно возрастать, хотя и разными темпами. Следовательно, у новорожденных и грудных детей лекарственные средства метаболизируются медленнее, чем у взрослых. Низкая активность глюкуронилтрансфераз — одна из причин физиологической желтухи новорожденных. На втором десятилетии жизни активность ферментов достигает максимума, а затем постепенно снижается. К сожалению, общих правил, позволяющих предсказать индивидуальные возрастные изменения фармакокинетики, немного, особенно у пожилых. Пожилые часто страдают несколькими болезнями и потому принимают много лекарственных средств, которые часто взаимодействуют. Играет роль и более высокая чувствительность органов мишеней, а также нарушение функции физиологических регуляторных систем. Активность ферментов I фазы метаболизма снижается в большей степени, чем активность ферментов II фазы метаболизма. Впрочем, возрастные изменения активности ферментов обычно менее значимы по сравнению с индивидуальными колебаниями скорости метаболизма лекарственных средств. Однако если препарат интенсивно метаболизируется при всасывании в кишечнике или первом прохождении через печень, даже при незначительном замедлении метаболизма биодоступность может сильно возрастать. Таким образом, у пожилых обычно приходится несколько снижать дозу и помнить о повышенной чувствительности к лекарственным средствам.
Чувствительность к некоторым лекарственным средствам у мужчин и женщин неодинакова. Половые различия отмечены и в скорости метаболизма препаратов, особенно реакций, катализируемых изоферментами подсемейства IIIА. Впрочем, по сравнению с индивидуальными колебаниями скорости метаболизма эти различия незначительны. Во II и в III триместре беременности происходит индукция ряда ферментов, отвечающих за метаболизм лекарственных средств, поэтому дозы некоторых препаратов нужно увеличить, а после родов вновь снизить до исходного уровня. Особенно важно скорректировать дозу фенитоина. Изоферменты цитохрома Р450 необратимо ингибируются многими пероральными контрацептивами (при этом ингибиторами служат не сами пероральные контрацептивы, а вещества, образующиеся из них под действием этих изоферментов).