Эстрогеновые рецепторы
Эстрогеновые рецепторы[править | править код]
Действие эстрогенов опосредовано внутриклеточными рецепторами. Существуют два типа эстрогеновых рецепторов, а и β, кодируемые разными генами — ESR1 и ESR2. Первыми были открыты а-рецепторы. Больше всего их содержится в женских половых органах, особенно в матке, во влагалище и в яичниках, а также в молочных железах, гипоталамусе, эндотелии и гладкомышечных клетках сосудов. Эстрогеновые β-рецепторы распределены в тканях несколько по-другому: больше всего их в предстательной железе и яичниках, меньше — в легких, головном мозге и сосудах. Эстрогеновые а- и β-рецепторы гомологичны на 44%, они содержат домены, характерные для внутриклеточных рецепторов (рис. 58.4
). Выделяют следующие домены: N-концевой домен А/В содержит участок AF-1, способный активировать транскрипцию независимо от связывания гормона; ДНК-связывающий домен С, сходный у обоих типов рецепторов, включает четыре остатка цистеина, образующих два цинковых пальца; домен D, часто называемый шарнирным, содержит участок, необходимый для попадания рецептора® ядро; рецепторный домен Е/F выполняет много функций, включая связывание гормона, димеризацию и гормонально-зависимую активацию транскрипции (последнюю обеспечивает участок AF-2). Эти два типа рецепторов существенно отличаются по структуре рецепторных доменов А/В, а также участков AF-1 и AF-2 (рис. 58.4). Очевидно, эти рецепторы выполняют разные функции и могут по-разному взаимодействовать с эстрогенами. Например, оба рецептора имеют одинаковое сродство к эстрадиолу (К около 0,3 нмоль/л), но у фитоэстрогена генистеина сродство к эстрогеновым β-рецепторам примерно в 5 раз выше, чем к а-рецепторам (Kuiper et al., I 1997). Впрочем, ввиду большого сходства ДНК-связываюших доменов оба типа рецепторов должны распознавать сходные последовательности ДНК и в целом влиять на одни и те же гены-мишени.
Самки мышей, лишенные эстрогеновых а-рецепторов (гомозиготы по мутации гена ESRI), бесплодны, у них наблюдаются атрофия матки и гиперемированные яичники без желтых тел (Lubahn et al., 1993); эстрадиол не вызывает у них пролиферации эндометрия. У самцов, лишенных эстрогеновых а-рецепторов, наблюдаются бесплодие (из-за аномалий яичек и семенных канальцев, сопровождающихся азооспермией), снижение плотности костной ткани и сердечно-сосудистые нарушения. Самки, лишенные эстрогеновых β-рецепторов, бесплодны из-за остановки развития фолликулов, но аналогичные самцы фертильны (Korach, 2000).
Описано несколько вариантов эстрогеновых а- и β-рецепторов (прежде всего в клетках рака молочной железы), синтезирующихся с помощью разных промоторов или альтернативного сплайсинга (Murphy et al., 1997). Некоторые из таких рецепторов активны и в отсутствие эстрогенов (Fuqua et al., 1991); физиологическое значение этих рецепторов не ясно. В гипофизе крысы найдены укороченные эстрогеновые а-рецепторы, препятствующие активирующему действию нормальных рецепторов обоих типов (Resnick et al., 2000); физиологическая роль таких рецепторов и их распространенность у других видов не известны. Ряд вариантов эстрогеновых рецепторов обусловлен полиморфизмом генов, кодирующих рецепторы, но попытки выявить связь определенных вариантов с различиями в плотности костной ткани (Kobayashi et al., 1996; Vandevyver et al., 1999), с риском рака молочной железы (Roodi et al., 1995) и тела матки (Weiderpass et al., 2000) дали неоднозначные результаты. Зависимость строения и функции эстрогеновых рецепторов от полиморфизма кодирующих их генов требует дальнейшего изучения. Механизм действия. После связывания с лигандом оба типа эстрогеновых рецепторов действуют как факторы транскрипции, усиливая или подавляя экспрессию генов-мишеней. Эстрогены проходят через клеточную мембрану путем простой диффузии и в ядре связываются с рецепторами. Конформация последних меняется, и происходит димеризация рецепторов. Это повышает сродство рецепторов к ДН К и скорость связывания с ней (Cheskiset al., 1997). Рецепторы взаимодействуют с эстроген-чувствительными регуляторными элементами генов-мишеней, содержащими последовательность оснований: гуанин—гуанин—тимин—цитозин—аденин— Х—Х—Х—тимин—гуанин—аденин—цитозин—цитозин (ГГТЦАХХХТГАЦЦ), где вместо X может быть любое основание.
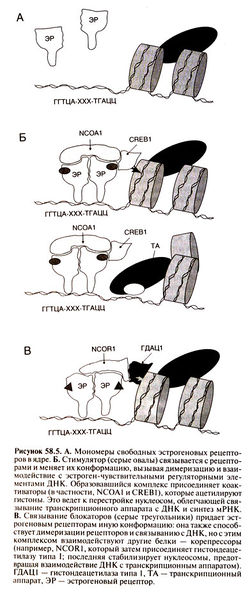
Комплекс рецептора с ДНК вызывает присоединение к области промотора одного или нескольких коактиваторов (рис. 58.5, Б)
, среди которых наиболее изучены белки NCOA1 и CREB1 (Collingwood et al., 1999). Коактиваторы ацетилируют гистоны либо напрямую, либо активируя соответствующие ферменты. Это меняет структуру хроматина в области промотора гена-мишени, облегчая сборку инициаторного комплекса и запуская транскрипцию. Присоединение блокатора также вызывает димеризацию рецепторов и связывание с ДНК, но комплексы рецепторов со стимуляторам и и с блокаторами имеют разную конформацию (Wijayaratne et al., 1999). Последние способствуют связыванию корепрессоров, таких, как NCOR1 и NCOR2, а затем гистондеацетилаз, например гистондеацетилазы типа 1 (рис. 58.5, В). Деацетилирование гистонов затрудняет образование инициаторного комплекса и подавляет транскрипцию. Различия в структуре участков AF-1 и AF-2 у эстрогеновых а- и β-рецепторов говорят о взаимодействии с разными коактиваторами и корепрессорами и неодинаковом сродстве к ним. Помимо гомодимеров образуются также гетеродимеры из двух типов рецепторов (Cowley et al., 1997) — таким образом, к области промотора гена-мишени могут присоединяться разнообразные комплексы рецепторов с коактиваторами или корепрессорами. Если клетка содержит оба типа рецепторов, они, по-видимому, оказывают противоположное действие (Hall and McDonnell, 1999).
Кроме коактиваторов и корепрессоров эстрогеновые рецепторы могут взаимодействовать и с другими факторами транскрипции, включая SP1 (Saville et al., 2000) и АР-1 (Paech et al.,1997). В таких случаях специфичность влияния комплекса рецептора с лигандом на гены-мишени определяется не эстроген-чувствительными регуляторными элементами, а связыванием SP1 и АР-1 с определенными последовательностями ДНК. Соответственно, эстрогены могут регулировать экспрессию генов, не имеющих данных элементов. При этом действие стимуляторов и блокаторов зависит также от типа рецептора и промотора. Например, в комплексе с эстрогеновыми а-рецепторами и факторами транскрипции семейства АР-1 эстрадиол повышает экспрессию генов, регулируемых этими факторами, а в комплексе с эстрогеновыми β-рецепторами — снижает ее. И наоборот, антиэстрогены активируют транскрипцию через комплексы АР-1 с эстрогеновыми β-рецепторами, но не с эстрогеновыми а-рецепторами.
Системы внутриклеточной передачи сигнала могут влиять на эстрогеновые рецепторы независимо от гормонов. Так, фосфорилирование серина в положении 118 под действием каскада митоген-активируемых протеинкиназ активирует эстрогеновые а-рецепторы, что указывает на связь мембранных рецепторов (рецепторов эпидермального фактора роста или ИФР-1), запускающих этот каскад, с внутриклеточными рецепторами (Katoetal., 1995).
Некоторые работы указывают на наличие мембранных эстрогеновых рецепторов, однако не ясно, кодируются ли они теми же генами, что и внутриклеточные (Razandi et al., 1999). Подобные мембранные рецепторы могут обеспечивать быструю передачу сигнала за счет подъема концентрации цАМФ (Aronica et al., 1993) или активации каскада митоген-активируемых протеинкиназ, фосфорилирование которых в отдельных типах клеток наблюдается уже через 5—10 мин после добавления эстрадиола (Endoh et al., 1997). Влияние эстрадиола на митоген-активируемые протеинкиназы указывает на дополнительный уровень взаимодействия между эстрогенами и факторами роста, включая эпидермальный фактор роста и ИФР-1. Кроме того, мембранные эстрогеновые рецепторы могут опосредовать быстрый выброс окиси азота при действии эстрадиола на эндотелий.