Витамин А
Источник:
Клиническая фармакология по Гудману и Гилману, том 4.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Витамин А[править | править код]
Организм нуждается в поступлении витамина А извне, но большинство эффектов этого витамина (как и витамина D) опосредуется рецепторами, сходными с рецепторами гормонов. Действие витамина А на клетки, в том числе на их дифференцировку, весьма разнообразно и конечно, не сводится к известному влиянию этого витамина на зрение. Аналоги витамина А, активно влияющие на дифференцировку эпителия, находят применение при различных кожных заболеваниях; изучается их роль и в профилактике рака.
Историческая справка[править | править код]
Гемералопия (куриная слепота) была описана еще в древнем Египте (почти за 1500 лет до н.э.).Хотяв то время ее и не связывали с дефицитом каких-то веществ в пище, все же рекомендовалось прикладывать запеченную или обжаренную печень. Впоследствии Гиппократ советовал в качестве лечения употреблять говяжью печень в пищу. Зависимость гемералопии от питания с определенностью выяснилась лишь в 1800-х гг. В 1865 г. впервые описана «бразильская офтальмия» болезнь глаз, поражавшая преимущественно истощенных рабов. Позднее было замечено, что у грудных детей, матери которых плохо питались, развивается спонтанный некроз роговицы. Вскоре кератомаляция при неполноценном питании была описана во многих странах, включая США.
Однако к открытию витамина А привели не клинические, а экспериментальные наблюдения. В 1913 г. две группы исследователей (Мак-Коллум и Дейвис; Осборн и Мендель) независимо друг от друга описали патологическое состояние у животных, получавших искусственную диету, в которой единственным источником жира служило топленое свиное сало. Это состояние, проявлявшееся в основном ксерофтапьмией (сухостью и утолщением конъюнктивы), удавалось излечивать добавлением к рациону сливочного масла, яичного желтка и рыбьего жира. Сходство причин клинического и экспериментального авитаминоза А выяснилось во время Первой мировой войны, когда было установлено, что ксерофтальмия у человека — результат отсутствия сливочного масла в диете.
Содержание витамина А в некоторых пищевых продуктах
|
Продукт |
Содержание витамина А, мг/100 г продукта |
|
Печень трески |
5-15 |
|
Печень говяжья |
3,83 |
|
Печень баранья |
3,60 |
|
Печень свиная |
3,45 |
|
Печень тресковая |
3,30 |
|
Икра зернистая |
0,2-1,0 |
|
Масло сливочное |
0,6-0,8 |
|
Яйцо куриное |
0,25-0,35 |
|
Сыр российский |
0,26 |
Строение и терминология[править | править код]
Витамином А вначале называли вполне определенные химические соединения — ретинол и его эфиры, но в настоящее время этим термином чаще обозначают любые вещества, обладающие биологической активностью ретинола. За собственно ретинолом и его природными производными закрепилось название ретиноиды. К ретиноидам (большинство эффектов которых опосредуется связыванием со специфическими внутриклеточными рецепторами и с изменением экспрессии генов) относят и синтетические аналоги, лишенные активности витамина A (Evans and Kaye, 1999).
Содержание витамина А в овощах влияет на их цвет, и это простое наблюдение (Steenbock, 1919) открыло путь к выделению витамина и определению его структуры. Особенно богатым источником витамина А оказался очищенный растительный пигмент каротин (провитамин А).
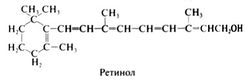
Ретинол, первичный спирт, в форме эфиров присутствует в тканях животных и морских рыб (главным образом в печени). Его структурная формула следующая:
Возможность цис-транс-изомеризации (вокруг двойных связей боковой цепи молекулы) обусловливает существование рада стереоизомеров ретинола. Рыбий жир содержит смесь стереоизомеров; синтетический ретинол представляет собой полностью транс-изомер. В организме изомеры ретинола легко превращаются друг в друга. В фоторецепторах родопсин образуется только при присоединении 11-цис-изомера ретиналя (альдегида витамина А) к белку опсину.
Простые и сложные эфиры ретинола также обладают биологической активностью. Для ее проявления необходимо наличие в молекуле циклического фрагмента (β-иононового кольца в ретиноле или более ненасыщенного дегидро-β-иононового кольца в 3-дегидроретиноле); гидрогенизация лишает молекулу биологической активности. Среди известных производных ретинола наибольшей биологической активностью обладают полностью транс-ретинол и его альдегид; 3-дегидроретинол действует примерно на 60% слабее.
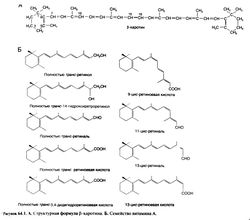
Ретиноевая кислота (производное ретинола с окисленной спиртовой группой) обладает не всеми свойствами ретинола и у некоторых видов животных с авитаминозом А не восстанавливает зрение и репродуктивную функцию. Однако она оказывает мощное стимулирующее влияние на рост и дифференцировку эпителиальных тканей. Полностью транс-ретиноевая кислота (третиноин) является, по-видимому, активной формой витамина А во всех тканях, за исключением сетчатки. In vitro третиноин в 10— 100 раз активнее ретинола. В организме третиноин изомеризуется в изотретиноин (13-цис-ретиноевую кислоту), который действует на эпителиальные ткани почти так же, как третиноин, но в 5 раз менее активно вызывает симптомы гипервитаминоза А.
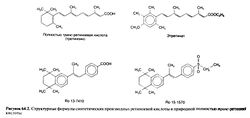
Синтезированы многочисленные аналоги ретиноевой кислоты, в том числе этретинат — этиловый эфир активного вещества ацитретина. Эти соединения являются представителями так называемых ретиноидов второго поколения, содержащих ароматическое кольцо; на одни процессы они действуют сильнее, а на другие — слабее, чем третиноин. Высокоактивные ретиноиды третьего поколения содержат два ароматических кольца, которые ограничивают гибкость полиеновой боковой цепи. Ароматические ретиноиды этого класса называют аротиноидами; к ним относится карбоновая кислота Ro 13-7410, а также этилсульфон Ro 15-1570. Строение ретиноевых кислот и некоторых ароматических ретиноидов показано на рис. 64.2. Структурно-функциональной зависимости у синтетических ретиноидов посвящен специальный обзор (Symposium, 1989b). Физиологические функции и фармакологическое действие. Витамин А выполняет в организме ряд важнейших функций. Он необходим для работы сетчатки, пролиферации и дифференцировки эпителия, остеогенеза, размножения и эмбрионального развития. Наряду с некоторыми каротиноидами витамин А повышает иммунитет, ослабляет последствия ряда инфекционных заболеваний и может препятствовать развитию злокачественных новообразований. Все это привлекает большое внимание к ретиноидам как возможным средствам профилактики онкологических заболеваний и лечения предраковых состояний. Ретиноиды и их аналоги применяются при ряде кожных заболеваний, включая старческие изменения кожи и последствия солнечного ожога (гл. 65).
Функции витамина А осуществляют разные производные ретинола. В процессах зрения участвует ретиналь, а на пролиферацию, дифференцировку и трансформацию тканей влияет, по-видимому, ретиноевая кислота. Ретиналь и зрительный цикл. Давно известно, что дефицит витамина А нарушает способность видеть в сумерках; такое состояние называют гемералопией (куриной слепотой). Пониманию этого феномена способствовал ряд фундаментальных исследований (Wald, 1968 и др).
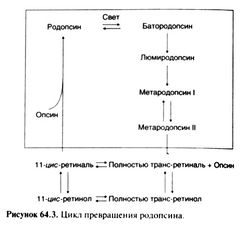
Свет воспринимается двумя видами специализированных клеток сетчатки, папочками и колбочками. Палочки особенно чувствительны к слабому свету, а колбочки воспринимают сильный свет и ответственны за цветовое зрение. Вначале свет поглощается хромофором, связанным с рецепторным белком. Хромофором как палочек, так и колбочек служит 11 -цис-ретиналь. В палочках 11 -цис-ретиналь в качестве простетической группы связан с белком опсином, образуя родопсин. Колбочки трех разных видов (воспринимающие красную, зеленую и синюю части спектра) содержат разные, но близкие фоторецепторные белки, лучше всего реагирующие на свет с соответствующей длиной волны.
Обратимое превращение 11-цис-ретинола в 11 -цис-ретиналь требует присутствия пиридиновых нуклеотидов. Затем 11-цис-ретиналь присоединяется к е-аминогруппе определенного остатка лизина в молекуле опсина, в результате чего образуется родопсин. Большая часть родопсина локализуется в мембранах дисков, расположенных в наружных сегментах палочек. Молекула белка семь раз пронизывает клеточную мембрану, что характерно для всех известных рецепторов, сопряженных с G-белками (гл. 2).
Зрительный цикл изображен на рис. 64.3. Поглощая фотон, родопсин последовательно проходит через ряд нестабильных конформаций и обесцвечивается; 11-цис-ретиналь при этом изомеризуется в полностью транс-форму и отщепляется от опсина. Активированный таким образом рецепторный белок быстро взаимодействует с другим белком наружного сегмента палочки — G-белком, называемым трансдуцином, или Gt. Трансдуцин стимулирует фосфодиэстеразу цГМФ и снижает его концентрацию в клетке, что приводит к снижению проводимости цГМФ-зависимых натриевых каналов клеточной мембраны и ее гиперполяризации — рецепторному потенциалу. Далее сигнал передается по клеткам сетчатки, и в конечном счете возникает потенциал действия, который по зрительному нерву поступает в головной мозг (Stryer, 1991).
Полностью транс-ретиналь либо сразу изомеризуется в 11-ф/с-ретиналь (который присоединяется к опсину, образуя родопсин), либо восстанавливается в полностью транс-ретинол, который вначале превращается в 11-цис-ретинол, а затем уже в 11-цис-ретиналь (рис. 64.3).
В отсутствие витамина А нарушается темновая адаптация. Функция палочек страдает в большей степени, чем функция колбочек. После истощения запасов ретинола в печени и крови (о чем свидетельствует падение его сывороточной концентрации ниже 20 мкг%, или 0,7 мкмоль/л) концентрации ретинола и родопсина уменьшаются и в сетчатке. Без стабилизирующего действия ретиналя опсин распадается, повреждаются наружные сегменты палочек. У крыс, не получающих витамин А, возникают необратимые ультраструктурные изменения в сетчатке и примерно в течение 10 мес развивается слепота.
При кратковременном дефиците витамина А темновую адаптацию можно нормализовать путем добавления к пище ретинола. Однако это происходит лишь через несколько недель потребления нормального количества витамина А. Причина столь длительного отсутствия эффекта не известна.
Витамин А и эпителиальные структуры[править | править код]
От витамина А зависит функциональная и структурная целость всех эпителиальных тканей. Ему принадлежит основная роль в индукции и регуляции дифференцировки базальных клеток эпителия — их превращения в клетки, секретирующие слизь, или в кератиноциты. В присутствии ретинола или ретиноевой кислоты базальные клетки эпителия начинают секретировать слизь. Избыток ретиноидов приводит к образованию толстого слоя муцина, подавлению ороговения и появлению бокаловидных клеток.
В отсутствие витамина А секретирующие слизь бокаловидные клетки исчезают; базальные клетки эпителия пролиферируют и превращаются в многослойный ороговеваюший эпителий. Угнетение секреторных процессов способствует раздражению и инфицированию эпителия. Все эти изменения исчезают после введения ретинола, ретиноевой кислоты или других ретиноидов. Аналогичные процессы в роговице обусловливают тяжелую гиперкератинизацию (ксерофтальмию), которая может стать причиной необратимой слепоты. Ксерофтальмия остается одной из наиболее частых причин слепоты во всем мире.
Механизм действия[править | править код]
В культуре фибробластов или в эпителиальных тканях ретиноиды усиливают синтез одних белков (например, фибронектина) и тормозят синтез других (например, коллагеназы и некоторых видов кератина). Эти эффекты можно целиком отнести на счет изменений процессов транскрипции в клеточных ядрах (Мап-gelsdorfet al., 1994). Ретиноевая кислота в данном отношении гораздо активнее ретинола.
Ретиноевая кислота влияет на экспрессию генов, связываясь с внутриклеточными рецепторами. Описано множество ретиноидных рецепторов. Среди них выделяют два семейства. Семейство RAR-рецепторов включает рецепторы, обозначаемые буквами а, (В и у, которые кодируются генами, локализованными у человека соответственно на 17, 3 и 12-й хромосомах. Семейство RXR-pe-цепторов также состоит из а-, β- и у-изоформ (Chambon, 1995). Ретиноидные рецепторы обнаруживают широкую гомологию аминокислотных последовательностей как в ДНК-связывающем, так и в рецепторном доменах и принадлежат к суперсемейсгву рецепторов, к которому относятся также рецепторы кальцитриола, стероидных и тиреоидных гормонов (Mangelsdorf et al., 1994; см. также гл. 2). Реакции клеток на тиреоидные и стероидные гормоны, кальцитриол и ретиноевую кислоту усиливаются в присутствии ядерных экстрактов, содержащих ретиноидные RXR-рецепторы. Регулируемые этими веществами гены содержат в промоторных участках специфические для каждого вещества чувствительные регуляторные элементы. Активация таких генов происходит при связывании активированного рецептора с соответствующим регуляторным элементом и последующей димеризации этого рецептора с комплексом лиганд— RXR-pe-цептор. Эндогенным лигандом ретиноидных RXR-pe-цепторов служит 9-цис-ретиноевая кислота (Heyman et al., 1992; Levin etal., 1992). Рецептор для ретинола до сих пор не найден. Возможно, прежде чем подействовать на клетки-мишени, ретинол окисляется в ретиноевую кислоту.
Ретиноиды изменяют экспрессию рецепторов некоторых гормонов и факторов роста и таким образом могут не только прямо, но и косвенно влиять на пролиферацию, дифференцировку и функцию клеток-мишеней (Love and Gudas, 1994).
Витамин А и канцерогенез[править | править код]
Роль витамина А в процессах дифференцировки и пролиферации эпителия обусловила большой интерес к возможному влиянию ретинола и близких соединений на канцерогенез (Moon etal., 1994; Hong and Itri, 1994). Авитаминоз А у человека увеличивает риск рака; базальные клетки различных эпителиальных структур подвергаются выраженной гиперплазии и слабее дифференцируются. Введение экспериментальным животным ретинола или других ретиноидов приводит к обратному развитию подобных изменений в эпителии дыхательных путей, молочных желез, мочевого пузыря и кожи, то есть замедляет или даже полностью блокирует опухолевую трансформацию клеток (Moon et al., 1994). Противоопухолевое действие ретиноидов наблюдается при индукции как эпителиальных, так и мезенхимных опухолей химическими агентами, вирусами, облучением и факторами роста. На уже существующие опухоли и метастазы, а также на рост перевиваемых опухолей у животных ретиноиды влияют слабее.
Точный механизм противоопухолевого действия ретиноидов не известен. Эффект сохраняется даже тогда, когда ретиноиды вводят через много недель после воздействия канцерогенов, что свидетельствует о торможении ретиноидами определенных стадий канцерогенеза. Возможно, ретиноиды индуцируют дифференцировку опухолевых клеток в морфологически зрелые нормальные клетки. Действительно, ретиноиды регулируют синтез некоторых белков (например, кератина), необходимых для дифференцировки эпителия. Кроме того, витамин А специфически влияет на синтез гликопротеидов и гликолипидов клеточной поверхности, которые участвуют в процессах межклеточного взаимодействия. В эпителиальных клетках ретинол превращается в ретинилфосфат, который используется микросомами для синтеза маннозилретинилфосфата (Rosso et al., 1975) — гликозилированного производного ретинола, которое переносит ман-нозу на отдельные гликопротеиды клеточной поверхности. При авитаминозе А образование этих гликопротеидов резко уменьшается. Такого рода реакциями можно объяснить влияние витамина А на многие процессы, зависящие от состояния поверхности клеток, в частности противоопухолевый эффект этого витамина после действия канцерогенов. Возможно, витамин А усиливает также иммунитет. Очень маловероятно, что ретиноиды обладают прямым цитотоксическим действием (Hong and ltri, 1994).
Во многих эпидемиологических исследованиях обнаружена обратная зависимость между потреблением витамина А, с одной стороны, и заболеваемостью раком (особенно раком легких) и смертностью от него — с другой. Однако связь этих показателей с потреблением именно ретинола не доказана (Hong and Itri, 1994). Поэтому сейчас особое внимание уделяется не ретинолу, а β-каротину и другим каротиноидам (см. ниже «Каротиноиды»).
Витамин А и иммунитет[править | править код]
Давно известно, что авитаминоз А повышает восприимчивость к бактериальным, паразитарным и вирусным инфекциям. Снижение сопротивляемости инфекциям в таких условиях продемонстрировано на многих экспериментальных моделях. Даже небольшой дефицит витамина А увеличивает тяжесть и продолжительность инфекционных заболеваний. Хотя у некоторых животных при авитаминозе А отмечено уменьшение числа клеток в лимфоидной ткани и массы этой ткани, однако этот эффект непостоянен, а его величина зависит от вида животного, выраженности и продолжительности авитаминоза. При авитаминозе А замедляется пролиферация лимфоцитов селезенки и уменьшается цитотоксическая активность NK-лимфоцитов. Результаты исследования гуморального иммунитета зависят от используемого антигена. У животных выявлена связь между уровнем витамина А и образованием антител к столбнячному анатоксину. В некоторых (но не во всех) исследованиях у истощенных людей, получавших витамин А, наблюдалось усиление реакций на противостолбнячную вакцинацию. Широко изучалась связь между потреблением витамина А и заболеваемостью корью. По данным крупных клинических исследований, введение витамина А детям значительно уменьшает заболеваемость корью и смертность от нее (Hussey and Klein. 1990). Совместная публикация ВОЗ и ЮНИСЕФ рекомендует в тех странах, где смертность от кори превышает 1%, [сразу же после установления диагноза давать детям витамина А, в дозе 30—60 мг (100 000—200 000 М Е) в зависимости от возраста (Anonymous, 1987). Зависимость иммунитета и течения инфекционных заболеваний от уровня витамина А рассматривается в обзоре Ross (1992).
Симптомы дефицита[править | править код]
Тканевые запасы ретиноидов позволяют взрослому человеку длительное время обходиться без поступления этих веществ извне. Авитаминоз А обычно наблюдается лишь при хроническом нарушении всасывания жиров (например при заболеваниях желчных путей и поджелудочной железы. спру, болезни Крона с поражением дистального отдела подвздошной кишки, циррозе печени и после частичной гастрэктомии) или при значительном длительном дефиците витамина А в пище.
Авитаминоз А — одно из самых тяжелых проявлений недостаточного питания в настоящее время. Он широко распространен в Юго-Восточной Азии, на Среднем Востоке, в Африке, а также в Центральной и Южной Америке, особенно у голодающих детей. Авитаминоз А иногда приводит к смерти, он особенно опасен для новорожденных и детей младшего возраста, страдающих квашиоркором и маразмом. Ежегодно во всем мире из-за недостаточного потребления витамина А более чем у четверти миллиона детей развивается необратимая слепота. Даже легкая ксерофтальмия сопровождается повышенным риском поноса и инфекций дыхательных путей, а также увеличивает смертность от этих состояний и от кори (Sommer в Symposium, 1989а). Примерно у 3% практически здоровых жителей США сывороточная концентрация ретинола не достигает нижней границы нормы — 20 мкг% (0,7 мкмоль/л). Большинство из них — дети, в том числе новорожденные.
Проявления легкого авитаминоза А малозаметны. К самым ранним симптомам относятся поражения кожи, такие, как фолликулярный гиперкератоз и инфекции, но наиболее яркий признак — гемералопия (куриная слепота) — появляется лишь при выраженном авитаминозе А. Иногда у детей замедляется рост, но это удается заметить только после восполнения дефицита витамина А. К авитаминозу А обычно более чувствительны быстро пролиферирующие клетки, которые легче теряют дифференцировку.
Глаза. При серьезных нарушениях питания у детей младшего возраста иногда остро развивается кератомаляция, характеризующаяся сухостью и изъязвлением роговицы и конъюнктивы. Обычно ей предшествует гемералопия — самый ранний глазной симптом авитаминоза А. В конце концов возникают тяжелые нарушения зрения вплоть до полной слепоты.
Дыхательные пути. При авитаминозе А эпителий дыхательных путей теряет секреторную активность и ороговевает, что приводит к учашению респираторных инфекций. Снижается и эластичность легочной и других тканей.
Кожа. Наблюдается ороговение и сухость эпидермального слоя; иногда, особенно на конечностях, возникают папулезные высыпания, захватывающие волосяные фолликулы.
Мочеполовая система. Авитаминоз А часто сопровождается мочекаменной болезнью. Эпителий мочевых путей изменяется так же, как и все другие эпителиальные структуры. Вокруг его обрывков в моче и формируются камни. У животных отмечаются нарушения сперматогенеза, атрофия яичек, самопроизвольные аборты, рассасывание плода или пороки его развития.
ЖКТ. В слизистой кишечника уменьшается количество бокаловидных клеток, но ороговение отсутствует. Часто наблюдаются повреждения кишечного эпителия и метаплазия эпителия протока поджелудочной железы, что может стать причиной поноса.
Потовые железы. Потовые железы могут подвергаться атрофии и плоскоклеточной метаплазии с ороговением.
Кости. У животных авитаминоз А сопровождается нарушением остеогенеза; кости утолщаются, и в них увеличивается содержание губчатого вещества.
Прочие симптомы. Ороговение эпителиальных структур при авитаминозе А часто приводит к изменению вкусовых и обонятельных ощущений. Может нарушаться и слух. Иногда страдает эритропоэз, но из-за увеличения потерь жидкости это трудно обнаружить. Описаны неврологические нарушения, повышение внутричерепного давления и гидроцефалия.
Гипервитаминоз А[править | править код]
Потребление ретиноидов в количествах, значительно превышающих потребности, приводит к развитию токсического синдрома, называемого гипервитаминозом А. Некоторые или даже все признаки этого состояния могут возникать и при лечении кожных заболеваний природными или синтетическими ретиноидами (гл. 65).
Гипервитаминоз А у детей чаще всего связан с тем, что родители дают им чрезмерно много витаминов с профилактической целью. У взрослых токсические эффекты возникают в результате самолечения или особых пищевых пристрастий, а также при использовании ретиноидов для лечения угревидной сыпи или других кожных заболеваний. Токсичность ретинола зависит от дозы и длительности его применения, а также от возраста больного. Хотя у взрослых потребление ретинола в дозе до 30 мг/суг редко сопровождается токсическими явлениями, легкие симптомы хронической интоксикации отмечались при приеме даже 10 мг/сут в течение 6 мес (Bendich and Langseth, 1989). У детей же потребление ретинола в дозе всего 7,5— 15 мг/сут в течение 1 мес приводило к интоксикации. Разовая доза ретинола более более 500 мг у взрослых, 100 мгу детей младшего возраста или 30 мг у новорожденных часто приводит к отравлению. Острое и иногда смертельное отравление возможно также при употреблении в пишу печени белого медведя, в 1 г которой содержится до 12 мг ретинола. Департамент по пищевым продуктам и питанию Национального исследовательского совета не рекомендует принимать ретинол в дозе более 7,5 мг/сут. Тем не менее почти 5% жителей США потребляют витамин в более высоких дозах.
Ранние проявления хронической интоксикации ретиноидами включают сухость и шелушение кожи, зуд, эритродермию, нарушение роста волос, трещины губ, болезненность костей, гиперостозы, головную боль, застойные диски зрительных нервов, потерю аппетита, отеки, утомляемость, раздражительность и кровоточивость. Может повышаться внутричерепное давление; неврологическая симптоматика иногда напоминает опухоль головного мозга. Повышение внутричерепного давления у детей рано проявляется выбуханием родничка и рвотой. Возникает гепатоспленомегалия; в печени происходит гипертрофия жировых клеток, наблюдаются фиброз, склероз центральных вен и цирроз. В результате развиваются портальная гипертензия и асцит. Из-за стимуляции остеобластов возрастает активность щелочной фосфатазы в плазме; в ряде случаев у детей отмечалась гиперкальциемия. Повышается концентрация триглицеридов, и снижается концентрация ЛПВП в плазме.
Клинические проявления острого отравления: вялость, раздражительность или непреодолимая сонливость, сильная головная боль (из-за повышения внутричерепного давления), головокружение, гепатомегалия, рвота, отек дисков зрительных нервов и спустя 24 ч — шелушение кожи.
При гипервитаминозе А сывороточная концентрация ретинола обычно превышает 100 мкг% (3,5 мкмоль/л). При отмене ретинола большинство симптомов исчезает через неделю, но шелушение кожи и гиперостозы сохраняются в течение нескольких месяцев; в редких случаях костные деформации остаются навсегда. Наблюдается также хроническое, иногда необратимое поражение печени.
Риск гипервитаминоза А возрастает при снижении концентрации ретинолсвязывающего белка (см. ниже) в плазме, что наблюдается при общем истощении и заболеваниях печени. Поскольку витамины А и D часто находятся в одних и тех же пищевых продуктах, некоторые проявления гипервитаминоза А (например, гиперкальциемия) на самом деле могут быть следствием избытка витамина D. Большие дозы витамина А даже препятствуют влиянию избытка витамина D на костную ткань. Гипопротромбинемия при гипервитаминозе А может быть связана с тем, что витамин А противодействует эффекту витамина К. Введение витамина Е экспериментальным животным устраняет некоторые признаки гипервитаминоза А. Аналогичный эффект у человека не доказан, но в препараты витамина А, которые в развивающихся странах назначают в больших дозах, включают некоторое количество витамина Е (Bendich and Langseth, 1989).
У детей, матери которых на протяжении I триместра беременности потребляли ретинол в дозе 7,5—12 мг/сут, отмечались врожденные пороки (Bernhardt and Dorsey, 1974). Поэтому потребление ретиноидов беременными женщинами не должно превышать рекомендованных количеств. Кроме того, женщинам, получавшим синтетические ретиноиды (накапливающиеся в жировой ткани), следует избегать беременности и после лечения до тех пор, пока организм полностью не освободится от препарата. При длительном применении этретината этот срок иногда растягивается до 2 лет и более (см. ниже).
Потребность[править | править код]
Ранее о потребностях в витамине А судили по его количествам, устраняющим симптомы экспериментального авитаминоза. Современные рекомендации Департамента по пищевым продуктам и питанию Национального исследовательского совета исходят из количества витамина, необходимого для сохранения темновой адаптации глаза; к этому добавляют еще небольшое количество для компенсации индивидуальных колебаний всасывания и метаболизма ретинола. Норма суточной потребности для здоровых взрослых мужчин и женщин составляет соответственно 1000 и 800 эквивалентов ретинола в сутки (5000 и 4000 ME, исходя из того что 50% витамина А пищи поступает в виде ретинола, а 50% — в виде β-каротина). Суточные потребности детей разного возраста приведены в табл. XIII. 1. Пищевые источники. Примерно половина витамина А, потребляемого взрослым жителем США, приходится на ретинол и его эфиры, а остальное количество — на каротиноиды. Основными пищевыми источниками витамина А служат печень, сливочное масло, сыр, цельное молоко, яичный желток и рыба. В желтых и зеленых фруктах и овощах присутствует β-каротин. Эти пищевые продукты содержат также множество каротиноидов, которые, хотя и не превращаются в ретинол, могут быть полезны в качестве антиоксидантов (Symposium, 1989а).
Всасывание, обмен и экскреция[править | править код]
Ретинол. В пищевых продуктах более 90% ретинола находится в форме эфиров, в основном в виде ретинола пальмитата. Большинство эфиров ретинола, подобно триглицеридам, перед всасыванием гидролизуются ферментами поджелудочной железы в просвете кишки и ферментами щеточной каемки. Несмотря на свою липофильную природу, ретинол поглощается клетками ЖКТ с помощью особого переносчика, а присутствие цитоплазматического белка, избирательно и с высоким сродством связывающего ретинол, облегчает всасывание витамина. Этот белок, сходный с соответствующими белками других клеток (см. ниже), называют клеточным ретинолсвязывающим белком II. Он присутствует только в клетках тонкой кишки, где происходит всасывание ретинола и где на долю этого белка приходится примерно 1% всех растворимых белков (Ong et al., 1994). Большая часть ретинола в этих клетках вновь этерифицируется (превращаясь главным образом в ретинилпапьмитат) и включается в состав хиломикронов. После приема больших доз ретинола значительные количества эфиров ретинола циркулируют в крови в составе ЛПНП. В кровь попадает и неэтерифицированный ретинол, взаимодействующий с ретинолсвязывающим белком плазмы.
В количестве, соответствующем суточной потребности, ретинол всасывается полностью, но при большем потреблении некоторая его часть выделяется с калом. Сывороточная концентрация эфиров ретинола достигает максимума примерно через 4 ч после его приема. При нарушении всасывания жиров (например, при заболеваниях поджелудочной железы и печени, кишечных инфекциях и муковисцидозе) уменьшается всасывание и ретинола. В таких случаях следует использовать водные микроэмульсии витамина.
После всасывания основная часть эфиров ретинола вместе с остаточными компонентами хиломикронов поглощается клетками печени путем опосредованного рецепторами эндоцитоза (гл. 36). Концентрация ретинола в крови возрастает только после насыщения печени эфирами ретинола. Средняя концентрация эфиров ретинола в печени человека составляет 100—300 мкг/г, а нормальная сывороточная концентрация ретинола равна 30— 70 мкг% (1,1—2,4 мкмоль/л). При прекращении поступления ретинола или его предшественников с пищей сывороточная концентрация ретинола много месяцев поддерживается за счет его запасов в печени; Т1/2 ретинола в печени составляет 50—100 сут. Поэтому сывороточная концентрация ретинола — недостаточно чувствительный показатель количества витамина А в организме. Тем не менее низкие сывороточные концентрации ретинола указывают на истощение его запасов в печени. Признаки авитаминоза А появляются при сывороточной концентрации ретинола менее 10—20 мкг% (0,35—0,7 мкмоль/л) и концентрации ретиноидов в печени менее 5—20 мкг/г. При алкогольном поражении печени содержание ретиноидов в ней резко падает (Leo and Lieber, 1982).
До поступления из печени в кровь эфиры ретинола гидролизуются и 90—95% ретинола соединяется с агглобулином, молекула которого обладает одним связывающим ретинол участком. Этот ретинолсвязывающий белок синтезируется печенью и циркулирует в крови в комплексе со стабилизирующим его транстиретином. Образование такого комплекса защищает ретинолсвязывающий белок (и ретинол) от распада и почечной экскреции.
В норме более 95% ретинола связано с ретинолсвязывающим белком плазмы. При насыщении печени и ретинолсвязывающего белка витамином (при избыточном потреблении последнего или поражении печени) почти 65% ретиноидов плазмы остаются в виде эфиров ретинола в составе липопротеидов. Эфиры ретинола накапливаются в крови и при однократном потреблении большого количества алкоголя. Поскольку связанный с белком ретинол биологически неактивен, токсические эффекты в таких случаях обусловлены, по-видимому, именно эфирами ретинола.
Ретинол в комплексе с ретинолсвязывающим белком плазмы достигает клеточных мембран различных орга-нов-мишеней, где этот комплекс взаимодействует со специфическими участками клеточной поверхности. Ретинол переносится в клетки мембранным белком (родственным растворимому клеточному ретинолсвязывающе-му белку) и этерифицируется. Образующийся эфир расщепляется мембранной гидролазой, но только при условии, что в цитоплазме имеется свободный клеточный ретинолсвязывающий белок. Этот ретинолсвязывающий белок присутствует почти во всех тканях, за исключением, в частности, сердечной и скелетных мышц, а также слизистой подвздошной кишки, которая содержит сходный с ним клеточный ретинолсвязывающий белок II (см. выше). Клеточный ретинолсвязывающий белок не только участвует в поглощении ретинола клетками, но и служит депо, откуда ретинол доставляется в те участки клетки, где превращается в активные соединения. В сетчатке ретинол превращается в 11-цис-ретиналь, который включается в родопсин; здесь присутствует и специфический связывающий белок (отличающийся от остальных клеточных ретинолсвязывающих белков). В других тканях ретинол, по-видимому, окисляется в ретиноевую кислоту, которая в комплексе со связывающим ее белком переносится к рецепторам, расположенным в ядре клетки. Тканевое распределение белка, связывающего ретиноевую кислоту, почти совпадает с распределением клеточного ретинолсвязывающего белка. Исключение составляет, по-видимому, печень у взрослых, где белок, связывающий ретиноевую кислоту, отсутствует (Ong et al., 1994).
Сывороточная концентрация ретинола и его доставка к тканям зависят от концентрации ретинолсвязывающего белка плазмы. При авитаминозе А синтез ретинолсвязывающего белка продолжается, но его секреция, по-видимому, тормозится. Поэтому его содержание в печени увеличивается, а в сыворотке снижается. Как только появляется ретинол, печень быстро выбрасывает ретинолсвязывающий белок в кровь для доставки витамина в ткани. При общем дефиците белка (например, при истощении, квашиоркоре или поражении паренхимы печени) уменьшается концентрация и ретинолсвязывающего белка плазмы; сывороточная концентрация ретинола при этом снижается, несмотря на его нормальные запасы в печени. Поэтому введение одного только ретинола в таких условиях бесполезно; необходимо восполнение энергетических субстратов и белка.
Концентрации ретинола и ретинолсвязывающего белка меняются и при других патологических состояниях. При муковисцидозе, алкогольном циррозе печени и других ее поражениях, когда нарушается синтез или секреция ретинолсвязывающего белка, сывороточная концентрация ретинола снижается. Резкое падение уровня ретинола при протеинурии, лихорадке или стрессе отчасти обусловлено усиленным его выведением с мочой. При ХПН распад ретинолсвязывающего белка замедляется, в силу чего сывороточные концентрации ретинола и ретинолсвязывающего белка возрастают.
Эстрогены и пероральные контрацептивы увеличивают концентрацию ретинолсвязывающего белка в плазме. Влияние беременности более сложно: в I триместре средняя сывороточная концентрация ретинола снижается, затем она несколько возрастает, нормализуясь лишь ко времени родов. По-видимому, из-за повышения потребности в ретиноле в начале беременности он исчезает из крови быстрее, чем выделяется из печени. Плацента ограничивает поступление ретинола и каротиноидов в организм плода. Опыты на животных показывают, что на ранних стадиях беременности ретинолсвязывающий белок проходит через плаценту, но затем плод начинает синтезировать собственный белок. Поэтому концентрация ретинола в крови плода ниже, чем в крови матери. Новорожденный получает ретинол с молозивом и молоком. Если количество ретинола, которое мать получаете пищей, достаточно для его запасания в печени, концентрация ретинола в женском молоке стабильно поддерживается на максимальном уровне.
В печени ретинол частично образует конъюгат β-глюкуронид, который претерпевает кишечно-печеночный кругооборот и окисляется в ретиналь и ретиноевую кислоту. Предполагают, что глюкурониды ретинола могут обладать определенной биологической активностью (Zi-le et al., 1982). Так, они стимулируют дифференцировку клеток некоторых линий. Механизм действия этих соединений остается неясным. Они не взаимодействуют с ретиноидными рецепторами. Возможно, происходит внутриклеточный гидролиз с образованием полностью транс-ретиноевой кислоты или ковалентное присоединение ретиноевой кислоты к белкам (Olson, 1993). Глюкурониды ретинола гораздо менее токсичны, чем другие ретиноиды, что открывает новые перспективы лечебного применения этих соединений.
С мочой и калом выводятся и некоторые другие водорастворимые метаболиты ретинола. Сам ретинол в моче здорового человека не обнаружен.
Применение[править | править код]
Авитаминоз А[править | править код]
В норме потребности взрослого человека в витамине А обеспечиваются обычной пищей. Дополнительный прием витамина показан при его дефиците и для профилактики авитаминоза в группах риска — например, в раннем детском возрасте или у женщин во время беременности и лактации, то есть в периоды высокой потребности в витамине А. Авитаминоз А требует интенсивного лечения с последующим полноценным питанием.
Ретинол выпускается во многих лекарственных формах. Лучше всего он всасывается из водных микроэмульсий, хуже — из эмульсий и медленнее всего — из масляных растворов. Масляные растворы обеспечивают большее запасание витамина в печени, тогда как водные препараты (микроэмульсии и эмульсии) — более высокие его сывороточные концентрации. Витамин А выпускается в капсулах. В качестве местного средства используют третиноин. При псориазе назначаютацитретин внутрь. Изотретиноин (13-цис-ретиноевоя кислота) и этретинат также -предназначены для приема внутрь. Адапален — синтетический аналог ретиноевой кислоты, который избирательно взаимодействует с некоторыми ретиноидными рецепторами, но не с внутриклеточными белками, связывающими ретиноевую кислоту. Его применяют местно для лечения угрей.
Во время беременности и лактации рекомендуется увеличить потребление витамина А примерно на 25%. Поскольку американцы обычно получают с пищей достаточное количество витамина, дополнительный его прием, как правило, не требуется. Тем не менее в США детям младшего возраста широко назначают витаминные добавки. Следует помнить, однако, что потребление здоровыми детьми ретинола в дозе всего 6 мг/сут (20 ООО МЕ/сут) на протяжении 1—2 мес может вызвать токсические явления.
Длительная терапия ретинолом показана в редких случаях нарушения его всасывания или запасания в печени (например, при стеаторее, обструкции желчных путей, циррозе печени и после гастрэктомии). Заместительная терапия ретинолом может потребоваться и при состояниях, сопровождающихся значительными его потерями. При нарушении всасывания или тяжелых дефектах зрения можно парентерально вводить водные микроэмульсии витамина. Потребность в ретиноле возрастает при инфекционных заболеваниях, характеризующихся ускоренным обновлением клеток слизистой и увеличением экскреции ретинола с мочой. Однако нет данных, которые указывали бы на снижение риска инфекционных заболеваний при потреблении ретинола сверх нормы. Хотя витамин А в умеренных количествах, по-видимому, безвреден, при алкоголизме даже небольшие его количества могут усугублять поражение печени. При назначении витамина А в качестве пищевой добавки следует помнить, что потребление 1,5 мг/сут ретинола в полтора раза превышает суточную потребность. Длительный прием значительно больших доз может привести к гипервитаминозу.
Детям при квашиоркоре и других состояниях, сопровождающихся тяжелым авитаминозом А, рекомендуется однократная инъекция ретинола, 30 мг в/м (в виде водной микроэмульсии ретинола пальмитата), с последующим периодическим приемом ретиноидов внутрь. ВОЗ предлагает следующую схему лечения ксерофтальмии у детей старше 1 года: ретинола пальми-тат, 110 мг (200 ООО ME) внутрь или 55 мг (100 000 ME) в/м, на следующий день и перед выпиской — еще по 110 мг (200 000 ME) внутрь. Одновременно назначают витамин Е (40 ME), поскольку он, по-видимому, увеличивает эффективность ретинола. Беременные женщины должны получать лишь небольшие дозы ретиноидов.
Кожные болезни[править | править код]
Витамин А может помочь при некоторых кожных заболеваниях, таких, как угри, псориаз, болезнь Дарье и ихтиоз. В таких случаях вместо ретинола широко используют другие ретиноиды.
Злокачественные новообразования и другие заболевания[править | править код]
Большое внимание уделяется возможному профилактическому и лечебному действию витамина А и других ретиноидов при злокачественных новообразованиях (Lippman et al., 1994). В недавних исследованиях получены обнадеживающие результаты в отношении профилактики рака головы и шеи, кожи, толстой кишки и шейки матки, а также лечения уже имеющихся опухолей головы и шеи, щитовидной железы и легких. Продолжающиеся исследования должны в ближайшем будущем внести окончательную ясность в этот вопрос. Клинические испытания, однако, не подтверждают защитной роли каротиноидов, и пока нельзя рекомендовать каротиноидные или ретиноидные добавки с целью профилактики злокачественных новообразований. Лучше при сбалансированной диете потреблять больше фруктов и овощей.
Примером заболеваний, при которых ретиноевая кислота оказывает лечебное действие, служит промиелоцитарный лейкоз. У значительной части больных с этой формой острого лейкоза, на долю которой приходится около 15% всех острых нелимфобластных лейкозов у взрослых (Chen et al., 1991), обнаруживается необычная хромосомная транслокация t(15,17), повреждающая ген ретиноидного RARa-рецептора на хромосоме 17. Кроме того, ретиноевая кислота регулирует рост и дифференцировку миелоидных клеток in vitro (Collins etal., 1990). Введение третиноина больным с острым промиелоцитарным лейкозом способствовало дифференцировке опухолевых клеток и резко увеличивало вероятность ремиссий. У больных, реагирующих на такое лечение, имелся дефектный ретиноидный RARa-рецептор (Castaigne et al., 1990; Warrell et al., 1991). К сожалению, несмотря на высокую долю полных ремиссий, почти всегда наблюдались ранние рецидивы независимо от последующего лечения (Castaigne et al., 1990). Тем не менее эти данные позволяют надеяться, что новые препараты ретиноидов окажутся эффективными средствами лечения лейкозов, а также других, более распространенных злокачественных новообразований.