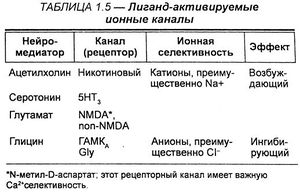
Белковые рецепторы
Белковые рецепторы
Хотя изменение первичной структуры белков может быть вызвано химическими веществами, которые вызывают разрыв пептидных связей или замещают одну аминокислоту на другую, маловероятным является объяснение обратимости действия фармакологических препаратов. Известно довольно много примеров того, что взаимодействие лекарственных веществ с аминокислотными остатками в молекуле белка приводит к сдвигам вторичной и третичной структур, но не первичной.
Аминокислотные остатки в белковой молекуле-рецепторе, как известно, содержат полярные и аполярные группировки, которые детерминируют образование полярных или аполярных связей между ними и фармакологическими препаратами.
Полярные группы (-ОН, —SH, COO-, —NH3, =0) обеспечивают образование главным образом ионных и водородных связей.
Аполярные группы (водород, метильные, циклические радикалы и др.) образуют гидрофобные связи с низкомолекулярными фармакологическими агентами.
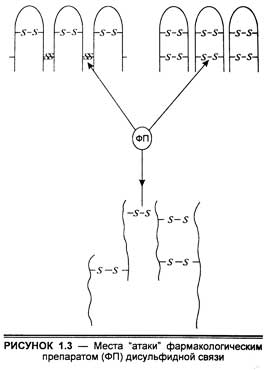
Конформации макромолекул стабилизируются часто и дисульфидными связями, которые также могут быть местом "атаки" фармакологических препаратов с образованием комплексов. Поскольку конформационные переходы белков имеют существенное значение во взаимодействии с лекарственными препаратами, видимо, целесообразно обсудить роль дисульфидной связи в этом процессе.
Поскольку дисульфидная связь стабилизирует белковую структуру и в связи с этим ответственна за физические и биологические свойства протеинов, влияние на нее некоторых фармакологических препаратов может вызвать множественные изменения как в структуре, так и в функции белков-рецепторов. В биохимии уже давно известны различные реагенты на сульфгидрильные группы, которые с успехом применяются для исследования особенностей их локализации и строения белков. К ним относятся p-хлормеркурийбензоат, монойодацетат, меркаптоэтанол, дитиотриэтол и др. Кроме того, в фармакологии используются препараты, влияющие на сульфгидрильные группы и связи, которые обладают различным спектром биологического действия. Наиболее существенными из них являются ртуть и мышьяк-содержащие агенты.
Дисульфидные связи могут располагаться как интермолекулярно, так и соединять поперечными связями различные молекулы, образуя межмолекулярные сшивки, которые определяют конформационные особенности молекул белков.
Более детальная информация о локализации дисульфидной связи, конформация молекул и ее влияние на третичную структуру была получена из рентгенодифракционного анализа. Этот метод был применен для анализа некоторых кристаллических белков, содержащих дисульфидные связи, таких, как лизоцим, а-химотрипсин и рибонуклеаза. Дисульфидная связь легко определяется в рентгенодифракционных картинах белков из-за ее прочности и комплексообразования с ионами тяжелых металлов.
Дисульфидная связь, как стало известно в последние годы, содержится в Н-холинорецепторах на некотором расстоянии от анионного пункта и отсутствует в М-холинорецепторах. После восстановления дисульфидная связь реагирует с реагентами на сульфгидрильные группы, которые имеют определенное сродство с холинорецептором посредством триметиламмониевой группы. Эти реагенты, меченные по тритию, типа Н3-4-(N-малеимидо)-а-бензилтриметиламмония, могут специфически связываться с SH-группами восстановленных рецепторов, в то время как неспецифическое связывание обусловлено избытком сульфгидрильных групп биологических мембран. Выделение белковых рецепторов после ингибиции неспецифических SH-групп и электрофореза в полиакриламидном геле позволило обнаружить зону с высокой радиоактивностью, молекулярный вес которой соответствовал 42 ООО.
Изучение холинорецепторов методом химической модификации позволило сделать заключение, что анионный пункт как М-, так и Н-холинорецепторов представлен карбоксильной или фосфатной группой, в то время как дисульфидная связь Н-холинорецептора расположена на расстоянии 12 А от анионного пункта.
Весьма интересным с точки зрения анализа белковых рецепторов для фармакологических препаратов является и то, что дисульфидная связь может обмениваться и перемещаться в различных направлениях. Это происходит в простейшем случае при некоторых физических и химических воздействиях. В частности, при агрегации овальбумина или бычьего альбумина наблюдается сдвиг от интра- к интермолекулярным дисульфидным связям. Дисульфидный обмен имеет место и при смешивании растворов и переводе их к менее родственным системам. На этот процесс влияют определенным образом окисляющие и восстанавливающие агенты.
Сульфгидрильные группы и дисульфидные связи принимают участие в транспорте гидридного иона Н- от восстановленного агента, содержащего SH-группу, к окислительному, имеющему S—S-группу. И. Клотц еще в 1958 г. высказал предположение, что молекулы воды образуют как бы мостик между -SH и -S—S-группами. Если гидридный ион переходит от сульфгидрильной группы к молекуле воды, то она сможет образовывать дисульфидную связь, так как у оставшейся серы не будет доставать двух электронов. Таким образом, гидридный ион может мигрировать по цепи, состоящей из молекул воды, на значительные расстояния между молекулами окислительно-восстановительных реакций. Установлено, что ионы водорода значительно быстрее продвигаются в структурированной воде, чем в жидкости. Эта подвижность обусловлена переносом водорода от одной молекулы воды к другой, следовательно, скорость полного переноса зависит как от протяженности системы водородных связей, так и от перехода иона водорода от одного атома кислорода к другому.
Дисульфидная связь может иметь значение при различных физико-химических взаимодействиях, что следует учитывать при оценке влияния фармакологических препаратов на эту реакционную группу.
Виды белковых рецепторов
Различаются несколько вариантов рецепторных образований для фармакологически активных веществ в организме. Эти варианты можно классифицировать следующим образом.
- Рецепторная область сформирована стереоспецифическим расположением аминокислотных остатков одной молекулы. Эти мономолекулярные белковые рецепторы являются стационарными и находятся в форме, готовой к соединению с молекулой фармакологического препарата.
- Рецепторная область может соответствовать нескольким молекулам.
- Рецепторная область может быть сформирована боковыми группами аминокислот соседних друг другу протеинов. Тогда она обозначается как межмолекулярный рецептор. Фармакологический препарат с комплементарной структурой рецепторному полю мог бы нарушить межмолекулярные взаимоотношения или разъединить функциональные цепи (например, меркурийсульфонат может находиться между двумя молекулами миоглобина в сферической позиции).
Как известно, оптимальные взаимоотношения фармакологического препарата и рецептора предполагают структурную комплементарность между ними. При первом приближении рассмотрения состояния белкового рецептора мы можем принять конформационное постоянство макромолекулы. Однако уже накопилось достаточно данных, которые позволяют сделать вывод, что экзогенные и эндогенные биологические вещества могут изменять конформацию макромолекул (в простейшем случае изменение конформации макромолекул может быть при изменении рН, температуры и других параметров).
Установлено, что начальным этапом адренергических реакций являются конформационные изменения адренорецепторов.
Изменения конформации макромолекулы рецептора и связанные с ними изменения рецепторного поля (или рецепторной области) обозначают как аллостерический эффект. Этот эффект, в конечном итоге, может быть причиной активации или ингибиции ферментативной активности, поэтому фармакологические препараты, взаимодействующие с рецепторными молекулами, изменяющие конформацию фермента и влияющие на его биологическую активность, называют аллостерическими активаторами, или аллостерическими ингибиторами.
Если рецепторное поле расположено в отдалении от активного центра фермента, то оно обозначается как рецептор 2-го порядка. В отличие от рецепторов 2-го порядка, активные центры ферментов, так называемые субстратные белковые рецепторы, принято называть рецепторами 1-го порядка.
Одним из перспективных направлений в изучении активных центров ферментов и рецепторов является присоединение спин-меток в различных участках молекулы с последующей регистрацией спектров ЭПР. Весьма полезная информация может быть получена при "посадке" двух или более меток к двум аминокислотным остаткам, расположенным относительно близко в одной и той же молекуле. Это позволяет наблюдать диполь-дипольное и обменное взаимодействие между двумя неспаренными электронами этих спин-меток и, следовательно, судить о расстоянии между этими аминокислотами и их взаимной ориентации. Последнее позволит судить о конформации молекулы и активного центра.
Определенный интерес представляет "посадка" на белок ковалентных и гидрофобных меток, с помощью которых можно судить не только о конформации макромолекулы, но и о характере связей фармакологического препарата с белковой матрицей. Конкуренция стероида с гидрофобной меткой за место "посадки" позволило сделать вывод о гидрофобном характере взаимодействия гормона с белком.
Выделение белкового рецептора в чистом виде, исследование его молекулярных характеристик методами гельфильтрации и седиментационного анализа, определение конформации методами ЭПР, ЯMP, рентгенострукгурного анализа и др. являются насущной задачей молекулярной фармакологии.
Отдельным направлением в молекулярной фармакологии рецепции является построение молекулярных моделей рецептора и выяснение возможностей взаимодействия препаратов с ним (например, характеристики холинорецепторов, α- и β-адренорецепторов, серотониновых рецепторов и др.).
Однако при исследованиях на молекулярном уровне и интерпретации полученных данных необходимо учитывать, что рецептор находится прежде всего в определенном окружении, которое может оказывать свое модифицирующее действие на его структуру прямо или косвенно. Одним из таковых факторов является вода.