Препараты для лечения герпеса
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Герпес
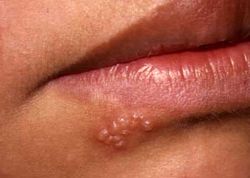
Ге́рпес — вирусное заболевание с характерным высыпанием сгруппированных пузырьков на коже и слизистых оболочках. В народе герспес часто называют простудой. Чаще всего возникает лабиальный герпес (на губах, реже на других частях лица). Возбудителем является вирус простого герпеса 1 типа (Herpes simplex), которым поражено до 98% населения. Данное заболевание не подлежит полному излечению, вирус продолжает персистировать в организме, даже после исчезновения симптомов.
Современная схема лечения лабиального герпеса строится следующим образом:
- Местно применяются Ацикловира мазь 5%
- Также можно дополнительно использовать мазь Виру-Мерц (Тромантадин), который имеет другой механизм действия. Эффективен только на начальных стадиях, когда пузырьки только начали образовываться.
- Внутрь принимается ацикловир в таблетках (обычно по 200 мг, три раза в сутки).
- Для активации иммунной защиты используют индукторы интерферона - Циклоферон, Аллокин-альфа.
![]() Помните, что Зовиракс это всего лишь дорогая торговая марка обычного ацикловира.
Помните, что Зовиракс это всего лишь дорогая торговая марка обычного ацикловира.
Препараты, действующие на герпесвирусы
Вирус простого герпеса типа 1 вызывает поражение кожи, рта, пищевода и головного мозга; вирус простого герпеса типа 2 — поражение наружных половых органов, прямой кишки, кожи и мозговых оболочек. В обоих случаях заболевание может быть первичным или возникать вследствие реактивации латентной инфекции.
Первым из допущенных к применению препаратов, действующих на герпесвирусы, стал видарабин (1977). Однако из-за высокой токсичности его использовали для лечения инфекций, вызванных вирусами простого герпеса и varicella-zoster, лишь по жизненным показаниям. С 1982 г. для лечения амбулаторных больных с менее тяжелыми инфекциями, вызванными этими вирусами, стали применять ацикловир. Впоследствии клинические испытания показали, что при инфекциях, вызванных вирусом varicella-zoster у лиц с ослабленным иммунитетом, и при герпетическом энцефалите эффективней и безопасней в/в введение ацикловира, чем видарабина. Ацикловир был первым из противовирусных препаратов, подавляющих синтез вирусной ДНК после фосфорилирования вирусной тимидинкиназой внутри зараженных клеток. В эту же группу входят пенцикловир, ганцикловир и их производные.
Ацикловир и валацикловир
Строение и противовирусная активность
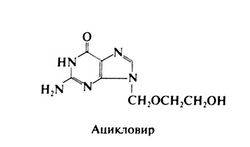
Ацикловир, или 9-[(2-гидроксиэтокси)метил]гуанин, — это ациклический аналог гуанозина. боковой радикал которого лишен гидроксильной группы в З'-положении. Ацикловир выпускают в виде капсул, мази и порошка для приготовления раствора для в/в введения. Валацикловир — это L-валиновый эфир ацикловира. Ацикловир действует только на герпесвирусы. In vitro он наиболее активен в отношении вируса простого герпеса типа 1 (в концентрациях 0,02—0,9 мкг/мл); его активность в отношении вируса простого герпеса типа 2 почти в 2 раза меньше (0,03—2,2 мкг/мл), а в отношении вируса varicella-zoster и вируса Эпштейна—Барр — в 10 раз меньше (0,8—4 мкг/мл). Наименее активен он в отношении цитомегаловируса (в концентрациях больше 20 мкг/мл) и герпесвируса человека типа 6 (Wagstaff et al., 1994). Пролиферацию незараженных герпесвирусами клеток млекопитающих, как правило, не подавляют даже высокие концентрации (> 50 мкг/мл) ацикловира. Структурная формула ацикловира следующая:
Механизм действия и устойчивость
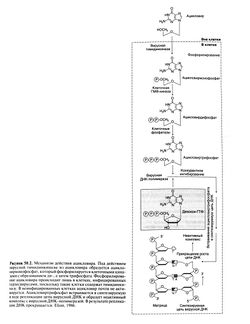
Механизм действия ацикловира на синтез вирусной ДНК схематически изображен на рис. 50.2 (Elion, 1986). Избирательность ацикловира определяется его взаимодействием с двумя вирусными белками. Захват ацикловира клетками и превращение его в монофосфат происходят при участии вирусной тимидинкиназы. Сродство ацикловира к этому ферменту в 200 раз больше, чем к тимидинкиназе клеток млекопитающих. Под действием клеточных ферментов из ацикловирмонофосата образуется ацикловиртрифосфат Концентрация последнего в зараженных клетках в 40—100 раз выше, чем в свободных от вируса, поэтому ацикловиртрифосфат успешно конкурирует с эндогенным дезокси-ГТФ. Мико-феноловая кислота (гл. 53) снижает концентрацию внутриклеточного дезокси-ГТФ, тем самым усиливая противовирусную активность ацикловира и родственных препаратов (Neyts et al. 1998). Ацикловиртрифосфат конкурентно ингибирует вирусные и, в гораздо меньшей степени, клеточные ДНК-полимеразы. Кроме того, он встраивается в вирусную ДНК и — из-за отсутствия гидроксильной группы в З'-положении рибозного кольца — останавливает ее репликацию. Молекула ДНК, в состав которой входит ацикловир, связывается с ДНК-полимеразой и необратимо инактивирует ее.
Устойчивость вируса простого герпеса к ацикловиру может возникать из-за снижения активности вирусной тимидинкиназы, нарушения ее субстратной специфичности (например, сохраняя активность в отношении тимидина, она перестает фосфорилировать ацикловир) и изменения вирусной ДНК-полимеразы. Изменения вирусных ферментов происходят за счет точечных мутаций, то есть вставок и делеций нуклеотидов в соответствующих генах. Устойчивыми могут быть и дикие штаммы, и вирусы, выделенные от больных после лечения противовирусными препаратами. У вируса простого герпеса устойчивость к ацикловиру чаше всего возникает из-за снижения активности вирусной тимидинкиназы (Hill et al., 1991), реже — из-за изменения субстратной специфичности этого фермента. Еще реже встречаются мутации гена ДНК-полимеразы. Штамм считают устойчивым, если ацикловир не действует на него in vitro в концентрациях выше 2—3 мкг/мл. У больных с ослабленным иммунитетом излечить инфекцию, вызванную таким штаммом, не удается.
Устойчивость к ацикловиру вируса varicella-zoster возникает вследствие мутаций вирусной тимидинкиназы и, реже, вирусной ДНК-полимеразы.
Фармакокинетика
В табл. 50.3 сравниваются фармакокинетические свойства ацикловира и других препаратов, действующих на герпесвирусы. Биодоступность ацикловира при приеме внутрь составляет 10—30% и уменьшается с увеличением дозы (Wags-taffetal., 1994). Максимальная сывороточная концентрация препарата равна 0,4—0,8 мкг/мл при приеме 200 мг и 1,6 мкг/мл при приеме 800 мг. При введении ацикловира по 5 мг/кг в/в 3 раза в сутки его максимальная и минимальная сывороточные концентрации составляют 9,8 мкг/мл и 0,7 мкг/мл, а при введении по 10 мг/кг в/в 3 раза в сутки — 20,7 мкг/мл и 2,3 мкг/мл соответственно.
У здоровых взрослых валацикловир при приеме внутрь быстро и почти полностью превращается в ацикловир — предположительно, за счет ферментативного гидролиза в кишечнике и печени (уже при первом прохождении). В отличие от ацикловира, валацикловир связывается в кишечнике и почках с белка-ми-переносчиками (Ganapathy et al., 1998). При приеме в виде валацикловира относительная биодоступность ацикловира возрастает в 3—5 раз, достигая 70% (Steingrimsdottir et al., 2000). Максимальная сывороточная концентрация ацикловира достигается через 2 ч после однократного приема 1 г валацикловира и составляет 5—6 мкг/мл. При приеме по 2 г валацикловира 4 раза в сутки максимальная и минимальная сывороточные концентрации ацикловира составляют соответственно 8,4 и 2,5 мкг/мл, приближаясь к таковым при в/в введении ацикловира (Jacobson et al., 1994). Максимальная сывороточная концентрация валацикловира в 25 раз меньше, чем ацикловира.
Большая часть препарата элиминируется в виде ацикловира, в моче обнаруживают менее 1% введенной дозы валацикловира.
Ацикловир проникает во многие биологические жидкости, в том числе в содержимое везикул при ветряной оспе, водянистую влагу и СМЖ. Его концентрация в слюне гораздо ниже сывороточной, а во влагалищном отделяемом она может колебаться в широких пределах. Ацикловир накапливается в молоке, околоплодных водах и плаценте. Сывороточные концентрации ацикловира у новорожденного и у матери примерно одинаковы (Frenkel et al., 1991). Через кожу ацикловир всасывается незначительно.
Т1/2 ацикловира составляет в среднем 2,5 ч, хотя у взрослых с нормальной функцией почек этот показатель может колебаться от 1,5 до 6 ч. У новорожденных Т1/2 ацикловира — около 4 ч, а при почечной недостаточности может достигать 20 ч (Blum et al., 1982). Ацикловир выводится в неизмененном виде, главным образом почками — путем клубочковой фильтрации и канальцевой секреции. Менее 15% введенной дозы выводится в виде 9-карбоксиметоксиметилгуанина или других метаболитов. При беременности фармакокинетика ацикловира и валацикловира при приеме внутрь существенно не меняется (Kimberlin et al., 1998).
Побочные эффекты
Как правило, ацикловир переносится хорошо. Мазь с ацикловиром на основе полиэтиленгликоля может вызывать раздражение слизистой половых органов и чувство жжения.
При приеме внутрь ацикловир изредка вызывает головную боль, головокружение, сыпь и понос. Еще реже отмечаются почечная недостаточность и нейротоксическое действие. Уже более 5 лет ацикловир успешно применяют для профилактики рецидивов герпеса половых органов (Goldberg et al., 1993). У женщин, принимавших ацикловир во время беременности, нарушения развития плода отмечались не чаще, чем в контрольной группе (ReifT-Eldridge et al., 2000). Вапацикловир переносится почти так же хорошо, как ацикловир. Сходны и побочные эффекты — тошнота, головная боль, понос. Высокие дозы валацикловира могут вызывать спутанность сознания, галлюцинации, поражение почек и, очень редко тяжелую тромбоцитопе-нию, которая при снижении иммунитета может представлять угрозу для жизни (Feinberg et al., 1998).
Основные дозолимитирующие побочные эффекты ацикловира для в/в введения — почечная недостаточность и поражение ЦНС. Их риск возрастает, если функция почек была уже нарушена до начала лечения, препарат назначен в высокой дозе, а его сывороточная концентрация превышает 25 мкг/мл.
Примерно у 5% больных развивается обратимое поражение почек, вызванное, вероятно, кристаллизацией препарата в различных отделах нефрона (так называемая кристаллическая нефропатия) (Sawyer et al., 1988). На нее указывают тошнота, рвота, боль в пояснице, нарастающая азотемия. Факторы риска — быстрое введение препарата, обезвоживание и снижение диуреза. Инфузию следует проводить с постоянной скоростью в течение по меньшей мере часа. Как правило, функция почек восстанавливается после отмены ацикловира и восполнения ОЦК. Нейротоксическое действие отмечено у 1—4% больных. При этом могут наблюдаться спутанность сознания, тремор, миоклония, судороги и признаки экстрапирамидных расстройств (Haefeli et al., 1993). В тяжелых случаях может потребоваться гемодиализ. Описаны также флебиты (при попадании ацикловира в окружающие ткани), сыпь, потливость, тошнота, артериальная гипотония и интерстициальный нефрит.
Рисунок 50.2. Механизм действия ацикловира. Под действием вирусной тимидинкиназы из ацикловира образуется ацикловирмонофосфат, который фосфорилируется клеточными киназами с образованием ди-, а затем трифосфата. Фосфорилирование ацикловира происходит лишь в клетках, инфицированных герпесвирусами, поскольку такие клетки содержат тимидинки-назу. В неинфицированных клетках ацикловир почти не активируется. Ацикловиртрифосфат встраивается в синтезируемую в ходе репликации цепь вирусной ДНК и образует неактивный комплекс с вирусной ДНК-полимеразой. В результате репликация ДНК прекращается. Elion, 1986.
В сочетании с зидовудином ацикловир может вызывать резкую сонливость. При назначении ацикловира вместе с циклоспорином или другими препаратами с выраженным нефроток-сическим действием риск поражения почек увеличивается. Пробенецид уменьшает почечный клиренс и увеличивает Т1/2 ацикловира. В свою очередь, ацикловир может уменьшать почечный клиренс препаратов, которые выводятся путем канальцевой секреции, например метотрексата.
Применение
У больных с нормальным иммунитетом ацикловир более эффективен при первичном герпесе, чем при рецидивах, которые обычно протекают легче (Whitley and Gnann, 1992). Ацикловир особенно важен при лечении инфекций, вызванных вирусами простого герпеса и varicella-zoster, у больных с нарушенным иммунитетом, поскольку эти инфекции у них возникают чаще и протекают тяжелее. Вирус varicella-zoster менее чувствителен к ацикловиру, поэтому при ветряной оспе и опоясывающем лишае дозу увеличивают. При герпесе валацикловир действует не хуже, а при опоясывающем лишае — лучше ацикловира.
Герпес. При первичном герпесе половых органов назначают ацикловир (200 мг 5 раз в сутки в течение 10 сут) или валацикловир (1 г 2 раза в сутки в течение 10 сут) внутрь: при этом уменьшается выделение вируса, улучшается самочувствие больного и скорее наступает выздоровление (Fife et al., 1997). При тяжелом течении заболевания показано в/в введение ацикловира — по 5 мг/кг 3 раза в сутки. При местном применении ацикловир действует гораздо слабее, чем при системном. Однако ни одна из схем лечения не гарантирует защиту от рецидивов. Рецидив герпеса половых органов разрешался на 1—2 сут быстрее, если больные самостоятельно начинали принимать внутрь ацикловир по 200 мг 5 раз в сутки в течение 5 сут или валацикловир по 0,5—1 г 2 раза в сутки в течение 5 сут (Tyring etal., 1998b). Местное применение ацикловира при рецидивах герпеса половых органов не помогает. При частых рецидивах эффективен длительный прием ацикловира (по 400 мг 2 раза в сутки или 200 мг 3 раза в сутки; Goldberg et al., 1993) или валацикловира (0,5—1 г 1 раз в сутки; Patel et al., 1997). При этом частота рецидивов снижается примерно в 10 раз, так что у большинства больных новое обострение наступает не ранее чем через 5 лет. Тем не менее даже в отсутствие признаков инфекции вирус может выделяться в окружающую среду и передаваться при половом акте. Длительный прием ацикловира рекомендуют также при тяжелых рецидивах герпетического панариция и спровоцированной герпесом полиморфной экссудативной эритеме.
Прием ацикловира внутрь хорошо помогает при первичном герпесе лица и полости рта (по 600 мг/м2 4 раза в сутки в течение 10 сут для детей), но при рецидивах он малоэффективен; слабо действует в этом случае и мазь с ацикловиром. Более надежным средством при рецидивах герпеса лица и полости рта или герпеса половых органов могут стать кремы с ацикловиром (еще не поступили в продажу в США). Профилактический прием ацикловира внутрь (по 400 мг 2 раза в сутки в течение недели) почти в 4 раза снижает частоту рецидивов герпеса лица и полости рта, возникающих под действием солнечного излучения (Spruance et al., 1988).
При герпесе кожи и слизистых у больных с ослабленным иммунитетом в/в введение ацикловира (по 250 мг/м2 3 раза в сутки в течение недели) ускоряет заживление, уменьшает продолжительность болевого синдрома и выделения вируса (Wade et al., 1982). Препарат назначают и внутрь (по 800 мг 5 раз в сутки). После отмены лечения герпес нередко появляется вновь — таким больным показан длительный профилактический прием ацикловира. Если высыпания локализуются только на губах или только на лице, можно назначить ацикловир для местного применения. В/в введение ацикловира рекомендуют при висцеральных формах герпеса на фоне иммунодефицита, а также при ожогах, осложненных герпесом.
Таблица 50.3. Фармакокинетика некоторых препаратов, действующих на герпесвирусы
|
Показатель |
Ацикловир |
Фамцикловир (пенцикловир) |
Ганцикловир |
Цидофовир |
Фоскарнет |
|
Биодоступность при приеме внутрь, % |
10-30 |
65-77 |
<10 |
<5 |
9-17 |
|
Влияние приема пиши на ПФК |
Уменьшается (на 18% при обильном приеме пиши) |
Незначительно |
Увеличивается (на 20%) |
Не установлено | |
|
Т1/2 в плазме, ч |
2,5-3 |
2 |
2-4 |
2-3 |
4—8 (начальный) |
|
Т1/2 трифосфата внутри клетки,ч |
Около 1 |
7-20 |
>24 |
17-65 |
— |
|
Соотношение концентраций в СМЖ и плазме (в среднем) |
0,5 |
Не установлено |
0,2-0,7 |
Не установлено |
0,7 |
|
Связывание с белками плазмы, % |
9-33 |
<20 |
1-2 |
<6 |
15 |
|
Метаболизм |
Около 15% |
Около 5% |
Незначителен |
Незначителен |
Незначителен |
|
Выведение почками (в неизмененном виде), % |
60-90 |
70 |
>90 |
>90 |
>80 |
|
Коррекция дозы |
СКФ<50 (в/в) СКФ<25 (внутрь) |
СКФ<60 |
СКФ<80 |
С>1,5 СКФ<55 |
СКФ<58-67 |
Ацикловир для системного применения с успехом используют для профилактики герпеса кожи и слизистых у серопозитивных больных, получающих иммуносупрессивную терапию. Так, в/в введение ацикловира (по 250 мг/м2 2—3 раза в сутки в течение нескольких недель), начатое еще до трансплантации, предупреждает герпес у реципиентов костного мозга. Больным, способным принимать препараты внутрь, назначают пероральные препараты ацикловира (по 400 мг 5 раз в сутки). Длительный прием препарата внутрь (по 200—400 мг 3 раза в сутки в течение 6 мес) снижает также риск инфекций, вызванных вирусом varicella-zoster (Steer et al., 2000). Кроме того профилактический прием ацикловира эффективен у реципиентов внутренних органов и у больных, получающих химиотерапию.
В/в введение ацикловира при герпетическом энцефалите (по 10 мг/кг 3 раза в сутки в течение как минимум 10 сут) уменьшает смертность более чем в 2 раза. Ацикловир в большей степени, чем видарабин, уменьшает частоту и тяжесть остаточных неврологических дефектов после перенесенного герпетического энцефалита (Whitley etal., 1986). Иногда рекомендуют более высокие дозы ацикловира (по 15—20 мг/кг в/в 3 раза в сутки в течение 3 нед). Так, при герпесе новорожденных ацикловир в/в в высокой дозе (по 20 мг/кг 3 раза в сутки в течение 3 нед) действовал эффективнее, чем в низкой (Kimberlin et al., 1999). У новорожденных, больных с ослабленным иммунитетом и, очень редко, у ранее здоровых людей после отмены ацикловира могут возникать рецидивы энцефалита; по-видимому, их можно избежать, назначая ацикловир более длительным курсом.
Существует глазная мазь с ацикловиром (в США в продаже нет); при герпетическом кератоконъюнктивите она действует по меньшей мере не хуже видарабина и трифлуридина для местного применения.
На фоне иммунодефицита устойчивые к ацикловиру штаммы вируса могут вызывать обширные поражения кожи и слизистых, а в редких случаях — менингоэнцефалит, пневмонию и поражение других внутренних органов. У больных с нормальным иммунитетом устойчивые штаммы обнаруживаются редко, тогда как при иммунодефиците их выделяют от 6—17% больных, получающих ацикловир (Christophers et al., 1998; Englund et al., 1990). Рецидивы, возникающие после отмены препарата, чаще обусловлены штаммами, чувствительными к ацикловиру, но у больных с ВИЧ-инфекцией рецидив могут вызвать и устойчивые штаммы. Локализованные инфекции, вызванные устойчивыми штаммами, иногда после окончания лечения ацикловиром проходят самостоятельно. Если заболевание прогрессирует, назначают фоскарнет в/в. Видарабин при этом почти неэффективен (Safrin et al., 1991).
Инфекции, вызванные вирусом varicella-zoster. При ветряной оспе у детей и взрослых ацикловир помогает, если его прием начинают в первые сутки после появления сыпи. У детей весом до 40 кг, получающих ацикловир (по 20 мг/кг внутрь 4 раза в сутки в течение 5 сут), на 1 сут раньше прекращается лихорадка и образование новых элементов сыпи. При неосложненной ветряной оспе у детей ацикловир обычно не назначают, за исключением случаев, когда есть риск, что заболевание может принять более тяжелое течение (например, когда в семье уже есть ребенок, больной ветряной оспой; у детей, страдающих хроническими кожными или легочными заболеваниями; у детей, получающих глюкокортикоиды или длительное лечение салицилатами; у детей старше 12 лет) (Committee on Infectious Diseases, 2000). У взрослых, начавших принимать ацикловир в первые сутки после появления сыпи (по 800 мг 5 раз в сутки в течение недели), примерно на 2 сут раньше образуются корки, а количество высыпаний уменьшается вдвое. Уменьшается при этом и продолжительность лихорадки (Wallace etal., 1992). В более поздние сроки назначение ацикловира не имеет смысла. В/в введение ацикловира помогает при ветряночной пневмонии и энцефалите у ранее здоровых взрослых.
Для профилактики ветряной оспы рекомендуют прием ацикловира внутрь по 10 мг/кг 4 раза в сутки в течение недели (с 7-го по 14-й дни) после контакта с больным (Kumagai et al., 1999).
При опоясывающем лишае с ограниченными высыпаниями у пожилых ацикловир (по 800 мг внутрь 5 раз в сутки в течение недели) уменьшает боль и ускоряет выздоровление при условии, что прием препарата начинают в течение первых 3 сут с появления высыпаний (Wood et щ al., 1998). При глазной форме опоясывающего лишая лечение ацикловиром снижает частоту осложнений (в частности, кератита и иридоциклита) (Cobo et al., 1986). При приеме ацикловира в сочетании с преднизоном в течение 3 нед состояние больных опоясывающим лишаем улучшается и выздоровление наступает скорее, чем при монотерапии этими препаратами (Whitley et al., 1996). При опоясывающем лишае у лиц старше 50 лет боль проходит быстрее при приеме валацикловира (по 1 г 3 раза в сутки в течение 7 сут), чем ацикловира (Beutner et al.,1995).
При опоясывающем лишае на фоне иммунодефицита ацикловир в/в (по 500 мг/м2 3 раза в сутки в течение недели) снижает частоту диссеминированного поражения кожи и внутренних органов. Кроме того, уменьшается выделение вируса, ускоряется заживление, а при диссеминированном поражении сокращается срок пребывания в стационаре. У детей при ветряной оспе на фоне иммунодефицита в/в введение ацикловира также ускоряет выздоровление и снижает риск поражения внутренних органов.
От ВИЧ-инфицированных детей и взрослых устойчивые к ацикловиру штаммы вируса varicella-zoster выделяют нечасто. На коже у таких больных могут возникать и длительно сохраняться папулы, покрытые роговыми наслоениями и напоминающие бородавки. Описана также менингорадикулопатия. При инфекциях, вызванных устойчивыми штаммами varicella-zoster, может быть эффективно в/в введение фоскарнета.
Другие вирусы. При лечении цитомегаловирусных инфекций ацикловир малоэффективен, однако его применяют для профилактики таких инфекций у лиц с ослабленным иммунитетом. При трансплантации костного мозга серопозитивным реципиентам в/в введение высоких доз ацикловира (по 500 мг/м2 3 раза в сутки в течение 1 мес) примерно в 2 раза снижает частоту цитомегалови-русной инфекции, а в сочетании с длительным приемом ацикловира внутрь (по 800 мг 4 раза в сутки в течение 6 мес) — увеличивает выживаемость (Prentice et al., 1994). Прием высоких доз ацикловира внутрь в течение 3 мес может снижать частоту цитомегаловирусной инфекции у реципиентов внутренних органов. Показано, что при приеме валацикловира (по 2 г 4 раза в сутки в течение 3 мес) у серонегативных реципиентов после трансплантации почки от серопозитивного донора реже развивались цитомегаловирусная и другие инфекции, а также снижался риск острого отторжения трансплантата (Lo-wance et al., 1999). Валацикловир в высокихдозах эффективнее ацикловира снижает риск цитомегаловирусной инфекции на поздних стадиях ВИЧ-инфекции. Однако валацикловир более токсичен и, по-видимому, уступает ацикловиру с точки зрения влияния на выживаемость (Feinberg et al., 1998).
При инфекционном мононуклеозе ацикловир оказывает лишь кратковременное противовирусное действие, не вызывая заметного улучшения состояния. Ацикловир может быть эффективен при волосатой лейкоплакии рта, вызванной вирусом Эпштейна—Барр.
Цидофовир
Строение и противовирусная активность
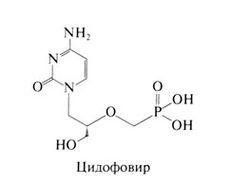
Цидофовир, или 1-[(S)-3-гидрокси-2-(фосфоно-метокси)-пропил]цитозин дигидрат, — фосфонометиловый эфир цитозина — действует на вирусы папилломы человека, герпесвирусы, полиомавирусы, поксвирусы и аденовирусы (Hitchcock et al., 1996). In vitro цидофовир действует на цитомегаловирус в концентрации ниже 0,2— 0,7 мкг/мл, на вирус простого герпеса — в концентрации 0,4— 33 мкг/мл, на аденовирусы — в концентрации 0,02—17 мкг/мл. Цидофовир фосфорилируется клеточными, а не вирусными ферментами, поэтому он действует на устойчивые к ацикловиру штаммы вирусов простого герпеса и varicella-zoster, у которых снижена активность тимидинкиназы. Цидофовир активен также в отношении устойчивых к ганцикловиру штаммов цитомегаловируса с мутациями гена вирусной протеинкиназы UL97 (но не гена ДНК-полимеразы) и некоторых штаммов цитомегаловируса, устойчивых к фоскарнету. При сочетании цидофовира с ганцикловиром или фоскарнетом действие препаратов на цитомегаловирус взаимно усиливается. Структурная формула цидофовира следующая:
Механизм действия и устойчивость
Цидофовир подавляет синтез вирусной ДНК, замедляя и в конце концов останавливая ее репликацию. Под действием клеточных ферментов цидофовир фосфорилируется с образованием активного дифосфата, при этом концентрация фосфорилированных метаболитов в зараженных и незараженных клетках одинакова. Цидофовирдифосфат одновременно ингибирует вирусную ДНК-полимеразу (выступая конкурентом дезокси-ЦТФ) и служит ее субстратом. Он надолго остается внутри клетки, причем чувствительность ДНК-полимераз цитомегаловируса и вирусов простого герпеса к цидофовиру в 8—600 раз выше, чем Д Н К-полимеразы человека (Hitchcock et al., 1996). Для фосфохолинового производного цидофовира Т1/2 внутри клетки составляет около 87 ч, поэтому он может служить внутриклеточным депо препарата. Таким образом, цидофовир можно принимать достаточно редко — при экспериментальных инфекциях, вызванных вирусами простого герпеса, varicella-zoster и поксвирусами, он давал эффект уже при однократном приеме.
Устойчивость цитомегаловируса к цидофовиру обусловлена мутациями вирусной ДНК-полимеразы. Через 3 мес лечения цидофовиром умеренно устойчивые штаммы цитомегаловируса к препарату выделяли лишь у некоторых больных (Jabs et al 1998). Штаммы цитомегаловируса с высокой устойчивостью к ганцикловиру, обусловленной мутациями генов ДНК-полимеразы и вирусной протеинкиназы UL97, устойчивы и к цидофовиру, то есть устойчивость к цидофовиру может возникнуть при лечении ганцикловиром. Устойчивость к цидофовиру проявляют и некоторые штаммы цитомегаловируса, устойчивые к фоскарнету. Описаны штаммы с мутациями ДНК-полимеразы, которые проявляют устойчивость ко все трем препаратам (Tataro-wiczetal., 1992).
Фармакокинетика
При физиологических значениях pH цидофовир существует в растворе в виде дианиона, поэтому его биодоступность при приеме внутрь очень низка (Cundy, 1999). При в/в введении сывороточная концентрация цидофовира описывается двухфазной кривой с конечным Т1/2 около 2,6 ч (Cundy et al., 1995b). Объем распределения цидофовира приближается к общему объему жидкости в организме. Насколько хорошо цидофовир проникает в ЦНС и ткани глаза, не установлено. Имеется сообщение о низком уровне цидофовира в СМЖ у больного прогрессирующей мультифокальной лейкоэнцефалопатией. При местном лечении обширных поражений кожи и слизистых гелем цидофовира последний иногда обнаруживают в неболь-шиой концентрации (< 0,5 мкг/мл) в плазме (Lalezari et al 1997).
Цидофовир выводится путем клубочковой фильтрации и канальцевой секреции. Более 90% введенной дозы экскретируется с мочой в неизмененном виде. С помощью системы канальцевого транспорта органических анионов цидофовир попадает в клетки эпителия проксимальных почечных канальцев (Hoet al., 2000). Ингибитор канальцевого транспорта пробенецид в больших дозах (2 г внутрь за 3 ч до введения цидофовира и по 1 г внутрь через 2 и 8 ч после введения цидофовира) препятствует канальцевой секреции цидофовира, тем самым уменьшая его почечный клиренс и нефротоксичность. На фоне приема про-бенецида канальцевая секреция цидофовира (в дозе 5 мг/кг) полностью подавляется, и максимальная сывороточная концентрация последнего возрастаете 11,5 до 19,6 мкг/мл. При почечной недостаточности скорость выведения цидофовира прямо пропорциональна СКФ. У больных, находящихся на постоянном амбулаторном перитонеальном диализе, Т j«2 цидофовира возрастает до 32,5 ч. При этой процедуре, как и при гемодиализе, удаляется более 50% введенной дозы (Cundy, 1999).
Побочные эффекты
Дозолимитирующий побочный эффект при в/в введении цидофовира — нефротоксичность, которая проявляется нарушением функции проксимальных канальцев — протеинурией, азотемией, глюкозурией, метаболическим ацидозом; в редких случаях развивается синдром Фанкони. Для снижения нефротоксичности перед каждой инфузией цидофовира вводят физиологический раствор в/в и одновременно назначают пробенецид (см. выше). На фоне поддерживающей терапии в дозе 5 мг/кг 1 раз в 2 нед у 50% больных отмечается протеинурия, у 10—15% — повышается сывороточная концентрация креатинина, у 15—20% — возникает нейтропения. На фоне в/в введения цидофовира часто развивается иридоциклит, при котором помогает местное применение глюкокортикоидов и М-холиноблокаторов. Изредка понижается внутриглазное давление (Ambati et al., 1999). Принимаемый вместе с цидофовиром пробенецид может вызывать желудочно-кишечные нарушения, общие симптомы и аллергические реакции, в том числе лихорадку, сыпь и, в редких случаях, анафилактический шок. Переносимость пробенецида улучшается при приеме во время еды и предварительном назначении противорвотных средств, Нд-блокаторов и парацетамола.
Пробенецид (но не цидофовир) замедляет элиминацию зидовудина, поэтому в те дни, когда больной получает пробенецид, дозу зидовудина следует снижать. Пробенецид влияет на элиминацию и многих других препаратов, в том числе (бета-лактамных антибиотиков, НПВС, ацикловира, лоразепама, фуросемида, метотрексата, теофиллина, рифампицина, поэтому может потребоваться коррекция их дозы. Вместе с цидофовиром нельзя назначать другие нефротоксичные препараты, а после аминогликозидов, пентамидина (в/в), амфотерицина В, фоскарнета, НПВС или рентгеноконтрастных средств цидофовир рекомендуется назначать не ранее чем через неделю. Одновременное введение цидофовира в/в и прием ганцикловира внутрь в полных дозах не рекомендуется из-за плохой переносимости.
При местном применении цидофовира могут возникать дозозависимые жжение, зуд и боль (до 33% больных), изредка образуются язвы (Lalezari et al., 1997). Инъекции цидофовира в стекловидное тело противопоказаны, так как они могут приводить к абсцессу стекловидного тела, снижению внутриглазного давления и слепоте.
Поданным доклинических испытаний, цидофовир оказывает мутагенное, тератогенное, эмбриотоксическое и гонадотоксическое действие. У крыс выявлен канцерогенный эффект; у обезьян такой эффект не обнаружен, но тем не менее нельзя исключить его и у человека. Цидофовир может вызывать бесплодие. При беременности он противопоказан.
Применение
Цидофовир разрешен к применению при цитомегаловирусном ретините у ВИЧ-инфицированных. У ранее нелеченных больных, а также при плохой переносимости или неэффективности ганцикловира и фоскарнета введение цидофовира (по 5 мг/кг в/в 1 раз в неделю в течение 2 нед с последующим переходом к введению поддерживающей дозы 1 раз в 2 нед) замедляло прогрессирование цитомегаловирусного ретинита (Lalezari et al., 1998; Safrin et al., 1997). В то же время лечение цидофовиром может не приводить к полному исчезновению цитомегаловируса из крови. Поддерживающая доза 5 мг/кг эффективнее, чем 3 мг/кг, но хуже переносится (Anonymous, 1997). Цидофовир в/в применяли для лечения устойчивого к ацикловиру герпеса кожи и слизистых (Lalezari et al., 1994), аденовирусной инфекции после трансплантации внутренних органов, атакже прогрессирующей мультифокальной лейкоэнцефалопатии и контагиозного моллюска у ВИЧ-инфицированных.
У некоторых ВИЧ-инфицированных с устойчивым к ацикловиру герпесом кожи и слизистых при применении геля цидофовира прекращалось выделение вируса, заживали язвы и эрозии (Lalezari et al., 1997). Гель цидофовира применяли и для лечения остроконечных кондилом, контагиозного моллюска на фоне иммунодефицита, дисплазии шейки матки. Введение цидофовира в очаги поражения помогало при папилломатозе гортани у взрослых и детей (Snoeck et al., 1998). Изучается эффективность местного применения цидофовира при аденовирусном кератоконъюнктивите.
Докозанол
Докозанол — это длинноцепочечный насыщенный спирт, который в США разрешен к применению при рецидивах герпеса лица и полости рта. Препарат выпускается в виде 10% крема и продается без рецепта. In vitro миллимолярных концентраций докозанола достаточно, чтобы подавить размножение многих вирусов с липидной внешней оболочкой, в том числе вирусов простого герпеса. По-видимому, докозанол препятствует слиянию мембран вируса и клетки-хозяина, и вирус лишается возможности проникнуть в клетку (Pope et al., 1998). Докозанол хорошо переносится, и если лечение начато в продромальный период или в течение 12 ч от появления первых высыпаний, то выздоровление наступает примерно на сутки раньше (Anonymous, Medical Letter, 2000). На более поздних стадиях докозанол неэффективен.
Фамцикловир и пенцикловир
Строение и противовирусная активность
Фамцикловир представляет собой диацетильный эфир 6-дезоксипенцикловира и сам по себе не обладает противовирусной активностью. Пенцикловир — 9-14-гидрокси-3-гидроксиметилбут-1-ил]гуанин — это ациклический аналог гуанозина. Его структурная формула следующая:
Как и ацикловир, пенцикловир действует главным образом на вирусы простого герпеса и varicella-zoster (Boyd et al., 1993), но отличается строением бокового радикала, в котором есть дополнительная гидроксиметильная группа, а кислород замещен на углерод. Концентрация, в которой пенцикловир действует на эти вирусы, зависит от типа клеток и обычно почти вдвое превышает таковую для ацикловира (Boyd et al., 1993). Кроме того, пенцикловир действует на вирус гепатита В.
Механизм действия и устойчивость
Пенцикловир подавляет синтез вирусной ДНК. В клетках, зараженных вирусами простого герпеса и varicella-zoster, он сначала фосфорилируется вирусной тимидинкиназой, а затем собственными киназами клетки с образованием пенцикловиртрифосфата, который служит конкурентным ингибитором вирусной ДНК-полимеразы (Vere Hodge, 1993) (рис. 50.2). По действию на вирусную ДНК-полимеразу пенцикловиртрифосфат уступает ацикловиртрифосфату почти в 100 раз, но благодаря более высокой концентрации и более длительному Т1/2 внутри клетки (7—20 ч) противовирусная активность пенцикловиртрифосфата сохраняется гораздо дольше, чем ацикловиртрифосфата. За счет наличия гидроксильной группы в 3'-положении пенцикловир может замедлять репликацию ДНК, но все же полностью ее не прерывает.
В клинике устойчивость к пенцикловиру встречается редко, хотя в перевиваемой культуре клеток удается получить устойчивые штаммы; у них выявляются мутации ДНК-полимеразы или тимидинкиназы. В последнем случае вирус простого герпеса устойчив также к пенцикловиру.
Фармакокинетика
В отличие от пенцикловира, биодоступность которого при приеме внутрь невысока (5%), фамцикловир хорошо всасывается. При всасывании в кишечнике и далее, при первом прохождении через печень, он быстро превращается в пенцикловир за счет деацетилирования бокового радикала и окисления пуринового кольца (Gill and Wood, 1996). Поэтому, хотя сам пенцикловир всасывается плохо, при приеме в виде фамцикловира его биодоступность возрастает до 65—77%. При приеме фамцикловира во время еды всасывание замедляется, но в целом биодоступность при этом не снижается. При однократном приеме 250 или 500 мг фамцикловира максимальная сывороточная концентрация пенцикловира составляет 1,6 и 3,3 мкг/мл соответственно. Фамцикловир в плазме не определяется; обнаруживают лишь следовые количества 6-дезоксипенцикловира (предшественника пенцикловира). При в/в введении пенцикловира в дозе 10 мг/кг его максимальная сывороточная концентрация составляет в среднем 12 мкг/мл. Объем распределения пенцикловира примерно в 2 раза превышает общий объем жидкости в организме, а Т1/2 в среднем составляет 2 ч. При в/в введении более 90% пенцикловира выводится с мочой в неизмененном виде, вероятно, путем клубочковой фильтрации и канальцевой секреции. При приеме внутрь фамцикловира внепочечные механизмы (в основном экскреция с калом) отвечают за элиминацию примерно 10% дозы. Пенцикловир и 6-дезоксипенцикловир при этом выводятся преимущественно с мочой; на долю этих веществ приходится соответствнно 60% и менее 10% принятой дозы фамцикловира. При почечной недостаточности (СКФ < 30 мл/мин) Т1/2 пенцикловира возрастает в среднем до 9,9 ч; он легко удаляется при гемодиализе. При компенсированной хронической печеночной недостаточности снижается минимальная сывороточная концентрация пенцикловира, но его биодоступность остается прежней (Boike et al., 1994).
Побочные эффекты
Фамцикловир переносится хорошо, но иногда при его приеме возникают головная боль, тошнота и понос (Saltzman et al., 1994). При кратких курсах лечения переносимость фамцикловира такая же, как у ацикловира. Из побочных эффектов описаны также крапивница, сыпь, а у пожилых — галлюцинации и спутанность сознания. Препараты пенцикловира для местного применения на основе 40-процентного про-пиленгликоля и цетомакрогола изредка (около 1%) вызывают контактный дерматит и изъязвления.
In vitro пенцикловир в высоких концентрациях обладает мутагенным действием. В экспериментах на животных установлено, что при длительном введении фамцикловир оказывает канцерогенное действие, угнетает сперматогенез и вызывает бесплодие у грызунов и собак. В то же время у человека при длительном приеме (в течение года) угнетения сперматогенеза не отмечалось (Sacks et al., 1998). У животных фамцикловир не оказывал тератогенного действия, но у человека его безопасность во время беременности не установлена.
Клинически значимых взаимодействий фамцикловира или пенцикловира с другими препаратами до настоящего времени не выявлено (Gill and Wood, 1996).
Применение
Во многих странах фамцикловир внутрь и пенцикловир местно и в/в разрешены для лечения простого герпеса и инфекций, вызванных вирусом varicella-zoster (Sacks and Wilson, 1999). При приеме внутрь (по 250 мг 3 раза в сутки в течение 5—10 сут) фамцикловир столь же эффективен при первичном герпесе половых органов, как и ацикловир (Loveless et al., 1997). При рецидивах герпеса половых органов больной может начать прием фамцикловира самостоятельно (по 125 или 250 мг внутрь 2 раза в сутки в течение 5 сут): при этом выздоровление наступает примерно на 1 сут раньше, чем в отсутствие лечения. Для профилактики рецидивов герпеса половых органов фамцикловир назначают по 250 мг внутрь 2 раза в сутки в течение года; при приеме 1 раз в сутки его эффективность ниже (Diaz-Mitoma et al., 1998). В более высокой дозе (по 500 мг внутрь 2 раза в сутки) фамиикловир предотвращает рецидивы герпеса у ВИЧ-инфицированных. При герпесе кожи и слизистых на фоне иммунодефицита пенцикловир по 5 мг/кг в/в 2—3 раза в сутки в течение недели действует так же хорошо, как и ацикловир при в/в введении (Lazarus et al., 1999). У больных с нормальным иммунитетом рецидивы герпеса лица и полости рта проходят примерно на I сут раньше при применении 1% крема пенцикловира (каждые 2 ч в течение 4 сут в дневные часы) (Spruance et al., 1997).
При опоясывающем лишае у взрослых с нормальным иммунитетом (особенно у лиц старше 50 лет) фамцикловир (по 500 мг внутрь 3 раза в сутки в течение 10 сут) по меньшей мере сталь же эффективен, как ацикловир (по 800 мг внутрь 5 раз в сутки): оба препарата ускоряют выздоровление и снимают боль, если их назначить в первые 3 дня после появления симптомов (Degreef et al., 1994).
У пожилых при опоясывающем лишае фамцикловир менее эффективен, чем валацикловир (Tyring et al., 2000) Прием фамцикловира внутрь (по 500 мг 3 раза в сутки в течение 10 сут) при опоясывающем лишае на фоне иммунодефицита и при глазной форме опоясывающего лишая не уступает по эффективности приему внутрь больших доз ацикловира (Tyring et al., 1998а).
При хроническом гепатите В прием фамцикловира вызывает дозозависимое снижение концентрации вирусной ДНК и активности аминотрансфераз в сыворотке (Тгеро et al., 2000). Препарат применяли при рецидивах гепатита В после трансплантации печени, но все же у таких больных ламивудин действует лучше фамцикловира При инфекциях, вызванных устойчивыми к ламивудину штаммами вируса гепатита В (Mutimer et al., 2000), фамцикловир также не действует, так как устойчивость в таких случаях развивается сразу к нескольким препаратам.
Фомивирсен
Фомивирсен — фосфоротиоатный олигонуклеотид из 21 пары нуклеотидов — первый из антисмысловых олигонуклеотидов, разрешенных для лечения вирусных инфекций. Он комплементарен мРНК сверхранних генов цитомегаловируса и подавляет его репродукцию как специфически — связывая мРНК, так и неспецифически, в том числе препятствуя адсорбции вируса на клеточной мембране (Anderson et al., 1996). Фомивирсен действует на штаммы цитомегаловируса, устойчивые к ганцикловиру, фоскарнету и цидофовиру. В перевиваемой культуре клеток удавалось получить штаммы цитомегаловируса, чувствительность которых к фомивирсену была в 10 раз ниже, чем у исходных штаммов (Mulamba et al., 1998).
Инъекции фомивирсена в стекловидное тело при ци-томегаловирусном ретините назначают при непереносимости или неэффективности других препаратов (Perry and Balfour, 1999). У обезьян Ти2 фомивирсена в стекловидном теле составляет около 24 ч, а в сетчатке — до 78 ч (Leeds et al., 1998). Элиминация фомивирсена происходит путем разрушения тканевыми экзонуклеазами. Введение фомивирсена ВИЧ-инфицированным с тяжелым цитомегаловирусным ретинитом, который не поддается лечению и представляет угрозу для зрения, значительно замедляло прогрессирование заболевания. Препарат вводили по следующей схеме: 330 мкг 1 раз в неделю в течение 3 нед, затем I раз в 2 нед (в 1 -й и 15-й дни), затем 1 раз в месяц. Из местных побочных эффектов отмечали ирит (до 25% больных), поддающийся лечению глюкокорти-коидами для местного применения, абсцесс стекловидного тела, катаракту, повышение внутриглазного давления (у 15—20% больных). Лечение цидофовиром незадолго до введения фомивирсена повышает риск воспалительной реакции.
Фоскарнет
Строение и противовирусная активность
Фоскарнет (тринатрий фосфоноформат) — аналог неорганического пирофосфата, действующий на все герпесвирусы и ВИЧ (Oberg, 1989 WagsiafTand Bryson, 1994). Структурная формула фоскарнет следующая:
In vitro фоскарнет эффективен в концентрации 100—300 мкмоль/л в отношении цитомегаловируса и в концентрации 80—200 мкмоль/л в отношении других герпесвирусов, в том числе большинства штаммов цитомегаловируса, устойчивых к ганцикловиру, а также вирусов простого герпеса и varicella-zoster, устойчивых к ацикловиру. Фоскарнет и ганцикловир усиливают действие друг друга на цитомегаловирус in vitro.
В высоких концентрациях (500—1000 мкмоль/л) фоскарнет обратимо подавляет репликацию ДНК и пролиферацию незаряженных клеток.
Механизм действия и устойчивость
Фоскарнет угнетает репликацию вирусных нуклеиновых кислот, избирательно взаимодействуя с ДНК-полимеразой герпесвируса или обратной транскриптазой ВИЧ (Oberg, 1989; Chrisp and Clissold, 1991; рис. 50.1, А). Он медленно поступает в клетки, где почти не подвергается превращениям. Взаимодействуя с участком связывания пирофосфата вирусной ДНК-полимеразы, фоскарнет обратимо блокирует отщепление пирофосфата от дезокси-нуклеотидтрифосфатов. Сродство фоскарнета к ДНК-полимеразам герпесвирусов почти в 100 раз выше, чем к клеточной ДНК-полимеразе а.
Устойчивость герпесвирусов к фоскарнету обусловлена точечными мутациями гена вирусной ДНК-полимеразы. При этом активность препарата in vitro снижается в 3—7 раз (Safrin et al., 1994; Schmit and Boivin, 1999).
Фармакокинетика
Биодоступность фоскарнета при приеме внутрь невелика (табл. 50.3). При в/в введении фоскарнета по 60 мг/кг 3 раза в сутки максимальная и минимальная сывороточные концентрации составляют соответственно 450—575 и 80—150 мкмоль/л. Концентрация фоскарнета в стекловидном теле приближается к сывороточной концентрации (Arevalo et al., 1995), а в СМЖ — составляет в среднем 66% сывороточной концентрации (Hengge et al., 1993).
Более чем на 80% фоскарнет выводится в неизмененном виде почками путем клубочковой фильтрации и, по-видимому, канальцевой секреции. Клиренс фоскарнета изменяется пропорционально СКФ, поэтому даже при незначительном нарушении функции почек дозу следует уменьшать. Динамика сывороточной концентрации фоскарнета сложная, с двумя пиками в начальной фазе (начальный Т1/2 4—8 ч) и длительной конечной фазой (конечный Т1/2 около 3—4 сут). Часть препарата (10— 20%) откладывается в костной ткани, откуда затем постепенно высвобождается. При гемодиализе фоскарнет удаляется примерно на 50%.
Побочные эффекты
Основные дозолимитирующие побочные эффекты — нефротоксичность и гипокальциемия. Более чем у 50% бальных возрастает сывороточная концентрация креатинина, но после отмены фоскарнета она чаще всего возвращается к норме. Риск поражения почек возрастает при введении больших доз фоскарнета или быстрой его инфузии, обезвоживании, почечной недостаточности и одновременном назначении других препаратов с нефротоксическим действием. Описаны острый канальцевый некроз, кристаллическая нефропатия, нефрогенный несахарный диабет и интерстициальный нефрит. Введение физиологического раствора перед инфузией фоскарнета позволяет ослабить нефротоксическое действие.
При физиологических значениях pH фоскарнет сильно ионизирован, что нередко приводит к электролитным нарушениям — колебаниям концентраций кальция и фосфатов, гипомагниемии и гипокалиемии. Гипокальциемия может вызвать парестезию, аритмии, тетанию, а также эпилептические припадки и другие центральные нарушения. При одновременном введении фоскарнета и пентамидина риск клинически выраженной гипокальциемии возрастает. Парентеральное введение сульфата магния не устраняет ни вызванную фоскарнетом гипокал ьциемию, ни ее проявления (Huycke et al., 2000).
Центральные побочные эффекты включают головную боль (около 25% больных), тремор, раздражительность, эпилептические припадки и галлюцинации. Описаны генерализованная сыпь, лихорадка, тошнота, рвота, анемия, лейкопения, изменения ЭКГ и биохимических показателей функции печени, тромбофлебит и болезненные язвы половых органов. При местном применении фоскарнета возможны контактный дерматит и изъязвления, а при приеме внутрь — нарушения со стороны ЖКТ. По результатам доклинических испытаний, в высоких концентрациях фоскарнет обладает мутагенным действием и может вызывать аномалии развития зубов и скелета у животных. Безопасность фоскарнета во время беременности и у детей не установлена.
Применение
В/в введение фоскарнета помогает при цитомегаловирусном ретините (в том числе вызванном штаммами вируса, устойчивыми к ганцикловиру) и при инфекциях, вызванных устойчивыми к ацикловиру штаммами вирусов простого герпеса и varicella-zoster. Препарат эффективен и при других формах цитомегаловирус -ной инфекции (Wagstaff and Bryson, 1994). Фоскарнет плохо растворим в воде; в/в его вводят в большом объеме жидкости.
При в/в введении фоскарнета по 60 мг/кг 3 раза в сутки или по 90 мг/кг 2 раза в сутки в течение 2—3 нед с последующим переходом к длительной поддерживающей терапии в дозе 90—120 мг/кг 1 раз в сутки состояние стабилизировалось почти у 90% ВИЧ-инфицированных с ци-томегаловирусным ретинитом (Wagstaff and Bryson, 1994).
В сравнительных испытаниях установлено, что фоскарнет и ганцикловир у таких больных одинаково эффективны, но при лечении фоскарнетом выживаемость оказалась выше (Studies of Ocular Complications of AIDS Research Group, 1992) — возможно, вследствие его антиретровирусного действия (Bergdahl et al., 1998). Однако из-за побочных эффектов больные отказываются от лечения фоскарнетом в 3 раза чаще, чем от лечения ганцикловиром. При цитомегаловирусном ретините, не поддающемся монотерапии фоскарнетом и ганцикловиром, помогает сочетание этих препаратов (Anonymous, 1996). Фоскарнет эффективен и при других проявлениях цито-мегаловирусной инфекции у ВИЧ-инфицированных и у реципиентов внутренних органов, однако при цитомега-ловирусной пневмонии у реципиентов костного мозга монотерапия фоскарнетом неэффективна (Oberg, 1989). Для профилактики осложнений у реципиентов костного мозга, у которых выявлены антигены цитомегаловируса, фоскарнет (по 90 мг/кг в/в 2 раза в сутки в течение 15 сут) по меньшей мере столь же эффективен, как ганцикловир в/в (Moretti et al., 1998). Установлено, что у ВИЧ-инфицированных введение фоскарнета снижает частоту саркомы Капоши (Glesby etal., 1996). Фоскарнет можно вводить в стекловидное тело.
Фоскарнет можно назначать при устойчивом к ацикловиру герпесе кожи и слизистых, но в более низкой дозе, чем при цитомегаловирусной инфекции, — 40 мг/кг 3 раза в сутки в течение недели или дольше. При этом примерно у 75% больных прекращается выделение вируса и полностью заживают язвы и эрозии (Safrin et al., 1991). По-видимому, фоскарнет эффективен и при инфекциях, вызванных устойчивыми к ацикловиру штаммами вируса varicella-zoster. Крем с фоскарнетом не помогает при рецидивах герпеса половых органов у больных с нормальным иммунитетом, но эффективен при хронических инфекциях, вызванных устойчивыми к ацикловиру штаммами вируса простого герпеса, на фоне иммунодефицита (Javaly et al., 1999).
Низкая эффективность фоскарнета может быть связана с появлением устойчивых к нему штаммов герпесвирусов (Birch et al., 1992; Safrin et al., 1994).
Ганцикловир и валганцикловир
Строение и противовирусная активность
Ганцикловир или 9-[(1,3-дигидрокси-2-пропокси)метил]гуанин — ациклический аналог гуанозина, отличающийся от ацикловира лишь дополнительной гидроксиметильной группой в боковом радикале. Валганцикловир — это L-валиновый эфир ганцикловира. Структурная формула ганцикловира следующая:
Ганцикловир
Ганцикловир действует на все герпесвирусы, но наиболее активен в отношении цитомегаловируса (Noble and Faulds, 1998). На вирусы простого герпеса и varicella-zoster ганцикловир действует примерно в такой же концентрации, как ацикловир, а на цитомегаловирусы — в концентрации в 10—100 раз ниже по сравнению с ацикловиром (0,2—2,8 мкг/мл).
Концентрации ганцикловира, в которых он эффективен в отношении цитомегаловируса, близки к концентрациям, повреждающим клетки костного мозга. Следовательно, ганцикловир может вызывать угнетение кроветворения. В терапевтических концентрациях (1—10 мкг/мл) ганцикловир может так-I же подавлять пролиферацию лимфоцитов.
Механизм действия и устойчивость
Ганцикловир угнетает синтез вирусной ДНК. В клетке под действием вирусных ферментов (тимидинкиназы вируса простого герпеса либо протеинкиназы, кодируемой геном UL97цитомегаловируса) он превращается в ганцикловирмонофосфат. Ди- и трифосфаты ганцикловира образуются при участии клеточных ферментов. В клетках, зараженных цитомегаловирусом, концентрация ганцикловиртрифосфата по меньшей мере в 10 раз выше, чем в свободных от вируса. Ганцикловиртрифосфат конкурентно ингибирует вирусные ДНК-полимеразы (намного сильнее, чем клеточные) и встраивается в вирусную и клеточную ДНК вместо дезокси-ГТФ, что, в конце концов, останавливает репликацию (рис. 50.1, А и 50.2).
В последнее время разрабатывается новый подход к лечению злокачественных новообразований. С помощью вирусных векторов в опухолевые клетки вводят гены чувствительности к химиотерапевтическим препаратам, в частности ген тимидинкиназы вируса простого герпеса. Последующее введение ганцикловира запускает апоптоз опухолевых клеток (так называемое самоубийство клеток-мишеней) (Beltinger et al., 1999).
По сравнению с ацикловиртрифосфатом концентрация ган-цикловиртрифосфата внутри клетки в 10 раз выше и снижается гораздо медленнее (Т1/2 > 24 ч) (Biron et al., 1985). Возможно, именно этим объясняется более высокая активность ганцикловира в отношении цитомегаловируса. Длительный Тщ позволяет вводить препарат один раз в сутки.
Устойчивость цитомегаловируса к ганцикловиру обусловлена либо неполным фосфорилированием его в клетке вследствие мутаций вирусной протеинкиназы, кодируемой геном UL97, либо мутациями ДНК-полимеразы (Erice, 1999). В большинстве случаев для развития устойчивости достаточно мутаций только вирусной протеинкиназы (Stanat et al., 1991), реже — только ДНК-полимеразы. В наиболее устойчивых штаммах обнаруживаются мутации обоих генов; такие штаммы устойчивы также к цидофовиру и фоскарнету. На штаммы вируса простого герпеса, устойчивые к ацикловиру за счет низкой активности тимидинкиназы, ганцикловир также действует слабо. На устойчивые штаммы ганцикловир действует в концентрации в 4— 20 раз выше, чем на чувствительные.
Фармакокинетика
Биодоступность ганцикловира составляет в среднем 6—9% при приеме во время еды и несколько меньше при приеме натощак. Максимальная и минимальная сывороточные концентрации при приеме ганцикловира по 1 г 3 раза в сутки во время еды и натощак составляют соответственно 0,5—1,2 и 0,2—0,5 мкг/мл. Валганцикловир при приеме внутрь хорошо всасывается и быстро гидролизуется с образованием ганцикловира. При приеме в виде валганцикловира биодоступность ганцикловира возрастает до 61%. Прием внутрь 360 мг валганцикловира дает максимальную сывороточную концентрацию ганцикловира 3 мкг/мл, при этом сам валганцикловир обнаруживается в крови лишь в следовых количествах (Jung and Dorr, 1999). При приеме валганцикловира во время еды биодос-тупность ганцикловира повышается еще на 25%. При приеме большой дозы валганцикловира вскоре после еды биодоступность ганцикловира примерно такая же, как и при в/в введении (Brown et al., 1999). При в/в введении ганцикловира в дозе 5 мг/кг его максимальная и минимальная сывороточные концентрации составляют соответственно 8—11 и 0,6—1,2 мкг/мл. При этом концентрация ганцикловира в стекловидном теле такая же, как в плазме, или даже выше (в среднем около 1 мкг/мл) (Arevalo et al., 1995). Т1/2 ганцикловира в стекловидном теле - 23—26 ч. При использовании внутриглазных имплантатов с замедленным высвобождением ганцикловира его концентрация в стекловидном теле может достигать 4,1 мкг/мл.
При нормальной функции почек Т1/2 ганцикловира в плазме составляет 2—4 ч. Более 90% препарата выводится почками в неизмененном виде путем клубочковой фильтрации и канальцевой секреции. Поэтому Т1/2 в плазме почти линейно возрастает с уменьшением СКФ и при тяжелой почечной недостаточности может достигать 28—40 ч.
Побочные эффекты
Основной дозолимитирующий побочный эффект — угнетение кроветворения. У 15—40% больных отмечается нейтропения и у 5—20% — тромбоцитопения (Faulds and Heel, 1990). Нейтропения чаще всего возникает на второй неделе лечения (в том числе и при приеме ганцикловира внутрь) и, как правило, проходит уже через неделю после отмены препарата. Вместе с тем известны случаи, когда стойкая глубокая нейтропения приводила к смертельному исходу. При приеме внутрь валганцикловира помимо побочных эффектов, характерных для ганцикловира, бывают также головная боль и нарушения со стороны ЖКТ (тошнота, боль в животе, понос). Нейтропения, вызванная приемом ганцикловира, поддается лечению препаратами Г-КСФ (филграстим, ленограстим) (гл. 54).
У 5—15% больных возникают нарушения со стороны ЦНС различной степени тяжести — от головной боли до изменения поведения, судорог и комы. Примерно треть больных вынуждены отказаться от лечения ганцикловиром из-за побочного действия на костный мозг и ЦНС. При в/в введении ганцикловира описаны также флебиты, азотемия, анемия, сыпь, лихорадка, изменение биохимических показателей функции печени, тошнота, рвота, эозинофилия.
У лабораторных животных ганцикловир (в дозах, сравнимых с терапевтическими для человека) оказывал тератогенное и эмбриотоксическое действие, необратимо нарушал репродуктивную функцию и угнетал кроветворение.
Зидовудин (Hochster et al., 1990) и, вероятно, другие препараты с цитостатическим действием усиливают побочное действие ганцикловира на костный мозг. Такой же эффект дают нефро-токсические препараты, поскольку они замедляют выведение ганцикловира. Пробенецид и, возможно, ацикловир уменьшают почечный клиренс ганцикловира. Зальцитабин увеличивает биодоступность принятого внутрь ганцикловира в среднем на 22%. В свою очередь, ганцикловир при приеме внутрь улучшает всасывание диданозина и зидовудина и повышает их максимальные сывороточные концентрации (диданозина примерно в 2 раза, а зидовудина — примерно на 20%) (гл. 51).
Применение
Ганцикловир с успехом применяют для лечения и постоянной профилактики рецидивов (поддерживающей терапии) цитомегаловирусного ретинита у больных с ослабленным иммунитетом, а также для профилактики цитомегаловирусной инфекции у реципиентов внутренних органов и костного мозга. При введении ганцикловира в/в в начальной дозе 5 мг/кг 2 раза в сутки в течение 10—21 сут улучшение или стабилизация состояния наступали у 85% больных цитомегаловирусным ретинитом (Faulds and Heel, 1990; Drew, 1992). Выделение вируса уменьшалось уже через неделю, а через 2 нед улучшение подтверждалось при офтальмоскопии. Из-за высокого риска рецидивов цитомегаловирусного ретинита ВИЧ-инфицированным назначают поддерживающую терапию ганцикловиром в высоких дозах (30—35 мг/кг в неделю в/в). Если в начале лечения ганцикловир вводили в/в, то в качестве поддерживающей терапии его можно назначить внутрь (по 1 г 3 раза в сутки). Для начальной и длительной поддерживающей терапии цитомегаловирусного ретинита прием валганцикловира внутрь не уступает по эффективности в/в введению ганцикловира.
Ганцикловир применяют также в виде инъекций в стекловидное тело или внутриглазных имплантатов с медленным высвобождением действующего вещества. Для поддерживающей терапии внутриглазные имплантаты эффективнее, чем в/в введение ганцикловира (Musch et al., 1997).
Лечение ганцикловиром (5 мг/кг в/в 2 раза в сутки в течение 14—21 сут) помогает и при других проявлениях цитомегаловирусной инфекции у ВИЧ-инфицированных и реципиентов внутренних органов (Nichols and Во-eckh, 2000). На фоне снижения доз иммунодепрессантов лечение ганцикловиром давало эффект у 67% больных и более. Без поддерживающей терапии цитомегаловирус-ная инфекция часто рецидивирует. При цитомегалови-русных пневмонии и поражении ЖКТ у реципиентов костного мозга монотерапия ганцикловиром не помогает. Однако в сочетании с нормальным иммуноглобулином для в/в введения или иммуноглобулином против цитомегаловируса ганцикловир почти вдвое снижает смертность от цитомегаловирусной пневмонии. У грудных детей с врожденной цитомегаловирусной инфекцией при в/в введении ганцикловира по 6 мг/кг 2 раза в сутки в течение 6 нед прекращается выделение вируса с мочой и улучшается состояние (Whitley et al., 1997).
Ганцикловир применяют для профилактики заражения и предупреждения рецидивов цитомегаловирусной инфекции у реципиентов внутренних органов и костного мозга. В/в введение ганцикловира (по 5 мг/кг 2 раза в сутки в течение 7—14 сут, а затем по 5 мг/кг/сут до 100— 120-х суток после трансплантации) реципиентам костного мозга начинают после выделения вируса из жидкости, полученной при бронхоальвеолярном лаваже (Schmidt et al., 1991), а также из мочи, крови, мазков из зева (Goodrich et al., 1991). При этом цитомегаловирусная пневмония развивается гораздо реже, и, по-видимому, снижается смертность. Опубликовано руководство по ведению больных после трансплантации (включая выявление антигенов цитомегаловируса и титров антител к нему в крови) и назначению им ганцикловира для профилактики цитомегаловирусной инфекции (Centers for Disease Control and Prevention, 2000). Иногда ганцикловир назначают сразу после трансплантации; при этом также снижается частота цитомегаловирусной инфекции, но выживаемость не увеличивается — возможно, из-за нейтропении (побочный эффект ганцикловира) и связанных с ней инфекций (Goodrich et al., 1993).
В/в введение ганцикловира снижает риск цитомегаловирусной инфекции у реципиентов внутренних органов (Pillay, 2000). У таких больных, в том числе при отторжении трансплантата, эффективна профилактика ганцикловиром по 5 мг/кг в/в 2 раза в сутки в течение 7 сут (лечение начинают, как только вирус начнет выделяться в окружающую среду) (Singh et al., 1994). Прием ганцикловира внутрь по 1 г 3 раза в сутки в течение 3 мес снижает риск цитомегаловирусной инфекции после трансплантации печени, в том числе у серонегативных реципиентов серопозитивной печени и реципиентов, получающих антитимоцитарный иммуноглобулин или другие препараты, резко угнетающие функцию Т-лимфоцитов (Gane et al., 1997). Показано, что для профилактики цитомегаловирусной инфекции у реципиентов внутренних органов прием ганцикловира внутрь эффективней, чем прием больших доз ацикловира внутрь (Flechneret al., 1998). Кроме того, прием ганцикловира внутрь (1 г 3 раза в сутки) может снизить риск цитомегаловирусной инфекции и, возможно, снизить смертность у больных СПИДом, не получающихдиданозин (Spectoretal., 1996; Brosgart et I al., 1998). Назначение больших доз (1,5 г 3 раза в сутки) ганцикловира внутрь одновременно с внутриглазными имплантатами ганцикловира еще больше замедляет прогрессирование цитомегаловирусного ретинита, снижает риск заражения новым штаммом цитомегаловируса (Martin et al., 1999) и развития саркомы Капоши.
После такой профилактики чувствительность к ганцикловиру штаммов цитомегаловируса, выделенных у реципиентов внутренних органов обычно не меняется. Однако в тех немногих случаях, когда устойчивые штаммы все же обнаруживаются, прогноз ухудшается (Kruger et al., 1999). Риск развития устойчивости повышается при введении антитимоцитарного иммуноглобулина и длительном лечении ганцикловиром. При иммунодефиците (в том числе у ВИЧ-инфицированных) цитомегаловирусная инфекция, вызванная устойчивыми к ганцикловиру штаммами, быстро прогрессирует (Erice, 1999). При лечении цитомегаловирусного ретинита ганцикловиром в течение 9 мес устойчивые штаммы вируса обнаруживались в СМЖ, стекловидном теле и во внутренних органах более чем у 25% больных.
При герпетическом кератите довольно хорошо действует глазной гель с ганцикловиром (Colin et al., 1997). При хроническом гепатите В на фоне приема ганцикловира внутрь снижаются уровень вирусной ДНК и активность аминотрансфераз (Hadziyannis et al., 1999).
Как уже говорилось, в/в введение ганцикловира применяют при злокачественных новообразованиях, в том числе опухолях головного мозга. При этом в опухолевые клетки вводят ген тимидинкиназы вируса простого герпеса (метод самоубийства клеток-мишеней, см. выше) (Packer et al., 2000).
Идоксуридин
Строение и противовирусная активность
Идоксуридин, или 5-йодо-2'-дезоксиуридин, — йодсодержащий аналог тимидина — in vitro подавляет репродукцию различных ДНК-содержащих вирусов, в том числе герпесвирусов и поксвирусов (Prusoff, 1988).
Его структурная формула следующая:
В отношении вируса простого герпеса типа 1 идоксуридин эффективен в концентрациях 2—10 мкг/мл, что по меньшей мере в 10 раз превышает концентрации, в которых действует ацикловир. Действие идоксуридина неизбирательно: даже в низких концентрациях он подавляет пролиферацию свободных от вируса клеток.
Механизм действия и устойчивость
Механизм противовирусного действия идоксуридина изучен не полностью; известно лишь, что его фосфорилированные производные подавляют активность ряда ферментов. Идоксуридинтрифосфат встраивается и в вирусную, и в клеточную ДНК, но ингибирует репликацию только вирусной ДНК. ДНК, в состав которой входит идоксуридин, становится более хрупкой, легко разрушается, при ее транскрипции чаше возникают ошибки. In vitro вирусы быстро приобретают устойчивость к идоксуридину. Устойчивые штаммы выделяют и от больных герпетическим кератитом, получавших лечение идоксуркдином.
Применение
В США идоксуридин разрешен лишь для местного применения при герпетическом кератите, но в других странах его раствор в диметилсульфоксиде применяется при герпесе лица и полости рта, герпесе половых органов и опоясывающем лишае. При герпетическом кератите идоксуридин для местного применения лучше всего помогает, когда поражение ограничено эпителием (особенно при первичной инфекции) и еще не распространилось на строму роговицы (Kaufman, 1988).
К побочным эффектам относятся боль, зуд, воспаление и отек в области глаз. Реже возникают аллергические реакции.
Трифлуридин
Трифлуридин, или 5-трифторметил-2'-дезоксиуридин, — фторированный пиримидиновый нуклеозид, действующий in vitro на вирусы простого герпеса типов 1 и 2, цитомегаловирус, вирус осповакцины и, в меньшей степени, на некоторые аденовирусы (Carmine et al., 1982). Его структурная формула следующая:
В концентрациях 0,2—10 мкг/мл трифлуридин подавляет ре-продукцию герпесвирусов, в том числе штаммов, устойчивых к ацикловиру (Birch et al., 1992). Кроме того, в относительно низкой концентрации он подавляет синтез клеточной ДНК. Механизм действия и устойчивость. Трифлуридин угнетает репликацию вирусной ДНК. Трифлуридинмонофосфат необратимо ингибирует тимидилатсинтазу, а трифлуридинтрифосфат конкурирует с дезокси-ТТФ за встраивание в клеточную и вирусную ДНК под действием ДНК-полимеразы (Carmine et al. 1982). In vitro удавалось получить устойчивые к трифлуридину штаммы вируса простого герпеса с нарушенной субстратной специфичностью тимидинкиназы. Устойчивые штаммы выделены и от больных, получавших трифлуридин.
Применение. В США трифлуридин разрешен для местного применения при первичных герпетических поражениях глаз — кератоконъюнктивите и рецидивирующем эпителиальном кератите (Kaufman, 1988; Carmine etal., 1982). При герпетическом поражении глаз трифлуридин действует лучше идоксуридина, приближаясь по эффективности к видарабину. При закапывании трифлуридина в глаза могут возникать неприятные ощущения и отек век. Реже наблюдают раздражение глаз, аллергические реакции, поверхностный точечный или эпителиальный кератит. По некоторым данным, местное применение трифлуридина эффективно при герпесе кожи и слизистых, вызванном устойчивыми к ацикловиру штаммами (Birch etal., 1992).
Видарабин
Видарабин (9-Р-D-арабинофуранозиладенин, арабинозиладе-нин) — аналог аденозина, в котором рибоза заменена на арабинозу. Его структурная формула следующая:
Видарабин активен в отношении герпесвирусов, поксвирусов, рабдовирусов, гепаднавирусов и некоторых РНК-содержа-щих онкогенных вирусов (Whitley et а]., 1980). В отношении вирусов простого герпеса и varicella-zoster (в том числе штаммов, устойчивых к ацикловиру) видарабин эффективен в концентрациях 3 мкг/мл и меньше.
Механизм действия видарабина до конца не изучен, однако точно установлено, что он подавляет репликацию вирусной ДНК. Клеточные ферменты фосфорилируют видарабин до три-фосфата, который ингибирует вирусную ДНК-полимеразу, выступая в качестве конкурента дезокси-АТФ. Встраиваясь в ДНК (как в вирусную, так и в клеточную), видарабинтрифосфат может останавливать ее репликацию. Кроме того, видарабинтрифосфат ингибирует рибонуклеотидредуктазу, полиаденилирование РНК и аденозилгомоцистеиназу — фермент, принимающий участие в реакциях трансметилирования. In vitro можно получить штаммы, устойчивые к видарабину за счет мутации гена вирусной ДНК-полимеразы.
При в/в введении видарабин оказывает дозозависимое ней-ротоксическое действие (в том числе болезненную нейропатию), вызывает нарушения со стороны ЖКТ, слабость, гипока-лиемию, сыпь, повышение активности аминотрансфераз, анемию, лейкопению и тромбоцитопению. На лабораторных животных установлено тератогенное и канцерогенное действие видарабина.
Раньше видарабин в/в назначали при герпетическом энцефалите, герпесе новорожденных и опоясывающем лишае или dетряной оспе на фоне иммунодефицита, сейчас во всех этих случаях назначают ацикловир. При угрожающих жизни инфекциях, вызванных герпесвирусами, иногда применяют комбинацию ацикловира и видарабина. При герпетическом кератоконъюнктивите видарабин для местного применения эффективней идоксуридина (Kaufman, 1988).