Болезнь Гентингтона (препараты)
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Болезнь Гентингтона
Клиническая картина
Болезнь Гентингтона — аутосомно-доминантное заболевание, которое возникает в зрелом возрасте и характеризуется прогрессирующими нарушениями координации движений, личности и интеллекта. Симптоматика развивается исподволь, но наиболее ярким симптомом является хорея — быстрые, отрывистые движения конечностей, туловища, лица и шеи. К ранним симптомам относят нарушения координации тонких движений и быстрых движений глаз. Иногда, особенно при развитии заболевания до 20 лет, преобладают гипокинезия и дистония. По мере прогрессирования болезни хорея усиливается, возникают дизартрия и дисфагия, нарушения равновесия. Когнитивные нарушения проявляются замедленностью мышления, затруднениями при выполнении сложных заданий. Характерны нарушения памяти, однако больные редко забывают членов своей семьи, друзей и, как правило, ориентируются в окружающей обстановке. Часто они становятся раздражительными, тревожными и подавленными; реже развиваются паранойя и иные формы бреда. За 15—30 лет больные полностью утрачивают способность к самообслуживанию и общению, нуждаются в постоянном уходе. Болезнь Гентингтона неизбежно приводит к смерти, обычно из-за осложнений, обусловленных длительной обездвиженностью (Hayden, 1981; Harper, 1991,1992).
Патогенез
Для болезни Гентингтона характерна массовая гибель нейронов хвостатого ядра и скорлупы (Vonsattel et al., 1985). Атрофия начинается с хвоста хвостатого ядра, а затем распространяется вперед — отдорсомедиальных отделов к вентролатеральным. Поражаются и другие отделы мозга, хотя в меньшей степени; так, по данным морфометрии, уменьшается число нейронов в коре, гипоталамусе и таламусе. Даже в пределах стриатума дегенерация нейронов происходит избирательно — гибнут в основном ГАМКергические нейроны, в то время как вставочные нейроны и афферентные волокна почти не страдают. По этой причине концентрация ГАМК в стриатуме значительно снижается, а концентрации соматостатина и дофамина остаются неизменными (Ferrante etal., 1987; Reineretal., 1988).
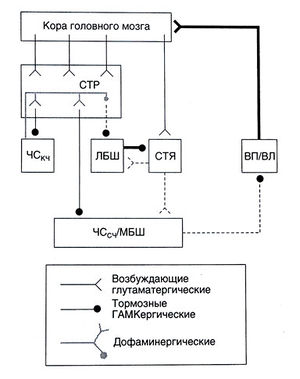
Похоже, что наиболее яркий симптом болезни Гентингтона — хорея — тоже связан с избирательным поражением нейронов. Вероятно, у большинства больных, у которых болезнь возникла в зрелом возрасте, ГАМКергические нейроны непрямого пути поражаются раньше, чем прямого (Albin et al., 1990, 1992). Из-за преимущественного поражения непрямого пути усиливаются возбуждающие влияния на кору больших полушарий, проявляясь хореическими гиперкинезами (рис. 22.10). В некоторых случаях, особенно при ювенильных формах, напротив, преобладает ригидность; в этом случае нейроны стриатума, образующие прямой и непрямой пути, поражаются в равной степени.
Описание к рис. 22.10. Нарушения в стриопаллидарной системе при болезни Гентингтона. При этом заболевании погибают нейроны стриатума, и прежде всего — непрямого пути. Это ведет в конечном счете к усилению возбуждающих влияний таламуса на кору (подробнее см. в тексте). Тонкие линии соответствуют нормальной активности того или иного пути, жирные — повышенной активности, пунктирные — пониженной активности. Сокращения те же, что на рис. 22.6.
Генетика
Болезнь Гентингтона — аутосомно-доминантное заболевание с почти полной пенетрантностью. Оно может развиться в 2 года и в 85 лет, но средний возраст составляет 35—45 лет. Ребенок может с равной вероятностью унаследовать мутантный ген от матери или отца, однако в 80% случаев развития заболевания до 20-летнего возраста оно передается от отца. Наследование болезни Гентингтона служит примером антиципации, при которой возраст начала болезни уменьшается в каждом последующем поколении; антиципация наблюдается и при других дегенеративных заболеваниях ЦНС с подобными генетическими механизмами. Клиническая картина одинакова у гомозигот и гетерозигот по мутантному гену, следовательно, присутствие нормальной хромосомы не уменьшает проявлений заболевания. До того как были установлены генетические механизмы болезни Гентингтона, считалось, что ее редко вызывают вновь возникшие мутации, но сегодня очевидно, что эту болезнь можно унаследовать и от здоровых родителей, особенно если у одного из них имеется аллель с промежуточным числом тринукле-отидных повторов (см. ниже).
В течение 10 лет группа исследователей активно работала над изучением мутации, ответственной за возникновение болезни Гентингтона. В 1993 г. было установлено, что в сегменте 4р16.3 имеются тринуклеотидные повторы ЦАГ, число которых при болезни Гентингтона гораздо больше, чем у здоровых людей (Huntington’s Disease Collaborative Research Group, 1993). Увеличение числа этих повторов и есть та мутация, которая приводит к болезни Гентингтона. Нормальные аллели содержат 9—34 тринуклеотидных повтора (в среднем 19), а у больных число повторов составляет 40— 100. Кроме того, есть аллели с промежуточным числом повторов (35—39), при наличии которых болезнь может развиться в пожилом возрасте, но далеко не всегда. Чем больше повторов содержит ген, тем раньше начинается болезнь. Эта взаимосвязь особенно ярко проявляется у тех больных, у которых заболевание возникло до 30 лет; в остальных же случаях она слабее. Таким образом, в большинстве случаев по числу повторов нельзя точно предсказать, когда именно возникнет болезнь. Было показано, что увеличение числа тринуклеотидных повторов ЦАГ лежит и в основе некоторых других дегенеративных заболеваний ЦНС: спиноцеребеллярных дегенераций и редкого поражения мотонейронов — Х-сцепленной бульбоспинальной амиотрофии (синдрома Кеннеди) (Paulson and Fischbeck, 1996). Избирательность поражения. Пока не известно, каким образом увеличение числа тринуклеотидных повторов приводит к клинике болезни Гентингтона. Ген болезни Гентингтона IT15сам по себе очень большой (10 тысяч нуклеотидов); он кодирует белок гентингтин с молекулярной массой около 348 000 (3144 аминокислотных остатка). Тринуклеотидный повтор, кодирующий аминокислоту глутамин, находится в 5'-концевой области гена IT15;рядом с ним располагается второй, более короткий повтор ЦЦГ, кодирующий аминокислоту пролин. Гентингтин не похож на все известные белки, и его функция у здоровых людей пока не ясна. Мыши с инактивированным геном IT15умирают на ранних сроках внутриутробного развития, что может свидетельствовать о важной функции гентингтина в клетках. Полагают, что вследствие мутации белок приобретает новые функции, которые не свойственны ему в норме.
Ген IT15 экспрессируется в разных органах, но наиболее активно в головном мозге, поджелудочной железе, кишечнике, мышцах, печени, железах, яичках. Похоже, что избирательное поражение отдельных групп нейронов в головном мозге не связано с уровнем его экспрессии; так, по неизвестным причинам гибнут в основном нейроны стриатума, хотя уровень экспрессии примерно одинаков во всех отделах головного мозга (Land-wehrmeyer et al., 1995). Возможно, избирательное поражение нейронов связано с нарушениями их метаболизма или нейротоксическим действием возбуждающих медиаторов. Давно подмечено, что больные болезнью Гентингтона обычно худые, что может свидетельствовать о системных нарушениях энергетического обмена. После введения в стриатум стимуляторов глутаматных NMDA-рецепторов у животных возникали симптомы, напоминающие болезнь Гентингтона (Beal et al., 1986). Еще более интересно то, что при введении средств, ингибирующих комплекс II дыхательной цепи митохондрий, — даже системном — возможны повреждения стриатума, сходные с таковыми при болезни Гентингтона (Beal etal., 1993). Эти повреждения уменьшаются после введения блокаторов глутаматных NMDA-рецепторов, а потому можно предположить, что в основе данных повреждений лежит склонность к нейротоксическому действию возбуждающих медиаторов, обусловленная метаболическими нарушениями.
В исследованиях с применением магнитно-резонансной спектроскопии in vivo удалось получить прямые доказательства нарушений энергетического обмена при болезни Гентингтона (Jenkins etal., 1993). Таким образом, избирательное поражение нейронов на фоне сходного во всем головном мозге уровня экспрессии мутантного гена может объясняться системным нарушением энергетического обмена, к которому особенно чувствительны нейроны стриатума (из-за особенностей окислительного метаболизма и распределения типов глутаматных рецепторов). Эта гипотеза может стать важной предпосылкой к созданию новых методов лечения болезни Гентингтона. В ближайшем будущем мы вряд ли сможем исправлять лежащий в ее основе генетический дефект, но, возможно, удастся создать препараты, влияющие на метаболизм или препятствующие нейротоксическому действию возбуждающих медиаторов. Можно надеяться, что такие препараты смогут влиять на течение болезни.
Лечение
К лечению болезни Гентингтона необходимо подходить индивидуально (Shoulson, 1992). Ни один из имеющихся препаратов не замедляет прогрессирование заболевания, причем многие из них могут вызвать побочные эффекты, из-за которых нарушается трудоспособность. Лечение требуется при депрессии, раздражительности, паранойе и других психозах, сильной тревожности. При депрессии эффективны обычные антидепрессанты, но нужно учитывать, что те из них, которые обладают выраженным М-холиноблокирующим действием, могут усилить хорею. Показано, что карбамазепин и флуоксетин эффективны при депрессии (последний также и при раздражительности). При психозах (в том числе паранойе и иных бредовых состояниях) обычно требуются нейролептики, но часто в меньших дозах, чем при иных психических заболеваниях. Эти препараты ухудшают когнитивные функции и двигательную активность, а потому их нужно назначать в наименьших дозах и отменять сразу после исчезновения соответствующих симптомов. У больных с преобладанием ригидности могут быть предпочтительны клозапин и карбамазепин.
Двигательные нарушения при болезни Гентингтона редко требуют медикаментозного лечения. При частых падениях и травмах, обусловленных крупноразмашистой хореей, показаны препараты, истощающие запасы дофамина, — тетрабеназин или резерпин, но важно помнить о риске артериальной гипотонии и депрессии. Кроме того, можно назначить нейролептики, однако часто они не улучшают состояние в целом, поскольку нарушают координацию тонких движений и увеличивают ригидность. У многих больных хореические гиперкинезы усиливаются на фоне тревоги или волнения. В таких случаях рекомендуют осторожно назначать бензодиазепины. При ювенильных формах ведущим симптомом является ригидность, а не хорея; в этих случаях состояние в разной степени улучшают стимуляторы дофаминовых рецепторов. У таких больных иногда развиваются припадки (в том числе миоклонические), при которых назначают клоназепам, вальпроевую кислоту и другие противосудорожные средства.