Синаптическая передача
Содержание
Синаптическая передача[править | править код]
Синапсы соединяют нервные клетки друг с другом (этот же принцип встречается в некоторых мышечных клетках), а также с чувствительными и эффекторными клетками (мышечными и секреторными).
Электрические синапсы - это прямые ионпроводящие соединения клеток посредством каналов (коннексонов) в области так называемых щелевых контактов. Они отвечают за проведение импульсов между соседними гладкими или сердечными мышечными волокнами (а кое-где и между нейронами - в сетчатке глаза и в ЦНС), а также обеспечивают коммуникационные функции между соседними эпителиальными или глиальными клетками.
В химических синапсах для передачи информации используются нейромедиаторы (нейротрансмиттеры). Они не только обеспечивают связь в нервной системе, но также служат переключательными элементами. Они могут ускорять или тормозить передачу информации нейроном или передавать ее вместе с другим входящим сигналом.
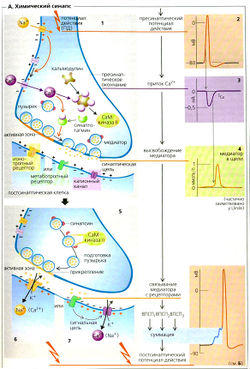
В химическом синапсе потенциал действия (A1,2) запускает высвобождение медиаторов из пресинаптических терминалей аксона. Затем медиатор диффундирует через узкую синаптическую щель (~ 30 нм), чтобы связаться с рецепторами на пресинаптической мембране нейрона, мышечной или секреторной клетки. В зависимости от типа рецептора и медиатора эффект на постсинаптическую мембрану может быть возбуждающим или тормозным, как описано ниже.
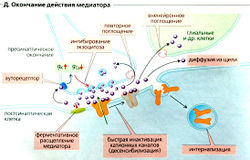
Медиаторы высвобождаются путем регулируемого экзоцитоза так называемых синаптических пузырьков (Д1). Каждый пузырек содержит некоторое количество («квант») нейромедиатора. В случае двигательной концевой пластинки высвобождается около 7000 молекул ацетилхолина (АХ). Некоторое количество пузырьков, готовых к высвобождению содержимого, скапливается у мембраны [в активной зоне). Поступающий потенциал действия служит сигналом для высвобождения нейромедиатора (А1, 2). Чем выше частота потенциала действия в аксоне, тем больше пузырьков высвобождают свое содержимое. Потенциал действия повышает (иногда колебательным образом) вероятность открывания потенциалзависимых Са2+-каналов в пресинаптической мембране, приводя к увеличению концентрации Са2+ в цитоплазме, [Са2+]внугр (А1,3). Внеклеточный Мg2+ ингибирует этот процесс. Са2+ связывается с синаптотагмином (А1), который запускает взаимодействие синтаксина и SNAP-25 на пресинаптической мембране с синапто-бревином на мембране пузырьков, таким образом запуская зкзоцитоз уже заякоренных пузырьков (примерно 100 на один потенциал действия) (А1, 4). С другой стороны, Са2+ активирует кальцийкальмодулинзависимую протеинкиназу II (СаМ-киназа-II А5 ), которая активирует фермент синапсин в пресинаптическом окончании. В результате пузырек заново закрепляется в активной зоне.
Синаптическая потенциация (облегчение). Если потенциал действия должен достигнуть пресинаптического окончания сразу же после другого потенциала действия (частота потенциала действия более 30 Гц), концентрация Са2+ в цитоплазме еще не успевает снизиться до значения при потенциале покоя, и остаточный Са2+ накапливается. В результате каждое последующее повышение [Са2+]внутр «наслаивается» на предыдущее. После второго стимула [Са2+]внутр. возрастает до более высокого уровня по сравнению с первым - высвобождается больше медиаторов. Следовательно, первый стимул облегчает ответ на второй. По тем же причинам мышечная сила возрастает при высокой частоте стимулов.
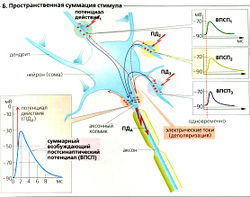
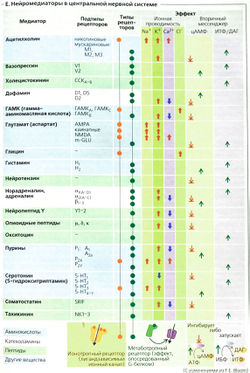
Среди многих агентов, действующих как возбуждающие медиаторы, наиболее распространенными являются ацетилхолин (АХ) и глутамат (Glu). Они часто высвобождаются вместе с комедиаторами, которые модулируют проведение стимула (например, АХ вместе с веществом Р, ВИП (вазоактивный интестинальный пептид) или галанином; Glu вместе с веществом Р или энкефалином). Если рецептором медиатора является ионный канал (ионотропный рецептор или лигандзависимый ионный канал, А6 и Е), например, в случае N-холинергического синапса, каналы открываются чаще и позволяют большему количеству катионов входить в клетку (Na+, иногда Са2+) и покидать ее (К+). Другие, так называемые метаботропные рецепторы воздействуют на канал через G-белки, которые контролируют каналы или непосредственно, или посредством «вторичных мессенджеров» (А7 и Е). По причине высокого электрохимического градиента Na+ количество входящих ионов Na+ гораздо больше, чем выходящих ионов К+. Са2+ может также входить в клетку через глутаматный NMDA-рецептор (Е). Суммарный приток катионов ведет к деполяризации: возбуждающему постсинаптическому потенциалу (ВПСП) (максимальный ВПСП —20 мВ; Б). ВПСП начинается примерно через 0,5 мс после того, как потенциал действия достигает пресинаптического окончания. Это синаптическое торможение (латентность) вызвано сравнительно медленным высвобождением и медленной диффузией медиатора.
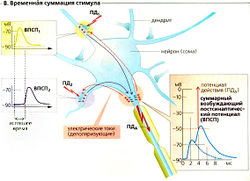
Единственный ВПСП обычно не может генерировать постсинаптический (аксонный) потенциал действия (ПДд), но вызывает множественные локальные деполяризации в дендритах. Волны деполяризации проходят через сому и суммируются на аксонном холмике (пространственная суммация; Б). Несмотря на то что индивидуальные стимулы возникают в разное время (с интервалом приблизительно в 50 мс), предыдущая деполяризация не успевает исчезнуть к моменту наступления следующей, а суммация облегчает достижение порогового уровня. Таким образом, временная суммация увеличивает возбудимость постсинаптического нейрона (В).
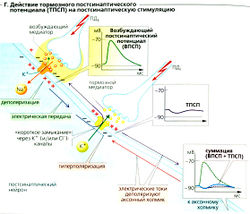
К тормозным медиаторам относятся такие вещества, как глицин, ГАМК (у-аминомасляная кислота) и ацетилхолин (в М2- и МЗ-рецепторах). Они увеличивают проводимость постсинаптической мембраны только для К+ (например, метаботропный ГАМКд-рецептор) или Сl- (например, ионотропные глициновый и ГАМКд-рецепторы; Е). Мембрана в результате обычно становится гиперполяризованной (максимум —4 мВ). Увеличение gк происходит, когда Ет достигает Ek<. Однако основной эффект тормозного постсинаптического потенциала ТПСП (Г) вовсе не гиперполяризация, противоположная деполяризации при ВПСП (ТПСП тоже иногда имеет легкий деполяризующий эффект). Вместо этого связанное с ТПСП увеличение мембранной проводимости замыкает электрическую цепь при ВПСП (высокая проводимость gK+ или gCl). Поскольку и Ek, и ECl близки к потенциалу покоя, происходит стабилизация, т. е. ВПСП отменяется из-за короткого замыкания, обусловленного высокими токами К+ и Cl. В результате связанная с ВПСП деполяризация уменьшается, и стимуляция постсинаптического нейрона ингибируется (Г).
Окончание синаптической передачи (Д) может произойти вследствие инактивации катионных каналов из-за изменения конформации канала, как это происходит во время потенциала действия. Этот очень быстрый процесс называется десенсибилизацией и может также происходить в присутствии медиатора. Другие пути окончания синаптической передачи включают быстрое ферментивное расщепление медиатора (например, ацетилхолина) непосредственно в синаптической щели; повторное поглощение медиатора (например, норадреналина, или норэпинефрина) в пресинаптическом окончании; или его поглощение клетками (отличными от нейронов, например в глиальных клетках ЦНС); а также интернализацию медиатора рецептором и связывание его на пресинаптической мембране (ауторецептором). В последнем случае может произойти увеличение gK+ и уменьшение gCa+, что будет ингибировать высвобождение медиатора, например ГАМК посредством ГАМКв-рецепторов или норадреналина посредством а2-адренорецепторов (Е ).
СИНАПТИЧЕСКАЯ ПЕРЕДАЧА В ВЕГЕТАТИВНОЙ И СОМАТИЧЕСКОЙ НЕРВНОЙ СИСТЕМЕ[править | править код]
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Первые прямые экспериментальные доказательства теории химической передачи нервного импульса были получены около ста лет назад (von Euler, 1981); в последующие годы эта теория бурно развивалась, и в настоящее время считается общепризнанной. Передача возбуждения в большинстве синапсов осуществляется с помощью химических веществ — медиаторов (нейромедиаторов, нейротрансмиттеров). Действие многих лекарственных средств, влияющих на гладкие мышцы, сердце и железы, обусловлено именно тем, что они воспроизводят или изменяют эффекты медиаторов на уровне вегетативных ганглиев либо исполнительных органов.
Многие закономерности медиаторной передачи в вегетативной нервной системе справедливы также для нервно-мышечных и центральных синапсов. Более того, именно исследования в области физиологии вегетативной нервной системы в значительной степени помогли понять, как происходит межнейронная передача в ЦНС (гл. 12). Как в центральных, так и в периферических синапсах действуют механизмы синтеза, запасания, высвобождения, инактивации и распознавания медиатора. Основными медиаторами вегетативной нервной системы служат ацетилхолин и норадреналин. Вспомогательное действие оказывают другие медиаторы, в том числе пептиды, пурины и N0.
Для понимания эффектов препаратов, действующих на уровне вегетативной нервной системы, — вегетотропных средств — необходимо ясно представлять себе анатомию и физиологию этой системы. Влияние подобных препаратов на внутренние органы часто можно предсказать, если знать, как реагируют эти органы на раздражение вегетативных нервов. В настоящей главе мы рассмотрим анатомию, биохимию и физиологию вегетативной и соматической нервной системы.
Этапы синаптической передачи[править | править код]
Знание этапов синаптической передачи чрезвычайно важно, так как многие препараты действуют на те или иные из них. Синаптическая передача включает распространение нервного импульса на пресинаптическое окончание и собственно передачу сигнала через синаптическую щель. Что касается первого этапа — распространения нервного импульса, — то на него, за исключением местных анестетиков, лекарственные средства почти не действуют, и поэтому мы разберем его лишь вкратце.
Распространение нервного импульса[править | править код]
Наши знания о механизмах возникновения и распространения нервного импульса в значительной степени базируются на основополагающих работах Ходжкина и Хаксли (1952).
В покое нервные клетки заряжены изнутри отрицательно, а снаружи — положительно; трансмембранная разность потенциалов в типичном аксоне при этом составляет около 70 мВ. Этот так называемый потенциал покоя представляет собой диффузионный потенциал. Концентрация К+ в аксоплазме в 40 раз выше, чем во внеклеточной среде, а мембрана для этого иона в покое высоко проницаема. Напротив, концентрации Na+ и СГ во внеклеточной среде выше, чем в аксоплазме, но мембрана в покое их почти не пропускает, и поэтому их вклад в потенциал покоя невелик. Эти концентрационные градиенты поддерживаются за счет системы активного транспорта (насоса), представляющей собой АТФазу, активируемую повышением внеклеточной концентрации Na+ и внутриклеточной — К+ (Hille, 1992; Hille et al., 1999a).
Если какой-либо участок мембраны деполяризовать до критического уровня, то в этом участке возникает потенциал действия. Он состоит из двух фаз. Первая — фаза деполяризации — обусловлена быстрым повышением натриевой проницаемости. Это повышение, в свою очередь, обусловлено тем, что в ответ на деполяризацию открываются потенциалзависимые натриевые каналы. В результате Na+ входит в клетку и деполяризует ее; на пике потенциала действия мембранный потенциал становится положительным (реверсия, или овершут). Затем следует фаза реполяризации, обусловленная инактивацией натриевых каналов и задержанным открыванием потенциалзависимых калиевых каналов; калий выходит из клетки, возвращая мембранный потенциал к уровню покоя. Видимо, инактивация натриевых каналов обусловлена потенциалзависимым изменением конформации некоего гидрофобного белка, который при этом перекрывает вход в канал со стороны цитоплазмы. В некоторых клетках (например, в сердце) в генерации потенциала действия участвует Са +. Вход этого иона в клетку продлевает деполяризацию, и кроме того, повышение внутриклеточной концентрации Са + служит сигналом, запускающим многие внутриклеточные процессы (Hille, 1992; Catterall, 2000). В генерации и проведении нервного импульса в аксонах Са2+ роли не играет.
Когда в каком-либо участке нервного волокна возникает потенциал действия, то между этим и соседними участками начинают протекать местные токи. В результате эти соседние участки деполяризуются до критического уровня, и в них тоже развивается потенциал действия (предыдущий участок в это время находится в состоянии рефрактерности). Именно таким образом нервный импульс и распространяется без затухания по аксону. В миелиновых волокнах потенциал действия возникает только в перехватах Ранвье, и поэтому он распространяется по таким волокнам скачкообразно (так называемое сальтаторное распространение) с высокой скоростью. Яд иглобрюха тетродотоксин и близкий к нему яд некоторых моллюсков сакситоксин избирательно подавляют возникновение и проведение потенциала действия, блокируя быстрые натриевые каналы. Напротив, батрахотоксин — чрезвычайно мощный стероидный алкалоид, содержащийся в яде некоторых видов короткоголовых лягушек из рода листолазов (Phyllobates), — увеличивает проницаемость быстрых натриевых каналов; в результате развивается постоянная деполяризация, и возникновение потенциала действия подавляется. Яды скорпионов также вызывают стойкую деполяризацию, но другим путем — они устраняют инактивацию натриевых каналов (Catterall, 2000). Подробнее натриевые и кальциевые каналы рассматриваются в гл. 15, 32 и 3S.
Синаптическая передача[править | править код]
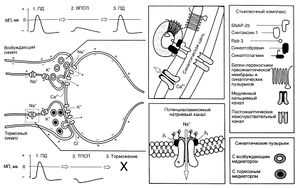
Поступление потенциала действия в пресинаптическое окончание запускает последовательность событий, приводящих к передаче сигнала через синапс (рис. 6.2).
1. Хранение и высвобождение медиатора. Непептидные (низкомолекулярные) медиаторы синтезируются преимущественно в пресинаптическом окончании и здесь же хранятся в синаптических пузырьках. Пептидные медиаторы (или их предшественники) синтезируются в теле нейрона и затем в крупных электроноплотных пузырьках переносятся по аксону в окончания. В покое из пресинаптических окончаний постоянно выделяются отдельные кванты медиатора (соответствующие содержимому отдельных синаптических пузырьков). В постсинаптической мембране скелетной мышцы это вызывает возникновение так называемых миниатюрных потенциалов концевой пластинки. Полагают, что благодаря таким потенциалам поддерживается функциональная готовность эффекторных органов (Katz, 1969); это особенно важно для скелетных мышц, не обладающих спонтанным миоген-ным тонусом. В ответ на поступление потенциала действия из пресинаптического окончания выбрасывается несколько сотен квантов медиатора. Этот выброс запускается деполяризацией пресинаптического окончания; в большинстве окончаний (но не во всех) связующим звеном между деполяризацией и выходом медиатора служит поступление в аксоплазму Са2+, вызывающее слияние синаптических пузырьков с пресинаптической мембраной (Meiret al., 1999; Hille et al., 1999a). После слияния с мембраной пузырьки посредством экзоцитоза высвобождают свое содержимое (медиатор, ферменты, другие белки) в синаптическую щель. Возможно как полное слияние пузырьков с мембраной с последующим обратным процессом (эндоцитозом), так и образование временной поры, через которую выходит медиатор (Murthy and Stevens, 1998).
Пресинаптическое окончание можно рассматривать как самостоятельную структуру, содержащую все необходимое для образования пузырьков, их экзоцитоза и эндоцитоза, синтеза и обратного захвата медиатора (Femandez-Chacon and Sudhof, 1999; Lin and Scheller, 1997).
Синаптические пузырьки располагаются в особых участках у пресинаптической мембраны, называемых активными зонами. Эти участки часто бывают расположены напротив субсинаптических складок. В пузырьках обнаружено 20—40 различных белков, отвечающих за перенос веществ через мембрану пузырьков и за экзоцитоз последних. Транспорт медиаторов в пузырьки осуществляется за счет электрохимического градиента, создаваемого Н+-АТФазой (протонным насосом).
Описание к рис. 6.2. Этапы передачи сигнала в возбуждающем и тормозном синапсах. 1. Потенциал действия — это распространяющееся колебание мембранного потенциала, при котором заряд внутренней поверхности мембраны временно меняется с отрицательного на положительный. Эти изменения обусловлены входом Na* с последующим выходом К . Когда потенциал действия приходит в пресинаптическое окончание, он вызывает высвобождение возбуждающего или тормозного медиатора. Механизм этого высвобождения следующий: деполяризация пресинаптического окончания приводит к входу в него Са2 , вызывающего сначала прикрепление, а затем слияние синаптических пузырьков с пресинаптической мембраной. 2. Соединение возбуждающего медиатора с постсинаптическими рецепторами приводит к местной деполяризации — ВПСП. Она обусловлена открыванием катионных, и особенно натриевых, каналов. Тормозный медиатор вызывает открывание каналов для К и СП, что сопровождается местной гиперполяризацией — ТПСП. 3. Поддействием ВПСП в постсинаптиче-ском нейроне возникает распространяющийся потенциал действия; ТПСП этому препятствует. Выделившийся медиатор инактивируется путем ферментативного распада, захвата пресинаптическим окончанием или соседними клетками глии или диффузии из синаптической щели. МП — мембранный потенциал, ПД — потенциал действия. Eccles, 1964,1973; Katz, 1966; Catterall, 1992; Jann and Sudhof, 1994.
Роль белков, ответственных за экзоцитоз, менее изучена. Известно, что белок пузырьков синаптобревин (он же VAMP — vesicle-associated membrane protein, везикулярный мембранный белок) соединяется с белками пресинаптической мембраны SNAP-25 (synaptosomal-associated protein of 25 kDa — синаптосомный белок с молекулярной массой 25 ООО) и синтаксином-1, образуя комплекс, запускающий или направляющий процесс слияния пузырьков с мембраной. Синаптобревин, SNAP-25 и синтаксин-1 называют белками SNARE (SNAP receptor — рецепторы SNAP, или soluble N-ethylmaleimide-sensitive-factor attachment protein receptor — растворимые, чувствительные к N-этилмалеимиду рецепторы стыковочных белков). Вызванный Са2+ экзоцитоз пузырьков, протекающий за доли миллисекунды, видимо, обеспечивается отдельным семейством белков — синаптотагминами.
ГТФ-связывающие белки подсемейства Rab-З регулируют слияние и повторное образование пузырьков. Функция этих белков связана с гидролизом ГТФ. Определенную роль в слиянии пузырьков с мембраной и экзоцитозе играют и другие, менее изученные регуляторные белки — синапсин, синаптофизин, синаптогирин и обнаруженные в активных зонах белки RIM (Rab3-interacting molecules — молекулы, реагирующие с Rab-З) и нейрексины. Многие из этих белков гомологичны тем, что отвечают за везикулярный транспорт в дрожжевых грибах.
За последние 30 лет было обнаружено множество пресинаптических рецепторов, от активации которых зависит выброс медиатора и, следовательно, синаптическая передача (Langer, 1997; MacDermott et al., 1999; von Kugelgen et al., 1999). Эти рецепторы оказались почти столь же многочисленными, как и постсинаптические рецепторы, и они также могут быть облегчающими или тормозными. Они могут активироваться как медиаторами других нейронов, так и медиатором того же самого нейрона после его выброса в синаптическую щель. В последнем случае они называются ауторецепторами. Так, норадреналин может взаимодействовать с пресинаптическими а2-адренорецепторами, подавляя тем самым собственное дальнейшее высвобождение. Активация таких же рецепторов приводит к снижению выброса ацетилхолина из холинергических окончаний. Активация пресинаптических М-холинорецепторов также угнетает высвобождение ацетилхолина (Wessler, 1992) и влияет на выброс норадреналина из симпатических окончаний в сердце и сосудах. Активация пресинаптических N-холинорецепторов усиливает выделение медиатора из окончаний мотонейронов (Bowman et al., 1990) и ряда других центральных и периферических нейронов (MacDermott et al., 1999).
На высвобождение медиатора в разных нейронах влияют также аденозин, дофамин, глутамат, ГАМК, простагландины и энкефалины. Этот модулирующий эффект частично обусловлен тем, что активация соответствующих рецепторов меняет проницаемость пресинаптических каналов (Tsien et al., 1988; Miller, 1998). Действительно, некоторые такие каналы непосредственно регулируют выброс медиатора из пресинаптических окончаний (Meir etal., 1999).
2. Соединение медиатора с рецептором и возникновение постсинаптического потенциала. После высвобождения в синаптическую щель медиатор диффундирует через нее и соединяется со специализированным рецептором на постсинаптической мембране. Это часто приводит к местному изменению ионных проницаемостей. За редкими исключениями (см. ниже), эти изменения бывают следующих трех типов: 1) повышение проницаемости для всех катионов (в основном для Na+, но также для Са2+). Это приводит 1 местной деполяризации, называемой ВПСП, 2) избирательное повышение проницаемости для анионов (обычно для СГ). В результате происходит стабилизация мембранного потенциала либо гиперполяризация — ТПСП, 3) повышение проницаемости для К+.
При этом также наблюдаются стабилизация мембранного потенциала и гиперполяризация (ТПСП).
Важно подчеркнуть, что постсинаптические потенциалы обусловлены пассивным током ионов в направлении их электрохимических градиентов. Эти токи возникают потому, что в результате соединения медиаторов с соответствующими рецепторами меняются проницаемости ионных каналов (см. ниже и гл. 12). Рецепторы могут либо располагаться в области специализированной постсинаптической мембраны (как, например, в нервно-мышечном и других четко оформленных синапсах), либо быть диффузно разбросанными по мембране (как в случае гладких мышц).
С помощью микроэлектродов, плотно присасывающихся к мембране, стало возможным регистрировать токи через одиночные каналы, в том числе связанные с рецепторами медиаторов (Hille, 1992). В присутствии медиатора канал периодически быстро открывается, остается в открытом состоянии примерно 1 мс и затем вновь закрывается. При этом регистрируется короткий П-образный импульс тока. В результате суммации этих токов одиночных каналов и возникает постсинаптический потенциал. Рост постсинаптического потенциала при повышении концентрации медиатора обычно обусловлен не большей степенью открывания канала и не большей длительностью его пребывания в открытом состоянии, а увеличением частоты актов открывания. Обычно такие каналы, непосредственно связанные с рецепторами (хемочувствительные каналы, рецепторы-каналы, ионотропные рецепторы), пропускают Na+ и СГ, реже — К+ и Са2+. Эти каналы принадлежат к обширному суперсемейству ионотропных рецепторных белков, включающему N-холинорецепторы, глутаматные рецепторы, некоторые 5-НТ3-ре-цепторы и пуриновые рецепторы (все они связаны с натриевыми каналами, и их активация приводит к деполяризации, то есть к ВПСП), а также рецепторы ГАМК и глициновые рецепторы (связаны с хлорными каналами; активация приводит к гиперполяризации, то есть к ТПСП). N-холинорецепторы, 5-НТ3-рецепторы, рецепторы ГАМК и глициновые рецепторы (но не глутаматные и пуриновые рецепторы) по своему строению во многом сходны (Karlin and Akabas, 1995). Некоторые рецепторы опосредованно связаны с калиевыми и кальциевыми каналами; в таких случаях рецептор и канал — это разные белки, а сигнал к каналу от рецептора передается через G-белок (гл. 2). Наконец, существуют рецепторы, связанные с внутриклеточными системами вторых посредников. Их активация может и не сопровождаться изменениями мембранного потенциала. Наиболее известные примеры — это рецепторы, активация которых приводит к усилению или подавлению активности аденилатциклазы либо к образованию ИФ3 и, как следствие, к повышению концентрации Са2+ в цитоплазме (гл. 2).
3. Дальнейшие постсинаптические процессы. Если ВПСП превышает критический уровень, то в ближайших к постсинаптической мембране участках возбудимой мембраны открываются потенциалзависимые каналы и возникает распространяющийся потенциал действия. Так происходит в посгсинаптических нейронах и скелетных мышцах. В некоторых гладких мышцах, где распространяются даже низкоамплитудные потенциалы, ВПСП может увеличивать частоту спонтанных потенциалов действия и тем самым повышать мышечный тонус. В железах ВПСП запускает секрецию за счет повышения концентрации Са2+ в цитоплазме. ТПСП, препятствующий эффектам ВПСП, возникает в нейронах и в гладких мышцах, но не в скелетных мышцах. Конечная реакция эффекторной клетки (например, возникновение потенциала действия) зависит от результатов суммации всех постсинаптических потенциалов.
4. Инактивация медиатора. Импульсы могут проводиться через синапсы с частотой до нескольких сотен в секунду. Отсюда ясно, что должны существовать механиамы быстрого удаления медиатора из синаптической щели. В холинергических синапсах, где передача происходит особенно быстро, это удаление обеспечивается присутствием в синаптической щели фермента АХЭ в высокой концентрации. Если активность АХЭ подавить ингибиторами, то инактивация ацетилхолина будет осуществляться только за счет его диффузии из синаптической щели и его действие будет более сильным и длительным.
Норадреналин инактивируется путем диффузии из синаптической щели и обратного захвата адренергическим окончанием (Iversen, 1975). Инактивация аминокислотных медиаторов обеспечивается их активным захватом нейронами и глией. Пептидные медиаторы гидролизуются пептидазами и диффундируют из синаптической щели; механизмов обратного захвата для этих медиаторов не обнаружено.
5. Трофическое действие медиаторов. Как уже говорилось, в синапсе происходит постоянное выделение квантов медиатора. Этого количества недостаточно для того, чтобы вызвать явный ответ постсинаптической клетки, но, видимо, оно играет важную роль в обеспечении готовности синапса к передаче сигнала. Возможно, это так называемое трофическое действие медиатора (или неких других трофических факторов, выделяемых нервными окончаниями) поддерживает активность и обновление ферментов синтеза медиатора, плотность пре- и постсинаптических рецепторов и другие важные для синаптической передачи процессы (Reichardt and Farinas, 1997; Sanes and Lichtman, 1999).