Корешковые и дискогенные болевые синдромы
Источник: «Боль в спине»
Автор: Авторы: Подчуфарова Е.В., Яхно Н.Н. 2013.
Содержание
Корешковые и дискогенные болевые синдромы
Заболеваемость пояснично-крестцовой радикулопатией в течение жизни составляет 2-5%. Она максимальна в 40-60 лет, а затем постепенно снижается. Поражение поясничных и крестцовых корешков одинаково часто выявляют у мужчин и женщин [J. Frymoyer, 1992]. У мужчин поражение поясничных или крестцовых корешков типично в возрасте 40 лет, а у женщин - в 50-60 лет [A. Tarulli, 2007]. Гораздо меньше известно о распространенности шейной и грудной радикулопатии. По данным наиболее крупного исследования [K. Radhakrishnan и др., 1994], распространенность шейной радикулопатии составляет 83,2 случая на 100 тыс. населения. Существуют отдельные сообщения, что удельный вес радикулопатии грудных корешков не превышает 5% всех случаев вертеброгенных корешковых синдромов [C. Stillerman и др., 2004; L. Almond и др., 2007]. Для формирования радикулопатии имеет значение множество средовых и наследственных факторов. Наиболее хорошо изучены факторы риска развития поясничнокрестцовой радикулопатии. Не установлено ее связи с полом и массой тела [M. Heliovaara и др., 1991]. Рост, возможно, является фактором риска радикулопатии, но только среди мужчин 50-64 лет. Число родов у женщины не связано с риском радикулопатии [M. Heliovaara, 1991, 1987, 1989].
Частота радикулопатии зависит от возраста. Ее редко диагностируют у лиц моложе 20 лет. Относительный ее риск увеличивается на 1,4 каждые 10 лет до достижения 64 лет [M. Heliovaara, 1989]. Радикулопатия часто встречается у ближайших родственников лиц, перенесших оперативное вмешательство по поводу грыжи диска [H. Matsui и др., 1998]. Регулярная ходьба повышает риск ее развития почти в 2 раза. Бег трусцой имеет двоякий эффект: у тех, кто не страдал от боли в спине на время начала занятий бегом, риск развития радикулопатии ниже, чем в здоровой популяции, а у тех, кто начал заниматься бегом после эпизода боли в спине, - выше [H. Miranda и др., 2002]. Определенные виды трудовой деятельности также повышают частоту развития радикулопатии. Она выше у операторов станков, плотников, водителей, фермеров, при работе в неудобном положении, особенно при сгибании и поворотах туловища или при подъеме рук выше плечевого пояса [H. Riihimaki и др., 1989, 1994; H. Miranda и др., 2002]. Риск развития как пояснично-крестцовой, так и шейной радикулопатии повышается при курении [M. Goldberg и др., 2000; V. Kostova, M. Koleva, 2001].
В подавляющем большинстве случаев повреждение корешков и спинномозговых нервов обусловлено вертебральными причинами - наличием грыжи межпозвоночного диска, дегенеративными изменениями в межпозвоночных суставах, узким позвоночным каналом. Поражение корешков может быть связано с новообразованиями: невриномами корешков, первичными и метастатическими опухолями позвонков, карциноматозом мозговых оболочек; врожденными аномалиями: артериовенозными мальформациями, арахноидальными и синовиальными кистами; инфекцией: остеомиелитом, эпидуральным абсцессом, туберкулезом, опоясывающим герпесом, болезнью Лайма, ВИЧ-инфекцией; воспалительными заболеваниями: саркоидозом, васкулитами; эндокринными и метаболическими расстройствами: сахарным диабетом, болезнью Педжета, акромегалией. Помимо дегенеративно-дистрофических изменений позвоночника указанные причины в совокупности составляют менее 1% случаев радикулопатии [A. Tarulli, 2007].
Патогенез и патофизиология дискогенных болевых синдромов
Основная функция межпозвоночных дисков - распределение нагрузки, связанной с массой тела и мышечной активностью, по позвоночному столбу. Межпозвоночные диски при этом обеспечивают наклоны вбок, вперед и вращение. Высота диска составляет примерно 7-10 мм, диаметр - около 40 мм. Диск состоит из толстого наружного фиброзного кольца, окружающего желатинозное содержимое - пульпозное ядро, сверху и снизу ограниченное хрящевыми концевыми пластинками.
Пульпозное ядро содержит коллагеновые волокна, расположенные внешне хаотично, и эластиновые волокна, упорядоченные в радиальном направлении. Коллагеновые волокна пульпозного ядра погружены в высокогидратированный гель, в нем же расположены клетки, подобные хондроцитам. Вода - главная составляющая пульпозного ядра. У молодых лиц оно более чем на 85% состоит из воды. К зрелому возрасту ее содержание уменьшается до 75% и далее продолжает снижаться. При нагрузке на диск вода выдавливается из пульпозного ядра и всасывается в него обратно при ее устранении. Основными факторами, увеличивающими нагрузку на диск, считают сокращение мышц, натяжение связок, увеличение массы тела и противодействие гравитации. Наибольшие компрессионные усилия на диск оказывает мышечное сокращение, в частности мощных мышц, выпрямляющих позвоночник. Соответственно, внутридисковое давление зависит в первую очередь от позы и движений позвоночника. Количество жидкости в пульпозном ядре постоянно меняется в течение дня, и эта циклическая компрессия важна для питания диска.
Фиброзное кольцо состоит из 15-25 концентрических колец или пластинок с параллельно расположенными в них коллагеновыми волокнами. В каждой пластинке волокна расположены с отклонением примерно на 60° от вертикальной оси. При этом волокна двух соседних слоев ориентированы разнонаправлено (либо слева направо, либо справа налево), так что угол между ними составляет 90°. Вероятно, это обеспечивает дополнительную прочность. Эластиновые волокна находятся между пластинками и, возможно, способствуют возвращению диска в первоначальное состояние после наклонов вперед и назад. Они также могут связывать пластинки между собой, так как расположены от одной пластинки к другой радиально [S. Bruehlmann и др., 2002].
Благодаря косой ориентации волокон фиброзное кольцо лучше противодействует скручивающим (торзионным) нагрузкам, а чередование направления волокон в соседних слоях обеспечивает сопротивление практически всем видам нагрузки на ПДС, включая его смещение. Несмотря на отсутствие растяжимости коллагеновых волокон, фиброзное кольцо имеет возможности для механической деформации и обеспечения гибкости в ПДС. Это достигается возможностью коллагеновых пластин смещаться относительно друг друга. Сзади фиброзное кольцо тоньше и его пластины слабее скреплены между собой. Это частично связано с эксцентрическим положением пульпозного ядра и предрасполагает к частому формированию дегенеративных изменений именно в этой части фиброзного кольца. Задние отделы фиброзного кольца подвергаются большей нагрузке при наклонах вперед и вращении. Фиброзное кольцо наиболее уязвимо при воздействии сил, направленных на смещение позвонков относительно друг друга, которое может приводить к отделению пластин кольца друг от друга [J. Taylor, L. Giles, 1997].
Третья структура в составе межпозвоночного диска - хрящевая концевая пластинка: тонкий (менее 1 мм) горизонтальный слой гиалинового хряща. Ее коллагеновые волокна расположены горизонтально и параллельно телу позвонка. Хрящевая концевая пластинка обеспечивает пассивную диффузию питательных веществ в диск, создает барьер, препятствующий потере протеогликанов, а также выполняет механическую функцию, выдерживая часть гидростатического давления, оказываемого на нее пульпозным ядром.
Биомеханическая функция диска реализована с участием трех его составляющих: коллагеновых волокон, аггрекана и матрикса. Основной состав диска - протеогликаны, коллаген и вода. Относительно небольшую его часть (2-5%) составляют клетки. Коллагеновые волокна, представленные в основном коллагеном I и II типа, составляют примерно 70 и 20% сухой массы фиброзного кольца и пульпозного ядра соответственно. Они обеспечивают устойчивость диска к растяжению и фиксируют его к позвонку. Аггрекан - основной протеогликан диска. В его состав входят цепочки гликозаминогликанов - хондроитинсульфата и кератансульфата, благодаря которым поддерживается гидратация диска. Содержание протеогликана и воды в пульпозном ядре (в среднем 15 и 80% соответственно) выше, чем в фиброзном кольце (приблизительно 5 и 70% соответственно). Матрикс - легкоизменяющаяся структура. Составляющие его молекулы постоянно разрушаются протеиназами, такими, как матриксные металлопротеиназы (ММП) и аггреканазы, которые вырабатываются клетками диска. Равновесие между синтезом, разрушением и накоплением матриксных макромолекул определяет состояние и механическую функцию диска в целом [P. Raj, 2008].
Взаимодействие между пульпозным ядром и фиброзным кольцом происходит, когда пульпозное ядро получает вертикальную нагрузку. Поскольку пульпозное ядро относительно несжимаемо (может только смещаться), оно перераспределяет вертикальную силу давления в силу, направленную радиально, и при этом ей противодействуют волокна фиброзного кольца. Основные мышцы, оказывающие компрессионное воздействие на межпозвоночные диски в поясничном отделе позвоночника, - подвздошно-поясничная мышца и мышца, выпрямляющая позвоночник. Доказано, что вертикальная компрессия диска, даже при повреждении фиброзного кольца, не приводит к формированию экструзии. Считают, что наибольшее повреждение диска вызывают скручивание и наклоны в ПДС. Поскольку ротация обычно сочетается с наклоном в сторону, на диск при этом одновременно воздействуют силы давления и смещения позвонков относительно друг друга [P. Raj, 2008].
У взрослого человека межпозвоночный диск содержит очень мало кровеносных сосудов. Также в диске имеются небольшое количество нервных волокон, которые расположены преимущественно в наружных отделах фиброзного кольца. Хрящевая концевая пластинка лишена кровеносных сосудов и нервных волокон. Считают, что нервные волокна диска представляют собой ветви синувертебрального нерва, первичные передние ветви спинномозгового нерва или серые соединительные ветви [S. Roberts и др., 1995].
При дегенеративных изменениях диска пульпозное ядро повреждается под воздействием не механических нагрузок, а скорее биохимических изменений, происходящих в нем самом. Поскольку вещество пульпозного ядра может выполнять функцию антигена, нарушение барьера между ним и микроциркуляторным руслом тела позвонка при механическом повреждении хрящевой концевой пластинки запускает каскад аутоиммунных реакций. С возрастом пульпозное ядро становится более фиброзированным и менее гелеобразным. В целом диск меняет свою морфологию и становится менее структурированным. Пластинки фиброзного кольца утрачивают свою строгую направленность, раздваиваются и переплетаются. Также теряют свою строгую упорядоченность коллагеновые и эластиновые волокна. В диске начинают формироваться трещины и щели, обычно в области пульпозного ядра. При этом в диске, как правило, обнаруживают нервные окончания и кровеносные сосуды. Отмечается усиление пролиферации клеток, которые образуют кластеры, особенно в области пульпозного ядра. Часть клеток гибнет, что морфологически подтверждают обнаружением в них признаков некрозов и апоптоза. Считают, что более 50% клеток диска взрослого человека некротизированы. Однако крайне трудно отличить признаки «нормального старения» диска от его патологических изменений [P. Raj, 2008].
Наиболее значимое биохимическое изменение, происходящее в диске с увеличением возраста, - утрата протеогликана [G. Lyons и др., 1981]. Молекулы аггрекана начинают распадаться на более мелкие фрагменты.
Гликозаминогликаны утрачиваются, это приводит к падению осмотического давления в матриксе диска и его дегидратации. Однако даже в диске, подвергшемся значительным дегенеративным изменениям, сохраняется способность к синтезу больших молекул аггрекана.
Несмотря на то что коллаген диска изменяется с возрастом, его изменения не так очевидны, как нарушения структуры протеогликана. Как правило, меняется не абсолютное количество коллагена, а его типы и распределение. Фибриллярный коллаген, например II типа, становится более денатурированным, частично при действии ферментов. Однако, как и в случае с протеогликанами, несмотря на дегенерацию диска, возможен синтез новых молекул коллагена [P. Raj, 2008].
Интересно, что пульпозное ядро практически отсутствует в дисках шейного отдела позвоночника у людей старше 40 лет, и после этого возраста формирование его экструзии с компрессией нервных структур практически невозможно. Шейный диск состоит из фиброзного кольца, включающего в себя «островки» гиалинового хряща, содержит мало воды, очень небольшое количество протеогликанов, структурно напоминая связку [J. Bland, 2005].
Утрата протеогликанов оказывает основное негативное влияние на способность диска противостоять механическим нагрузкам [J. Urban, J. McMullin, 1988]. Утрачивая воду, диск не может гидростатически противостоять нагрузке. При этом большая ее часть ложится на фиброзное кольцо и концевую пластинку. Такие изменения диска отражаются на состоянии и других структур позвоночника, предрасполагая их к повреждению. Как правило, в результате снижения высоты диска увеличивается нагрузка на дугоотростчатые суставы, в которых развиваются дегенеративные изменения. Также может уменьшаться натяжение желтой связки, ее утолщение и выбухание в позвоночный канал, что считают одним из факторов его стенозирования, особенно значимым в пожилом возрасте.
Кроме указанных изменений, утрата протеогликанов влияет на перемещение других молекул внутрь и наружу диска. Аггрекан, благодаря высокой концентрации и отрицательному заряду, предотвращает движение крупных неионизированных молекул, например белков сыворотки и цитокинов, в матрикс. Снижение концентрации аггрекана при дегенерации диска приводит к утрате его мелких, но осмотически активных фрагментов и увеличению проникновения в диск таких крупных молекул, как факторы роста нервов и цитокины, что усиливает дегенеративный процесс. Прорастание сосудов и нервных волокон при дегенерации диска, которое отмечено у пациентов с болью в поясничной области, возможно, связано с утратой протеогликанов. Доказано, что аггрекан обладает способностью ингибировать прорастание в диск нервных волокон [W. Johnson и др., 2002; J. Melrose и др., 2002].
В настоящее время общепризнанно что сдавление корешка грыжей диска не может быть единственной причиной формирования болевого синдрома, поскольку протрузии диска выявляют более чем в 70% случаев при обследовании асимптомной популяции. Существует предположение, что нервные волокна становятся сенситизированными к давлению под воздействием молекул воспалительного каскада арахидоновой кислоты: простагландина E2, тромбоксана, а также фосфолипазы А2, ФНО-α, ИЛ, ММП. Клетки диска, в котором сформировалась экструзия, могут продуцировать эти вещества, воздействующие на корешок при формировании тесного контакта между ним и веществом диска. В настоящее время есть две основные теории, объясняющие развитие воспаления в области поврежденного диска . Первая предполагает иммунный механизм, при котором повреждение диска инициирует взаимодействие антител с антигенами пульпозного ядра, в норме не «представленными» иммунной системе, приводя к каскаду биохимических реакций, поддерживающих воспаление. Показано, что экструзия диска вызывает пролиферацию моноцитов и макрофагов, синтезирующих медиаторы воспаления. Другой механизм развития воспаления может быть связан с непосредственным воздействием ферментов, содержащихся в диске, на окружающие ткани. Есть мнение, что вещества, содержащиеся в грыже диска, при воздействии на нервные волокна вызывают аксональную дегенерацию и повреждение леммоцитов. Наличием воспаления, сопровождающего развитие экструзии, можно объяснить эффективность эпидурального введения глюкокортикоидов при компрессионной радикулопатии [P. Raj. 2008].
Одной из основных причин формирования дегенеративных изменений в диске считают нарушение питания его клеток. Снижение концентрации кислорода и уменьшение pH приводят к снижению синтеза клетками диска молекул внеклеточного матрикса, что также ведет к его дегенерации [H. Ishihara, J. Urban, 1999; H. Ohshima, J. Urban, 1992; H. Horner, J. Urban, 2001]. Клетки пульпозного ядра наиболее подвержены ишемии, поскольку кровоснабжаются капиллярами, начинающимися в теле позвонка, пенетрирующими субхондральную пластинку и заканчивающимися над хрящевой концевой пластинкой [J. Urban и др., 1978]. Питательные вещества диффундируют через капилляры концевой пластинки и внеклеточный матрикс к клеткам, которые могут находиться на расстоянии до 8 мм от капиллярной сети. Питание пульпозного ядра может ухудшаться при нарушении кровоснабжения тела позвонка. Атеросклероз, серповидно-клеточная анемия, кессонная болезнь, болезнь Гоше сопровождаются выраженным дегенеративным процессом в позвоночнике [J. Jones, 1997; L. Kauppila, 1997]. Значительные физические нагрузки или их отсутствие также оказывают влияние на диффузию питательных веществ в диск. Показано, что физические упражнения с нагрузкой на позвоночник усиливают потребление диском кислорода и уменьшают выработку лактата, и наоборот, фиксация и иммобилизация позвоночника приводят к противоположному эффекту. Предполагается, что не тяжелые физические упражнения изменяют в лучшую сторону строение капиллярной сети на границе тела позвонка и диска [P. Ray, 2008]. Показано, что длительная физическая активность стимулирует повышение содержания в нем протеогликанов.
Экспериментальные данные свидетельствует о том, что избыточная нагрузка или травматизация диска вызывает его дегенеративные изменения [K. Puustjarvi и др., 1993; J. Iatridis и др., 1999; J. Lotz и др., 1998; O. Osti и др., 1990]. Существует связь боли в спине с тяжелым физическим трудом.
Остается неясным значение генетической предрасположенности в дегенерации дисков. Несколько исследований подтвердили семейную предрасположенность к развитию дистрофических изменений дисков и формированию грыж [J. Heikkila и др., 1989]. У близнецов конкордантность по формированию грыж дисков превышает 60% [M. Battie и др., 1995; P. Sambrook и др., 1999]. Лица с полиморфизмом гена, кодирующего синтез аггрекана, имеют более высокий риск возникновения ранних дистрофических изменений диска [H. Watanabe и др., 1997]. Исследования трансгенных мышей свидетельствуют о том, что мутации генов, кодирующих синтез структурных матриксных белков (аггрекана, коллагена II и IX типов), могут вызывать дегенерацию диска [S. Li и др., 1995; T. Kimura и др., 1996].
Наиболее важным в патогенезе патологии межпозвоночного диска считают повреждение фиброзного кольца. Если фиброзное кольцо повреждается при воздействии сил, превышающих механические свойства волокон, оно больше не может выполнять стабилизирующую или ограничивающую функцию при движении тел позвонков или повышении давления пульпозного ядра. При этом зона повреждения фиброзного кольца не может оказывать достаточного сопротивления давлению пульпозного ядра, в результате чего возникает прогиб волокон фиброзного кольца и выбухание диска. Повреждение фиброзного кольца, предрасполагающее к формированию грыжи диска, может быть следствием повторных микротравм, длительного воздействия вибрации или статической нагрузки, а также единичной травмы обычно из-за форсированного скручивающего движения позвоночника. Пролонгированное разгибание (в частности, при гиперлордотической деформации позвоночника) может оказывать большее воздействие на более слабые от природы задние отделы фиброзного кольца, предрасполагая его к большему повреждению. Сочетание наклона вперед с вращением создает условия для растяжения косорасположенных коллагеновых волокон диска. Если при этом сила растяжения превышает способность волокон диска к сопротивлению посредством его эластических свойств, происходит их необратимое удлинение и снижение резистивной и стабилизирующей функции фиброзного кольца. Повреждение задних отделов фиброзного кольца происходит по аналогичному механизму при пролонгированных статических нагрузках с наклоном туловища вперед. В начале наклона вперед ось вращения находится в области пульпозного ядра, но по мере движения центр вращения медленно смещается кпереди и все структуры, находящиеся кзади от оси вращения, значительно растягиваются.
В поясничном отделе позвоночника до 90% протрузий и экструзий локализуются на уровне Liv-Lv и Lv-SI в шейном - в 45-60% случаев их можно обнаружить на уровне С-С. Экструзии и секвестры диска могут состоять из пульпозного ядра, фиброзного кольца, хрящевой концевой пластинки и различных сочетаний этих элементов. При этом в молодом возрасте гелеобразное пульпозное ядро, оказывая более высокое давление, легче проникает между поврежденны-
ми волокнами фиброзного кольца, что обусловливает более частое формирование радикулопатии у молодых (20-45 лет) по сравнению с пожилыми. Интересно, что у пожилых пациентов отмечают более частое формирование грыж межпозвоночных дисков на уровне выше чем LIV-LV.
Связь поражения корешков спинномозговых нервов с наличием грыжи диска предполагали еще в начале XX в. G. Schmorl и A. Andrae (1929) описали задние протрузии дисков, выявленные при аутопсии. Однако они не связали найденные изменения с состоянием, известным как «ишиас», а расценили их как асимптомные изменения диска [по M. Stafford и др., 2007]. В 1931 г. C. Eleberg описал удаленные им из позвоночного канала пациентов с «ишиасом» «хрящевые опухоли» и предположил, что они представляют собой фрагменты грыжи диска. Однако эта идея была подвергнута сомнениям. Позже ее подтвердили W. Mixter и J. Barr (1934) [по M. Stafford и др., 2007]. С этого времени компрессию диска грыжей признали наиболее частой причиной поражения поясничных и крестцовых корешков. Изолированное участие компрессионного механизма в формировании болевого синдрома при радикулопатии поставил под сомнение M. Kelly в 1956 г., сравнивший воздействие на корешок опухоли и грыжи диска и предположивший, что изолированно компрессия корешка без развития в нем воспаления не может быть причиной боли. O. Lindahl и B. Rexed (1951) при интраоперационных исследованиях выявили воспалительные изменения в корешках и предположили, что они связаны с грыжей межпозвонкового диска. Отечественные исследователи также активно изучали иммунные механизмы формирования радикулопатии [А.И. Осна и др., 1970; В.И. Латышева и др., 1985; М.Д. Благодатский, Ю.В. Солодун, 1987, 1988; В.В. Галимский, 1999]. В настоящее время теория об участии воспаления в формировании радикулопатии, связанной с грыжей диска, активно развивается.
В патогенезе радикулопатии имеет значение комплексное взаимодействие воспалительных, иммунологических и компрессионных механизмов.
В пользу участия воспаления в патогенезе радикулопатии свидетельствуют данные экспериментальных работ, в которых нанесение вещества пульпозного ядра на структуры позвоночного канала (корешки, твердую мозговую оболочку) приводило к развитию в них выраженной воспалительной реакции [R. McCarron и др., 1987]. В веществе грыжи диска, полученном при оперативном вмешательстве по поводу радикулопатии, выявлено значительное повышение активности фосфолипазы A2 - важного фермента воспалительных реакций [J. Saal и др., 1990]. Фосфолипаза А2 способствует высвобождению арахидоновой кислоты и повышению концентрации лейкотриенов и тромбоксанов. Отмечена связь между содержанием фосфолипазы A2 в веществе грыжи диска и плазме крови [M. Piperno и др., 1997]. Введение фосфолипазы A2 в эпидуральное пространство у крыс приводит к двигательным и чувствительным расстройствам в конечностях и формированию эктопических разрядов в поясничных корешках. При гистологическом исследовании нервов и корешков в этом случае выявляют признаки демиелинизации [C. Chen и др., 1997]. В веществе межпозвоночных дисков, полученном интраоперационно, отмечено повышенное содержание лейкотриена В4 и тромбоксана В2 [O. Nygaard и др., 1997]. Еще одно подтверждение провоспалительных свойств пульпозного ядра было получено при введении его материала экспериментальным животным. Нанесение содержимого собственного пульпозного ядра на корешки спинномозговых нервов крыс приводило к снижению кровотока в узле заднего корешка и эндоневральному отеку [S. Yabuki и др., 1998].
В патогенезе развития радикулопатии пока не ясно значение цитокинов. В межпозвоночных дисках пациентов, оперированных по поводу радикулопатии, отмечено повышение уровня ИЛ-1α, ИЛ-β, ИЛ-6, ИЛ-8, простагландина Е2 и ФНО-α [H. Takahashi и др., 1996; J. Burke и др., 2002, H. Brisby и др., 2002].
Цитокины, особенно ФНО-α, усиливают синтез мощного медиатора воспаления - оксида азота. В экспериментах на животных активность синтетазы оксида азота повышалась при воздействии содержимого пульпозного ядра на корешки спинномозговых нервов, а ее ингибирование уменьшало выраженность отека корешка и улучшало СПВ по нервным волокнам [H. Brisby и др., 2000].
Наиболее тесная связь отмечена между выраженностью воспаления, связанного с воздействием на содержимое позвоночного канала вещества пульпозного ядра, и активностью ФНО-α. В частности, в экспериментах на животных показано, что нарушение проведения импульса по корешкам, на которые наносили вещество пульпозного ядра, полностью регрессировало при введении доксициклина, способного ингибировать ФНО-α [K. Olmarker, 1998]. Применение других ингибиторов ФНО-α - этанерцепта и инфликсимаба в экспериментах на животных уменьшает интраневральный отек, частоту внутрикапиллярного тромбообразования, повышенную активность нейронов заднего рога спинного мозга и улучшает проведение возбуждения по корешкам, подвергшимся воздействию веществом пульпозного ядра [A. Onda, 2003; K. Olmarker, 2001]. Пилотное исследование моноклональных антител к ФНО-α - введение инфликсимаба пациентам с компрессинной радикулопатией - показало уменьшение интенсивности боли, сохранявшееся 3 мес [J. Karppinen, 2003].
Иммунная система также может опосредовать воздействие пульпозного ядра на корешки спинномозговых нервов. У пациентов с радикулопатией повышен титр антител к гликосфинголипидам. В норме титр антител к этим клеточным компонентам очень низкий. Он повышается при некоторых аутоиммунных поражениях нервной системы, в частности при синдроме Гийена-Барре. В цереброспинальной жидкости пациентов с радикулопатией также повышен уровень маркеров клеточного повреждения - белков нейрофиламентов и белка S-100 [H. Brisby и др., 1999]. Эти данные показывают, что иммунные реакции, направленные против нервной ткани, могут принимать участие в патогенезе радикулопатии.
Кроме перечисленных механизмов, собственно компрессионное воздействие может иметь значение в развитии поражения корешков. В экспериментах на животных показано, что прямая компрессия корешка спинномозгового нерва (а не изолированное воздействие на него содержимого пульпозного ядра) приводит к повышению содержания белков нейрофиламентов в цереброспинальной жидкости [J.S. Skouen, 1999]. Только сочетание смещения корешка спинномозгового нерва с воздействием на него вещества пульпозного ядра приводит к изменению порогов чувствительности к механическим и тепловым стимулам [R. Myers, K. Olmarker, 1998]. Пояснично-крестцовые корешки обладают повышенной чувствительностью к сдавлению из-за относительно легко возникающей компрессии их вен, которая предрасполагает к быстрому формированию отека и интраневрального воспаления [А.Г. Глауров, 1986; B. Rydevik и др., 1991]. В отличие от периферических нервов вены в корешках не сопровождают артерии, а спиралевидно располагаются в глубине нервной ткани. Гематоневральный барьер между капиллярами и аксонами корешка более проницаем, чем у периферического нерва, в частности, для альбуминов сыворотки крови. Этим объясняется более частое формирование отека в корешках, по сравнению с периферическими нервами [H. Yoshizawa, H. Crock, 1997]. Значение нарушений микроциркуляции при формировании компрессионной радикулопатии показано в работах российских исследователей [С.П. Миронов и др., 2006]. Скорее всего, изолированное нарушение венозного оттока не приводит к воспалению в корешках, но может предрасполагать к его развитию при воздействии других патогенетических факторов.
Таким образом, болевой синдром при компрессионной радикулопатии вероятно носит смешанный характер. Ноцицептивный механизм принимает участие в его формировании при активации ноцицепторов в поврежденном диске и окружающих его тканях, содержащих свободные нервные окончания (в первую очередь в самих корешках и твердой мозговой оболочке). Повреждение диска инициирует иммунное воспаление, а также воспалительную реакцию, связанную с непосредственным воздействием ферментов, содержащихся в диске, на окружающие ткани. Ноцицепторы диска, корешка и других структур внутри позвоночного канала сенситизируются под воздействием молекул воспалительного каскада арахидоновой кислоты: простагландина E2, тромбоксана, фосфолипазы А2, ФНО-α, ИЛ, ММП. Невропатический компонент болевого синдрома при дискогенной радикулопатии может быть связан как с повреждением корешка при его компрессии, отеке, ишемии и формировании интраневрального воспаления, так и в результате аксональной дегенерации и повреждения шванновских клеток на фоне иммунных реакций, направленных против нервной ткани, а также при непосредственном токсическом воздействии веществ, содержащихся в грыже диска.
Дискогенная радикулопатия
Одной из основных причин формирования радикулопатии считают грыжу межпозвоночного диска. Боль, связанная с поражением корешков грыжей межпозвоночного диска, носит неоднородный характер. Классическая картина компрессионной радикулопатии заключается в остром развитии стреляющей, прокалывающей, реже - жгучей боли и парестезий, сочетающихся со снижением чувствительности (гипалгезией) в зоне иннервации пораженного корешка. Кроме чувствительных расстройств, характерно развитие слабости в индикаторных мышцах, иннервируемых пораженным корешком, а также снижение (выпадение) соответствующего сухожильного рефлекса.
При корешковой компрессии обычно отмечается усиление боли при повышении внутрибрюшного давления (при кашле, чихании), в вертикальном положении и уменьшение в горизонтальном положении. Шейная радикулопатия в подавляющем большинстве случаев начинается без четких провоцирующих причин с возникающей в утреннее время боли в шее с иррадиацией в руку. Характерный симптом - ощущение скованности в мышцах шеи. Зона иррадиации боли зависит от локализации поражения. Часто оказываются положительными пробы на корешковую компрессию: наклон головы в больную сторону с последующим аксиальным давлением на нее приводит к появлению или усилению иррадиирующей боли и парестезий в руке. В случае экстрадуральной (дискогенной) компрессии шейных корешков уменьшение болевого синдрома отмечается при отведении руки в плечевом суставе или когда пациенты принимают вынужденное положение с заведением руки за голову [B. Kuijper и др., 2009].
В 45-60% случаев поражается корешок СVII при его сдавлении грыжей диска С-С. В 20-25% случаев отмечается компрессия корешка грыжей диска СV-СVI. На компрессионную радикулопатию СVI и СVIII корешков приходится по 10% случаев.
Поражение верхних шейных корешков встречается относительно редко. Обычно они уязвимы при патологии шейного отдела позвоночника у пациентов с ревматоидным артритом, при подвывихах в атлантозатылочных суставах. Боль при поражении верхних шейных корешков может иррадиировать в затылочную, височную и периорбитальную область, в шею и надплечье. В 50-70% случаев задние корешки сегмента С1 отсутствуют. Дерматому СII соответствует зона иннервации формирующегося из корешка С большого затылочного нерва, которая включает в себя затылочную область от большого затылочного отверстия до макушки, ограниченную латерально сосцевидными отростками. Дерматому СIII соответствует зона иннервации малого затылочного нерва (ушная раковина, сосцевидный отросток, угол нижней челюсти, нижнелатеральная часть затылочной области). Боль при поражении корешка СIV иррадиирует преимущественно в шею и надплечье, при такой локализации поражения чувствительные нарушения могут появляться на боковой поверхности шеи. Патогномоничного паттерна клинически определяемых двигательных нарушений при поражении верхних шейных корешков не выявлено [D. Dubuisson, 2006].
Поражение корешков с уровня ТII по LI в основном проявляется опоясывающей болью в области туловища. Боль, связанная с поражением грудных корешков грыжей диска, как правило, провоцируется кашлем, чиханием и натуживанием. Часто она отличается ноющим, жгучим или стягивающим характером. Слабость мышц туловища не типична для монорадикулярного поражения, или ее трудно выявить клинически. Поражение грудных корешков требует обязательного дифференциального диагноза с невертеброгенной патологией (опоясывающий герпес, опухолевое поражение корешка или позвоночника, эпидуральный абсцесс, диабетическая тораколюмбальная радикулопатия). Инфильтрация корешков опухолью обычно встречается при метастатическом поражении ребер, позвоночника, забрюшинного пространства. Может отмечаться поражение нескольких спинномозговых корешков. Типично усиление болей при кашле и чихании. Вовлечение нервных корешков может быть односторонним или двусторонним. Диабетическая тораколюмбальная радикулопатия встречается при II типе сахарного диабета. Для этого состояния характерны одноили двусторонние стреляющие или жгучие боли в области грудной клетки или живота, сопровождающиеся гипералгезией, а иногда аллодинией в зоне иннервации пораженного корешка. Для эпидурального абсцесса, локализующегося в грудном отделе позвоночника, характерен невропатический болевой синдром в зоне иннервации пораженных корешков, сопровождающийся повышением температуры, локальной (ноцицептивной) болью в позвоночнике, иногда отмечается нижний парапарез.
Большинство грыж межпозвоночных дисков, поражающих поясничные и крестцовые корешки, выявляют на уровне LIV-LV (59%) (с компрессией корешка LV), следующий по частоте поражения - уровень LV-SI (30%) (с компрессией корешка SI), реже отмечаются грыжи на уровне LIII-LIV [K. Malik, H. Benson, 2008]. Высокая частота поражения ПДС на уровне LIV-LV и LV-SI связана с биомеханическими особенностями этих сегментов. Поскольку межпозвоночный диск относительно хорошо противостоит компрессионным нагрузкам, основной причиной его повреждения становятся перегрузки, связанные с вращением и сгибанием. Амплитуда сгибания в поясничном отделе позвоночника в двух указанных сегментах выше (20-25° в каждом), чем в остальных ПДС в поясничном отделе [J. Porterfield, 1998]. В то же время известно, что наклон вперед - движение, наиболее часто встречающееся в повседневной жизни. Кроме этого, межпозвоночные диски на уровне LIV-LV и LV-SI для поддержания поясничного лордоза имеют клиновидную форму в сагиттальной плоскости с утолщением передних отделов почти в 2 раза больше по сравнению с задними, что, возможно, также предрасполагает к большей частоте повреждения лежащих кзади сегментов фиброзного кольца. Известно, что дугоотростчатые суставы на указанных уровнях из-за необходимости противостоять силе, направленной на смещение позвонка кпереди, которую прилагает гравитация к ПДС, участвующему в формировании лордоза, наиболее часто подвергаются дегенеративным изменениям, а при их патологии основная нагрузка ложится на межпозвоночный диск. Сегмент LV-SI при флексии и вращении дополнительно стабилизирует подвздошно-поясничная связка. Отсутствие такого пассивного «стабилизатора» на уровне ПДС LIV-LV, возможно, приводит к более частой перегрузке и повреждению межпозвонкового диска [L. Giles, 1997].
У 50% пациентов с радикулопатией пояснично-крестцовых корешков формируется наклон туловища в сторону (сколиоз), исчезающий в положении лежа, что обусловлено сокращением преимущественно квадратной мышцы поясницы. Симптом Ласега имеет 80% чувствительность и 40% специфичность для выявления экструзии диска.
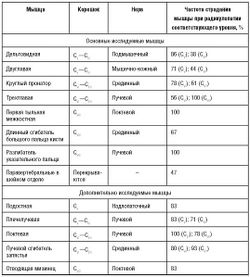
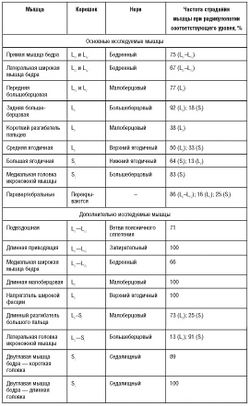
Характерные чувствительные, двигательные и рефлекторные нарушения при наиболее часто встречающихся вариантах компрессионной радикулопатии шейных и пояснично-крестцовых корешков представлены в табл. 3-2 и 3-3.
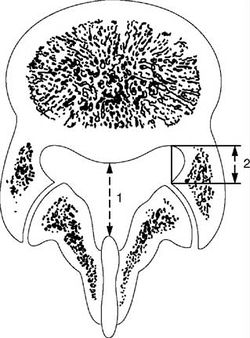
Компрессия корешка может происходить в корешковом канале (латеральном кармане - области между заднебоковой поверхностью тела позвонка и верхним суставным отростком) и в межпозвоночном отверстии, нередко она связана с наличием латеральной грыжи диска, а чаще с латеральным стенозом позвоночного канала в результате гипертрофии дугоотростчатых суставов [D. Long, 2006]. Выделяют стеноз «зоны входа», стеноз «средней зоны» и стеноз «зоны выхода» корешка из межпозвоночного отверстия. «Зона входа» в межпозвоночное отверстие - латеральный карман. Основная причина компрессии корешка в этой области - гипертрофия верхнего суставного отростка дугоотростчатого сустава, врожденные изменения формы, размера, ориентации дугоотростчатых суставов и остеофиты края тела позвонка. «Средняя зона» спереди ограничена задней поверхностью тела позвонка, сзади - межсуставной частью дужки позвонка, медиальные отделы этой зоны открыты в область центрального канала. Основными причинами стеноза «средней зоны» считают появление остеофитов в месте прикрепления желтой связки и гипертрофию суставной сумки дугоотростчатого сустава. «Зона выхода» ограничена спереди нижележащим межпозвоночным диском, сзади - наружными отделами дугоотростчатого сустава. Причины компрессии корешка в «зоне выхода» - гипертрофия и подвывихи дугоотростчатых суставов, остеофиты у верхнего края межпозвоночного диска [А.Ю. Смирнов, 1999]. Боль при латеральной компрессии корешка обычно сохраняется в покое, нарастая при ходьбе и пребывании в вертикальном положении. Она не усиливается при кашле и чихании. Симптомы натяжения, как правило, выражены слабо. Наклоны вперед ограничены меньше, чем при срединной или парамедианной экструзии, а болевые ощущения, как правило, провоцируют разгибание и ротация. При стенозе корешкового канала клиническая картина, в отличие от компрессии корешка грыжей межпозвоночного диска, развивается постепенно. Для изолированного сужения корешкового канала перемежающаяся хромота не характерна. При нейровизуализации выявляют латеральную грыжу диска или стеноз на уровне, соответствующем выходу пораженного корешка через межпозвоночное отверстие (в частности, типично поражение корешка LV грыжей диска LV-SI).
Отдельным состоянием, связанным с компрессией спинномозговых корешков и сопровождающих их сосудов, на поясничном или крестцовом уровне (обычно поражается корешок LV или SI), считают парализующий ишиас. Парализующий ишиас - редкое состояние, встречающееся в 1% случаев пояснично-крестцовых радикулопатий. При этой патологии паралич мышц стопы значительно преобладает над выраженностью чувствительных нарушений. Быстрому (от нескольких часов до 1-3 сут) нарастанию двигательных расстройств, вплоть до плегии в мышцах стопы, обычно предшествует недлительный корешковый болевой синдром. Я.Ю. Попелянский выделяет изолированный «корешковый» сосудистый синдром, связанный, предположительно, со сдавлением грыжей диска vasae nervori, и «спинальный синдром», связанный с поражением дополнительной радикуломедуллярной артерии, когда помимо корешкового поражения у пациентов определяют симптомы ишемии спинного мозга [Я.Ю. Попелянский, 1997]. По-видимому, дополнительные радикуломедуллярные артерии в основном кровоснабжают корешки конского хвоста, но также участвуют в механизмах компенсации кровообращения всего поясничного утолщения. Доказано, что дополнительная радикуломедуллярная артерия участвует в кровоснабжении спинного мозга у 15-17% людей [Г. Лазорт, 1977]; А.А. Скоромец и др. [1998]. указывают, что в патогенезе парализующего ишиаса основное значение имеет нарушение кровообращения в эпиконусе спинного мозга, связанное с компрессией дополнительной радикуломедуллярной артерии, и предлагает обозначать клиническую картину парализующего ишиаса термином «радикуломиелоишемия» с уточнением пораженных сегментов спинного мозга.
Данные визуализации (КТ, МРТ) позвоночника необходимо анализировать в совокупности с клиническими проявлениями радикулопатии. Прямой зависимости между размерами канала и появлением признаков компрессии корешков нет, хотя вероятность их повреждения тем больше, чем значительнее размер грыжи диска и чем меньше исходные размеры центрального и латерального позвоночных каналов [О.А. Черненко и др., 1996]. Острая и быстро возникающая компрессия приводит к значительно более грубым повреждениям тканей, чем постепенная или периодическая.
КТ и МРТ имеют сходную чувствительность (62-90% и 60-100% соответственно) и специфичность (70-87% и 43-97% соответственно) для выявления грыжи межпозвоночного диска, но при МРТ можно получить более детальную картину состояния невральных структур и мягких тканей [D. Gregory и др., 2008; J. Jarvik, R. Deyo, 2002]. Иногда полезна стандартная контрастная миелография или КТ-миелография, но эти методы являются инвазивными, и их использование ограничено диагностически сомнительными случаями после интерпретации данных КТ или МРТ. Сроки проведения нейровизуализационного обследования определяет наличие маркеров потенциально опасных заболеваний позвоночника (см. «Обследование пациентов с болью в спине») и динамика заболевания. Экстренное проведение КТ или МРТ показано при наличии симптомов компрессии корешков конского хвоста, нарастании пареза, признаках миелопатии. Их применение в короткие сроки необходимо также при подозрении на инфекционное, опухолевое, воспалительное поражение позвоночника и в диагностически неясных случаях. При отсутствии потенциально опасных состояний нейровизуализацию можно проводить на 4-6-й неделе со времени возникновения симптомов. Эти временные рамки совпадают с рекомендоваными сроками консервативного лечения радикулопатии и определения дальнейшей тактики ведения пациента (оперативного или продолжения консервативного лечения) [D. Gregory и др., 2008; University of Michigan Health System, 2003]. Проспективное исследование свидетельствует о достоверном уменьшении размеров экструзий и секвестраций дисков (75-100% случаев) и признаков компрессии корешков и спинноозговых нервов (21-80% случаев) через 14 мес наблюдения за пациентами с компрессионной радикулопатией, получавшими консервативное лечение. Положительная динамика визуализационных изменений не зависила от метода лечения и возраста пациентов [T. Jensen и др., 2006].
В качестве инструментальных методов диагностики при радикулопатии применяют ЭНМГ и игольчатую ЭМГ. СПВ по двигательным волокнам у пациентов с радикулопатией обычно остается нормальной даже при выявлении слабости в пораженном миотоме из-за того, что только часть волокон в пределах нерва оказывается поврежденной. Анализ амплитуд М-ответов и СПВ по двигательным волокнам не отличается высокой чувствительностью в отношении выявления корешкового уровня поражения, но полезен для дифференцировки этого состояния от периферических невропатий.
СПВ по чувствительным волокнам периферических нервов при радикулопатии также обычно остается нормальной, поскольку компрессия корешков происходит проксимальнее спинномозгового ганглия. Эта особенность часто помогает дифференцировать поражение корешка от поражения нерва или сплетения, поскольку в двух последних случаях часто отмечается повреждение чувствительных волокон. Исключение составляет радикулопатия LV. Поскольку спинномозговой ганглий LV в 40% случаев расположен в спинномозговом канале, он может поражаться при дегенеративных изменениях позвоночника, что вызывает антероградную дегенерацию аксонов чувствительных клеток. В таких случаях при стимуляции поверхностного малоберцового нерва S-ответы могут отсутствовать.
Особое внимание в диагностике радикулопатий традиционно уделяют таким показателям, как F-волна и Н-рефлекс, которые характеризуют проведение импульса по наиболее проксимальным сегментам нервов.
F-волны - поздние моторные ответы, которые чаще регистрируют на руках со срединного и локтевого нервов (мышцы возвышения большого пальца и мышцы возвышения мизинца соответственно), а на ногах - с большеберцового и малоберцового нервов (мышца, отводящая большой палец, и короткий разгибатель пальцев соответственно). F-волны распространяются по двигательным волокнам сначала в антидромном (к спинному мозгу), затем в ортодромном (к месту регистрации) направлении. Они отличаются различнй латентностью и амплитудой (примерно 5% амплитуды М-ответа соответствующей мышцы). Полагают, что для оценки состояния проксимальных отделов двигательных аксонов нервных проводников имеют значение количество выпадений F-волн, минимальная и максимальная латентность, показатель их разброса (хронодисперсия), минимальная, максимальная и средняя СПВ и их разброс (тахеодисперсия) [В.Н Команцев., В.А. Заболотных, 2001]. Тем не менее значение F-волн в диагностике радикулопатии остается предметом дискуссии. Частота выявления F-волн в норме колеблется от 20 до 100% в зависимости от исследуемого нерва. Процент выявления F-волн для локтевого нерва составляет 90%, для малоберцового нерва - 40% [В.Н. Команцев, В.А. Заболотных, 2001]. Отсутствие F-волн при стимуляции срединного, локтевого или большеберцового нерва при нормальной амплитуде М-ответов с соответствующей мышцы позволяет предполагать наличие блока проведения или недавно развившееся (менее 5-8 сут) аксональное повреждение проксимальнее точки стимуляции. Эти изменения отмечают как при изолированном вертеброгенном поражении корешка, так и при демиелинизирующих полирадикулоневропатиях.
Обычно измеряют минимальную латентность F-волны - из регистрируемых F-волн выявляют волну с минимальным латентным периодом. Однако ее абсолютные значения нельзя считать надежным критерием для вывода о нарушении проведения импульса по проксимальным сегментам нерва из-за зависимости этого показателя от возраста и роста пациента. Увеличение минимальной латенции F-волны отмечают при равномерном поражении всех волокон в проксимальном сегменте нерва, что крайне редко отмечается при радикулопатии. Для более точной количественной оценки параметров F-волны электрофизиологами предложена оценка СПВ по F-волне, которая не зависит от роста и ее всегда можно сопоставить с СПВ по дистальному участку нерва [J. Kimura, 1974; В.Н. Команцев, В.А. Заболотных, 2001].
Кроме указанных выше показателей F-волн, некоторые исследователи предлагают оценивать длительность F-волны, ее среднюю латентность и хронодисперсию (разница между минимальной и максимальной латентностью в последовательной серии стимулов) [C. Panayiotopoulos, E. Chroni, 1996]. По отдельным данным, совместное применение оценки этих параметров увеличивает чувствительность анализа F-волн при радикулопатии корешков L5 и S1 до уровня, сравнимого с чувствительностью игольчатой ЭМГ [A. Berger и др., 1999, M. Toyokura, K. Murakami, 1997]. В одном исследовании показано увеличение хронодисперсии F-волн у пациентов со стенозом позвоночного канала и поражением корешков LV и SI через 3 мин после пребывания в положении стоя [L. Tang и др., 1988]. В то же время M. Aminoff (2005) отмечает, что «F-волны обычно не изменены у пациентов с предполагаемой радикулопатией, а если такое нарушение все-таки отмечается, ему всегда соответствуют изменения при игольчатой ЭМГ, которые более точно помогают установить диагноз».
Игольчатая ЭМГ - достаточно чувствительный метод для диагностики радикулопатии. Для правильной интерпретации данных необходимо выявить патологические изменения неврального характера в двух или более мышцах, иннервирующихся одним корешком, но разными периферическими нервами. Выявление поражения всех мышц в пределах одного миотома не обязательно, но мышцы прилежащих сегментов должны быть интактны. В частности, у пациента с изолированным поражением корешка CVII должны быть интактны двуглавая мышца плеча и первая тыльная межкостная мышца. В пределах миотома желательно исследовать проксимальные и дистальные мышцы для исключения мононевропатии как причины их поражения. Исследование паравертебральных мышц помогает подтвердить проксимальный уровень поражения и исключить плексопатию и моневропатию, однако фибрилляции в паравертебральных мышцах выявляют также при поражении переднего рога спинного мозга и отдельных заболеваниях мышц (некротизирующая миопатия). Кроме того, выявление поражения паравертебральных мышц не позволяет точно установить уровень поражения корешков из-за значительного перекрытия зон иннервации этой группы мышц. Особенности иннервации мышц верхних и нижних конечностей с учетом частоты их вовлечения при поражении корешков указаны в табл. 5-1 и 5-2.
Для диагностики радикулопатии необходимо исследовать мышцы согласно указанным выше рекомендациям и выявить в них одно или более из перечисленных ниже изменений: положительные острые волны, потенциалы фибрилляций, снижение рекрутирования двигательных единиц, признаки реиннервации [(увеличение длительности и (или) амплитуды потенциала действия двигательной единицы (ПДДЕ)], полифазные ПДДЕ) [K. Levin, 2002]. Исследование лучше проводить как минимум через 3 нед после появления симптомов, когда появляется денервационная спонтанная активность.
Маркерами остроты процесса считают потенциалы фибрилляций в денервированных мышцах (денервационные изменения), сочетающиеся с нормальными параметрами ПДДЕ. Как правило, потенциалы фибрилляций сначала появляются в более проксимальных (паравертебральных) мышцах, а после - в мышцах конечностей. Реиннервация происходит также в направлении от проксимальных к дистальным отделам, и фибрилляции исчезают в той же последовательности, в которой появились. В паравертебральных мышцах они могут полностью исчезнуть уже через 6 нед, а в дистальных сохраняются до 1-2 лет.
При хроническом течении денервационно-реиннервационного процесса отмечаются признаки текущей реиннервации - изменения амплитуды и длительности ПДДЕ с сопутствующими денервационными изменениями (потенциалами фибрилляций) или без них. На ранних стадиях реиннервации отмечается нестабильность конфигурации ПДДЕ, со временем они приобретают стабильную форму полифазных ПДДЕ с увеличенной длительностью и амплитудой. Эти изменения сохраняются много лет после развития первых симптомов радикулопатии.
Ниже кратко представлена примерная программа ЭМГ-исследования при подозрении на часто встречающиеся корешковые болевые синдромы [K. Levin, 2002].
Поражение корешка CV характеризуется типичным паттерном изменений при игольчатой ЭМГ: примерно с одинаковой частотой поражаются остистые мышцы, двуглавая мышца плеча, дельтовидная и плечелучевая мышца. Все перечисленные мышцы у одного пациента вовлекаются в процесс редко. В неясных случаях можно дополнительно исследовать ромбовидную мышцу. Круглый пронатор (CVICVII) никогда не поражается при радикулопатии CV. Трапециевидная мышца (CIV) также должна оставаться интактной. ЭНМГ редко бывает полезной для диагностики радикулопатии CV Иногда, при тяжелом поражении, отмечают снижение амплитуды М-ответа по подмышечному и мышечно-кожному нервам.
Поражение корешка С. Для корешка CV нет характерного паттерна поражения мышц, который можно выявить при ЭМГ. Иногда нарушения сходны с изменениями, выявляемыми при поражении корешка CV с дополнительным вовлечением трехглавой мышцы (в 50% случаев) и круглого пронатора (в 80% случаев). Поражение последнего обычно выявляют и при радикулопатии CVII. Таким образом, существует значительное сходство ЭМГ-картины радикулопатии корешков CV и CVI и корешков CVI и CVII. Кроме этого, практически нет патогномоничных для поражения корешка CV изменений и при ЭНМГ.
Поражение корешка CVII. Для радикулопатии CVII существует типичный паттерн поражения мышц при игольчатой ЭМГ, характеризующийся вовлечением трехглавой мышцы плеча, локтевой мышцы, лучевого сгибателя запястья и круглого пронатора. Трехглавая мышца плеча вовлекается в патологический процесс во всех случаях радикулопатии CVII. Мышцы, иннервирующиеся из прилежащих сегментов [в частности, двуглавая мышца плеча (CVI-CVII) и разгибатель указательного пальца (CVIII)], должны остаться интактными. Изменений при ЭНМГ, патогномоничных для поражения корешка CVI , нет.
Поражение корешка С характеризуется типичным вовлечением мышц, иннервирующихся локтевым нервом, а также длинного сгибателя большого пальца кисти и разгибателя указательного пальца. Из всех корешковых поражений радикулопатия CVIII отличается наибольшей простотой ЭМГ-исследования из-за отсутствия перекрывания миотомов. Интактным должен быть круглый пронатор или другие мышцы, иннервирующиеся из сегментов CVII, и единственная мышца, получающая преимущественную иннервацию из TI-сегмента, - короткая мышца, приводящая большой палец. При ЭНМГ в отдельных случаях можно выявить снижение амплитуды М-ответа при стимуляции локтевого нерва и наложении регистрирующего электрода на мышцу, отводящую мизинец или первую тыльную межкостную мышцу. Также могут изменяться параметры F-волн при стимуляции локтевого нерва и наложении регистрирующего электрода на мышцы возвышения мизинца.
В качестве рутинного метода диагностики поражения верхних шейных корешков ЭМГ применяют очень редко. При поражении корешка CIV могут отмечаться изменения при игольчатой ЭМГ в длинной мышце головы и мышце, поднимающей лопатку, при поражении корешка CIII дополнительно к изменениям в вышеуказанных мышцах - в грудино-подъязычной, грудино-щитовидной и лопаточно-подъязычной мышцах, при поражении корешка CII, кроме изменений, характерных для поражения СIV- и С111- корешков, - в прямой боковой и прямой передней мышце головы. Для подтверждения поражения корешка CI денервационные изменения необходимо выявить в верхней и нижней косой мышце головы, подбородочноподъязычной и щитовидно-подъязычной мышцах [Д. Боренштейн и др., 2005].
Поражения корешков LII-LIV электромиографически практически неотличимы друг от друга. Рутинно рекомендуют исследовать прямую мышцу бедра, латеральную широкую мышцу бедра, подвздошную мышцу и длинную приводящую мышцу. Поскольку длинная приводящая мышца - единственная из перечисленных мышц не иннервируется бедренным нервом, выявление ее поражения при ЭМГ крайне важно для дифференцировки невропатии бедренного нерва от радикулопатии LII-LIV.
Поражение корешка LV характеризуется частым вовлечением длинной малоберцовой мышцы и напрягателя широкой фасции. В 75% случаев отмечают поражение передней, задней большеберцовой мышцы и длинного сгибателя пальцев. Существуют противоречивые сведения о преимущественной иннервации передней большеберцовой мышцы LV- или LIV- корешками [E. Johnson, F. Fletcher, 1981; L. Phillips, T. Park, 1991]. Для дифференциальной диагностики радикулопатии Lv и перонеальной невропатии очень важно исследовать заднюю большеберцовую мышцу или длинный сгибатель пальцев, которые не иннервируются малоберцовым нервом. Для выявления радикулопатии Lv также целесообразно исследовать проксимальные мышцы - напрягатель широкой фасции или среднюю ягодичную мышцу для исключения невропатии седалищного и малоберцового нервов, которые особенно часто отмечают у пожилых пациентов. У половины пациентов выявляют денервационные изменения в паравертебральных мышцах. Мышцы, иннервирующиеся соседними сегментами [в частности, двуглавая мышца бедра (SI), прямая мышца бедра (LIII-LIV)] должны оставаться интактными. Данные ЭНМГ для выявления радикулопатии LV значительно менее информативны: Fволны при стимуляции малоберцового нерва часто отсутствуют. При грубом поражении может возникать снижение амплитуды М-ответа с короткого разгибателя пальцев при стимуляции малоберцового нерва. В отдельных случаях при стимуляции поверхностного малоберцового нерва могут отсутствовать S-ответы.
Поражение корешка SI характеризуется сочетанным поражением икроножной и двуглавой мышцы бедра. Для дифференциальной диагностики с более дистальными периферическими невропатиями целесообразно исследовать проксимальные мышцы, иннервирующиеся корешком SI: короткую головку двуглавой мышцы бедра и большую ягодичную мышцу. При ЭНМГ может отмечаться изменение параметров F-волн при стимуляции большеберцового нерва, а также изменение H-рефлекса. При стимуляции заднего большеберцового нерва и регистрации М-ответа с мышцы, отводящей большой палец, можно выявить снижение его амплитуды. Лечение дискогенной радикулопатии
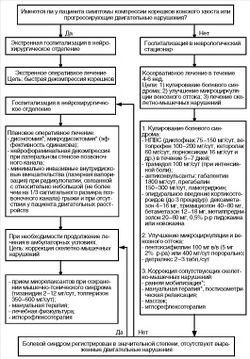
В каждом из случаев компрессионной радикулопатии следует определиться, какую тактику лечения предпочесть: оперативные или консервативные методы воздействия. Цель оперативного лечения - быстрое устранение сдавления корешка спинномозгового нерва или его раздражения веществом диска, подвергшегося экструзии. Абсолютными показаниями к оперативному лечению поясничнокрестцовой радикулопатии следует считать сдавление корешков конского хвоста с парезом стоп, анестезией аногенитальной области, нарушением функций тазовых органов, нарастание пареза в соответствующем иннервации пораженного корешка миотоме. Хирургическое лечение - метод выбора при спондилогенной шейной миелопатии. Следует иметь в виду, что многолетняя ишемизация спинного мозга при данном состоянии, обусловливает относительно умеренный эффект операций по сравнению, например, с удалением грыжи.
В остальных случаях имеющиеся клинические рекомендации предлагают определить динамику изменений в период 6-8 нед заболевания, которая влияет на тактику дальнейшего лечения [D.S. Gregory, 2008]. Показано, что длительное консервативное лечение (более 18 нед) пациентов с компрессионной радикулопатией не влияет на эффективность проводимой в последующем микродискэктомии по сравнению с оперативным вмешательством в более ранние сроки [W. Peul и др., 2007].
Относительными показаниями к хирургическому вмешательству как при шейной, так и при пояснично-крестцовой радикулопатии считают выраженный корешковый (невропатический) болевой синдром, не поддающийся адекватному консервативному лечению в течение 6 нед, а также нарастание неврологических нарушений. Пациентам этой группы необходимо проведение нейровизуализации (КТ, МРТ), а при выявлении клинически значимых изменений - решение вопроса об оперативном лечении.
Показано, что эффективность стандартной дискэктомии и микродискэктомии (удаление грыжи диска с применением специального микроскопа) при компрессионной радикулопатии пояснично-крестцовых корешков одинакова [T. Markova и др., 2007].
Существует относительно немного сравнительных исследований эффективности оперативного и консервативного лечения радикулопатии пояснично-крестцовых корешков. Недавно было завершено мультицентровое сравнительное исследование эффективности стандартной дискэктомии и консервативного лечения у пациентов с сохранявшимися симптомами пояснично-крестцовой радикулопатии после консервативного лечения длительностью 6 нед. В двух обследованных группах отмечено значительное улучшение состояния пациентов, результаты оперативного и консервативного лечения по основным показателям оценки боли и инвалидизации оказались сходными. Выявлена тенденция к большей эффективности оперативного лечения по показателям выраженности радикулопатии и субъективным ощущениям пациентов. Некоторые методические сложности (переход пациентов из одной группы в другую) не позволяют считать это исследование достаточно надежным [J. Weinstein и др., 2006].
Шейная радикулопатия, как правило, отличается благоприятным прогнозом для выздоровления без оперативного лечения. Хирургическое вмешательство показано пациентам с длительным и стойким корешковым болевым синдромом. Имеется ограниченное число РКИ по сравнению оперативной и консервативной тактики лечения пациентов с компрессионной радикулопатией шейных корешков. В исследовании L. Persson и др. (1997) показано преимущество хирургического лечения в отношении уменьшения интенсивности боли при длительно сохраняющихся (более 3 мес) проявлениях радикулопатии по сравнению с ЛФК и физиотерапией или ношением шейного корсета при оценке результатов лечения на протяжении ближайших 4 мес. Через 16 мес разницы в мышечной силе, сенсорном дефиците и выраженности боли при применении сравниваемых методов лечения не отмечено. Декомпрессия шейных корешков и ганглиев с помощью микрохирургической техники также дает положительные результаты [B. Kuijper и др., 2008].
Исследования эффективности различных методов консервативного лечения при пояснично-крестцовой и шейной радикулопатии ограничены. В 1966 г. Британской ассоциацией физиотерапевтов у 483 пациентов с шейной радикулопатией проведено сравнение эффективности тракционной терапии, ее имитации, ношения шейного корсета, приема плацебо или имитации физиотерапии, которое не выявило преимуществ ни одного из методов лечения при оценке исходов через 4 нед. При этом у 75% пациентов отмечался регресс болевого синдрома, что свидетельствует в пользу благоприятного прогноза течения шейной радикулопатии [по B. Kuijper и др., 2009].
В остром периоде в большинстве случаев предпочтение отдают разгрузке шейного и пояснично-крестцового отделов позвоночника. Это достигается кратковременным назначением постельного режима. Необходимо отметить, что у пациентов с острой радикулопатией пояснично-крестцовых корешков постельный режим и сохранение повседневной активности одинаково влияют на исход заболевания с высокой степенью доказательности.
Консервативное лечение включает в себя назначение вазоактивных препаратов [пентоксифиллин по 100 мг внутривенно (5 мл 2% раствора) или 400 мг/сут внутрь, аминофиллин (эуфиллин) по 240 мг внутривенно (10 мл 2,4% раствора), детралекс 2 раза в сутки] для уменьшения отека и улучшения микроциркуляции. При интенсивных, не купирующихся другими средствами болях возможно кратковременное назначение наркотических анальгетиков (трамадол по 100 мг/сут). С позиции доказательной медицины при радикулопатии пояснично-крестцовых корешков назначение НПВС неэффективно [J. Jordan и др., 2004]. Учитывая роль невропатического механизма в формировании болевого синдрома, можно предполагать потенциальный эффект от применения противосудорожных препаратов, но данные об их эффективности остаются скудными. Применение топирамата в дозе около 200 мг/сут при хроническом течении пояснично-крестцовой радикулопатии выявило его эффективность в отношении снижения интенсивности боли, но побочные эффекты ограничивают широкое назначение этого препарата при лечении корешковых болей [S. Khoromi, 2005]. Открытое несравнительное исследование свидетельствует о потенциальной эффективности ламотриджина при лечении болевого синдрома, связанного с компрессионной радикулопатией [E. Eisenberg и др., 2007]. Для лечения невропатической боли у пациентов с компрессионной радикулопатией можно назначать габапентин (средняя эффективная доза - 1,8 г/сут) и прегабалин (средняя доза - 150-300 мг/сут) [R. Baron, A. Binder, 2004].
При улучшении самочувствия пациента к лечению добавляют физиопроцедуры, направленные на уменьшение рефлекторного мышечного спазма (вакуумный массаж, фонофорез с местными анестетиками, массаж). В зависимости от состояния пациента уже на 3-5-е сутки от начала лечения можно подключать методы щадящей мануальной терапии (приемы мобилизации, релаксация мышц), что ведет к уменьшению анталгического сколиоза и увеличению объема движений в позвоночнике. Мануальная терапия эффективна по сравнению с плацебо и тракционной терапией у пациентов с компрессионной радикулопатией пояснично-крестцовых корешков. Однако эти манипуляции могут приводить и к ухудшению состояния пациентов с шейной и пояснично-крестцовой радикулопатией, особенно в случаях, когда имеются относительные показания к оперативному лечению [T. Markova, 2007].
В стационарах достаточно широко применяют такой метод лечения поясничной или крестцовой радикулопатии, как эпидуральное введение глюкокортикоидов [дексаметазона, триамцинолона, метилпреднизолона с 1-20 мл 0,9% раствора натрия хлорида или в сочетании с местным анестетиком (от 2 до 20 мл 0,5% раствора лидокаина или прокаин, что определяется уровнем и техникой проведения процедуры)]. Глюкокортикоиды можно вводить трансламинарным и трансфораминальным доступом. При трансламинарном доступе иглу проводят через паравертебральные мышцы (при парамедианном доступе) или межостистую связку (при срединном доступе), затем - через желтую связку. При трансфораминальном доступе иглу проводят через межпозвоночное отверстие, вентральнее корешка, затем направляют к заднелатеральной части тела позвонка, расположенной непосредственно под ножкой дуги позвонка. Иногда используют каудальный доступ через крестцовую щель. Сравнения эффективности введения глюкокортикоидов указанными доступами не проводили. Большинство специалистов предпочитают рентгеноскопический контроль при проведении этой процедуры, так как инъекция вслепую в 30-40% случаев сопровождается неправильным положением иглы. Общий объем вводимого раствора определяется местом и техникой введения. При вмешательствах на шейном и грудном уровне ограничиваются 1,5-2 мл раствора при трансфораминальном способе введения и 3-5 мл раствора при интерламинарной процедуре. При пояснично-крестцовых радикулопатиях объем раствора, вводимого трансфораминально, составляет 3-4 мл, интерламинарно - 6-10 мл, а каудально - до 20 мл [M. Heran и др., 2008].
Данные об эффективности эпидурального введения глюкокортикоидов противоречивы, из-за чего возникают трудности в определении места этого вида лечения у пациентов с компрессионной радикулопатией. Эпидуральное введение глюкокортикоидов доказано не влияет на исход заболевания, но может принести кратковременное, сохраняющееся от 2 нед до 4 мес, облегчение от боли. Уменьшение выраженности боли отмечается в 60-75% случаев. Эффективность эпидурального введения глюкокортикоидов выше при длительности заболевания менее 3 мес [W. Lavelle, 2008]. Известно, что глюкокортикоиды эффективно ингибируют воспалительную реакцию, а эпидуральный способ их введения обеспечивает создание высокой локальной концентрации и минимизирует побочные эффекты, связанные с их системным применением [М.В. Чурюканов, О.А. Черненко, 2007]. Для определения показаний к применению этого метода лечения необходимо дальнейшее проведение качественно спланированных РКИ. В настоящее время относительным показанием к эпидуральному введению глюкокортикоидов может быть наличие острой (менее 3 мес) дискогенной радикулопатии с болевым синдромом высокой интенсивности.
Дозы и вид вводимого препарата (по данным различных исследований) могут значительно варьировать. Наиболее часто назначают дексаметазон, метилпреднизолон, бетаметазон и триамцинолон. Эти препараты отличаются по размеру частиц и их склонности к агрегации (табл. 5-3). Эффективность глюкокортикоидов, состоящих из крупных и мелких частиц, относительно одинакова, что доказано при их трансфораминальном введении для лечения шейной радикулопатии. Нет достоверных различий в эффективности эпидурального введения 80 или 40 мг метилпреднизолона при уменьшении частоты побочных эффектов на фоне применения более низких доз [M.K. Heran, 2008]. Мужчины отмечают большую интенсивность боли и неприятных ощущений, связанных с первым эпидуральным введением глюкокортикоидов, чем женщины, с исчезновением различий в реакции на эту процедуру при последующих манипуляциях [S. Inman и др., 2004].
Для уменьшения частоты побочных эффектов рекомендуют ограничить применение глюкокортикоидов до 1-3 введений в разовой дозе, эквивалентной 80 мг метилпреднизолона, и назначать препараты с наименьшим размером частиц и низкой склонностью к агрегации [R. Derby и др., 2008]. В зависимости от эффективности повторные инъекции проводят через несколько дней или недель. Противопоказания к эпидуральному введению глюкокортикоидов: непереносимость местных анестетиков, гипокоагуляция, воспаление мягких тканей в месте проведения инъекции, инфекционные заболевания, неконтролируемый сахарный диабет, компрессия корешков конского хвоста. Осложнения эпидурального введения глюкокортикоидов: повреждение нерва или твердой мозговой оболочки (развитие ликворной гипотензии); ишемические поражения спинного мозга, связанные с повреждением спинальных артерий; инфекции (эпидуральный абсцесс, менингит, дисцит), местные и системные реакции на вводимый лекарственный препарат (в частности, остеопороз, стероидная миопатия, стрии, увеличение массы тела, отеки, гипергликемия). Серьезные осложнения обычно отмечают при выполнении процедуры на шейном уровне [J. Obray, M. Huntoon, 2008], поэтому, по видимому, трансфораминальное введение глюкокортикоидов должно быть ограничено поясничным уровнем.
Таблица 3. Глюкокортикоиды, применяемые для эпидурального введения
|
Препарат |
Торговое название |
Свойства |
Разовая доза, мг |
|
Метилпреднизолон |
Депо-Медрол |
Частицы плотно сгруппированы, размер меньше эритроцитов: склонность к агрегации отсутствует, могут растворяться неполностью |
20-80 |
|
Триамцинолон |
Кеналог |
Частицы значительно варьируют в размерах, часто агрегируют |
40-80 |
|
Бета метазон |
Целестон |
Частицы значительно варьируют в размерах, часто образуют растворимый осадок |
12-18 |
|
Дексаметазон |
Дексазон |
Частицы в 5-10 раз меньше размера эритроцита могут агрегировать |
Вариабельна (4-16) |
*В настоящее время консенсус относительно рекомендуемых доз глюкокортикоидов для эпидурального введения не достигнут. Можно рекомендовать применение наименьшей эффективной дозы для уменьшения частоты побочных явлений.
Системное применение специфических противовоспалительных препаратов - относительно новое направление в лечении корешковых болевых синдромов. Данные о целесообразности их применения необходимо уточнять. В пилотных исследованиях показана эффективность ингибиторов ФНО-α - инфликсимаба и этанерцептаΘ [T. Korhonen и др., 2004; S. Genevay и др., 2004].
Прогностическими факторами, определяющими благоприятный исход консервативного лечения компрессионной пояснично-крестцовой радикулопатии, считают отсутствие симптомов натяжения, усиления боли в ноге при разгибании в поясничном отделе позвоночника, стеноза позвоночного канала при КТ или МРТ, хороший эффект от эпидурального введенияглюкокортикоидов, регресс неврологических расстройств через 12 нед с начала возникновения заболевания, высокую мотивацию пациента в участии в двигательной реабилитации, более 12 лет образования, отсутствие выраженных психологических нарушений и необходимости получения финансовой компенсации (страховки, пенсии), связанной с настоящим заболеванием [J. Saal и др., 1996].
При фораминальной компрессии корешков эффективность консервативной терапии относительно низка, но в случаях с легко выраженными неврологическими нарушениями возможно консервативное лечение с подключением программы ЛФК. Оперативное лечение отличается высокой эффективностью и заключается в так называемой нейрофораминальной декомпрессии, особенности которой определяются данными нейровизуализации и интраоперационными находками [А.И. Осна, 1965; А.Ю. Смирнов, 1999; D. Long, 2006]. При стенозах корешкового канала («зоны входа») декомпрессия предполагает проведение медиальной фасетэктомии, иногда в сочетании с удалением краевых остеофитов. При стенозе «средней зоны» для устранения корешковой компрессии проводят гемиламинэктомию в сочетании с резекцией нижнего суставного отростка. При компрессии корешка в области его выхода из межпозвоночного отверстия можно выполнить резекцию верхнего суставного отростка и удаление остеофитов.
Подавляющее большинство пациентов с шейной или пояснично-крестцовой радикулопатией выздоравливает в течение 3 мес. Состояние некоторых пациентов улучшается дольше (3-6 мес), и, наконец, если обострение длится более 6 мес (примерно 14% пациентов), выраженность клинических проявлений заболевания, вероятно, останется на прежнем уровне в течение ближайших 2 лет, без ухудшения или улучшения [D. Long, 2006].
В настоящее время все больше внимания уделяют так называемым минимально инвазивным вмешательствам при грыжах межпозвоночных дисков. Несмотря на длительную историю применения данных методов воздействия, научно обоснованных доказательств их эффективности пока нет. Проведенные многочисленные несравнительные исследования отличаются небольшими выборками, разными техническими характеристиками оборудования, применяющегося для вмешательства, критериями включения пациентов в исследование, оценками исходов и периодами наблюдения. Эти факторы не позволяют экстраполировать результаты проведенных исследований в повседневную практику. Однако потенциальные медицинские и экономические преимущества малоинвазивных методов лечения требуют проведения методологически качественных исследований для создания доказательной базы их применения.
История развития минимально инвазивных внутридисковых вмешательств насчитывает более 45 лет - с первой чрескожной внутридисковой иньекции химопапаина в 1963 г. Дальнейшее развитие методы, направленные на снижение внутридискового давления (нуклеотомия), получили в 1970-е годы, когда были предложены различные технические решения механической нуклеотомии. В частности, были разработаны эндоскопические методы удаления содержимого пульпозного ядра. Несколько позже были предложены другие, менее травматичные методы нуклеотомии - лазерная декомпрессия и высокочастотная аблация диска. На основе последней методики был разработан метод нуклеопластики - техники, позволяющей устранять разрывы фиброзного кольца высокочастотным электротермическим воздействием на коллагеновые волокна [D. Samartzis и др., 2007].
Чрескожная лазерная декомпрессия диска в форме лазерной вапоризации - один из наиболее часто применяемых в России методов минимально инвазивных вмешательств [С.П. Миронов и др., 1998]. Для вапоризации пульпозного ядра используют различные виды лазеров [YAG (yttrium aluminium garnet - лазер на иттриево-алюминиевом гранате), PTP (potassium-titanyl-phosphate - лазер на калий-титанилфосфате), аргоновый, углекислотный и др.]. Оборудование также включает в себя тонкую иглу, через просвет которой вводят световод. Поясничные и грудные диски обычно пунктируют под контролем КТ, заднебоковым доступом, шейные - переднебоковым. Иглу вводят в пульпозное ядро и при воздействии лазера удаляют примерно 4-5 г его содержимого. Точный механизм, объясняющий эффективность этого метода, неизвестен. Предполагают, что снижение внутридискового давления приводит к смещению протрузии в направлении к центру диска и уменьшению ее влияния на корешок [V. Singh, R. Derby, 2006]. Диск, подходящий для этого метода воздействия, должен иметь свойство замкнутой гидравлической системы. Только сохраняя целостность фиброзного кольца, можно обеспечить потенциальное снижение внутридискового давления в результате этой манипуляции. Лазерная вапоризация потенциально эффективна для лечения радикулопатии, связанной с грыжей межпозвоночного диска, при сохранении целостности фиброзного кольца, выбухании его не более чем на 1/3 сагиттального размера позвоночного канала (в среднем 6 мм) и отсутствии у пациента двигательных расстройств или симптомов компрессии корешков конского хвоста. Преимуществами внутридисковых методик считают малую травматичность (вмешательство проводят под местной анестезией, не нужен разрез мягких тканей) и отсутствие послеоперационного эпидурального фиброза. Главный критерий эффективности внутридисковой операции - регресс клинических проявлений радикулопатии. Однако определить степень уменьшения объема диска после вмешательства с помощью методов нейровизуализации до настоящего времени не удается [K. Malik, H. Benson, 2008; R. Delamarter и др., 1995].
Тактика лечения пациентов с компрессионной радикулопатией представлена на Рис. 1.
Клинический пример
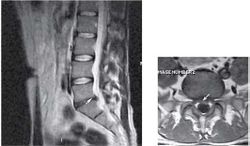
Пациентка С., 37лет, штукатур, заболела остро примерно 2 нед назад, когда утром после сна отметила острую боль при движении в шейном отделе позвоночника, ощущение скованности в шее, невозможность повернуть голову влево. В течение дня к болям в шейном отделе позвоночника постепенно присоединилась боль, иррадиирующая в левую лопатку, надплечье, по наружной поверхности левого плеча, которая имела жгучий и ломящий характер. Боль в руке и надплечье сохранялась в ночное время, нарушая сон, и частично уменьшалась в положении лежа с согнутой в локтевом суставе и заложенной за голову левой рукой. При наклоне головы в больную сторону пациентка эпизодически отмечала появление парестезий в виде «ползания мурашек» по наружной поверхности левого плеча. Прием НПВС и трамадола почти не приносил облегчения. В неврологическом статусе отмечено снижение болевой и температурной чувствительности в области левого надплечья и по наружной поверхности левого плеча, гипотония и снижение рефлекса с сухожилия двуглавой мышцы плеча слева, ограничение всех движений в шейном отделе позвоночника, но в большей степени - ротации и бокового сгибания влево. Наклон головы влево с аксиальным давлением на нее приводил к усилению боли в плече. Отмечено напряжение и умеренная болезненность при пальпации левой передней лестничной и трапециевидной мышц при отсутствии в них ТЗ. По данным рентгенографии шейного отдела позвоночника, выявлено снижение высоты межпозвоночных промежутков СIII-СIV СIV-СV, субхондральный остеосклероз, артроз дугоотростчатых суставов СIV-СV, унковертебральный неоартроз СIII-СIV СIV-СV Сагиттальный размер спинномозгового канала составил 16 мм. При МРТ шейного отдела позвоночника выявлена левосторонняя протрузия на уровне СIV-СV размером до 4,5 мм с компрессией дурального мешка, циркулярная протрузия на уровне СIII-СIV до 2 мм. Таким образом, при сопоставлении данных клинического обследования (невропатический характер болевого синдрома, наличие характерных для поражения корешка С5 чувствительных, двигательных и рефлекторных нарушений) с данными рентгенографии и МРТ позвоночника - наличие на соответствующем уровне (СIV-СV) латеральной протрузии и дистрофических изменений дугоотростчатого сустава с формированием сужения левого корешкового отверстия - у пациентки можно диагностировать компрессионную радикулопатию корешка СV слева, обусловленную левосторонней грыжей диска СIV-СV на фоне первично узкого спинномозгового канала на шейном уровне (Рис. 2). ЭМГ-обследование не проводили из-за небольшой (менее 3 нед) длительности заболевания и дальнейшей его положительной динамики на фоне лечения. Пациентке были назначены венотонические препараты (эскузан по 15 капель 3 раза в сутки), амитриптилин в дозе 50 мг/сут, внутривенные инфузии пентоксифиллина (5 мл 2% раствора), массаж мышц левой руки и надплечья, мануальная терапия (мобилизация шейных и грудных ПДС), ПИР трапециевидной и лестничной мышцы. На 10-е сутки лечения болевой синдром значительно уменьшился, его полный регресс произошел через 1,5 мес после начала заболевания.
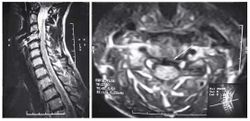
Клинический пример
Пациент К., 45 лет, водитель, заболел примерно 8 нед назад, когда после поднятия тяжести (работал в гараже) появилась боль в поясничной области, а через 3 сут она стала иррадиировать по задней поверхности левого бедра и голени в пятку и в IV-V палец стопы. Боль в ноге пациент описывал как «глубокую», «выкручивающую» и «мозжащую», а в пояснице - как «глубокую ноющую». Из-за боли пациент к 3-му дню заболевания не мог самостоятельно передвигаться, так как она резко усиливалась при ходьбе и в положении сидя, также отмечал усиление боли при кашле и чихании. В положении лежа боль в пояснице несколько уменьшалась, но сохранялась в голени и стопе, которая частично регрессировала при приеме вынужденного положения - на животе с подушкой, подложенной под живот, и с согнутыми в коленных и тазобедренных суставах ногами. Через 5 сут после начала заболевания пациент отметил присоединение ощущения «ползания мурашек» и онемения по задней поверхности левого бедра, голени и в IV-V пальце левой стопы. Амбулаторно назначенное лечение в виде внутримышечного введения НПВС и миорелаксантов не принесло облегчения. Госпитализирован на 7-е сутки после начала заболевания. Сохранялся выраженный болевой синдром (до 8 баллов по ВАШ), нарушавший сон. В неврологическом статусе отмечено снижение болевой и температурной чувствительности по заднелатеральной поверхности левого бедра и голени, латеральному краю левой стопы, снижение ахиллова рефлекса и слабость подошвенного сгибания пальцев левой стопы до 4 баллов. Симптом Ласега под углом 30°. Движения в поясничном отделе позвоночника резко ограничены, особенно флексия - до 2,5 см в тесте Шобера, выявлен мышечно-тонический синдром мышцы, выпрямляющей позвоночник, левой квадратной мышцы поясницы, анталгический сколиоз в поясничном отделе позвоночника с дугой, направленной влево, который значительно регрессировал в положении лежа. При рентгенографии пояснично-крестцового отдела позвоночника отмечался умеренный сколиоз с ротацией позвонков по оси влево, сужение межпозвонкового промежутка на уровне LV-SI, склероз замыкательных пластинок на уровне LIII-LIV, LIV-LV, LV-SI На основании особенностей клинической картины у пациента была диагностирована компрессионная радикулопатия корешка S1 слева. Назначено консервативное лечение: пентоксифиллин внутривенно капельно (5 мл 2% раствора) в сочетании с аминофиллином (10 мл 2,4% раствора) 7 раз за 4 нед, детралекс внутрь (2 раза в сутки) в течение 4 нед, фуросемид по 40 мг/ сут в течение 3 сут, эпидуральное введение глюкокортикоидов каудальным доступом (дексаметазон в дозе 12 мг на 15 мл 0,5% раствора прокаина), карбамазепин по 600 мг/сут для уменьшения выраженности болевого синдрома. Также назначен массаж пояснично-крестцовой области и левой ноги. Постепенная активизация пациента была ограничена выраженным болевым синдромом. Кратковременное (до 24 ч) облегчение отмечено на фоне эпидурального введения глюкокортикоидов, но болевой синдром возобновлялся. Добавление к лечению миорелаксантов (тизанидин по 8 мг/сут) на 10-е сутки лечения существенно не повлияло на динамику болевого синдрома. На проведенной через 2 нед после госпитализации МРТ поясничнокрестцового отдела позвоночника выявлена левосторонняя парамедианная экструзия диска на уровне LV-SI, пролабирующая в просвет позвоночного канала на 7 мм с признаками компрессии дурального мешка (Рис. 3).
Учитывая отсутствие положительной динамики через 4 нед консервативного лечения, а также наличие клинически значимых изменений при нейровизуализации, пациенту была предложена операция (микродискэктомия), на проведение которой пациент дал согласие. После хирургического лечения уже на следующие сутки болевой синдром в поясничной области и левой ноге значительно регрессировал и не требовал дополнительного назначения анальгетиков. Пациент смог приступить к трудовой деятельности через 3 нед после оперативного лечения с рекомендациями не проводить длительное время за рулем и значительно ограничить подъем тяжестей. При осмотре через 1 мес после проведенного лечения болевой синдром полностью регрессировал, в неврологическом статусе сохранялась легкая гипалгезия в зоне иннервации S1 корешка слева и отсутствовал левый рефлекс с пяточного сухожилия, парез сгибателей пальцев стопы регрессировал.
Клинический пример
Пациентка Н., 47лет, парикмахер, в течение более 10 лет страдала рецидивирующей болью в поясничной области с продолжительностью обострений до 2-3 нед, по поводу которых лечилась амбулаторно с применением НПВС, курсов массажа, физиотерапии и мануальной терапии. Последнее обострение возникло примерно 1,5 мес назад после длительной поездки (в течение 3 сут) на автобусную экскурсию. Практически сразу к боли в пояснице присоединилась ее иррадиация по задней поверхности левого бедра и голени. Пациентка сообщила, что «с трудом доехала до дома, так как встряска в автобусе причиняла ей сильную боль». Боль также усиливалась при чихании. Поскольку пациентка находилась в отпуске, а текущее обострение было не первым, она самостоятельно внутримышечно вводила диклофенак, амбене (комбинированный препарат, в состав которого входит дексаметазон, лидокаин, фенилбутазон, салициламид). Болевой синдром в поясничной области несколько уменьшился, но боль в ноге сохранялась, пациентка хромала из-за выраженной боли (о наличие слабости в стопе в этот период точно судить не могла). Через 3 нед больная стала посещать мануального терапевта, у которого уже неоднократно проходила лечение. Пациентке также было проведено несколько сеансов подводного вытяжения. На фоне лечения болевой синдром сохранялся, и Н. была записана на МРТ поясничного отдела позвоночника, проведение которой планировалось через 2 нед. После 3 нед амбулаторного лечения пациентка стала замечать появление слабости в левой стопе, но болевой синдром не нарастал, и Н. решила сообщить о слабости врачу на очередном (через 2 сут) сеансе мануальной терапии. Однако на следующий день при выходе из маршрутного такси отметила резкую интенсивную боль («прострел») в поясничной области и ногах, острое развитие слабости в обеих ногах, ощущение онемения в аногенитальной области. Самостоятельно идти не могла. Была экстренно госпитализирована в неврологическое отделение. В неврологическом статусе: периферический парез сгибателей и разгибателей обеих стоп до 2 баллов слева и 3 баллов справа с утратой рефлекса с пяточных сухожилий, гипалгезия в дерматомах LV-SI и «седловидная» анестезия. У пациентки диагностирован синдром компрессии корешков конского хвоста. В этот же день развилась острая задержка мочеиспускания, установлен мочевой катетер. На МРТ поясничного отдела позвоночника выявлена парамедианная экструзия диска LV-SI размером до 9 мм (Рис. 4). По экстренным показаниям в день поступления было проведено оперативное вмешательство - ламинэктомия на уровне LV-SI, дискэктомия. Болевой синдром после оперативного лечения регрессировал, сохранялась слабость в дистальных отделах ног, чувствительные и тазовые нарушения. При осмотре через 1 мес после оперативного лечения выявлена гипалгезия в дерматомах S1 и в аногенитальной области, но выраженность онемения значительно уменьшилась. Уменьшился парез в дистальных отделах ног - слева до 3 баллов, справа до 4 баллов. Пациентка не чувствовала наполнения мочевого пузыря, мочеиспускание осуществляла через определенные интервалы времени с умеренным натуживанием. При УЗИ объем остаточной мочи после мочеиспускания - 80 мл. Описанный случай подтверждает данные о том, что даже экстренно проведенное оперативное вмешательство по поводу компрессии корешков конского хвоста может не привести к полному восстановлению неврологических нарушений, особенно функций тазовых органов.
Узкий позвоночный канал
Помимо собственно дисковой патологии, возникновению корешковых симптомов способствует относительная узость позвоночного канала. Синдром, при котором происходит поражение корешков спинномозговых нервов из-за дегенеративных изменений костных структур и мягких тканей позвоночного канала, клинически отличается от острой протрузии межпозвоночного диска. Выделяют стеноз центрального канала позвоночника (центральный поясничный стеноз) и латеральные стенозы с уменьшением размеров корешкового канала или межпозвоночного отверстия (фораминальный стеноз). Наименьший допустимый переднезадний диаметр позвоночного канала на поясничном уровне составляет 10,5 мм. Иногда сагиттальный диаметр позвоночного канала остается нормальным, а сужение выявляют в корешковом канале (латеральном кармане), который ограничен спереди заднебоковой поверхностью тела позвонка, а сзади верхним суставным отростком (Рис. 5). Латеральный стеноз диагностируют при уменьшении сагиттального размера корешкового канала до 3 мм. В 20-30% случаев центральный и латеральный поясничный стеноз сочетаются. Чаще поражается корешок LV, что можно объяснить значительной выраженностью дегенеративных изменений и большей длиной латеральных каналов на уровне LV-SI. Ущемление корешков может произойти в центральном канале; это более вероятно в том случае, когда он имеет небольшой диаметр в сочетании с дегенеративными изменениями межпозвоночных дисков, суставов, связок. Абсолютный размер корешковых каналов не может свидетельствовать о наличии или отсутствии компрессии, имеет значение его соотношение с величиной спинномозгового ганглия или корешка. Обычно выделяют два основных типа стеноза позвоночного канала - врожденный и приобретенный. Для врожденного поясничного стеноза характерна гипертрофия суставных отростков поясничных позвонков и уменьшение переднезаднего размера позвоночного канала. При приобретенном стенозе основными причинами уменьшения размера позвоночного канала считают дегенеративные изменения межпозвоночных суставов, протрузии дисков, гипертрофию желтой связки и дегенеративный спондилолистез.
Клинические проявления поясничного стеноза неоднородны. Иногда он может иметь бессимптомное течение. Проявления поясничного стеноза в молодом возрасте выявляют крайне редко. Обычно клиническая картина врожденного стеноза проявляется после 50 лет при присоединении к врожденным особенностям позвоночного канала дегенеративных изменений. Характерное проявление поясничного стеноза - неврогенная (каудогенная) перемежающаяся хромота (клаудикация). Первое сообщение в отечественной литературе, посвященное поясничному стенозу, опубликовали в 1974 г. Д.Р. Штульман и соавт. Наиболее часто его отмечают у мужчин 40-45 лет, занятых физическим трудом. Боль возникает в одной или обеих ногах при ходьбе, обычно локализуется выше или ниже уровня колена, иногда распространяясь на всю конечность. В покое боль не выражена. Для неврогенной перемежающейся хромоты характерно развитие или нарастание парезов, ослабление сухожильных рефлексов, увеличение латентных периодов и снижение амплитуд соматосенсорных вызванных потенциалов спинного и головного мозга с ног после ходьбы («маршевая проба»). Пройденное до возникновения болевых ощущений расстояние часто не превышает 150 м. Характерно уменьшение боли при наклоне вперед и ее усиление при разгибании в поясничном отделе позвоночника. Нарастания болевых ощущений при кашле и чихании не происходит. Неврологические и невроортопедические проявления выражены умеренно (ограничение разгибания туловища в 80% случаев, положительный симптом Ласега с умеренным ограничением угла подъема прямой ноги до 80° в 74%), рефлекторные и чувствительные нарушения отмечают у 85% больных, мышечную слабость - у 5% пациентов. Факторами стенозирования в этом случае могут быть: полисегментарная гипертрофия суставных отростков, утолщение желтой связки и небольшие протрузии дисков.
В некоторых случаях поясничного стеноза пациенты страдают от выраженного постоянного болевого синдрома, не регрессирующего в покое, который нарастает при ходьбе. Как правило, они не могут пройти более 50 м и принимают вынужденное положение как при ходьбе (наклон вперед), так и в покое (в частности, лежа на боку с согнутой в коленном и тазобедренном суставе ногой). У этой группы пациентов выявляют постоянные клинические проявления поражения поясничных и крестцовых корешков: чувствительные расстройства, выпадение рефлексов и парезы. При нейровизуализации выявляют все основные факторы стенозирования. Данное состояние отличается от других проявлений поясничного стеноза наличием протрузий межпозвоночных дисков среднего и большого размера (более 5 мм). По-видимому, особенности клинических проявлений поясничного стеноза зависят не столько от формы, степени и распространенности сужения позвоночного канала, сколько от «жесткости» формирующих его структур. При выраженной спондилоартропатии корешки конского хвоста оказываются как бы «замурованными» в жесткие структуры, формирующие стеноз позвоночного канала [Н.Г. Минаева, 2004].
Необходимо дифференцировать синдром неврогенной перемежающейся хромоты с другими причинами вертеброгенной боли, которые могут сопровождать клинически незначимый поясничный стеноз. У части пациентов с узким позвоночным каналом изолированное нарастание интенсивности боли при ходьбе, часто имеющей нетипичную для корешкового поражения локализацию, обычно обусловлено сопутствующими поясничному стенозу скелетно-мышечными нарушениями и дегенеративным поражением суставов позвоночника и ног («псевдостеноз»). При этом отмечают медленное прогредиентное или рецидивирующее течение заболевания. Боль в большинстве случаев не распространяется ниже колен, локализуясь в области крестца, ягодиц, тазобедренных суставов, редко появляется в голенях. Пациенты, как правило, могут пройти более 500 м. Основные факторы стенозирования в этом случае - небольшие протрузии дисков и гипертрофия желтой связки. Гипертрофия дугоотростчатых суставов если и встречается, как правило, ограничивается одним уровнем. При ходьбе не нарастает неврологический дефицит, при невроортопедическом обследовании выявляют дисфункцию КПС, связочного аппарата таза, дегенеративно-дистрофическое поражение крупных суставов ног, МФБС ишиокруральной мускулатуры. У этой группы пациентов, как правило, эффективно консервативное лечение [Н.Г. Минаева, 2004].
Большое значение для постановки диагноза имеют и другие причины перемежающейся хромоты. Часто неврогенную перемежающуюся хромоту приходится дифференцировать от перемежающейся хромоты сосудистого генеза при стенозирующих поражениях артерий ног. Хроническую артериальную недостаточность при поражении сосудов нижних конечностей можно разделить на два типа: связанную с поражением дистальных отделов аорты и подвздошных артерий и обусловленную поражением артерий ног. В зависимости от уровня стенозирующего процесса боль, возникающая при ходьбе или в покое, может локализоваться в ягодичных областях, бедрах, голенях или стопах. Наиболее часто боль появляется в области икроножных мышц. Она возникает при прохождении определенного расстояния и регрессирует в покое через несколько минут. Еще один типичный признак сосудистой клаудикации - периодические судороги в икроножных мышцах (редко они могут появляться и при неврогенной перемежающейся хромоте). При проксимальной окклюзии (аортально-подвздошное поражение) может возникать боль в ягодичной области и бедре, регрессирующая в покое. Обычно развивается импотенция. Иногда пациенты предъявляют жалобы на ощущение слабости в мышцах бедра. Относительно редко, при недостаточности кровотока в нижней ягодичной артерии, может возникать боль и парестезии по ходу седалищного нерва (по задней поверхности бедра и голени), сочетающиеся с преходящей слабостью в стопе («седалищная» хромота). Для перемежающейся хромоты сосудистого генеза характерны отсутствие ее связи с позой, положением позвоночного столба, возникновение боли при выполнении «велосипедной пробы». Цвет стопы при артериальной недостаточности может быть нормальным. Подъем конечности на 45° выше горизонтального уровня приводит к резкому побледнению стопы. При опускании ноги ниже горизонтального уровня появляется покраснение стопы, которое часто ошибочно принимают за гиперемию, в то время как это проявление компенсаторной хронической дилатации посткапиллярных венул. Характерно отсутствие пульсации периферических сосудов, шум при аускультации магистральных артерий ног. Одним из надежных признаков облитерирующего поражения артерий ног считают уменьшение отношения систолического артериального давления в задней большеберцовой артерии к систолическому артериальному давлению в плечевой артерии, так называемый голенно-плечевой индекс (в норме - 1). При сосудистой перемежающейся хромоте он составляет 0,6-0,9. Недостаточность артериального кровотока можно подтвердить при ультразвуковой допплерографии. Следует помнить и о возможности сочетания сосудистой и неврогенной хромоты.
Усиливаться при ходьбе может и отраженная боль из поясничного отдела позвоночника. От неврогенной хромоты ее отличают распространение на бедро и голень, как правило, не ниже верхней ее трети, наличие боли при ходьбе и вне ее, отсутствие стеноза позвоночного канала по данным МРТ и миелографии. Нестабильный спондилолистез в поясничном отделе позвоночника может «маскироваться» под неврогенную хромоту, вызывая при ходьбе боль, отраженную от связочно-суставных структур позвоночника, либо реже боль, связанную с преходящей корешковой компрессией, иррадиирующую в дистальные отделы ноги и сопровождающуюся преходящими чувствительными, рефлекторными или двигательными нарушениями в зоне иннервации пораженного корешка. Более редкая причина боли в ногах при ходьбе - «венозная хромота»: боль, возникающая при нагрузке, исчезающая только при поднимании ноги вверх, которая отмечается у лиц, перенесших венозный тромбоз, в период до нормализации коллатерального кровообращения. Боль в ногах может быть и при микседеме. Она сопровождается быстрой утомляемостью мышц, в основе которой лежит отсутствие ускорения метаболизма при физической нагрузке.
При подозрении на сужение позвоночного канала необходима МРТ или КТ (при необходимости с контрастированием) поясничного отдела позвоночника. Оценивают переднезадний размер позвоночного канала и бокового кармана. Целесообразно измерить площадь поперечного сечения канала (в норме - не менее 145 мм2 на поясничном уровне), особенно в тех случаях, когда канал имеет нормальный переднезадний размер в центре аксиального среза, но отличается узкими латеральными карманами. Поперечный размер позвоночного канала в норме составляет более 16 мм. Наличие широкого позвоночного канала исключает диагноз неврогенной хромоты. Для подтверждения диагноза могут быть полезны электрофизиологические методы - соматосенсорные вызванные потенциалы, ЭНМГ.
Неврогенная перемежающаяся хромота характеризуется медленно прогрессирующим течением с периодами (иногда длительными) стабилизации симптоматики.
Точный патогенез заболевания не известен. Основными причинами стенозирования позвоночного канала считают: гипертрофию желтой связки, дугоотростчатых суставов, протрузии межпозвонковых дисков, задние остеофиты и спондилолистез. Наличие спинального стеноза на одном уровне или сужения латеральных каналов недостаточно для возникновения перемежающейся хромоты. Обычно диагностируют многоуровневый стеноз в сочетании с уменьшением размеров корешковых каналов.
Развитие корешковой компрессии может быть обусловлено не только дегенеративными изменениями, но и наличием утолщения вен и эпидурального фиброза (после травмы, оперативного вмешательства). Разгибание и ротация уменьшают имеющееся пространство, сдавливая корешок и его сосуды, что объясняет ограничение этих видов движения у пациентов с такой патологией. Наклон вперед приводит к увеличению размеров латеральных каналов и облегчению симптомов. В основе заболевания лежит нарушение метаболизма в корешках конского хвоста из-за их ишемии при физической нагрузке. Нарушение оттока крови из эпидуральных венозных сплетений приводит к полнокровию в периневральных и эндоневральных венулах корешков на уровне поясничного стеноза и сужению мелких артерий. Это создает условия для хронической тканевой гипоксемии и энергетического дефицита, который усугубляется при движении, когда потребность нервных клеток в энергии возрастает. При этом нарушается передача нервного импульса и формируются временные блоки проведения возбуждения по нервным волокнам. Боль, связанная с поясничным стенозом, может иметь несколько механизмов развития. При невроортопедическом обследовании пациентов с поясничным стенозом наряду с синдромом неврогенной перемежающейся хромоты обычно возникают скелетно-мышечные нарушения (поражение суставов позвоночника и ног, дисфункция связочного аппарата таза). Кроме непосредственной компрессии и ишемии поясничнокрестцовых корешков, вызывающих их повреждение и формирование невропатического болевого синдрома, определенное значение может иметь поражение быстропроводящих волокон в составе корешков, приводящее к нарушению механизма «воротного контроля», когда болевая импульсация от скелетно-мышечных структур становится клинически значимой [Н.Г. Минаева, 2004].
Лечение
В настоящее время выбор тактики лечения пациентов с поясничным стенозом остается предметом дискуссии. Поскольку синдром неврогенной перемежающейся хромоты рассматривают как прогрессирующее состояние, пациентам с узким позвоночным каналом традиционно проводят оперативное лечение. Несмотря на то что в ранние сроки после хирургического лечения у большинства пациентов отмечают хорошие результаты, с течением времени этот эффект уменьшается [B. Jonsson и др., 1997]. Поясничный стеноз часто диагностируют у пожилых пациентов, у которых обычно есть противопоказания к инвазивным вмешательствам. Отсроченное проведение оперативного вмешательства, даже при наличии выраженных визуализационных изменений, оказывает незначительное влияние на его результаты [T. Amundsen и др., 2000]. В связи с этим необходимо рассмотреть эффективность применения различных методов консервативного лечения этой группы пациентов. При узком позвоночном канале предлагают избегать провоцирующих боль ситуаций. Лечение предусматривает отказ от тяжелой физической нагрузки. Целесообразно (хотя не доказано) применение венотонических препаратов (эскузан* по 15 капель 3 раза в сутки), пентоксифиллина по 400 мг/сут внутрь или в виде внутривенных инфузий (5 мл 2% раствора). При выраженном болевом синдроме возможно эпидуральное введение глюкокортикоидов и местных анестетиков, позволяющее временно уменьшить болевой синдром [H. Benzon, 1986]. При обострении боли целесообразен курсовой прием НПВС. Рекомендуют назначение упражнений, связанных с флексией в поясничном отделе позвоночника, во время которой временно увеличивается размер позвоночного канала и улучшается микроциркуляция в корешках конского хвоста (велоэргометр, ходьба по бегущей дорожке с наклоном вперед). Это помогает пациентам лучше переносить физическую нагрузку и предотвращает увеличение массы тела. Также полезно плавание, а при спондилолистезе - упражнения, направленные на укрепление мышц брюшного пресса [M. Bodack, M. Monteiro, 2001]. Наибольшую эффективность консервативного лечения отмечают при скелетно-мышечной боли на фоне поясничного стеноза [В.В. Алексеев и др., 2005].
Хирургическое вмешательство (декомпрессия) показано при отсутствии эффекта консервативного лечения, в частности, при резко выраженном невропатическом болевом синдроме и проявлениях повреждения корешков конского хвоста. При центральном стенозе основу хирургической тактики составляет ламинэктомия и удаление желтой связки на уровне стеноза. При уменьшении поперечного размера позвоночного канала необходима дополнительная частичная резекция дугоотростчатых суставов - медиальная фасетэктомия. Предметом дискуссии остаются и показания к проведению дополнительной фиксации структур позвоночника (спондилодез, артродез) при оперативном вмешательстве по поводу поясничного стеноза. Отдельные исследователи рекомендуют проведение фиксации во многих случаях оперативного вмешательства при поясничном стенозе. Учитывая, что нестабильность после оперативного лечения поясничного стеноза развивается относительно редко (нарастание подвывихов в дугоотростчатых суставах отмечают примерно в 1% случаев), а создание дополнительных конструкций в позвоночном канале увеличивает риск осложнений и само по себе может усугубить имеющийся стеноз, фиксирующие операции целесообразно ограничить редкими случаями поясничного стеноза у молодых пациентов с признаками нестабильности ПДС, или когда декомпрессия сопровождается удалением двух дугоотростчатых суставов и межпозвоночного диска [А.Ю. Смирнов, 1999].
Сравнение результатов консервативного и оперативного лечения в случаях различных проявлений поясничного стеноза свидетельствует о том, что при преобладании в клинической картине перемежающейся хромоты болевого синдрома результаты оперативного и консервативного лечения сопоставимы и не зависят от степени сужения позвоночного канала. У пациентов с «классической» картиной неврогенной перемежающейся хромоты при оценке оперативного лечения преобладают отличные и хорошие результаты, а при оценке консервативного лечения - хорошие и удовлетворительные. Практически всем пациентам с сочетанием постоянного болевого синдрома с его усилением при ходьбе потребовалось проведение оперативного лечения [Н.Г. Минаева, 2004].
Клинический пример
Пациент Д., 65 лет, пенсионер, в прошлом - геолог. Впервые боли в пояснично-крестцовой области отметил в 30 лет, когда в длительных экспедициях часто испытывал физические нагрузки и переохлаждался. Длительность боли в спине составляла до 7 сут, она регрессировала самостоятельно либо на фоне приема НПВС. С 60 лет эпизоды ноющей боли в пояснице участились, появилось ощущение скованности. Пациент отметил, что для уменьшения выраженности боли в спине необходимо «расхаживаться» после сна или длительно сидеть, также отмечал положительный эффект от приема НПВС короткими курсами по 5-10 сут и за медицинской помощью не обращался. Причиной настоящего обращения послужило присоединение примерно 9 мес назад к болям в пояснице иррадиации по передней поверхности левого бедра и переднемедиальной поверхности левой голени, а 5 мес назад - и по передней поверхности правого бедра. Боль появлялась при движении, ограничивая пройденное расстояние сначала до 500 м, а на время обращения до 150-200 м. Иногда вместе с появлением боли в ногах отмечалось ощущение онемения по передней поверхности левой голени. Пациент был вынужден останавливаться и наклоняться вперед для уменьшения болевых ощущений, иногда для этой цели брал с собой трость. При этом боль и чувствительные нарушения регрессировали через 1-2 мин и пациент мог продолжать движение. В покое боль в ногах не отмечалась. При осмотре в неврологическом статусе за исключением рефлексов орального автоматизма патологической симптоматики не выявлено. Отмечается ограничение (до 20°) и болезненность при разгибании в поясничном отделе позвоночника, латерофлексия ограничена до 20°. При пальпации определяется болезненность в проекции дугоотростчатых суставов на уровне LIII-LIV и LIV-LV с обеих сторон, несколько больше слева. Угол подъема прямой ноги - 70° с обеих сторон. При «маршевой пробе» пройденное до возникновения болевых ощущений расстояние составило 180 м. При этом в неврологическом статусе отмечены следующие изменения: появление зоны гипалгезии по медиальной поверхности левой голени и выпадение левого коленного рефлекса. Угол подъема прямой ноги составил 70°. При исследовании соматосенсорньх вызванных потенциалов с ног отмечалось снижение амплитуд их ранних компонентов после проведения «маршевой пробы». При МРТ пояснично-крестцового отдела позвоночника выявлен центральный стеноз с уменьшением переднезаднего диаметра позвоночного канала на уровне LII-LIII до 6 мм, LIII-LIV - до 8 мм из-за гипертрофии желтой связки, дугоотростчатых суставов на уровне LIII-LIV протрузии межпозвонковых дисков на уровнях LII-LIII LIII-LIV до 4 мм, LIV-LV - до 3 мм (Рис. 6). При рентгенографии пояснично-крестцового отдела позвоночника выявлен субхондральный остеосклероз, снижение высоты межпозвонковых промежутков LII-LIII LIII-LIV LIV-LV LV-SI, спондилоартроз LIII-LIV задние остеофиты у нижнего края тел LII и LIII позвонков. После проведения диагностической блокады с местным анестетиком в проекции дугоотростчатых суставов на уровне LIII-LIV и LIV-LV в течение 2 ч отмечался полный регресс локальной боли в поясничной области. Таким образом, ведущим в клинической картине можно считать синдром каудогенной перемежающейся хромоты (в виде появляющихся при ходьбе болей и преходящих неврологических расстройств в зонах иннервации LIII- и LIV- корешков, регрессирующих при приеме характерной позы - наклоне вперед). Диагностика данного состояния не вызывает сомнений с учетом выявленного по данным МРТ стеноза позвоночного канала. Причина локальной боли в пояснице - дегенеративное поражение дугоотростчатых суставов, о чем свидетельствуют особенности болевого синдрома в виде усиления боли при разгибании в поясничном отделе (возрастает нагрузка на дугоотростчатые суставы), феномен «расхаживания», характерный для артропатического синдрома, и временный регресс боли после диагностических блокад с местными анестетиками. Пациенту был проведен курс консервативного лечения, включавший в себя прием НПВС (мелоксикам по 15 мг курсом 14 сут), вазоактивные препараты (пентоксифиллин в виде внутривенных инфузий (5 мл 2% раствора, 5 раз) с последующим постоянным приемом препарата в дозе 400 мг/сут курсом 2 мес, детралекс 3 раза в сутки), блокады с местными анестетиками и глюкокортикоидами в проекции дугоотростчатых суставов, ЛФК и массаж. На фоне проводимого лечения отмечалось увеличение проходимого без боли и неврологических нарушений расстояния до 300 м, регрессировала локальная боль в поясничной области. Однако через 6 мес состояние пациента вновь ухудшилось, появилась необходимость остановки при ходьбе из-за выраженной боли в ногах и ощущения слабости в бедре, которые по-прежнему регрессировали при остановке и приеме вынужденного положения. Пациенту было предложено оперативное лечение, на которое он дал согласие. Проведена ламинэктомия на клинически значимом уровне - LIII-LIV и удаление гипертрофированной желтой связки. После оперативного вмешательства болевой синдром при ходьбе практически регрессировал. Пациент мог пройти без боли, слабости и ощущения онемения в ногах более 1 км. Продолжала беспокоить умеренной интенсивности боль в поясничной области, связанная с дисфункцией дугоотростчатых суставов, по поводу которой пациент проходил в дальнейшем курсы консервативного лечения (блокады с местными анестетиками, прием НПВС, физиотерапия, ЛФК) с хорошими результатами.
Клинический пример
Пациентка Н., 64 года, пенсионерка, ранее работала воспитателем в детском саду. Боли в пояснично-крестцовой области беспокоят на протяжении 15 лет. Провоцировались физической нагрузкой. Несколько лет назад частота обострений увеличилась до 4-5 раз в год, в течение последних 2 лет боль в пояснице носит практически постоянный характер, усиливаясь при наклонах, поворотах туловища, после длительного пребывания в положении сидя. В течение года беспокоит боль в области крестца, в паховых областях, больше слева, которая усиливается как после длительного пребывания в положении сидя (пациентка отмечает, что для ее уменьшения «необходимо расходиться»), так и при ходьбе на расстояние более 500 м. Иногда боль при ходьбе иррадиирует по задней поверхности левой ноги до уровня верхней трети голени. Для уменьшения боли в крестцовой, паховой области и в левой ноге пациентка вынуждена останавливаться, отмечает, что «желательно присесть», но в отсутствии места для сидения может «просто остановиться» на 3-4 мин. Боль в этом случае также регрессирует. Пациентка отмечала положительный эффект от приема НПВС. При осмотре в неврологическом статусе патологической симптоматики не выявлено. Амплитуда движений в поясничном отделе позвоночника ограничена незначительно - сгибание в тесте Шобера - 4,5 см. При пальпации определяется болезненность в проекции дугоотростчатых суставов на уровне LIV-LV с обеих сторон. Угол подъема прямой ноги - 60° с обеих сторон. Положительная проба Патрика слева, болезненность при внутренней ротации бедра с обеих сторон, больше слева. Положительные пробы на связочный аппарат таза - крестцовоостистую связку, больше слева. Феномен «опережения» слева. При «маршевой пробе» пройденное до возникновения болевых ощущений расстояние составило 480 м. В неврологическом статусе изменений не отмечено. При МРТ пояснично-крестцового отдела позвоночника выявлен центральный стеноз с уменьшением переднезаднего диаметра позвоночного канала на уровне LIV-LV до 8 мм, LV-SI до 10 мм из-за гипертрофии желтой связки и протрузий межпозвонковых дисков на уровне LIV-LV до 4 мм, LV-SI - до 3 мм. При рентгенографии пояснично-крестцового отдела позвоночника выявлен субхондральный остеосклероз, снижение высоты межпозвонковых промежутков LIII-LIV LIV-LV, спондилоартроз LIV-LV артроз левого КПС. На рентгенограммах тазобедренных суставов - умеренно выраженный коксартроз. После проведения диагностической блокады с местным анестетиком в проекции левого КПС на протяжении 2 ч отмечен полный регресс боли в крестцовой области и отсутствие боли в левой ноге при ходьбе. Пациентка прошла примерно 700 м и была вынуждена остановиться на короткое время из-за умеренной интенсивности боли в проекции тазобедренного сустава, иррадиирующей в паховую область.
Таким образом, в приведенном случае клинически незначимый поясничный стеноз сопровождали скелетно-мышечные нарушения, ставшие основной причиной перемежающейся хромоты: дисфункция левого КПС и коксартроз. У пациентки с узким позвоночным каналом отмечалось изолированное нарастание интенсивности боли при ходьбе, нетипичной для корешкового поражения локализации, которое было обусловлено сопутствующим поясничному стенозу дегенеративным поражением суставов таза и ног («псевдостеноз»). Диагностически важен временный регресс боли после диагностических блокад крестцово-подвздошного сочленения с местными анестетиками. Примечательно, что в приведенном случае при ходьбе не было нарастания неврологического дефицита, при невроортопедическом обследовании выявлена дисфункция КПС, связочного аппарата таза, дегенеративное поражение крупных суставов ног. Был проведен курс консервативного лечения, включавший прием НПВС (целекоксиб по 200 мг/сут курсом 14 сут), блокады КПС с местными анестетиками и глюкокортикоидами, ультразвуковое воздействие с местными анестетиками на пораженные суставы, ЛФК, массаж. На фоне проводимого лечения отмечен полный регресс перемежающейся хромоты. Пациентка была направлена на консультацию к артрологу для определения оптимальной тактики лечения коксартроза.
Дископатия как причина боли в спине
Возможность самостоятельности изолированного поражения межпозвоночного диска в качестве источника боли в спине дискутабельна. В то же время существует точка зрения, что диск может быть основным источником локальной боли у 10% пациентов с острой болью в спине и в 1/3 случаев хронической боли в пояснично-крестцовой области [Y. Zhou, S. Abdi, 2006].
По данным литературы, КТ-дискография позволяет выявить пораженный межпозвоночный диск в качестве основного источника боли у 30-40% пациентов с хроническими скелетно-мышечными болевыми синдромами, в том числе и в тех случаях, когда боль расценили как «психогенную» [N. Bogduk, 2004]. Проведение КТ-дискографии позволяет определить разрывы в фиброзном кольце межпозвоночного диска (как отмечено выше, содержимое пульпозного ядра обладает потенциальным токсическим воздействием на невральные структуры внутри позвоночного канала и способно запускать иммунное воспаление), а также спровоцировать типичный паттерн боли, связанной с пораженным диском.
Четких критериев клинической диагностики дискогенной боли не существует. По мнению многих авторов, ее нельзя клинически отличить от других причин хронической боли в спине [L. Kapural, A. Goyle, 2007]. Дископатию наиболее часто отмечают у пациентов молодого и среднего возраста (до 40 лет). Считают, что дискогенная боль обычно имеет локальный характер или отражается в ягодичную область. Она может характеризоваться как тупая, ноющая, усиливающаяся в положении сидя, особенно при отсутствии опоры, и требует постоянной перемены положения тела. Как правило, пациенты с дискогенной болью не могут находиться в одной позе в положении сидя более 30 мин. Боль может усиливаться при наклоне вперед и вращении. Диагностика дискогенной боли требует проведения КТдискографии. Перед принятием решения о целесообразности этой инвазивной диагностической процедуры рекомендуют провести тщательный поиск других возможных причин боли в спине (фасеточный синдром, дисфункция КПС). Согласно последним рекомендациям Международной ассоциации по инвазивным методам лечения заболеваний позвоночника (international Spine intervention Society - ISIS) дискографию можно использовать для установления точного источника боли в спине в случаях, когда есть необходимость решить вопрос о целесообразности дальнейшего проведения инвазивных лечебных мероприятий [T. Maus, 2008]. В тех случаях когда пациента нельзя рассматривать как потенциального кандидата для малоинвазивных методов лечения, от проведения дискографии рекомендуют воздерживаться. Иногда этот диагностический метод используют у пациентов с послеоперационным люмбоишиалгическим синдромом (ПЛС), например, после проведения заднего спондилодеза, чтобы дифференцировать боль, связанную с патологией межпозвонковых суставов, от дискалгии.
Относительными показаниями к проведению КТ-дискографии считают:
- необходимость сопоставления выявленных неинвазивными методами визуализации изменений в межпозвоночном диске с клинической картиной (выявление «симптоматического» диска);
- целесообразность более углубленного обследования пациента с выраженным болевым синдромом, у которого другие диагностические исследования не выявили источник боли;
- исследование для выявления «симптоматического» диска перед минимально инвазивными вмешательствами.
Противопоказания к проведению дискографии - дисцит, локальные инфекционные поражения мягких тканей в области проведения вмешательства, коагулопатии, аллергические реакции на контрастные вещества, местные анестетики и антибиотики, применяющиеся при выполнении процедуры. Относительным противопоказанием считают грыжу межпозвоночного диска [P. Raj, 2003]. Нецелесообразно проведение дискографии при острой и подострой боли в спине.
Основным критерием болевого синдрома, связанного с дископатией, считают выявление внутренних разрывов диска, при этом введение контрастного вещества воспроизводит «узнаваемую» пациентом боль в спине («провокационная» дискография), а стимуляция как минимум одного асимптомного диска не вызывает болевых ощущений [Y. Zhou, S. Abdi, 2006]. Если при дискографии боль возникает при воздействии на все исследуемые диски, диагностика дископатии не правомерна. Обычно интенсивность боли, «узнаваемой» пациентом, достигает 7-10 баллов по ВАШ. При правильном выявлении пораженного диска боль возникает уже при небольшом повышении давления в нем, которое контролируют манометрией. Оно обычно превышает давление, под которым контраст начинает поступать в диск, менее чем на 1,02 атм. Боль, возникающая при повышении давления от 1,02 до 3,4 атм, в пользу или против наличия дископатии не свидетельствует. Также при дискографии необходимо выявить морфологические изменения диска, например его разрыв, распространяющийся до наружной трети фиброзного кольца. В нормальном диске контраст, введенный в пульпозное ядро, остается в его пределах в виде скопления округлой или четырехугольной формы. При дегенеративных изменениях в диске появляются трещины и щели различной ширины, распространяющиеся от пульпозного ядра в радиальном направлении. Иногда они заканчиваются полостями с циркумферентным накоплением контраста, когда щель распространяется между пластинами фиброзного кольца. Если щель в дистальных отделах не замкнута, отмечают утечку контраста в эпидуральное пространство или паравертебральные ткани. Наиболее хорошо эти изменения видны на аксиальных КТ-изображениях, полученных непосредственно сразу после контрастирования [T. Maus, 2008].
Несмотря на то, что «провокационная» дискография остается самым чувствительным методом диагностики дискогенной боли, ее применение сопряжено с болезненностью, риском большего повреждения диска и нарастанием в нем дегенеративных изменений. В качестве альтернативы предлагают проведение МРТ с контрастированием (внутривенное введение гадолиния), при котором можно выявить участки накопления контраста грануляционной тканью в области разрывов фиброзного кольца [P. Raj, 2008].
В патогенезе дискогенной боли имеет значение иммунное воспаление, прорастание нервных волокон и кровеносных сосудов вглубь диска и снижение синтеза протеогликанов (см. «Патофизиология дискогенной боли»). Считают, что повреждение диска может быть следствием его дегенеративных, связанных с возрастом, изменений, травмы, курения и, возможно, влияния отдельных генетических факторов. Доказано, что у пациентов с хронической болью в спине нервные окончания прорастают во внутренние слои фиброзного кольца и пульпозное ядро [A. Freemont, T. Peacock, 1997]. Также в патогенезе дискогенной боли имеет значение фактор роста нервных волокон. Его не обнаруживают в интактных дисках, но в симптоматическом диске определяется повышение экспрессии его рецептора TrkA [A. Freemont, T. Peacock, 2002].
В последние годы используют несколько методов лечения дискогенной боли. Большинство из них относятся к минимально инвазивным - чрескожная декомпрессия диска [лазерная дискэктомия, радиочастотная аблация (плазменная дискэктомия), механическая декомпрессия диска, ручная чрезкожная декомпрессия], эндоскопическая чрескожная дискэктомия и аннулопластика [внутридисковая электротермическая терапия (intradiscal electrothermal therapy), радиочастотная задняя аннулопластика]. При наиболее часто применяющейся малоинвазивной процедуре для лечения дископатии - внутридисковой электротермической терапии - термически воздействуют на задние отделы фиброзного кольца проводимой чрескожно нагревающейся спиралью, при этом радиочастотная энергия конвертируется в тепловую. Предполагаемый механизм воздействия этого метода заключается в изменении свойств коллагеновых волокон фиброзного кольца. На молекулярном уровне трехслойные спирали коллагена внутри фиброзного кольца связаны между собой термочувствительными водородными мостиками. При воздействии тепла они разрушаются и коллагеновые спирали «слипаются» между собой, создавая новую сокращенную молекулу, обладающую большими резистивными свойствами. Отсюда название «пластика». Одновременно происходит и термокоагуляция прорастающих в более глубокие отделы фиброзного кольца ноцицептивных волокон, что вызывает денервацию пораженного диска, подобную той, которая происходит при РЧД медиальной ветви, иннервирующей дугоотростчатый сустав. Эффективность всех перечисленных методов нуждается в подтверждении [P. Raj, 2008]. Исследование по эффективности внутридискового введения ингибитора ФНО-α этанерцептаΨ не показало пользы от его однократного применения [P. Cohen и др., 2007].
Список рекомендуемой литературы
- Алексеев В.В., Кузнецов И.В., Строков И.А. и др. Сочетание послеоперационной люмбоишиалгии с субклиническим поясничным стенозом // Боль. - 2005. - № 1. - С. 47-53.
- Благодатский М.Д. Патогенез и хирургическое лечение корешковых болевых синдромов поясничного остеохондроза /: Автореф: дис. ... д-ра мед. наук. - Л., 1987. - 43 с.
- Благодатский М.Д., Солодун Ю.В. Об аутоиммунном компоненте воспалительных реакций при корешковых синдромах поясничного остеохондроза // Журнал неврологии и психиатрии. - 1988. - № 4. - С. 48-51.
- Боренштейн Д., Визель С., Боден С. Боли в шейном отделе позвоночника: Пер. с англ. - М.: Медицина, 2005. - 790 с. Галимский В.В. Иммунологические механизмы развития радикулопатий // Актуальные вопросы фармакологии. - 1999. - С. 144-145.
- Герасимова М.М., Петушков А.Ю., Власенко Н.Ю. Клиникоэлектромиографическая характеристика пояснично-крестцовых радикулопатий // Журнал неврологии и психиатрии. - 2006. - № 2. - С. 52-55.
- Глауров А.Г. Нарушения венозного кровообращения и методы его коррекции при вертеброгенных радикулярных синдромах // Сосудистые заболевания нервной системы. - М., 1986. - С. 33-34.
- Команцев В.Н., Заболотных В.А. Методические основы клинической электронейромиографии. - СПб. Лань, 2001. - 350 с.
- Лазорт Г. Васкуляризация и гемодинамика спинного мозга. Анатомия, физиология, патология, ангиография: Пер. с фр. - М.: Медицина, 1977. - 256 с.
- Латышева В.И., Антонов И.П., Борткевич Л.Г. Аутоиммунные механизмы патогенеза неврологических проявлений поясничного остеохондроза // Иммунология. - 1985. - № 2. - С. 80-81.
- Минаева Н.Г. Клинико-инструментальные характеристики поясничного стеноза: Дис. ... канд. мед. наук. - М., 2004. - 119 с.
- Миронов С.П., Ветрилэ С.Т., Крупаткин А.И. и др. Микрогемоциркуляция нервных корешков и твердой мозговой оболочки до и после дискэктомии при поясничных болях // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 2006. - № 3. - С. 57-61.
- Миронов С.П., Назаренко Г.И., Черкашов А.М. и др. Лечение остеохондроза поясничного отдела позвоночника методом чрескожной лазерной дискэктомии // Вестник травматологии и ортопедии. - 1998. - № 2. - С. 19-24.
- Осна А.И. Хирургическое лечение поясничных остеохондрозов. - М.: Медицина, 1965. - 192 с.
- Осна А.И., Путинцева Л.С., Атучина С.И. Аутоиммунные реакции в патогенезе остеохондроза позвоночника // Журнал невропатологии и психиатрии. - 1970. - № 11. - С. 1621-1625.
- Попелянский Я.Ю. Ортопедическая неврология. - Казань, 1997. - Т. 1-2.
- Скоромец А.А., Тиссен Т.П., Панюшкин А.И. и др. Сосудистые заболевания спинного мозга. - СПб.: СОТИС, 1998. - 526 с. Смирнов А.Ю. Клиника, диагностика и лечение поясничного стеноза // Нейрохирургия. - 1999. - № 2. - С. 59-64.
- Черненко О.А, Ахадов Т.А., Яхно Н.Н. Соотношение клинических данных и результатов магнитно-резонансной томографии при болях в пояснице // Неврологический журнал. - 1996. - T. 2. - С. 12-16.
- Чурюканов М.В., Черненко О.А. Эпидуральное введение глюкокортикоидов при люмбоишиалгии: механизмы действия, оценка эффективности // Боль. - 2007. - Т. 14. - № 5. - С. 46-52.
- Штульман Д.Р., Макарова Е.В., Фрих-Хар Г.И. и др. Перемежающаяся хромота при врожденном стенозе позвоночного канала // Современная медицина. - 1974. - № 8. - С. 10-13.
- Almond L.M., Hamid N.A., Wasserberg J. Thoracic intradural disc herniation // Br. J. Neurosurg. - 2007. - Vol. 21 (1). - P. 32-34.
- Aminoff M.J., Eisen A. Somatosensory evoked potentials. In: Aminoff M.J. Ed. Electrodiagnosis in clinical neurology, 5th edition. - New York: Churchhill Livingstone, 2005. - P. 553-576.
- Amundsen T., Weber H, Nordal H.J. et al. Lumbar spinal stenosis: Conservative or surgical management? A prospective 10-year study // Spine. - 2000. - Vol. 25. - P. 1424-1436.
- Baron R., Binder A. How neuropathic is sciatica? The mixed pain concept. // Orthopade. - 2004. - Vol. 33. - № 5. - P. 568-575.
- Battie М.С., videman T., Gibbons L.E. et al. 1995 Volvo Award in clinical sciences. Determinants of lumbar disc degeneration. A study relating lifetime exposures and magnetic resonance imaging findings in identical twins // Spine. - 1995. - Vol. 20. - P. 2601-2612.
- Benzon H.T. Epidural steroid injections for low back pain and lumbosacral radiculopathy // Pain. - 1986. - Vol. 24. - P. 277-295.
- Berger A.R., Sharma K., Lipton R.B. Comparison of motor conduction abnormalities in lumbosacral radiculopathy and axonal polyneuropathy // Muscle Nerve. - 1999. - Vol. 22. - P. 1053-1057.
- Bland J. Anatomy and pathology of the cervical spine. In: Clinical anatomy and management of cervical spine pain / Ed. by Giles L., Singer K. - Butterworth/Heinemann, 2005. - P. 23-39.
- Bodack M.P., Monteiro M. Therapeutic exercise in the treatment of patients with lumbar spinal stenosis // Clin Orthop. - 2001. - Vol. 384. - P. 144-152. Bogduk N. Management of chronic low back pain // MJA. - 2004. - Vol. 180. - P. 79-83.
- Braddom R.i., Johnson E.W. Standardization of H-reflex and diagnostic use in S1 radiculopathy // Arch Phys Med Rehabil. - 1974. - Vol. 55. - P. 161-166.
- Brisby H., Byrod G., Olmarker K. et al. Nitric oxide as a mediator of nucleus pulposus-induced effects on spinal nerve roots // J Orthop Res. - 2000. - Vol. 18. - P. 815-820.
- Brisby H., Olmarker K., Larsson K. et al. Proinflammatory cytokines in cerebrospinal fluid and serum in patients with disc herniation and sciatica // Eur Spine J. - 2002. - Vol. 11. - P. 62-66.
- Brisby H., Olmarker K., Rosengren L. et al. Markers of nerve tissue injury in the cerebrospinal fluid in patients with lumbar disc herniation and sciatica // Spine. - 1999. - Vol. 24. - P. 742-746.
- Bruehlmann S.B., Rattner J.B., Matyas J.R. et al. Regional variations in the cellular matrix of the annulus fibrosus of the intervertebral disc // J Anat. - 2002. - Vol. 201. - P. 159-171.
- Burke J.G., Watson R.W.G., M^ormack D. et al. Intervertebral discs which cause low back pain secrete high levels of proinflammatory mediators // J Bone Joint Surg Br. - 2002. - Vol. 84. - P. 196-201.
- Cameron Т., Barolat G. Evolving Patterns of Spinal Cord Stimulation in Patients Implanted for Intractable Low Back and Leg Pain // Neuromod. - 2002. - Vol. 5 (3). - P. 167-179.
- Chen C., Cavanaugh J.M., Ozaktay C. et al. Effects of phospholipase A2 on lumbar nerve root structure and function // Spine. - 1997. - Vol. 22. - P. 1057-1064.
- Cohen P., Wenzell D., Hurley R. et al. A double-blind, placebo-controlled, dose-response pilot study evaluating intradiscal etanercept in patients with chronic discogenic low back pain or lumbosacral radiculopathy // Anesthesiology-2007. - Vol. 107(1). - P. 99-1.
- Delamarter R.B., Howard M.W., Goldstein T. et al. Percutaneous lumbar discectomy: Preoperative and postoperative magnetic resonance imaging // J Bone Joint Surg Am. - 1995. - Vol. 77. - P. 578-584.
- Derby R., Lee S.-H., Date E.S. Size and aggregation of corticosteroids used for epidural injections // Pain Med. - 2008. - Vol. 9 (2). - P. 227-234.
- Dubuisson D. Root disorders and arachnoiditis // McMahon: Wall and Melzack's Textbook of Pain, 5th ed. 2006 Churchill Livingstone, An Imprint of Elsevier.
- Eisenberg E., Damunni G., Hoffer E. et al. Lamotrigine for intractable sciatica: correlation between dose, plasma concentration and analgesia // Eur J Pain. - 2003. - Vol. 7 (6). - P. 485-491.
- Freemont A.J., Peacock T.E., Goupille P. et al. Nerve ingrowth into diseased intervertebral disc in chronic back pain // Lancet. - 1997. - Vol. 350. - P. 178-181.
- Freemont A.J., Watkins A., Le M.C. et al. Nerve growth factor expression and innervation of the painful intervertebral disc // J Pathol. - 2002. - Vol. 197. - P. 286-292.
- Frymoyer J. Lumbar disc disease: epidemiology // Instr Course Lect. - 1992. - Vol. 41. - P. 217-223.
- Genevay S., Stingelin S., Gabay C. Efficacy of etanercept in the treatment of acute severe sciatica: A pilot study // Ann Rheum Dis. - 2004. - Vol. 63. - P. 1120-1123.
- Goldberg M.S., Scott S.C., Mayo N.E. A review of the association between cigarette smoking and the development of non specific back pain and related outcomes // Spine. - 2000. - Vol. 25. - P. 995-1014.
- Gregory D.S., Seto C. K., Wortley G.C. Acute lumbar disk pain: navigating evaluation and treatment choices // Am Fam Physician. - 2008. - Vol. 78 (7). - P. 835-842.
- Heikkila J.K., Koskenvuo M., Heliovaara M. et al. Genetic and environmental factors in sciatica. Evidence from a nationwide panel of 9365 adult twin pairs // Ann Med. - 1989. - Vol. 21. - P. 393-398.
- Heliovaara M. Body height, obesity and risk of herniated lumbar intervertebral disc // Spine. - 1987. - Vol. 12. - P. 469-472. Heliovaara M. Risk factors for low back pain and sciatica // Ann Med. - 1989. - Vol. 21. - P. 257-264.
- Heliovaara M., Makela M., Knekt P. et al. Determinants of sciatica and low back pain // Spine. - 1991. - Vol. 16. - P. 608-614.
- Heran M.K. Smith A.D., Legiehn G.M. Spinal injection procedures: a review of concepts, controversies, and complications.// Radiol Clin North Am. - 2008. - Vol. 46 (3). - P. 487-514.
- Horner H.A., Urban J.P. Volvo Award Winner in Basic Science Studies: effect of nutrient supply on the viability of cells from the nucleus pulposus of the intervertebral disc // Spine. - 2001. - Vol. 26. - P. 2543-2549.
- Iatridis J.C., Mente P.L., Stokes I.A. et al. Compression-induced changes in intervertebral disc properties in a rat tail model // Spine. - 1999. - Vol. 24. - P. 996-1002.
- Inman S.L., Faut-Callahan M., Swanson B.A. et al. Sex differences in responses to epidural steroid injection for low back pain // J Pain. - 2004. - Vol. 5 (8). - P. 450-457.
- Ishihara H., Urban J.P. Effects of low oxygen concentrations and metabolic inhibitors on proteoglycan and protein synthesis rates in the intervertebral disc// J Orthop Res. - 1999. - Vol. 17. - P. 829-835.
- Jarvik J.G., Deyo R.A. Diagnostic evaluation of low back pain with emphasis on imaging // Ann Intern Med. - 2002. - Vol. 137 (7). - P. 586-597.
- Jensen T.S., Albert H.B., Soerensen J.S. et al. Natural course of disc morphology in patients with sciatica: an MRI study using a standardized qualitative classification system // Spine. - 2006. - Vol. 31 (14). - P. 1605-1612.
- Johnson E., Fletcher F.R. Lumbosacral radiculopathy: review of 100 consecutive cases // Arch Phys Med Rehabil. - 1981. - Vol. 62. - P. 321-323.
- Johnson W.E., Caterson B., Eisenstein S.M. et al. Human intervertebral disc aggrecan inhibits nerve growth in vitro // Arthritis Rheum. - 2002. - Vol. 46. - P. 2658-2664.
- Jones J.P. Subchondral osteonecrosis can conceivably cause disk degeneration and 'primary' osteoarthritis. In: Urbaniak J.R., Jones J.P., eds. Osteonecrosis. Park Ridge. - IL: American Academy of Orthopedic Surgeons, 1997. - P. 135-142.
- Jonsson B., Annertz M., Sjoberg C. et al. A prospective and conservative study of surgically treated lumbar spinal stenosis. Part II: Five-year follow-up by an independent observer // Spine. - 1997. - Vol. 22. - P. 2938- 2944.
- Jordan J., Shawver M.T., Weinstein J. Herniated lumbar disc // Clin Evid. - 2004. - Vol. 11. - P. 1477-1492.
- Kapural L., Goyle A. Imaging for provocative discography and minimally invasive percutaneous procedures for treatment of discogenic lower back pain // Tech Reg Anesth Pain Manage. - 2007. - Vol. 11 (2). - P. 73-80.
- Karppinen J., Korhonen T., Malmivaara A. et al. Tumor necrosis factor-a monoclonal antibody, infliximab, used to manage severe sciatica // Spine. - 2003. - Vol. 28. - P. 750-754.
- Karppinen J., Malmivaara A. Efficacy of infliximab for disc herniationinduced sciatica. One-year followup // Spine. - 2004. - Vol. 29. - P. 2115-2119.
- Kauppila L.I. Prevalence of stenotic changes in arteries supplying the lumbar spine. A postmortem angiographic study on 140 subjects // Ann Rheum Dis. - 1997. - Vol. 56. - P. 591-595.
- Kauppila L.I., McAlindon T., Evans S. Disc degeneration/back pain and calcification of the abdominal aorta. A 25-year follow-up study in Framingham // Spine. - 1997. - Vol. 22. - P. 1642-1647.
- Kelly M. Pain due to pressure on nerves. Spinal tumours and the intervertebral disc // Neurology. - 1956. - Vol. 6. - P. 32-36.
- Khoromi S., Patsalides A., Parada S. еt al. Topiramate in chronic lumbar radicular pain. // J Pain. - 2005. - Vol. 6 (12). - P. 829-836.
- Kimura J. F-wave velocity in the central segment of the median and ulnar nerves. A study in normal subjects and in patients with Charcot-MarieTooth discase // Weurology - 1974. - Vol. 27. - P. 539-546.
- Kimura T., Nakata K., Tsumaki N. et al. Progressive degeneration of articular cartilage and intervertebral discs. An experimental study in transgenic mice bearing a type IX collagen mutation // Int Orthop. 1996. - Vol. 20. - P. 177-181.
- Korhonen T., Karppinen J., Paimela L. et al. The treatment of disc-herniationinduced sciatica with infliximab: one-year follow-up results of FIRST II, a randomized controlled trial // Spine. - 2006. - Vol. 15 (24). - P. 2759-2766.
- Kostova v., Koleva M. Back disorders (low back pain, cervicobrachial and lumbosacral radicular syndromes) and some related risk factors // Journal of the Neurological Sciences. - 2001. - Vol. 192. - P. 17-25.
- Kuijper B., Tans J., Schimsheimer R. J. Degenerative cervical radiculopathy: diagnosis and conservative treatment. A review // European Journal of Neurology. - 2009. - Vol. 16 (1). - P. 15-20.
- Lavelle W.F. Interventional techniques for back pain // Clin Geriatr Med. - 2008. - Vol. 24 (2). - P. 345-368.
- Levin K.H. Electrodiagnostic approach to the patient with suspected radiculopathy // Neurol. Clin. - 2002. - Vol. 20 (2). - P. 397-421.
- Levin K.H., Maggiano H.J., WilbournA.J. Cervical radiculopathies: comparison of surgical and EMG localization of single-root lesion // Neurology. - 1996. - Vol. 46. - P. 1023.
- Li S.W., Prockop D.J., Helminen H. et al. Transgenic mice with targeted inactivation of the Col 2 alph. 1 gene for collagen II develop a skeleton with membranous and periosteal bone but no endochondral bone // Genes Dev. - 1995. - Vol. 9. - P. 2821-2830.
- Lindahl O., Rexed B. Histological changes in spinal nerve roots of operated cases of sciatica // Acta Orthop Scand. - 1951. - Vol. 20. - P. 215-225.
- Long D. Surgical treatment for back and neck pain /McMahon. Wall and Melzack's Textbook of Pain, 5th ed. Churchill Livingstone, An Imprint of Elsevier, 2006.
- Lotz J.C, lliou O.K., СЫп J.R. et al. 1998 Volvo Award winner in biomechanical studies - compression-induced degeneration of the intervertebral disc: an in vivo mouse model and finite-element study // Spine. - 1998. - Vol. 23. - P. 2493-2506.
- Lyons G., Eisenstein S.M., Sweet M.B. Biochemical changes in intervertebral disc degeneration // Biochim Biophys Acta. - 1981. - Vol. 673. - P. 443-453.
- Malik K., Benzon H. Low back pain in Benzon: Raj's Practical Management of Pain, 4th ed. - Mosby, 2008.
- Markova T., Dhillon B.S., Martin S.i. Treatment of Acute Sciatica // American Family Physician. - 2007. - Vol. 75. - № 1. - P. 99-100.
- Matsui H., Kanamori M., ishihara H. et al. Familial predisposition for lumbar degenerative disc disease // Spine. - 1998. - Vol. 23. - P. 1029-1034.
- Maus T.P. Radiologic Assessment of the Patient with Spine Pain in Benzon: Raj's Practical Management of Pain, 4th ed. - Mosby, 2008.
- McCarron R.F., Wimpee M.W., Hudkins P.G. et al. The inflammatory effects of nucleus pulposus: a possible element in the pathogenesis of low back pain // Spine. - 1987. - Vol. 12. - P. 760-764.
- Melrose J., Roberts S., Smith S. et al. Increased nerve and blood vessel ingrowth associated with proteoglycan depletion in an ovine anular lesion model of experimental disc degeneration // Spine. - 2002. - Vol. 27. - P. 1278-1285.
- Miranda H., riikari-Juntura E., Martikainen R. et al. Individual factors, occupational loading and physical exercise as predictors of sciatica pain // Spine. - 2002. - Vol. 27. - P. 1002-1009.
- Myers R., Olmarker K. Pathogenesis of sciatic pain: role of herniated nucleus pulposus and deformation of spinal nerve root and dorsal root ganglio // Pain. - 1998. - Vol. 78. - P. 99-105.
- Nygaard O.P., Mellgren S.I., Osterud B. The inflammatory properties of contained and noncontained lumbar disc herniation // Spine. - 1997. - Vol. 22. - P. 2484-2488.
- Obray J.B., Huntoon M.A. Interlaminar and Transforaminal Epidural Steroid Injections in Benzon: Raj's Practical Management of Pain, 4th ed. - Mosby, 2008.
- Ohshima H., Urban J.P.G. Effect of lactate concentrations and pH on matrix synthesis rates in the intervertebral disc // Spine. - 1992. - Vol. 17. - P. 1079-1082.
- Olmarker K., Larsson K.Tumor necrosis factor a and nucleus-pulposusinduced nerve root injury // Spine. - 1998. - Vol. 23. - P. 2538-2544.
- Olmarker K., Rydevik B. Selective inhibition of tumor necrosis factor-a prevents nucleus pulposus-induced thrombus formation, intraneural oedema, and reduction of nerve conduction velocity // Spine. - 2001. - Vol. 26. - P. 863-869.
- Onda A., Yabuki S., Kikuchi S. Effects of neutralizing antibodies to tumor necrosis factor-alpha on nucleus pulposus-induced abnormal nociresponses in rat dorsal horn neurons // Spine. - 2003. - Vol. 28. - P. 967-972.
- Osti O.L., rernon-Roberts B., Fraser R.D. 1990 Volvo Award in experimental studies. Anulus tears and intervertebral disc degeneration. An experimental study using an animal model // Spine. - 1990. - Vol. 15. - P. 762-767.
- Panayiotopoulos C.P., Chroni E. F-waves in clinical neurophysiology: a review, methodological issues and overall value in peripheral neuropathies // Electroencephalogr Clin Neurophysiol. - 1996. - Vol. 101. - P. 365-374.
- Persson L.C., Moritz U., Brandt L. et al. Cervical radiculopathy: pain, muscle weakness and sensory loss in patients with cervical radiculopathy treated with surgery, physiotherapy or cervical collar. A prospective, controlled study // European Spine Journal. - 1997. - Vol. 6. - P. 256-266.
- Peul W.C., van Houwelingen H.C., van den Hout W.B. The Hague Spine Intervention Prognostic Study Group, et al. Surgery versus prolonged conservative treatment for sciatica // N Engl J Med. - 2007. - Vol. 356 (22). - P. 2245-2256.
- Phillips L.H., Park T.S. Electrophysiologic mapping of the segmental anatomy of the muscles of the lower extremity // Muscle Nerve. - 1991. - Vol. 14. - P. 1213-1218.
- Piperno M., le Graverand H., Reboul P. et al. Phospholipase A2 activity in herniated lumbar discs // Spine. - 1997. - Vol. 22. - P. 2061- 2065.
- Porterfield J., DeRosa C. Mechanical low back pain. 2nd ed. - Philadelphia: W.B. Saunders Company, 1998. - P. 278.
- Puustjarvi K., Takala T., Wang W. et al. Proteoglycans in the interverterbal disc of young dogs following strenuous running exercise // Conn Tiss Res. - 1993. - Vol. 30. - P. 1-16.
- Radhakrishnan K., Litchy W.J., O'Fallon W.M. et al. Epidemiology of cervical radiculopathy. A population-based study from Rochester, Minnesota, 1976 through 1990 // Brain. - 1994. - Vol. 117. - P. 325-335.
- Raj P. Intervertebral Disc: Anatomy-Physiology-Pathophysiology-Treatment // Pain Practice. - 2008. - Vol. 8 (1). - P. 18-44.
- Raj P.P., Lou L., Erdine S. Radiographic imaging for regional anesthesia and pain management. - New York: Churchill Livingstone, 2003.
- Riihimaki H., Tola S., rideman T. et al. Low back pain and occupation // Spine. - 1989. - Vol. 14. - P. 204-209.
- Riihimaki H., riikari-Juntura E., Moneta G. et al. Incidence of sciatic pain among men in machine operating, dynamic physical work and sedentary work // Spine. - 1994. - Vol. 19. - P. 138-142.
- Roberts S., Eisenstein S.M., Menage J. et al. Mechanoreceptors in intervertebral discs. Morphology, distribution, and neuropeptides // Spine. - 1995. - Vol. 20. - P. 2645-2651.
- Roberts S., Urban J.P.G., Evans H. et al. Transport properties of the human cartilage end-plate in relation to its composition and calcification // Spine. - 1996. - Vol. 21. - P. 415-420.
- Rydevik B.L., Pedowitz R.A., Hargens A.R. et al. Effects of acute, graded compression on spinal nerve root function and structure. An experimental study of the pig cauda equina // Spine. - 1991. - Vol. 16. - P. 487493.
- Saal J.A. Natural history and nonoperative treatment of lumbar disc herniation // Spine. - 1996. - Vol. 21(24S). - P. 2-9.
- Saal J.S., Franson R.C., Dobrow R. et al. High levels of inflammatory phospholipase A2 activity in lumbar disc herniations // Spine. - 1990. - Vol. 15. - P. 674-678.
- Samartzis D., Shen F.H., Perez-Cruet M.J. Minimally Invasive Spine Surgery: A Historical Perspective // Orthop Clin North Am. - 2007. - Vol. 38(3). - P. 305-326.
- Sambrook P.N, MacGregor A.J., Spector T.D. Genetic influences on cervical and lumbar disc degeneration: a magnetic resonance imaging study in twins // Arthritis Rheum. - 1999. - Vol. 42. - P. 366-372.
- Singh V., Derby R. Percutaneous lumbar disc decompression // Pain Physician. - 2006. - Vol. 9. - P. 139-146.
- Skouen J.S., Brisby H., Otani K. et al. Protein markers in cerebrospinal fluid in experimental nerve root injury // Spine. - 1999. - Vol. 24. - P. 21952000.
- Stafford M. A., Peng P., Hill D.A. Sciatica: a review of history, epidemiology, pathogenesis, and the role of epidural steroid injection in management // British Journal of Anaesthesia. - 2007. - Vol. 99 (4). - P. 461-473.
- Stillerman C.B., McCormick P.C., Bensel E.C. Thoracic discectomy in Spine Surgery: techniques, complications, avoidance, and management / Ed. by E. Benzel. 2nd Ed. - Elsevier-Churchill Livingstone, 2004. - Vol 1. - P. 582-600.
- Takahashi H., Suguro T., Okazima Y. et al. Inflammatory cytokines in the herniated disc of the lumbar spine // Spine. - 1996. - Vol. 21. - P. 218-224.
- Tang L.M., Schwartz M.S., Swash M. Postural effects on F-wave parameters in lumbosacral root compression and canal stenosis // Brain. - 1988. - Vol. 111. - P. 207-213.
- Tarulli A.W. Lumbosacral radiculopathy // Neurol Clin. - 2007. - Vol. 25 (2). - P. 387-405.
- Taylor J.R., Giles L.G. Lumbar intervertebral discs / Clinical anatomy and management of low back pain/ Ed. by Giles L., Singer K. - Butterworth/ Heinemann, 1997. - P. 72-96.
- Toyokura M., Murakami K. F-wave study in patients with lumbosacral radiculoathies // Electromyography Clinical Neurophysiology. - 1997. - Vol. 37. - P. 19-26.
- Tsao B.E., Levin K.H., Bodnar R.A. Comparison of surgical and electrodiagnostic findings in single root lumbosacral radiculopathies // Muscle Nerve. - 2003. - Vol. 27. - P. 61.
- University of Michigan Health System: Acute low back pain, University of Michigan Health System Ann Arbor, Mich, 2003.
- Urban J.P., Holm S., Maroudas A. Diffusion of small solutes into the intervertebral disc: as in vivo study // Biorheology. - 1978. - Vol. 15. - P. 203-221.
- Urban J.P., McMullin J.F. Swelling pressure of the lumbar intervertebral discs: influence of age, spinal level, composition and degeneration // Spine. - 1988. - Vol. 13. - P. 179-187.
- Watanabe H., Nakata K., Kimata K. Dwarfism and age-associated spinal degeneration of heterozygote cmd mice defective in aggrecan // Proc Natl Acad Sci USA. - 1997. - Vol. 94. - P. 6943-6947.
- Weinstein J.N., Tosteson T.D., Lurie J.D. et al. Surgical vs Nonoperative Treatment for Lumbar Disk Herniation: The Spine Patient Outcomes Research Trial (SPORT): A Randomized Trial // JAMA. - 2006. - Vol. 296 (20). - P. 2441-2450.
- Yabuki S., Kikuchi S., Olmarker K. et al. Acute effects ofnucleus pulposus on blood flow and endoneurial fluid pressure in rat dorsal root ganglia // Spine. - 1998. - Vol. 23. - P. 2517-2523.
- Yoshizawa H., Rock H. Blood supply of lumbosacral vertebrae, spinal cord, nerve roots and ganglia in Clinical anatomy and management of low back pain / Ed. by Giles L., Singer K. - Butterworth/Heinemann, 1997. - P. 134-155.
- Zhou Y., Abdi S. Diagnosis and minimally invasive treatment of lumbar discogenic pain-a review of the literature // Clin J Pain. - 2006. - Vol. 22 (5). - P. 468-481.