Другие причины боли в спине
Источник: «Боль в спине»
Автор: Авторы: Подчуфарова Е.В., Яхно Н.Н. 2013.
Другие причины боли в спине
Спондилоартриты
Спондилоартриты - группа воспалительных заболеваний суставов, характеризующихся сходными клиническими признаками и носительством аллеля HLA-B27. В группу спондилоартритов входят анкилозирующий спондилит (болезнь Бехтерева), псориатический артрит, реактивные артриты, артрит и спондилит при заболеваниях кишечника и нозологически недифференцированный спондилоартрит. Эти болезни имеют ряд общих признаков: сакроилеит и спондилит; асимметричный артрит суставов нижних конечностей; воспаление кишечника (клинически манифестное или скрытое); внесуставные проявления (в частности, увеит, однотипное поражение кожи и слизистых оболочек, кардит); отсутствие ревматоидного фактора; носительство аллеля HLA-B27.
Эти заболевания относятся к компетенции ревматологов и подробно описаны в соответствующих руководствах [В.А. Насонова (ред.), 1997; Е.Л. Насонов, В.А. Насонова (ред.), 2008, P. Lipsky, 2006; В. И. Мазуров (ред.), 2005].
Клинические признаки спондилоартритов: боли в спине, особенно в поясничной области, области крестца и таза. Типичен «воспалительный» характер боли, которая имеет ряд особенностей: возникает у лиц моложе 40 лет; характеризуется постепенным началом; продолжается не менее 3 мес; характерна утренняя скованность; боль уменьшается после упражнений или другой физической нагрузки. Для других заболеваний, когда боль в позвоночнике вызвана не воспалительным поражением, а механическим повреждением или дегенеративными процессами, указанный характер болей не характерен. Часто боли в спине сочетаются с ощущением скованности, болями в мышцах и в местах прикрепления связок. Одновременно поражаются суставы осевого скелета - грудины, грудинно-реберные сочленения, реберно-позвоночные суставы. Обычно развивается асимметричный артрит (синовит) периферических суставов. Типичны энтезиты - воспаление в местах прикрепления сухожилий или связок к кости. У родственников первой и второй степени родства встречаются псориаз, острый увеит, реактивный артрит, воспалительные заболевания кишечника [P. Lipsky, 2006].
Анкилозирующий спондилит (болезнь Бехтерева) - хроническое воспалительное системное заболевание осевого скелета, характеризующееся преимущественным поражением КПС и позвоночника. Заболевание обычно начинается на 2-3-м десятилетии жизни, мужчины болеют в 3 раза чаще женщин. Анкилозирующий спондилит связан с носительством HLA-B27, и его частота коррелирует с распространенностью носительства указанного аллеля. Носительство HLA-B27 тем не менее не влияет на тяжесть болезни. Анкилозирующий спондилит развивается примерно у 1-6% взрослых носителей HLA-B27. Типичное раннее проявление заболевания - сакроилеит. Сначала обычно появляется постепенно нарастающая боль и скованность в поясничнокрестцовой области, ягодицах, грудной клетке. Периодически боль может носить острый характер, усиливаться при кашле, резких поворотах туловища, наклонах. Со временем боль распространяется на грудной и шейный отделы позвоночника, формируется стойкое ограничение движений во всех его отделах. На поздних стадиях развивается кифотическая деформация шейного и грудного отделов позвоночника («поза просителя»), связанная с окостенением связок позвоночника. У 25-35% пациентов возникает артрит тазобедренных и плечевых суставов, часто уже в начале заболевания. Иногда отмечаются преимущественно общие симптомы - утомляемость, потеря аппетита, лихорадка, похудание, потливость по ночам. Самое частое внесуставное проявление анкилозирующего спондилита, которое может даже предшествовать поражению позвоночника, - острый иридоциклит, проявляющийся болью в глазу, светобоязнью и слезотечением.
В некоторых случаях развиваются аортит и амилоидоз. Более чем у половины пациентов диагностируют колит и илеит, которые обычно протекают асимптомно. У 5-10% пациентов наблюдается развернутая картина неспецифического язвенного колита или болезни Крона. Лабораторных тестов для диагностики анкилозирующего спондилита не существует. Диагноз устанавливают по клиническим и рентгенологическим данным. Для диагностики анкилозирующего спондилита широко используют модифицированные нью-йоркские критерии 1984 г. Они включают в себя:
- боль в спине «воспалительного» характера в анамнезе;
- ограничение подвижности поясничного отдела позвоночника в сагиттальной и фронтальной плоскости;
- ограничение экскурсии грудной клетки (с учетом пола и возраста);
- рентгенологически подтвержденный сакроилеит.
Для диагностики анкилозирующего спондилита необходимы рентгенологические признаки сакроилеита в сочетании хотя бы с одним из остальных симптомов заболевания.
Патогенез анкилозирующего спондилита недостаточно изучен. Анкилозирующий спондилит начинается с появления грануляционной ткани в субхондральной части кости. В области надкостницы и связок отмечается лимфоцитарная и макрофагальная инфильтрация. Затем развивается деструкция хряща, склероз суставных поверхностей, фиброзный и костный анкилоз сустава. В позвоночнике начало патологического процесса характеризуется формированием воспаления и грануляций на границе фиброзного кольца межпозвоночного диска с телом позвонка. Внешние волокна фиброзного кольца при этом разрушаются и замещаются костной тканью, формируются перемычки между позвонками - синдесмофиты. Процесс распространяется в краниальном направлении, и со временем позвоночник на рентгенограммах становится похож на бамбуковую палку. Другие изменения позвоночника при анкилозирующем спондилите включают в себя диффузный остеопороз, деструкцию тел позвонков на границе с межпозвоночным диском, изменение формы тел позвонков («квадратные позвонки»). В дугоотростчатых суставах отмечаются воспалительные изменения, сопровождающиеся эрозивными изменениями суставного хряща и анкилозом.
Несомненна дизиммунная природа заболевания. Значительный регресс всех проявлений анкилозирующего спондилита при лечении ингибиторами ФНО-α свидетельствует о ключевом значении цитокинов в его иммунопатогенезе [J. Zochling, 2006]. В развитии забо левания предполагают участие кишечной микрофлоры. Существуют определенные данные об участии в патогенезе заболевания аутоантител к хрящевому протеогликану аггрекану.
В лечении анкилозирующего спондилита и других воспалительных спондилоартритов изменения произошли с начала применения ингибиторов ФНО-α. До их появления не было методов лечения, доказанно уменьшающих прогрессирование болезни. В настоящее время у пациентов, получающих ингибиторы ФНО-α (инфликсимаб, этанерцептΨ), отмечается быстрый и значительный регресс как клинических, так и лабораторных признаков активности заболевания. Инфликсимаб назначают в виде внутривенной инфузии в дозе 5 мг/кг с ее повторением через 2 нед, затем - через 6 и 8 нед. ЭтанерцептΨ применяют в виде подкожных инъекций в дозе 25 мг 2 раза в неделю. Традиционный метод лечения спондилоартритов - применение любых НПВС, позволяющих уменьшить интенсивность болей и скованности. Наиболее эффективными считают индометацин и диклофенак (вольтарен). В начале лечения назначают максимальную суточную дозу каждого препарата. Рекомендовано распределять прием НПВС в течение суток, учитывая индивидуальные особенности времени появления болей и скованности. Часто необходим отдельный прием препарата на ночь. При появлении эффекта (1-2 нед) и хорошей переносимости НПВС назначают длительно, обычно на несколько месяцев. Длительность приема определяют индивидуально для каждого пациента. При стойком уменьшении болей можно снизить дозу, а затем и отменить НПВС. Обострение болей считают показанием для возобновления лечения. При плохой переносимости или недостаточной эффективности выбранного препарата в полной дозе показан переход на другой препарат из группы НПВС. При поражении периферических суставов и энтезитах эффективно локальное введение пролонгированных глюкокортикоидов. В ранний период болезни при артрите периферических суставов и высокой лабораторной активности назначают сульфасалазин по 2 г/сут, длительно (на 6-12 мес и более).
Реактивный артрит - воспалительное асептическое поражение суставов, которое может осложнить любые инфекционные заболевания (обычно урогенитальные или кишечные). Для этой патологии характерен асимметричный олигоартрит преимущественно нижних конечностей, энтезиты, тендинит, тендосиновит, остеит и поражение слизистых оболочек. Многие пациенты с реактивным артритом жалуются на боль в спине. Считают, что она связана с воспалением сухожилий, мышечным спазмом, сакроилеитом и воспалительными изменениями в межпозвоночных суставах. Синдром Рейтера - сочетание реактивного артрита с уретритом и конъюнктивитом; за месяц до начала суставного синдрома обычно отмечается урогенитальная (хламидийная) или кишечная инфекция.
Как и анкилозирующий спондилит, реактивный артрит поражает в основном носителей HLA-B27. Обычно заболевают лица 18-40 лет, иногда реактивный артрит диагностируют у детей старше 5 лет и пожилых. Наиболее часто заболевание связано с инфицированием Shigella flexneri. Оно может возникать при инфекциях, вызванных и другими возбудителями: отдельными видами сальмонелл, Yersinia enterocolitica, Yersinia pseudotuberculosis, Campylobacter jejuni, Chlamidia trachomatis, Clostridium difficile, Ureaplasma urealiticum. Остается неясным, существует ли единый механизм развития реактивного артрита при разных инфекциях. Вероятно, большое значение в патогенезе реактивного артрита имеют антигенспецифичные Т-клетки. Роль HLAB27 в развитии данного состояния неясна.
Реактивный артрит - клинический диагноз, поскольку специфических лабораторных и нейровизуализационных изменений при нем не найдено. В острую фазу болезни отмечается увеличение СОЭ. В синовиальной жидкости обнаруживают неспецифические воспалительные изменения. На ранних стадиях заболевания рентгенологические изменения в суставах отсутствуют или ограничены околосуставным остеопорозом. Сакроилеит и спондилит - поздние проявления реактивного артрита. В отличие от анкилозирующего спондилита сакроилеит при реактивном артрите, как правило, бывает односторонним, синдесмофиты, иногда крупные, образуются в середине тел позвонков, а не по краям. Костный анкилоз позвонков формируется редко. Для правильной диагностики реактивного артрита важны анамнестические указания на эпизоды диареи и дизурии в течение месяца, предшествовавшего развитию артрита. При физикальном обследовании особое внимание следует обращать на внесуставные проявления заболевания: поражение глаз (конъюнктивит, иридоциклит), кожи (бленнорейная кератодермия - везикулы, которые постепенно ороговевают и, прежде чем исчезнуть, покрываются коркой), ногтей (онихолиз, подногтевой кератоз, желтые пятна на дистальной части ногтя), наружных половых органов (цирцинарный баланит - везикулы, на месте которых формируются безболезненные поверхностные эрозии). Если диагноз не вызывает сомнений, определять наличие HLA-B27 не обязательно. Диагностическая ценность этого исследования возрастает в сомнительных случаях, так как в отсутствие HLA-B27 вероятность реактивного артрита снижена.
В большинстве случаев эффективны НПВС. Обычно назначают индометацин по 75-150 мг/сут. При хламидийном артрите кроме противовоспалительного лечения рекомендованы антимикробные препараты (доксициклин) в терапевтических дозах курсом 10-30 сут. При тендинитах и энтезитах эффективно местное введение глюкокортикоидов. При стойком течении можно назначить сульфасалазин (внутрь до 3 г/сут в несколько приемов), азатиоприн (в дозе 1-2 мг/кг в сутки) или метотрексат (в дозе 7,5-15 мг/нед) [P. Lipsky, 2006].
Псориатический артрит - состояние, сочетающееся с кожным псориазом, по некоторым проявлениям сходен с ревматоидным артритом. Псориатический артрит развивается у 5-8% больных псориазом, чаще после 20 лет. Заболевание обычно отличается тяжелым течением с системными проявлениями. Характерно поражение дистальных межфаланговых суставов, часто в сочетании с псориатическими изменениями ногтей. Наряду с асимметричным моно- и олигоартритом крупных суставов может встречаться и симметричный полиартрит мелких суставов кистей и стоп. Спондилит возникает относительно редко и по клинической картине напоминает анкилозирующий спондилит. От анкилозирующего спондилита псориатический артрит отличает рентгенологическая картина: сакроилеит при последнем часто асимметричен, артрит в межпозвоночных суставах менее выражен, отмечается окостенение паравертебральных мягких тканей, некраевое расположение синдесмофитов, значительное поражение шейного отдела позвоночника, иногда с формированием подвывихов в атлантоаксиальном сочленении, меньшая степень поражения грудного и поясничного отделов.
При лечении псориатического артрита применяют ингибиторы ФНО α. Иногда возможна монотерапия НПВС (при умеренно выраженном моноолигоартрите). При полиартрите с высокой активностью назначают противовоспалительное («базисное») лечение медленно действующими препаратами с иммуномодулирующими и цитостатическими свойствами - метотрексат, сульфасалазин, циклоспорин. Глюкокортикоиды применяют редко, при выраженном обострении поражения кожи и суставов и развитии системных проявлений. Другие методы лечения псориатического артрита - фотохимиотерапия (PUVA-терапия) или PUVA-терапия в сочетании с приемом ретиноидов.
Артрит и спондилит при заболеваниях кишечника. Обе формы наиболее частых воспалительных заболеваний кишечника - неспецифический язвенный колит и болезнь Крона - могут сопровождаться спондилоартритом. Последний клинически и рентгенологически не отличим от идиопатического анкилозирующего спондилита. Его диагностируют примерно у 20% пациентов с воспалительными заболеваниями кишечника. Спондилоартрит может развиваться на любой стадии воспалительных заболеваний кишечника или предшествовать им. Патогенетическая связь данных состояний остается неизвестной. Диагностика этого состояния основана в основном на результатах исследования кишечника.
В отличие от ряда других спондилоартропатий спондилит при болезни Крона хорошо поддается лечению инфликсимабом, но не этанерцептомΨ. При этом ни один из этих препаратов не показал эффективности для лечения спондилоартропатии при неспецифическом язвенном колите. Другие методы лечения воспалительных заболеваний кишечника - назначение сульфасалазина, системное применение глюкокортикоидов, цитостатики - эффективны и при спондилоартропатиях, связанных с ними.
Недифференцированная и ювенильная спондилоартропатия. Иногда у пациентов, обычно молодого возраста, отмечаются те или иные симптомы спондилоартрита при отсутствии указаний на перенесенную инфекцию, без классической триады синдрома Рейтера, признаков воспалительных заболеваний кишечника или псориаза. При этом спондилоартропатия не соответствует и критериям анкилозирующего спондилита. У таких пациентов диагностируют недифференцированную спондилоартропатию. В некоторых случаях она может представлять собой реактивный артрит, при котором инфекцию, запустившую патологический суставной процесс, выявить не удается. У некоторых пациентов в последующем развивается воспалительное заболевание кишечника, псориаз или анкилозирующий спондилит. Примерно в половине случаев обнаруживают HLA-B27, но его выявление не подтверждает и не исключает диагноз недифференцированной спондилоартропатии. В семейных случаях спондилоартропатии при выявлении HLA-B27 в последующем, как правило, развивается анкилозирующий спондилит. Ювенильная спондилоартропатия обычно возникает у мальчиков 7-16 лет и проявляется асимметричным олигоартритом и энтезитом нижних конечностей. У большинства, хотя и не у всех пациентов с ювенильной спондилоартропатией, в более старшем возрасте развивается анкилозирующий спондилит.
Ревматоидный артрит - воспалительное заболевание неизвестной этиологии, характеризующееся симметричным хроническим эрозивным артритом (синовитом) периферических суставов и системным воспалительным поражением внутренних органов. Он относится к мультифакториальным аутоиммунным заболеваниям с генетической предрасположенностью и характеризуется прогрессирующим течением. Клинические проявления на ранней стадии заболевания обусловлены развитием синовитов, со временем постепенно присоединяются необратимые деструктивные изменения - эрозии и анкилозы, что ведет к деформациям и ограничению подвижности суставов. Нарушение функций суставов приводит к инвалидизации. Сначала воспалительному процессу наиболее подвержены мелкие суставы кистей и стоп, лучезапястные, голеностопные, коленные, плечевые и суставы шейного отдела позвоночника. Поражение позвоночника при ревматоидном артрите обычно ограничено верхней частью шейного отдела, боль в поясничной области для данного состояния нехарактерна. Артрит межпозвоночных суставов верхних шейных позвонков может приводить к подвывиху срединного атлантоосевого сустава и, редко, - к компрессии спинного мозга.
Характерный признак воспаления синовиальной оболочки суставов при ревматоидном артрите - утренняя скованность (обычно не менее часа), длительность которой коррелирует с выраженностью синовита. Внесуставные проявления включают в себя поражение кожи (васкулит, ревматоидные узелки), сердца, серозных оболочек, легких, почек, глаз, нервной системы и кроветворения. У 70-90% больных в крови обнаруживается увеличение титра ревматоидного фактора класса IgM (Ig - иммуноглобулины), значительно увеличивается СОЭ, повышается концентрация С-реактивного белка, уровень гемоглобина - снижается. Для диагностики ревматоидного артрита широко используют определение ревматоидного фактора. Он представляет собой антитела к Fc-фрагменту IgG. С помощью существующих методов лабораторной диагностики определяют в основном ревматоидный фактор класса IgM. Важно учитывать, что с возрастом частота выявления ревматоидного фактора у здоровых лиц увеличивается, и после 65 лет он присутствует в сыворотке 10-20% людей. Титр ревматоидного фактора также повышается при системной красной волчанке, синдроме Шегрена, саркоидозе, туберкулезе, сифилисе, идиопатическом фиброзирующем альвеолите, у здоровых людей после вакцинации, у родственников больных ревматоидным артритом. У большинства пациентов с ревматоидным артритом определяют антитела к цитруллин-содержащим белкам (anti-CCP). Их чувствительность при ревматоидном артрите сравнима с таковой для ревматоидного фактора класса IgM, а специфичность выше. Рентгенологическое исследование суставов выявляет эрозии (узуры) на суставных поверхностях и, реже, остеолиз - обширное разрушение поверхности мелких суставов, а позже анкилозы и подвывихи.
Лечение ревматоидного артрита направлено на уменьшение симптомов суставного воспаления, предотвращение деструкции, нарушений функции и деформации суставов. Принципиальную основу лечения ревматических заболеваний составляет системная фармакотерапия препаратами, модулирующими течение основного заболевания. Так называемые «базисные» препараты оказывают глубокое воздействие на ведущие звенья патогенеза и тормозят активность и прогрессирование хронических аутоиммунных ревматических болезней, закономерно уменьшая болевой синдром. Начинают лечение с метотрексата, лефлуномида, солей золота, сульфасалазина, циклоспорина или цитотоксиков (азатиоприн, циклофосфамид, хлорамбуцил). Однако, несмотря на эффективное применение базисных средств, болевые ощущения не всегда подавляются в достаточной степени. Для симптоматического лечения ревматоидного артрита - уменьшения боли и воспаления в суставах - применяют все известные НПВС. При выраженном болевом синдроме в первые дни заболевания может назначаться кеторолак (но не более 5 дней) в виде внутримышечных инъекций (90 мг/сут) с дальнейшим переходом на применение найза в дозе 200 мг/сут. При назначении этих препаратов нужно использовать как можно меньшую дозу, которую следует снизить или отменить при наступлении эффекта от «базисных» средств. По особым показаниям назначают глюкокортикоиды в низких дозах. К этим показаниям относят развитие тяжелых системных проявлений на фоне высокой лабораторной активности, неэффективность НПВС и «базисной» терапии или противопоказания к такому лечению. Местное (внутрисуставное) лечение пролонгированными глюкокортикоидами имеет вспомогательное значение. Не рекомендовано повторное введение глюкокортикоидов в один и тот же сустав чаще чем 1 раз в 3 мес. В последние несколько лет для лечения ревматоидного артрита шире применяют антицитокиновые препараты - этанерцепт, инфликсимаб, адалимумаб. Есть данные об эффективности рекомбинантного антагониста рецепторов к ИЛ-1 (анакинраΨ) [P. Lipsky, 2006].
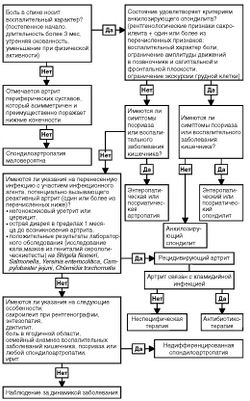
На Рис. 1 представлен алгоритм диагностики воспалительных спондилоартропатий [P. Lipsky, 2006].
Остеопороз
Остеопороз - заболевание скелета, для которого характерно снижение прочности кости и повышение риска возникновения переломов. Остеопороз - очень распространенное состояние. При денситометрическом обследовании его выявляют примерно у каждой третьей женщины и каждого пятого мужчины старше 50 лет. Выделяют первичный (постменопаузальный, сенильный, идиопатический) и вторичный (в частности, на фоне длительного приема глюкокортикоидов) остеопороз. Основными немодифицируемыми факторами риска остеопороза считают низкую минеральную плотность кости, женский пол, возраст старше 65 лет, европеоидную расу, семейный анамнез остеопороза и (или) наличие переломов при минимальной травме у родственников в возрасте старше 50 лет, гипогонадизм, системный прием глюкокортикоидов более 3 мес, предшествующие переломы и иммобилизация. К модифицируемым факторам риска остеопороза относят индекс массы тела менее 20 кг/м2 или массу тела менее 57 кг, курение, низкую физическую активность, склонность к падениям, недостаточное употребление кальция, дефицит витамина D, злоупотребление алкоголем [Е.Л. Насонов., 2008].
Само по себе снижение минеральной плотности костной ткани не связано с развитием боли в спине. Ее причиной могут быть компрессионные переломы тел позвонков. Считают, что частота их возникновения у лиц пожилого возраста высока и составляет до 63% [O. Blam, J. Cotler, 2003]. Обычно они протекают практически асимптомно, и пациент с удивлением может обнаружить уменьшение роста из-за предшествующих компрессионных переломов. Другие симптомы переломов тел позвонков при остеопорозе - увеличение грудного кифоза и уменьшение амплитуды движений в позвоночнике. Наиболее часто они отмечаются в среднем, нижнем грудном и поясничном отделах. Спонтанные переломы в вышележащих отделах позвоночника позволяют предположить, что они скорее связаны со злокачественными новообразованиями, чем с остеопорозом. Причинами компрессионных переломов могут быть падение, резкое движение, подъем тяжести и даже минимальные нагрузки (кашель). Интенсивность боли варьирует от высокой до полного ее отсутствия. Обычно отмечается локальная боль в месте повреждения. Она усиливается при кашле, натуживании, наклоне вперед, длительном сидении и стоянии и уменьшается в положении на боку с согнутыми в коленных и тазобедренных суставах ногами. Из этого положения пациенты обычно предпочитают садиться. В большинстве случаев боль уменьшается в течение нескольких недель и полностью регрессирует через 3 мес. Симптомы поражения спинномозговых корешков редки.
При клиническом обследовании отмечают болезненность при пальпации над областью перелома, деформацию позвоночного столба и со временем слабость мышц брюшной стенки. Повторные компрессионные переломы вызывают характерную кифотическую деформацию позвоночника.
При подозрении на компрессионный перелом позвонка необходимо проведение рентгенографии соответствующего отдела позвоночника в прямой и боковой проекции, а при ее недостаточной информативности - сцинтиграфии костей. При отсутствии переломов рентгенографию нельзя использовать для диагностики или исключения остеопороза из-за ее низкой чувствительности.
Двуэнергетическую рентгеновскую абсорбциометрию осевого скелета (денситометрию) считают наилучшим методом диагностики остеопороза и оценки риска переломов у женщин. Проведение денситометрического скрининга у всех женщин в период постменопаузы и у всех мужчин старше 50 лет не оправдано. Показания для костной денситометрии имеются у всех женщин в возрасте старше 65 лет, у женщин в постменопаузальном периоде моложе 65 лет при наличии факторов риска, у мужчин старше 70 лет, у взрослых с переломами при минимальной травме, при заболеваниях или состояниях, приводящих к снижению минеральной плотности костной ткани, приеме препаратов, снижающих костную массу [Е.Л. Насонов, 2008].
Программы профилактики и лечения остеопороза включают в себя нефармакологические и медикаментозные воздействия. Женщинам в любом возрасте для профилактики остеопороза следует выполнять комплексы физических упражнений, включающие упражнения из исходного положения стоя. Для пожилых женщин с риском падений необходимо разрабатывать индивидуальные программы ЛФК, включающие ходьбу, тренировку равновесия и упражнения, направленные на увеличение мышечной силы. Необходим отказ от курения и злоупотребления алкоголем. Лицам пожилого возраста необходимо проводить коррекцию нарушений зрения, отмену препаратов, повышающих риск падений, лечение сопутствующих заболеваний, оценку и коррекцию домашней обстановки, обучение стереотипу движений.
Препаратами первой линии в лечении постменопаузального остеопороза, остеопороза у мужчин и глюкокортикоидного остеопороза считают бисфосфонаты (алендроновая кислота) [О.М. Лесняк, Л.И. Беневольская, 2009]. Препарат назначают в дозе 70 мг 1 раз в неделю или 10 мг ежедневно в течение 3-5 лет. При глюкокортикоидном остеопорозе алендроновую кислоту назначают в дозе 5-10 мг/ сут. Назальный спрей кальцитонина - препарат второй линии для лечения постменопаузального остеопороза. Его можно применять для лечения остеопороза у мужчин. Рекомендуемые дозы кальцитонина - 200 международных единиц (МЕ) интраназально ежедневно или 100 ME внутримышечно через день. Селективный модулятор эстрогеновых рецепторов ралоксифен - препарат первой линии для профилактики и второй линии - для лечения постменопаузального остеопороза. Паратиреоидный гормон терипаратид - препарат первой линии для лечения тяжелого остеопороза у женщин в постменопаузе, а также при неэффективности или плохой переносимости бисфосфонатов и других препаратов для лечения остеопороза. Также доказана его эффективность для лечения остеопороза у мужчин старше 70 лет. Препараты кальция и витамина D должны быть обязательным компонентом любой схемы лечения остеопороза. Суточная доза кальция для пациентов с установленным диагнозом остеопороза, для лиц, получающих глюкокортикоиды, и людей старше 65 лет составляет 1000-1500 мг (по 600 мг на один прием), витамина D3 при проживании севернее 40° северной широты - в среднем 400-800 МЕ.
Основные мероприятия при недавно произошедшем компрессионном переломе позвонка включают в себя использование анальгетиков, ношение корсета, лечение и профилактику запоров. При условии адекватного обезболивания рекомендовано раннее восстановление двигательной активности. Доказана эффективность кальцитонина для уменьшения интенсивности боли и укорочения срока иммобилизации. Ношение корсета лучше использовать как временное дополнение к комплексу мероприятий для уменьшения боли, его длительного применения следует избегать. Через 3 мес после перелома важно начать выполнение регулярных упражнений, направленных на укрепление мышц брюшной стенки, силовые упражнения для укрепления мышц конечностей, тренировку равновесия [Е.Л. Насонов, 2008; О.М. Лесняк, Л.И. Беневольская, 2009].
В настоящее время для лечения пациентов с выраженным болевым синдромом, связанным с компрессионным переломом тела позвонка при остеопорозе, обычно применяют малоинвазивные вмешательства - кифопластику и вертебропластику. Показанием к их проведению считают болевой синдром, рефракторный к консервативному лечению. При этом необходимо уточнение связи сохраняющегося болевого синдрома именно с компрессионным переломом, а не с психологическими нарушениями или выраженным стенозом позвоночного канала. В ряде случаев перед вмешательством целесообразно проведение диагностической блокады дугоотростчатых суставов для исключения их патологии в качестве основной причины боли в спине. Вертебропластика заключается в чрескожной инъекции полиметилметакрилата в тело пораженного позвонка. При кифопластике с целью частичного восстановления высоты тела позвонка в него сначала вводят раздуваемый баллон. После нагнетания воздуха в создавшуюся полость вводят цементирующее вещество. Процедуры проводят под контролем нейровизуализации. Их эффективность, по предварительным данным, достигает 90% в отношении уменьшения интенсивности боли в ранний период после проведенной манипуляции. Эффект может быть обусловлен как стабилизацией микропереломов внутри тела позвонка, так и разрушением свободных нервных окончаний [D. Wilson и др., 2000]. В настоящее время методику кифопластики продолжают совершенствовать [L. Kapural, 2008].
Дегенеративный спондилолистез и сегментарная нестабильность позвоночника
Дегенеративный спондилолистез (смещение позвонков по отношению друг к другу) наиболее часто образуется на уровне LIV-LV и LV-S1, что обусловлено более слабым связочным аппаратом, большой высотой диска, преимущественно сагиттальной ориентацией суставных поверхностей дугоотростчатых суставов. Формированию дегенеративного спондилолистеза также способствуют:
- снижение механической прочности субхондральной кости (микропереломы на фоне остеопороза приводят к изменению взаимоотношения суставных поверхностей);
- уменьшение сопротивления нагрузке межпозвоночного диска, поврежденного дегенеративным процессом, и, как следствие,
повышение нагрузки на дугоотростчатые суставы для противостояния усилию переднего сдвига;
- усиление поясничного лордоза при изменении связочного аппарата;
- слабость мышц туловища;
- ожирение.
Дегенеративный спондилолистез может сочетаться с проявлениями сегментарной нестабильности позвоночника. Наиболее часто болевой синдром связан с формирующимся спондилоартрозом. Амплитуда движений в поясничном отделе позвоночника, как правило, сохранена, но пациенты обычно испытывают боль при гиперэкстензии. При осмотре, как правило, выявляют гиперлордоз. Неврологические расстройства при этом связаны с сужением и деформацией центрального и корешкового канала. Возможно развитие неврогенной перемежающейся хромоты, компрессии корешков и спинномозговых нервов, обычно на уровне LIV-LV. Диагноз подтверждают данными рентгенографии. При выявлении спондилолистеза для исключения нестабильности при рентгенографии целесообразно провести функциональные пробы (сгибание и разгибание). По данным нейровизуализации, прогрессирование спондилолистеза при наблюдении за пациентами в течение 10 лет отмечают в 34% случаев, в остальных случаях отмечено только нарастание дегенеративных изменений в пораженном ПДС (снижение высоты межпозвоночного диска). Не выявлено четкой связи между клиническими проявлениями и выраженностью визуализационных изменений, в том числе при нарастании последних. Отмечено лишь уменьшение выраженности локальной боли в спине при наблюдении за пациентами в течение нескольких лет, у которых не увеличивался спондилолистез, но продолжала снижаться высота межпозвоночного диска, что, возможно, является следствием «самостабилизации» ПДС. Неврологических проявлений спондилолистеза при таком периоде наблюдения не отмечали у 76% пациентов. Однако если неврологические нарушения диагностировали в начале наблюдения, то в 83% случаев они прогрессировали (с развитием, в основном клинических проявлений поясничного стеноза) [S. Canale, 2008].
При спондилолистезе показана коррекция связанных с ним скелетно-мышечных нарушений: ношение корсета, ЛФК, направленная на укрепление мышц спины и брюшного пресса. При присоединении фасеточного синдрома - лечебные блокады с местными анестетиками и глюкокортикоидами, РЧД дугоотростчатых суставов. При наличии стойкого болевого синдрома, не поддающегося лечению консервативными методами, показано проведение оперативного лечения. Как правило, в хирургическом лечении нуждаются не более 10-15% пациентов с дегенеративным спондилолистезом. Оно целесообразно при развитии неврологических нарушений - корешковых симптомов или клинических проявлений вторично суженного позвоночного канала. Цель оперативного лечения - декомпрессия содержимого позвоночного канала и стабилизация пораженных сегментов [А.И. Продан и др., 2005; М.С. Ветрилэ, 2004; D. Long, 2006]. Оперативное лечение при отсутствии клинических признаков поясничного стеноза и поражения корешков показано только при уверенности в наличии связи боли с изменениями биомеханики позвоночника и при неэффективности консервативного лечения.
Сегментарная нестабильность позвоночника (смещение тел позвонков по отношению друг к другу, величина которого меняется при движениях позвоночника) проявляется болью в спине, усиливающейся при длительной нагрузке, стоянии; часто возникает ощущение усталости, вызывающее необходимость отдыха лежа. Развитие нестабильности типично для женщин среднего возраста, страдающих умеренным ожирением, с эпизодами боли в спине в анамнезе, впервые отмеченной во время беременности. Наличие неврологической симптоматики необязательно. Сгибание не ограничено. При разгибании пациенты часто прибегают к помощи рук, «вскарабкиваясь по себе». Для установления окончательного диагноза необходима рентгенография с функциональными пробами (сгибание, разгибание).
При сегментарной нестабильности позвоночника необходимо соблюдение мер предосторожности при физической нагрузке, ношение корсета, ЛФК, направленная на укрепление мышц спины и брюшного пресса. Хирургическая коррекция не дает удовлетворительных результатов. Часто нестабильность исчезает с возрастом.
«Синдром неудачного оперативного вмешательства на позвоночнике» (послеоперационный люмбоишиалгический синдром)
Случаи, при которых не происходит улучшения после оперативных вмешательств на позвоночнике, представляют собой гетерогенную группу состояний, условно объединенных под диагностическим «ярлыком» «синдром неудачного оперативного вмешательства на позвоночнике» (послеоперационный люмбоишиалгический синдром (ПЛС)), или failed back surgery syndrome (FBSS) - в англоязычной литературе.
История хирургического лечения грыж межпозвоночных дисков началась в 1935 г. Частота оперативных вмешательств (ламинэктомий, дискэктомий и артродеза) при вертеброгенных болевых синдромах стала особенно высокой в 1979-1987 гг. В течение 1987 г. она возросла на 100% по сравнению с показателями прошлых лет [V. Taylor, 1994]. В США ежегодно проводят 250 тыс. ламинэктомий по поводу компрессионных радикулопатий и поясничного стеноза, и 30-40 тыс. повторных оперативных вмешательств связаны с ПЛС. Исходы оперативных вмешательств на позвоночнике определяются видом учреждения, где проводится оперативное лечение (худшие показатели ниже в специализированных центрах, возможно, из-за более тщательного отбора кандидатов для хирургического лечения), и критериями оценки эффективности лечения. Соответственно положительные исходы составляют 49-90% [C. Slipman и др., 2002].
Причины развития ПЛС условно можно разделить на связанные (прямо или косвенно) с собственно оперативным вмешательством и не связанные с ним. Первая группа пациентов с ПЛС включает тех, кому изначально не было показано проведение оперативного лечения (пациенты с преимущественно скелетно-мышечными источниками боли: фасеточным синдромом, дисфункцией КПС; психическими расстройствами и рентными установками). Во вторую группу можно включить пациентов, у которых были четкие показания к хирургическому лечению, но оно не устранило имеющиеся патологические изменения позвоночника (сохраняющаяся компрессия корешка грыжей, стеноз позвоночного канала). Обычно это происходит при неправильно определенном уровне оперативного вмешательства из-за аномалии развития позвоночника - наличия сакрализации или люмбализации, когда корешком, выходящим между нижним поясничным позвонком и крестцом, оказывается не LV, а LIV (при сакрализации) и SI (при люмбализации). В ряде случаев ошибки в сопоставлении клинических и визуализационных особенностей происходят при аномально высоком выходе корешка из твердой мозговой оболочки или когда корешки, наоборот, отличаются большей длиной в пределах дурального мешка. Часто отмечают аномалии прохождения корешков в межпозвоночном отверстии. При аутопсии их выявляют в 14-15% случаев. Они включают в себя аномалии, когда два соседних корешка покидают твердую мозговую оболочку в одной общей манжетке или проходят в одном межпозвоночном отверстии. Как правило, такие аномалии не только мешают правильной интерпретации визуализационной картины (иногда их ошибочно принимают за грыжу диска), но и могут приводить к интраоперационной травме корешка, так как такие слияния менее подвижны и легче повреждаются при тракции, чем обычные корешки. Еще одна аномалия характеризуется наличием анастомоза между корешками в пределах дурального мешка. Эта веточка часто пересекает межпозвоночный диск и ее можно легко повредить при дискэктомии. Аномалии расположения корешков наиболее часто отмечают на уровне LV и SI [S.T. Canale, 2008]. Причинами сохранения послеоперационного корешкового болевого синдрома также считают неполное удаление фрагментов грыжи. Иногда трудности для удаления представляют оссифицированные грыжи межпозвоночного диска, в ряде случаев остаются незамеченными свободно лежащие мигрировавшие фрагменты грыжи [О.Б. Шуваева, 2005]. Третью группу составляют пациенты, у которых появились новые источники боли в спине, прямо или косвенно связанные с проведенным оперативным вмешательством. Наиболее часто осложнения возникают после проведения ламинэктомии и стабилизирующих операций. Они заключаются в повреждении спинномозгового корешка, межпозвоночного диска, формировании ликворных кист в результате интраоперационной перфорации дурального мешка, ятрогенной нестабильности ПДС, инфекционных осложнениях и разрастании рубцовой ткани [А.А. Борзунов, О.Н. Древаль, 2004; D. Long, 2006]. Рубцово-спаечный процесс признают частой причиной ПЛС. Необходимо отметить, что он может быть как клинически асимптомным, так и приводить к поражению одного или нескольких корешков на уровне оперативного вмешательства и смежных с ним уровнях. Относительно небольшую группу составляют пациенты с ПЛС, которым было показано оперативное лечение, но причина неврологических нарушений была определена неверно (в частности, имелась шваннома или эпендимома, приводящая к поражению корешков конского хвоста, а оперативное вмешательство выполнено по поводу «грыжи» межпозвоночного диска) [D. Long, 2006]. В табл. 6-1 представлена частота отдельных состояний, обусловливающих формирование ПЛС [C. Slipman и др., 2002]. Удельный вес психических нарушений в структуре формирования ПЛС остается недостаточно изученным. По отдельным данным, преобладание эмоциональных расстройств в развитии ПЛС отмечено у 27,5% пациентов [В.И. Матвеев, А.В. Глущенко, 2005]. Наличие инвалидности до оперативного вмешательства по поводу боли в спине, юридические проблемы, связанные с заболеванием, выраженные психические нарушения считают факторами, предопределяющими неудачный исход оперативного вмешательства [А.Л. Кривошапкин и др., 2004].
Таблица 1. Причины послеоперационного люмбоишиалгического синдрома [по C.Slipman, 2002]
|
Причина |
Частота встречаемости, % |
|
Стеноз позвоночного канала (все случаи) |
21,5 |
|
Латеральный стеноз позвоночного канала |
15,6 |
|
Центральный стеноз позвоночного канала |
5,9 |
|
Внутренние разрывы дисков |
21,5 |
|
Рецидив/сохранение грыжи |
12,4 |
|
Спондилолистез |
1,6 |
|
Синовиальные кисты |
1,1 |
|
Миелогенная перемежающаяся хромота |
1,1 |
|
Спинальная нестабильность |
0,5 |
|
Псевдоменингоцеле |
0,5 |
|
Фиброз (общая частота) |
14,5 |
|
Эпидуральный фиброз |
8,1 |
|
Интраневральный фиброз |
6.5 |
|
Дископатия |
9.1 |
|
Радикулопатия и радикулярная иррадиация боли |
10,2 |
|
Детренированность мышц |
3.8 |
|
Фасеточный синдром |
2.7 |
|
Дисфункция КПС |
1,6 |
|
Комплексный регионарный болевой синдром |
1,1 |
|
Фибромиалгия |
0.5 |
|
Дисцит |
0.5 |
|
Арахноидит |
0.5 |
|
Неизвестная причина |
5,6 |
*В таблице не указана частота СБР, конверсионных расстройств и других психопатологических состояний, являющихся важной потенциальной причиной ПЛС, поскольку они не изучались в представленном исследовании.
Во всех случаях ПЛС необходимо изучить характеристики боли, особенности неврологических и невроортопедических нарушений. Необходимо уточнить, являются ли характеристики боли «новыми» для пациента или боль похожа на ту, которая беспокоила до операции. Необходимо выявить скелетно-мышечные нарушения и признаки поражения корешков. Частота невропатического болевого синдрома при ПЛС не превышает 10%. В большинстве случаев он связан с сохраняющейся корешковой компрессией или интраоперационной травмой корешка [A. Waguespack и др., 2002]. Прямой зависимости между клиническими проявлениями поражения корешков и причинами их компрессии выявить не удалось. Иногда точную причину поражения корешков удается установить только при повторном оперативном вмешательстве. Можно отметить, что при травме корешков клинические симптомы их поражения нарастают уже в первые сутки после проведения операции [А.А. Борзунов, О.Н. Древаль, 2006]. При проведении оперативного вмешательства в недостаточном объеме или на другом уровне клинические проявления корешковой компрессии сохраняют прежнюю локализацию. При формировании рубцово-спаечного процесса в первые месяцы после оперативного вмешательства клинические изменения часто соответствуют нормальному течению послеоперационного периода. Нарастание болевого синдрома часто происходит через 5-7 мес после хирургического лечения. Относительно небольшое число пациентов может связать обострение с физическими нагрузками или переохлаждением. Типично наличие выраженных симптомов натяжения и поражение (более чем в 50% случаев) корешков на противоположной стороне [В.И. Матвеев, А.В. Глущенко, 2005; О.Б. Шуваева, 2005]. Попытки «разгрузить» поясничный отдел позвоночника не приносят выраженного облегчения, для удобства передвижения пациенты часто используют дополнительную опору (костыль, палку). Рецидив грыжи межпозвоночного диска, как правило, развивается через 325 мес после операции. Наиболее типичным провоцирующим обострение фактором считают физическую нагрузку (43% случаев), реже (16,3% случаев) пациенты отмечают в качестве провоцирующего фактора охлаждение. Клиническая картина характеризуется быстрым нарастанием болевого синдрома и неврологических нарушений. Частично это связано с тем, что при рецидивах грыжи на уровне предшествующего оперативного вмешательства спинномозговые корешки становятся менее «мобильными» из-за спаечного процесса, эпидурального фиброза и других, связанных с операцией факторов, что предрасполагает их к большей подверженности внешней компрессии и ишемии [В.И. Матвеев, А.В. Глущенко, 2005]. Клинические проявления поясничного стеноза, как правило, развиваются постепенно. Обычно развивается латеральный стеноз. Уменьшение размера латерального канала происходит при подвывихах и деформации межпозвоночных суставов на фоне прогрессирующих в них дегенеративных изменений при поражении межпозвоночного диска или развитии послеоперационной нестабильности и формирования рубцово-спаечного процесса [Л.А. Фурсова и др., 1985; О.Б. Шуваева, 2005]. Латеральный стеноз проявляется отсроченным рецидивом радикулопатии на соответствующем уровне, центральный стеноз - синдромом перемежающейся хромоты. В остальных случаях ПЛС обусловлен скелетно-мышечными расстройствами, психологическими нарушениями и их сочетанием.
Визуализацию позвоночника начинают с рентгенографии в прямой и боковой проекции с функциональными пробами для исключения нестабильности ПДС. При КТ (которую желательно проводить с режимом реконструкции) можно уточнить характер оперативного воздействия на костные структуры (в частности, целостность дуги позвонка), состояние дугоотростчатых суставов, размер межпозвоночного отверстия. МРТ необходима для уточнения состояния межпозвоночного диска, размера позвоночного канала и наличия в нем воспалительных изменений. Иногда для уточнения состояния структур позвоночного канала и его размера (при невозможности выполнить МРТ после стабилизирующих операций) показано проведение КТ-миелографии.
Профилактика рубцово-спаечного процесса заключается в уменьшении хирургической травмы во время первого оперативного вмешательства - минимизации хирургического доступа, использовании микрохирургической и эндоскопической техники [А.А. Борзунов, О.Н. Древаль, 2006; К.Б. Певзнер и др., 1999; Ю.А. Щербук и др., 1999]. Тактика лечения пациента с ПЛС определяется выявленной причиной его развития. В некоторых случаях, в частности когда ПЛС связан с сохраняющейся корешковой компрессией, целесообразно проведение повторного оперативного вмешательства. Применение микрохирургической техники позволяет снизить риск послеоперационных осложнений. При наличии скелетно-мышечных источников боли целесообразно их устранение, в том числе с применением малоинвазивных методов лечения (РЧД суставов) (см. «Скелетномышечные болевые синдромы»). Необходимо выявлять и корректировать психические нарушения у пациентов с ПЛС с помощью психотерапевтических воздействий в рамках мультидисциплинарных программ лечения. При стойком сохраняющемся невропатическом болевом синдроме и невозможности его коррекции консервативными и хирургическими методами воздействия показана эффективность нейромодуляции (стимуляция задних столбов спинного мозга на нижнегрудном уровне) [Э.Д. Исагулян, В.А. Шабалов, 2007; J. Birknes и др., 2006].
Читайте также
- Боль в спине: эпидемиология и факторы риска
- Морфофункциональные основы боли в спине
- Боль в спине: обследование пациентов
- Скелетно-мышечные болевые синдромы
- Корешковые и дискогенные болевые синдромы
- Психологические аспекты боли в спине
- Лечение боли в спине
- Боль в пояснице
Список рекомендуемой литературы
- Борзунов А.А., Древаль О.Н. Послеоперационные рецидивирующие болевые синдромы у больных с грыжами межпозвонковых дисков на поясничном уровне // Боль. - 2006. - № 2. - С. 11-15.
- Ветрилэ М.С. Оперативное лечение спондилолистеза с применением транспедикулярных фиксаторов: Автреф. дис. ... д-ра мед.
наук. - М., 2004. - 24 с.
- Исагулян Э.Д., Шабалов В.А. Хроническая электростимуляция спинного мозга в лечении неврогенных болевых синдромов // Боль. - 2007. - № 2. - С. 2-10.
- Кривошапкин А.Л., Фонин В.В., Некрасов А.Д. и др. Анализ результатов микродискэктомии при грыжах межпозвонковых дисков //
Боль. - 2004. - № 1. - С. 20-23.
- Лесняк О.М., Беневольская Л.И. (ред.) Остеопороз. - 2-е изд. - М.: ГЭОТАР-Медиа. - 2009. - 272 с.
- Мазуров В.И. (ред.) Клиническая ревматология: Руководство для врачей. - СПб.: Фолиант, 2005. - 516 с.
- Матвеев В.И., Глущенко А.В. Отдаленные результаты хирургического лечения грыж межпозвонковых дисков поясничного отдела позвоночника // Боль. - 2005. - № 3. - С. 41-44.
- Насонов Е.Л. (ред.) Клинические рекомендации: Ревматология. - М.: ГОЭТАР-Медиа, 2008. - 262 с.
- Насонов Е.Л., Насонова В.А. (ред.) Ревматология. Национальное руководство. - М.: ГЭОТАР-Медиа, 2008. - 714 с.
- Насонова В.А., Бунчук Н.В. (ред.) Ревматические болезни Руководство для врачей. - М.: Медицина, 1997. - 520 с.
- Певзнер К.Б., Гельфенбейн М.С., Васильев С.А. Микродискэктомия в лечении дискогенного радикулита // Нейрохирургия. - 1999. -
№ 3. - С. 59-64.
- Продан А.И., Куценко В.А., Колесниченко В.А. и др. Дегенеративный спондилолистез: современные концепции лечения // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 2005. - № 3. - С. 89-94.
- Фурсова Л.А., Пашко Г.В., Секач С.Ф. Клинико-рентгенологический анализ рецидивирующих синдромов поясничного остеохондроза в отдаленном послеоперационном периоде // Периферическая нервная система /Под ред. Н.П. Антонова. - Вып. 8. - Минск: Наука и техника, 1985. - С. 138-141.
- Шуваева О.Б. Клинический полиморфизм рецидивирующих болевых синдромов после оперативного вмешательства при компрессионной радикулопатии на пояснично-крестцовом уровне // Журнал неврологии и психиатрии. - 2005. - № 11. - С. 11-15.
- Щербук Ю.А., Парфенов В.Е., Топтыгин С.В. Значение эндоскопического видеомониторинга в предупреждении рецидивов дискогенных пояснично-крестцовых радикулопатий при их хирургическом лечении // Нейрохирургия. - 1999. - № 3. - С. 9-12.
- Birknes J.K., Sharan A., Rezai A.R. Treatment of chronic pain with neurostimulation. // Prog Neurol Surg. - 2006. - Vol. 19. - P. 197-207.
- Blam O., Cotler J. Fractures in the stiff and osteoporotic spine in: Skeletal trauma: basic science, management, and reconstruction B.D. Browner [et al.]. 3rd ed. - Saunders, An Imprint of Elsevier, 2003.
- Campbell's operative orthopaedics. - 11th ed. (edited by Canale S.T., Beaty J.H). - Philadelphia: Mosby Elsevier, 2008. - http://www. mdconsult.com
- KapuralL. Indications for Minimally Invasive Disk and Vertebral Procedures // Pain Medicine. - 2008. - Vol. 9 (Suppl 1). - P. 65-72. Lipsky P. Rheumatoid arthritis/Harrisons rheumatology. /Ed. by Fauci A. // McGraw-Hill Comp. - 2006. - P. 86-104.
- Long D. Surgical treatment for back and neck pain /McMahon: Wall and Melzack's Textbook of Pain, 5th ed. - Churchill Livingstone, An Imprint of Elsevier, 2006.
- Simon L.S. Osteoporosis // Rheum Dis Clin North Am. - 2007. - Vol. 33 (1). - P. 149-176.
- Slipman C.W., Shin C.H., Patel R.K. Etiologies of Failed Back Surgery Syndrome // Pain Medicine. - 2002. - Vol. 3 (3). - P. 200-214.
- Taurog J.D. The spondyloarthritides / Harrisons rheumatology /Ed. by Fauci A. - McGraw-Hill Comp. - 2006. - P. 139-155. Taylor V.M., Deyo R.A., Cherkin D.C., Kreuter W. Low back pain hospitalization. Recent United States trends and regional variations // Spine. - 1994. - Vol. 19. - P. 1207-1213.
- Waguespack A., Schofferman J., Slosar P. et al. Etiology of Long-term Failures of Lumbar Spine Surgery // Pain Medicine. - 2002. - Vol. 3(1). - P. 18-22.
- Wilson D.R., Myers E.R., Mathis J.M. et al. Effect of augmentation on the mechanics of vertebral wedge fractures // Spine. - 2000. - Vol. 25. - P. 158-165.
- Zochling J., van der Heijde D., Burgos-Vargas R. et al. ASAS/EULAR recommendations for the management of ankylosing spondylitis // Ann Rheum Dis. - 2006. - Vol. 65. - P. 444-452.