Вторичная структура белка — различия между версиями
Django (обсуждение | вклад) |
Django (обсуждение | вклад) |
||
| Строка 1: | Строка 1: | ||
== Вторичная структура белка == | == Вторичная структура белка == | ||
| − | + | ||
| − | + | Вторичную структуру белка определяют водородные связи между атомами, образующими пептидную связь. Третичная структура белков обусловлена связями между радикалами аминокислот. | |
| − | |||
=== β-Цепь и β-слой === | === β-Цепь и β-слой === | ||
| + | По своей структуре полипептидная цепь может быть организована как β-цепь. Когда несколько таких β-цепей связываются друг с другом, они формируют параллельный или антипараллельный β-слой. | ||
| − | + | <gallery> | |
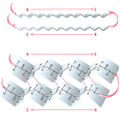
| + | Файл:Bio_wiki_7_1.jpg|<small>Рис. 7.1. Антипараллельный β-слой. Полипептидная цепь существует в виде зигзагообразной β-цепи. β-Цепи могут связываться друг с другом водородными связями, образуя β-слой. Если соседние β-цепи в β-слое ориентированы противоположно, эта структура называется «антипараллельный β-слой»</small> | ||
| + | Файл:Bio_wiki_7_2.jpg|<small>Рис. 7.2. Параллельный β-слой. Три β-цепи связываются водородными связями, формируя р-складчатый слой. Поскольку β-цепи ориентированы в одном направлении, β-слой называется параллельным</small> | ||
| + | </gallery> | ||
=== α-Спираль === | === α-Спираль === | ||
| − | + | ||
| − | |||
| − | |||
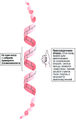
Полипептидные цепи стабилизируются водородными связями с образованием правозакрученной а-спирали (рис. 7.3). | Полипептидные цепи стабилизируются водородными связями с образованием правозакрученной а-спирали (рис. 7.3). | ||
| Строка 21: | Строка 22: | ||
[[Прионы]] — это белковоподобные инфекционные частицы. Они не содержат РНК или ДНК, а состоят только из белка. Перестройка вторичной структуры прионов вызывает губчатую энцефалопатию — почесуху (у овец) и губчатую энцефалопатию крупного рогатого скота («коровье бешенство»). К прионным болезням человека относятся '''болезнь Крейтцфельда-Якоба''', куру (она распространилась из-за традиции каннибалов поедать человеческий мозг) и «новый вариант болезни Крейтцфельда-Якоба». '''Белок приона''' (РrР<sup>с</sup>) — обычный клеточный белок с неизвестной функцией, который экспрессируется в нейронах. Как показано на рис. 7.5, в норме вторичную структуру приона составляют главным образом а-спирали. Однако РrР<sup>с</sup> может перестроиться в инфекционную форму РrР<sup>sc</sup> (sc— от слова scarpie, почесуха), вторичная структура которого в основном представлена β-складчатыми слоями. Из-за этого изменяется третичная структура белка (о которой ниже), что и вызывает губчатую энцефалопатию. Механизм превращения а-спиралей в β-складчатый слой неизвестен. Каким-то образом наличие дефектных молекул РrР<sup>с</sup> стимулирует переход нормальных молекул РrР<sup>с</sup> в РrР<sup>sc</sup>-форму, и по цепной реакции болезнь распространяется по всему мозгу подобно тому, как ложка дегтя портит всю бочку меда. | [[Прионы]] — это белковоподобные инфекционные частицы. Они не содержат РНК или ДНК, а состоят только из белка. Перестройка вторичной структуры прионов вызывает губчатую энцефалопатию — почесуху (у овец) и губчатую энцефалопатию крупного рогатого скота («коровье бешенство»). К прионным болезням человека относятся '''болезнь Крейтцфельда-Якоба''', куру (она распространилась из-за традиции каннибалов поедать человеческий мозг) и «новый вариант болезни Крейтцфельда-Якоба». '''Белок приона''' (РrР<sup>с</sup>) — обычный клеточный белок с неизвестной функцией, который экспрессируется в нейронах. Как показано на рис. 7.5, в норме вторичную структуру приона составляют главным образом а-спирали. Однако РrР<sup>с</sup> может перестроиться в инфекционную форму РrР<sup>sc</sup> (sc— от слова scarpie, почесуха), вторичная структура которого в основном представлена β-складчатыми слоями. Из-за этого изменяется третичная структура белка (о которой ниже), что и вызывает губчатую энцефалопатию. Механизм превращения а-спиралей в β-складчатый слой неизвестен. Каким-то образом наличие дефектных молекул РrР<sup>с</sup> стимулирует переход нормальных молекул РrР<sup>с</sup> в РrР<sup>sc</sup>-форму, и по цепной реакции болезнь распространяется по всему мозгу подобно тому, как ложка дегтя портит всю бочку меда. | ||
| + | <gallery> | ||
| + | Файл:Bio_wiki_7_3.jpg|<small>Рис. 7.3. Правозакрученная α-спираль</small> | ||
| + | Файл:Bio_wiki_7_4.jpg|<small>Рис. 7.4. Мутация AF508 вызывает муковисцидоз. Из-за делеции трех оснований — СТТ — в белке CFRT отсутствует фенилаланин в позиции 508. Функции такого белка нарушены, и вследствие этого развивается муковисцидоз. Примечание: делеция основания не влияет на изолейцин в позиции 507, так как и АТС, и ATT кодируют изолейцин</small> | ||
| + | Файл:Bio_wiki_7_5.jpg|<small>Рис. 7.5. Белки прионы. В норме белок прион (РrР<sup>с</sup>) растворим и состоит в основном из а-спиралей. Но в мутантной форме приона, которая вызывает почесуху (РrР<sup>sc</sup>), часть а-спиралей переходит в р-складчатую конформацию, и белок становится нерастворимым. Мутантная форма РrР<sup>sc</sup> «инфекционна», так как в ее присутствии а-спирали трансформируются в β-конформацию</small> | ||
| + | </gallery> | ||
== Читайте также == | == Читайте также == | ||
*[[Третичная и четвертичная структура белка]] | *[[Третичная и четвертичная структура белка]] | ||
Текущая версия на 21:31, 15 мая 2016
Вторичная структура белка[править | править код]
Вторичную структуру белка определяют водородные связи между атомами, образующими пептидную связь. Третичная структура белков обусловлена связями между радикалами аминокислот.
β-Цепь и β-слой[править | править код]
По своей структуре полипептидная цепь может быть организована как β-цепь. Когда несколько таких β-цепей связываются друг с другом, они формируют параллельный или антипараллельный β-слой.
α-Спираль[править | править код]
Полипептидные цепи стабилизируются водородными связями с образованием правозакрученной а-спирали (рис. 7.3).
При изменениях первичной структуры белка меняется и его вторичная структура: так, делеция одной аминокислоты вызывает муковисцидоз
Первичной структурой белка называют последовательность аминокислот в пептидной цепи. Всего лишь одна неправильная аминокислота в цепи из 1480 аминокислот может изменить функции белка. Именно это происходит при муковисцидозе. Это врожденное заболевание, при котором нарушена структура гена CFRT (cystic fibrosis transmembrane conductance regulator — трансмембранный регулятор проводимости при муковисцидозе). Продукт этого гена — трансмембранный белок, который в норме выполняет функцию транспортера для ионов хлорида; однако в случае муковисцидоза его функции нарушаются. Самая распространенная причина муковисцидоза, которая наблюдается у 70% больных, — делеция трех пар оснований в гене CFRT, из-за чего мутантный белок CFRT не содержит фенилаланина в положении 508 (рис. 7.4). Эта мутация называется ДР508-мутацией (А — делеция, F — фенилаланин, 508 — положение фенилаланина в первичной структуре белка). После синтеза дефектный CFTR-белок сворачивается в неправильную вторичную структуру и удерживается в эндоплазматическом ретикулуме. Из-за отсутствия транспортера для ионов хлора клетки секретируют густую вязкую слизь, которая накапливается в дыхательных путях и нарушает функционирование легких. Кроме того, нарушается экзокринная функция поджелудочной железы, что проявляется в синдроме мальабсорбции.
Перестройка вторичной структуры приона вызывает губчатую энцефалопатию (болезнь Крейтцфельда-Якоба, «коровье бешенство»)
Прионы — это белковоподобные инфекционные частицы. Они не содержат РНК или ДНК, а состоят только из белка. Перестройка вторичной структуры прионов вызывает губчатую энцефалопатию — почесуху (у овец) и губчатую энцефалопатию крупного рогатого скота («коровье бешенство»). К прионным болезням человека относятся болезнь Крейтцфельда-Якоба, куру (она распространилась из-за традиции каннибалов поедать человеческий мозг) и «новый вариант болезни Крейтцфельда-Якоба». Белок приона (РrРс) — обычный клеточный белок с неизвестной функцией, который экспрессируется в нейронах. Как показано на рис. 7.5, в норме вторичную структуру приона составляют главным образом а-спирали. Однако РrРс может перестроиться в инфекционную форму РrРsc (sc— от слова scarpie, почесуха), вторичная структура которого в основном представлена β-складчатыми слоями. Из-за этого изменяется третичная структура белка (о которой ниже), что и вызывает губчатую энцефалопатию. Механизм превращения а-спиралей в β-складчатый слой неизвестен. Каким-то образом наличие дефектных молекул РrРс стимулирует переход нормальных молекул РrРс в РrРsc-форму, и по цепной реакции болезнь распространяется по всему мозгу подобно тому, как ложка дегтя портит всю бочку меда.
Рис. 7.4. Мутация AF508 вызывает муковисцидоз. Из-за делеции трех оснований — СТТ — в белке CFRT отсутствует фенилаланин в позиции 508. Функции такого белка нарушены, и вследствие этого развивается муковисцидоз. Примечание: делеция основания не влияет на изолейцин в позиции 507, так как и АТС, и ATT кодируют изолейцин
Рис. 7.5. Белки прионы. В норме белок прион (РrРс) растворим и состоит в основном из а-спиралей. Но в мутантной форме приона, которая вызывает почесуху (РrРsc), часть а-спиралей переходит в р-складчатую конформацию, и белок становится нерастворимым. Мутантная форма РrРsc «инфекционна», так как в ее присутствии а-спирали трансформируются в β-конформацию