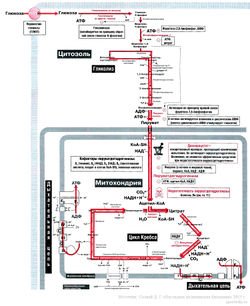
Регуляция гликолиза и цикл Кребса
Содержание
Регуляция гликолиза[править | править код]
В разных тканях гликолиз выполняет разные функции. В белых мышцах, сетчатке и эритроцитах в процессе гликолиза осуществляется анаэробный синтез АТФ, а в качестве побочного продукта образуется молочная кислота. При аэробном гликолизе в мышцах образуется пируват, который окисляется в цикле Кребса. Продукты цикла Кребса поступают в дыхательную цепь, и уже в ней синтезируется АТФ. В печени и жировой ткани в ходе аэробного гликолиза и пентозофосфатного пути образуется пируват, используемый для синтеза жирных кислот. Помните, что регуляция метаболических путей всегда имеет свою логику, именно функция процесса определяет способы его регуляции.
На стадии поступления глюкозы в клетку процесс гликолиза регулируется транспортерами глюкозы (ГЛЮТ), глюкокиназой или гексокиназой, фосфофруктокиназой-1, пируваткиназой и пируватдегидрогеназой.
Транспортеры глюкозы ГЛЮТ[править | править код]
Глюкоза поступает в клетку с помощью транспортеров глюкозы (ГЛЮТ). Существует несколько типов транспортеров глюкозы — ГЛЮТ1, ГЛЮТ2 и т.д. Все они расположены в плазматической мембране, кроме ГЛЮТ4, который регулирует поступление глюкозы в клетку и тем самым регулирует гликолиз в мышцах и жировой ткани. При голодании молекулы ГЛЮТ4 располагаются во внутриклеточных везикулах. После приема пищи под действием сигнала инсулина происходит перемещение ГЛЮТ4 в плазматическую мембрану, и клетка начинает интенсивно поглощать глюкозу.
Глюкокиназа и гексокиназа[править | править код]
Эти ферменты катализируют первую реакцию гликолиза — фосфорилирование глюкозы до глюкозо-6-фосфата. Гексокиназа содержится во многих тканях; у этого фермента низкое значение Km (т.е. высокое сродство к глюкозе). Гексокиназа по принципу обратной связи ингибируется продуктом реакции — глюкозо-6-фосфатом. Глюкокиназа содержится в печени и р-клетках поджелудочной железы. У глюкокиназы, напротив, высокое значение Km (т.е. низкое сродство к глюкозе). В печени она активна при высоких концентрациях глюкозы (до 15 ммоль/л), которая после приема углеводсодержащей пищи поступает из кишечника в печень по воротной вене печени. {Важно: глюкокиназа находится в печени.)
Фосфофруктокиназа-1[править | править код]
Активация фосфофруктокиназы-1. Этот фермент активируется фруктозо-2,6-бисфосфатом (Ф-2,6-бисФ). Кроме того, АМФ также активирует фосфофруктокиназу-1. Высокие концентрации АМФ говорят о том, что клетка испытывает недостаток в энергии и требуется усилить синтез АТФ. Поэтому АМФ способствует интенсификации гликолиза.
(В печени образование фруктозо-2,6-бисфосфата активируется под действием инсулина и ингибируется под действием глюкагона. В скелетных мышцах образование этого вещества стимулируется высокой, а ингибируется низкой концентрацией фруктозо-6-фосфата.)
Ингибирование фосфофруктокиназы-1. Высокая концентрация АТФ ингибирует фосфофруктокиназу-1, и интенсивность гликолиза снижается. Кроме того, этот фермент ингибируется цитратом.
Пируваткиназа[править | править код]
Ингибирование пируваткиназы. В печени пируваткиназу ингибируют аланин и циклический АМФ. Эти вещества образуются при голодании. При голодании секретируется глюкагон, который стимулирует синтез циклического АМФ. Аланин же образуется при распаде мышечных белков при голодании и используется для синтеза глюкозы в процессе глюконеогенеза. При ингибировании пируваткиназы блокируется использование фосфоенолпирувата в гликолизе, и в клетке интенсифицируется глюконеогенез.
Активация пируваткиназы. В печени пируваткиназа активируется фруктозо-1,6-бисфосфатом (активация по принципу прямой связи). Этот процесс особенно важен при переходе от периода голодания к липогенезу. При голодании пируваткиназа неактивна, и в клетке интенсивно идет глюконеогенез, а при липогенезе пируваткиназа активируется.
Пируватдегидрогеназа[править | править код]
Пируватдегидрогеназа — комплекс из трех ферментов, который расположен в митохондриях. Он контролирует скорость поступления пирувата в цикл Кребса.
Активация пируватдегидрогеназы. После приема богатой углеводами пищи под действием инсулина происходит активация пируватдегидрогеназы в печени и жировой ткани, где пируват требуется для синтеза жирных кислот. Фермент также активируется своим субстратом (пируватом) и коферментами КоА и НАД+. Наконец, повышение концентрации АДФ также активирует пируватдегидрогеназу. Уровень АДФ повышается, когда клетка испытывает недостаток в энергии. Повышение концентрации АДФ свидетельствует о необходимости активации цикла Кребса и дыхательной цепи для синтеза АТФ.
Ингибирование пируватдегидрогеназы. Высокие концентрации АТФ ингибируют пируватдегидрогеназу, и окисление пирувата в цикле Кребса приостанавливается. Кроме того, активность фермента ингибируют продукты пируватдегидрогеназной реакции — ацетил-КоА и НАДН. Такая ситуация создается при голодании, когда в качестве источника энергии используются жирные кислоты, из которых образуется ацетил-КоА. В этом случае ингибирование пируватдегидрогеназы способствует сохранению пирувата для синтеза глюкозы. [Примечание: во время голодания пируват образуется из резервных запасов, т.е. из глюкозы, образующейся из гликогена и аминокислот, образующихся при распаде белков мышц.]
Регуляция цикла Кребса[править | править код]
В разных тканях цикл Кребса выполняет разные функции. Так, в мышцах и головном мозге в цикле Кребса ацетил-КоА окисляется с образованием НАДН и ФАДН2, которые используются для синтеза АТФ в дыхательной цепи. В печени при голодании ацетил-КоА не окисляется в цикле Кребса. Вместо этого цикл Кребса используется для синтеза малата из некоторых аминокислот, который превращается в оксалоацетат и вступает в глюконеогенез. После приема пищи ацетил-КоА в печени и жировой ткани поступает в цикл Кребса на очень короткий период. В первой реакции цикла он преобразуется в цитрат, затем экспортируется в цитозоль и используется для биосинтеза жирных кислот.
Изоцитратдегидрогеназа[править | править код]
Изоцитратдегидрогеназа ингибируется при высокой концентрации НАДН. Кофермент изоцитратдегидрогеназы — НАД+. Когда НАД+ восстанавливается до НАДН, изоцитратдегидрогеназа инактивируется, поскольку ее кофермент отсутствует.
Нарушения активности пируватдегидрогеназы[править | править код]
Недостаточность тиамина[править | править код]
В нервной ткани ведущую роль в синтезе АТФ играют гликолиз и дальнейший синтез ацетил-КоА в пируватдегидрогеназной реакции, который затем окисляется в цикле Кребса. Для нормального функционирования пируватдегидрогеназы необходим тиамин. При недостаточности тиамина активность фермента снижается, и нервная ткань испытывает недостаток в производимой энергии. Развиваются гиперлактатемия, заболевания нервной системы; в тяжелых случаях — болезнь Вернике, психоз Корсакова. Недостаточность тиамина наблюдается при хроническом алкоголизме, из-за плохого питания.
(Запомните, что, хотя ацетил-КоА может образовываться из жирных кислот независимо от пируватдегидрогеназной реакции, головной мозг не может использовать жирные кислоты в качестве источника энергии, поскольку они не проходят через гематоэнцефалический барьер.)
Болезнь Ли[править | править код]
Некоторые формы болезни Ли вызываются дисфункцией пируватдегидрогеназы.