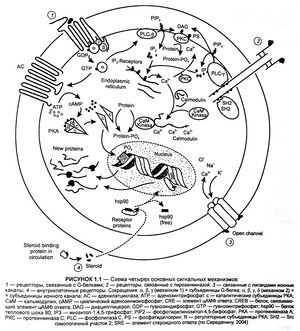
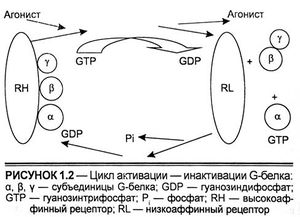
Тирозинкиназные рецепторы
Тирозинкиназные рецепторы[править | править код]
Данная группа рецепторов опосредует сигнал от ряда эндогенных веществ, включающих инсулин, эпидермальный фактор роста (EGF), тромбоцитарный фактор роста (platelet-derived growth factor — PDGF)- Эти рецепторы сформированы одной полипептидной цепью, которая пронизывает цитоплазматическую мембрану, образуя три домена: лигандсвязываюший экстрацеллюлярный, трансмембранный и интрацеллюлярный, который содержит участок, обеспечивающий ферментативную активность. Некоторые из этих рецепторов, например инсулиновый, существуют в виде димеров из двух рецепторов, сопряженных друг с другом нековалентными связями. Другие, такие, как EGF-рецептор, существуют внутри мембраны в единичной форме и образуют димер в ответ на присоединение лиганда к каждой субъединице. В любом случае связывание фактора роста с рецептором приводит к аллостерической активации тирозинкиназной активности в цитоплазматическом домене рецептора.
Первый шаг в этой активации включает перекрестное фосфорилирование множественных остатков тирозина двух рецепторных субъединиц внутри интрацеллюлярного домена. Это автофосформатирование действует как сигнал к связыванию других внутриклеточных белков, тирозиновые остатки которых фосфорилируются рецептором и таким образом активируются. Специфичность клеточного ответа детерминируется специфичными для данной клетки комбинациями белков, которые присоединяются к рецепторам факторов роста.
В последнее время большое количество белков, присоединяющихся к активированным рецепторам факторов роста, было идентифицировано. Имея различную структуру, эти белки включают два консервативных домена, известных как SH2 и SH3 (Sre homology region). Впервые они были выявлены в протоонкогене, названном Sre-белок, отсюда и название; SН2-домены распознают фосфотирозины на рецепторах факторов роста, функции SНЗ-доменов пока не ясны.
Характеристика белков, содержащих SH2- и SНЗ-домены, является сегодня предметом многих исследований. Роль некоторых из них показана. Например, одним из механизмов, которым факторы роста регулируют клеточный рост и дифференцировку, является активация каскада протеинкиназ, известных как митогенактивируемые протеинкиназы (mitogen activated protein kinas — MAP kinase pathway). Активация этого пути инициируется фосфорилированием тирозинов белка Grb2, содержащего SH2- и SНЗ-домены. SH3-домен на Grb2 присоединяет другой белок, известный как mSOS, и совместно комплекс Grb2/ mSOS активирует Ras, мономерный G-белок. Ras имеет структуру, аналогичную α-субъединице G-белков, которая взаимодействует с 7-трансмембранными (сопряженными с G-белками) рецепторами и активируется и инактивируется сходными механизмами. Отсюда взаимодействие Ras с Grb2/mSOS ускоряет обмен ГДФ на ГТФ на Ras, стимулируя его активацию.
Следующий шаг в этом каскаде включает, по-видимому, активацию Ras серин/треонинкиназы, известную как Raf, которая затем активирует фосфорилированием другую киназу, МЕК (известную как МАР-киназная киназа), которая в свою очередь фосфорилирует МАР-киназу, которая способна проходить через ядерную мембрану, и в ядре она фосфорилирует различные факторы транскрипции. Возникающие изменения транскрипции гена инициируют процессы пролиферации или дифференцировки.
Другие белки, взаимодействующие с рецепторами факторов роста, способны регулировать внутриклеточные вторичные мессенджеры. Например, члены семейства фосфолипазы с-у, которые регулируют уровень внутриклеточного IP3 и диацилглицерола, как и семейство PLC-P, рассмотренные выше, содержат SH2- и SН3-домены и могут быть активированы тирозинкиназными рецепторами. Пока из рецепторов факторов роста только инсулиновые используются как фармакологические мишени у больных диабетом. Однако роль этих рецепторов в клеточном росте, неконтролируемое проведение через них сигналов при воспалительных и неопластических заболеваниях определяют большой интерес к разработке блокирующих их активность агентов. Например, мутантные Ras-белки были обнаружены более чем в 30 % опухолей человека, поэтому в настоящее время в качестве препаратов лечения опухолей разрабатываются вещества, способные ингибировать мутантные белки Ras и другие в МАР-киназном пути.