Токсические эффекты
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Типы токсических эффектов[править | править код]
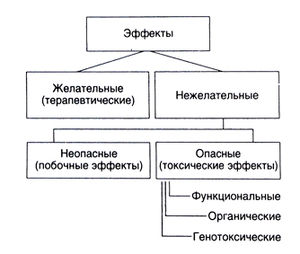
Нежелательные эффекты химических веществ могут быть самыми разными и с трудом поддаются строгой классификации (рис. 4.5). Лекарственные средства, как правило, оказывают множество эффектов, из которых часто лишь один необходим для лечения, а большинство других нежелательны. Если нежелательные эффекты не представляют особой опасности для организма (например, сухость во рту при приеме трициклических антидепрессантов), их обычно называют побочными, в противном случае — токсическими. Классифицировать токсические реакции важно для того, чтобы научиться избегать их, а в случае необходимости — назначать правильное лечение.
Все токсические эффекты можно разделить на функциональные, органические и генотоксические (связанные с повреждением ДНК). Частота и тяжесть токсических эффектов определяются концентрацией вещества в организме (по крайней мере, в определенном диапазоне доз). Примером функционального токсического эффекта служит чрезмерное угнетение ЦНС под действием барбитуратов; органического — поражение печени, вызванное парацетамолом; генотоксического — развитие злокачественных новообразований под действием хлорметина. Если концентрация вещества в тканях не превышает некий критический уровень, то его токсические эффекты, как правило, обратимы. Функциональные токсические эффекты обычно проходят после того, как концентрация вещества в тканях снижается вследствие его элиминации. В организме существуют и механизмы устранения последствий органических и генотоксических эффектов. Однако, если поражения слишком тяжелые, они могут быстро привести к смерти; менее тяжелые, но не устраненные путем репарации повреждения ДНК способны вызвать злокачественные новообразования в отдаленном будущем (через несколько месяцев или лет у животных, через 10 лет и более — у человека).
Местные и системные токсические эффекты[править | править код]
Местные токсические эффекты возникают в месте непосредственного контакта организма с химическим веществом. Они могут быть вызваны проглатыванием едких жидкостей или вдыханием веществ раздражающего действия. Системные токсические эффекты возникают после всасывания вещества и его распределения. Большинство веществ (за исключением соединений с высокой реакционной способностью) вызывают именно системные эффекты. Впрочем, одно и то же вещество может вызывать эффекты обоих типов. Так, в месте контакта с кожей тетраэтилсвинец вызывает ее повреждение, а после попадания в кровоток — поражение ЦНС.
Большинство системных токсических эффектов затрагивают преимущественно один или несколько органов — причем необязательно те, в которых накапливается токсическое вещество. Так, свинец накапливается в костях, но токсическое действие оказывает в основном на внутренние органы. С другой стороны, инсектицид ДЦТ накапливается в жировой ткани, не оказывая на нее токсического действия.
При системном токсическом действии чаще всего страдает ЦНС, поскольку многие вещества наряду с другими органами действуют на головной мозг. Поражаются также сердечно-сосудистая система, органы кроветворения, печень, почки и легкие, реже — кожа. Меньше всего токсическому действию подвержены мышцы и кости. Частота поражений тех или иных органов веществами, оказывающими преимущественно местные токсические эффекты, зависит главным образом от того, каким образом вещество проникает в организм (через кожу, ЖКТ или дыхательные пути).
Обратимые и необратимые токсические эффекты[править | править код]
Побочные эффекты лекарственного средства должны быть по возможности обратимыми — в противном случае они могут оказаться слишком тяжелыми. В случае повреждения тканей обратимость или необратимость эффекта определяется в основном способностью самой ткани к регенерации. Поражения печени, как правило, обратимы именно потому, что ткань печени хорошо регенерирует. Втоже время поражения ЦНС часто необратимы, поскольку высокодифференцированные нейроны головного мозга почти не способны к делению и регенерации.
Отсроченные токсические эффекты[править | править код]
Токсические эффекты лекарственных средств, как правило, возникают спустя предсказуемое (обычно короткое) время после введения. Однако имеются и другие примеры. Так, апластическая анемия, вызванная хлорамфениколом, может развиться через несколько недель после отмены препарата. Длительные латентные периоды (до 20— 30 лет) характерны и для канцерогенов. Поскольку такого рода замедленные эффекты почти нельзя выявить на стадии клинических испытаний, необходимы надежные и быстрые тесты, позволяющие их предсказывать. Кроме того, необходимо вести систематическое наблюдение за долговременными эффектами лекарственных средств и других химических веществ, имеющихся в продаже (гл. 3).
Химические канцерогены[править | править код]
Эти вещества разделяют на две основные группы — генотоксичные (повреждающие ДНК) и негенотоксичные. Развитие опухоли под действием канцерогенов — многоступенчатый процесс. Большинство генотоксичных канцерогенов сами по себе неактивны (проканцерогены), но в организме они метаболизируются с образованием истинных канцерогенов. Под действием печеночных ферментов из проканцерогенов часто образуются реакционноспособные электрофильные соединения, которые взаимодействуют с нуклеофильными участками ДНК, вызывая мутации. По-видимому, именно такого рода взаимодействия инициируют первый этап химического канцерогенеза. В случае успешной репарации восстанавливается нормальная ДНК; в противном случае клетка может переродиться в опухолевую.
Негенотоксичные канцерогены (промоторы) сами по себе не вызывают злокачественного перерождения, однако они усиливают действие генотоксичных канцерогенов, в том числе способствуя росту и развитию так называемых покоящихся опухолевых клеток. От наличия промоторов, вероятно, зависит латентный период (от первичной мутации до развития опухоли). Для некоторых опухолей человека этот период может составлять от 15 до 45 лет.
Возможную канцерогенность химических веществ для человека изучают с помощью двух основных типов лабораторных исследований. В одном из них определяют мутагенное действие вещества, поскольку многие канцерогены являются также мутагенами. Как правило, такие исследования проводят in vitro. Примером служит мутационный тест на Salmonella typhimurium (тест Эймса), который можно провести за несколько дней (Ames et al., 1975). Такие исследования позволяют выявить только генотоксичные канцерогены, но не промоторы. В исследованиях второго типа экспериментальным животным (мышам и крысам) на протяжении всего срока их жизни скармливают химические вещества в высоких дозах, а после их гибели проводят аутопсию и выявляют гистологические изменения. Затем сравнивают частоту развития опухолей у опытной партии и у контрольных животных. При этом удается выявить как генотоксичные канцерогены, так и промоторы.
Аллергические реакции[править | править код]
Такие реакции возникают в том случае, если ранее имела место сенсибилизация в результате контакта с данным веществом или с родственным ему по структуре соединением. Эффекты такого рода опосредованы иммунной системой. Часто используют также термины гиперчувствительность и лекарственная аллергия.
Аллергические реакции на низкомолекулярные вещества обычно возникают, если само вещество или его метаболит выступают в роли гаптена, который связывается с эндогенным белком с образованием полного антигена. В этом случае примерно через 1—2 нед образуются специфические антитела, и при последующем контакте с данным веществом образуется его комплекс с этими антителами, который и вызывает аллергическую реакцию. Интенсивность такой реакции, как правило, слабо зависит от дозы.
В зависимости от особенностей иммунного ответа различают четыре основных типа аллергических реакций (Coombs and Gell, 1975). Быстрее всего развиваются аллергические реакции немедленного типа, которым предшествует продукция IgE и их фиксация на поверхности базофилов и тучных клеток. Взаимодействие антигена с фиксированными IgE приводит к высвобождению медиаторов воспаления (гистамина, лейкотриенов, простагландинов), которые вызывают расширение сосудов, отек и воспаление. Эти реакции чаще всего затрагивают ЖКТ (пищевая аллергия), кожу (крапивница, диффузный нейродермит), дыхательные пути (аллергический ринит, бронхиальная астма) и сосуды (анафилактический шок).
Цитотоксические аллергические реакции обусловлены взаимодействием IgG или IgM с антигенами, фиксированными на мембранах собственных клеток организма. Связывание антител с мембранами клеток приводит к активации комплемента и гибели этих клеток. Такие реакции обычно затрагивают клетки крови. Примерами служат вызываемая пенициллинами и метилдофой гемолитическая анемия, вызываемая хинидином тромбоцитопеническая пурпура и вызываемая сульфаниламидами гранулоцитопения. К счастью, такие реакции обычно проходят через несколько месяцев после отмены провоцирующих препаратов.
В иммунокомплексных аллергических реакциях главную роль играют IgG, которые связывают попавшие в кровоток антигены с образованием иммунных комплексов, которые затем активируют комплемент. Отложение этих комплексов в эндотелии запускает воспалительную реакцию, приводящую к его повреждению. Таким образом, иммунокомплексные реакции существенно отличаются от цитотоксических, обусловленных взаимодействием антител с антигенами самих клеток организма. Иммунокомплексные реакции лежат в основе сывороточной болезни, проявляющейся крапивницей, артралгией, артритами, увеличением лимфоузлов и лихорадкой. Ее симптомы обычно длятся от 6 до 12 сут и проходят после устранения раздражающего фактора. Сывороточную болезнь могут вызывать сульфаниламиды, пенициллины, некоторые противосудорожные средства и препараты йода. Более тяжелая форма васкулита — синдром Стивенса—Джонсона — проявляется полиморфной экссудативной эритемой, артритами, нефритом, поражением ЦНС и миокардитом. Этот синдром вызывают, в частности, сульфаниламиды.
Аллергические реакции замедленного типа обусловлены взаимодействием с антигеном сенсибилизированных Т-лимфоцитов и макрофагов. Это взаимодействие стимулирует синтез цитокинов и приток клеток воспаления (нейтрофилов и макрофагов). Пример аллергической реакции замедленного типа — аллергический контактный дерматит, вызванный ядоносным сумахом (Rhus toxicodendron).
Идиосинкразические реакции[править | править код]
Идиосинкразией называют генетически обусловленную патологическую реакцию на химическое вещество. Она может проявляться как крайне высокой чувствительностью к низким дозам вещества, так и исключительной устойчивостью к высоким дозам; при этом качественно идиосинкразическая реакция сходна с нормальной реакцией на данное вещество. Идиосинкразические реакции могут быть обусловлены особенностями фармакокинетики препарата вследствие полиморфизма генов, кодирующих ферменты его метаболизма. Так, при наследственной недостаточности ацетилирующих ферментов отмечается повышенная частота нейропатий на фоне лечения туберкулеза изониазидом. Генетический полиморфизм может касаться и фармакодинамических механизмов, например взаимодействия лекарственных средств с рецепторами (Evans and Relling, 1999). Так, у темнокожих мужчин на фоне приема противомалярийного препарата примахина часто возникает тяжелая гемолитическая анемия (около 10% случаев), что обусловлено недостаточностью Г-6-ФД (гл. 40). Изменения в гене витамин-К-эпоксидредуктазы могут обусловливать устойчивость к антикоагулянтному действию варфарина (гл. 55). Применением данных генетического анализа для объяснения индивидуальных реакций на лекарственные средства, а также подбором доз для лиц с установленным генетическим полиморфизмом занимается фармакогенетика.
Химические взаимодействия[править | править код]
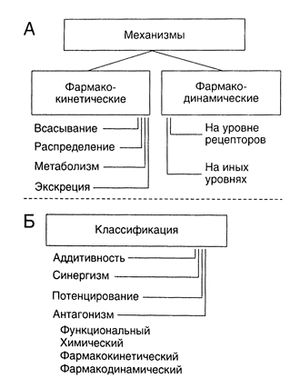
Механизмы взаимодействий химических веществ в организме бывают разными (рис. 4.6). В случае фармакокинетических взаимодействий может меняться скорость всасывания, степень связывания с белками, скорость метаболизма и экскреции. Примером фармакодинамических взаимодействий служит конкуренция за рецепторы. Так, в качестве антидота при отравлении фосфорорганическими инсектицидами (ингибиторами АХЭ) применяют атропин: он блокирует М-холинорецепторы и тем самым препятствует их активации избытком ацетилхолина. Фармакодинамические взаимодействия возможны и тогда, когда механизмы действия веществ различны: примером могут быть кровотечения, возникающие при одновременном приеме гепарина и аспирина.
Эффект нескольких веществ при их совместном применении может быть равен сумме их эффектов по отдельности, а может быть больше или меньше ее (рис. 4.6, Б). В первом (наиболее распространенном) случае говорят об аддитивном эффекте. Если два вещества усиливают эффекты друг друга, то это называют синергизмом. Например, при совместном действии четыреххлористого углерода и этанола повреждающее влияние на печень гораздо больше, чем просто сумма гепатотоксических эффектов этих веществ в отдельности. В случае усиления эффекта токсического вещества нетоксическим соединением говорят о потенцировании. Например, сам по себе изопропиловый спирт не обладает гепатотоксическим действием, но в его присутствии резко усиливается гепатотоксический эффект четыреххлористого углерода. Вещества, ослабляющие действие друг друга, называются антагонистами. Именно антагонисты токсического вещества часто стараются применять в качестве антидотов при отравлениях. Если два вещества влияют на одну и ту же физиологическую функцию в противоположном направлении, говорят о функциональном, или физиологическом, антагонизме. Примером может служить применение дофамина для поддержания кровоснабжения внутренних органов при некоторых тяжелых отравлениях, сопровождающихся падением АД. В случае если эффекты двух веществ ослабляются за счет химической реакции между ними, то это химический антагонизм, или инактивация. Например, димеркапрол ослабляет токсическое действие ряда металлов, образуя с ними хелатные комплексы (гл. 67). Если изменяется фармакокинетика вещества (всасывание, распределение, метаболизм или экскреция), в результате чего уменьшается его концентрация или время пребывания в органе-мишени (см. ниже), говорят о фармакокинетическом антагонизме. Наконец, при фармакодинамическом антагонизме эффект вещества ослабляется, например за счет блокады его рецептора другим веществом. Так, блокатор опиатных рецепторов налоксон применяют при угнетении дыхания, вызванном опиоидами.