Аминогликозиды
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Аминогликозиды[править | править код]
Аминогликозиды (аминогпикозидные аминоциклитолы) это бактерицидные антибиотики, подавляющие синт. белка. Несмотря на большую токсичность по сравнению другими антибиотиками, аминогликозиды по-прежнему применяют в клинике, в основном для лечения инфекций вызванных аэробными грамотрицательными бактериями, а стрептомицин — для лечения туберкулеза и некоторых редких инфекций. В этой статье рассмотрены спектр действия, фармакокинетика и побочные эффекты аминогликозидов, а также применение отдельных препаратов этой группы — гентамицина, тобрамицина, амикацина, нетилмицина, канамицина, стрептомицина и неомицина.
Аминогликозиды состоят из остатков аминосахаров, соединенных гликозидными связями с гексозой (аминоциклитолом). Это полярные соединения, содержащие большое количество положительно заряженных групп, что во многом определяет общие для данной группы препаратов фармакокинетические свойства. Так, все аминогликозиды плохо всасываются при приеме внутрь, с трудом проникают в СМЖ и в норме довольно быстро выводятся почками.
Аминогликозиды применяют преимущественно при инфекциях, вызванных аэробными грамотрицательными бактериями. Механизм действия этих препаратов заключается в нарушении синтеза белка у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка, аминогликозиды обладают не бактериостатическим, а бактерицидным действием. В результате мутаций, приводящих к изменению белков — мишеней аминогликозидов (рибосомных белков), микроорганизмы могут приобретать устойчивость к этим препаратам. Однако чаще всего устойчивость к аминогликозидам обусловлена нарушением транспорта препаратов в клетку или синтезом инактивирующих их бактериальных ферментов. Гены, кодирующие эти ферменты, располагаются на плазмидах или транспозонах. Возможна перекрестная устойчивость к нескольким аминогликозидам.
Аминогликозиды — эффективные и широко распространенные антибиотики, но выраженное побочное действие ограничивает их применение. Все аминогликозиды обладают сходными побочными эффектами, в первую очередь нефротоксичностью и ототоксичностью. Последняя проявляется как слуховыми, так и вестибулярными расстройствами и обусловлена поражением волосковых клеток внутреннего уха.
Историческая справка[править | править код]
Стрептомицин был получен в результате тщательно спланированного научного поиска. Открытие пенициллина побудило Ваксмана и его сотрудников к изучению почвенных актиномицетов (1939—1943 гг.). В 1943 г. был выделен штамм Streptomycesgriseus, вырабатывавший мощное антимикробное вещество, названное стрептомицином. Стрептомицин подавлял рост микобактерий туберкулеза, ряда аэробных грамположительных и грамотрицательных бактерий. Менее чем за 2 года были всесторонне изучены антимикробные, химические и фармакологические свойства стрептомицина и доказана его клиническая эффективность (Waksman, 1949). С появлением устойчивых к стрептомицину грамотрицательных палочек и грамположительных кокков (энтерококков) область применения этого препарата стала уже, и сейчас его используют только для лечения туберкулеза, туляремии, чумы и некоторых случаев стрептококкового и энтерококкового эндокардита.
В 1949 г. Ваксман и Лешевалье выделили почвенный микроорганизм Streptomyces fradiae, вырабатывавший группу антимикробных веществ, названную неомицином. Одно из этих веществ, неомицин В, до сих пор назначают местно для лечения поверхностных инфекций кожи или внутрь для подавления кишечной микрофлоры. Парентерально препарат не применяют из-за выраженной нефро- и ототоксичности.
Канамицин — антибиотик, который продуцируют Streptomyces kanamyceticus. Препарат был впервые получен Умэдзавой и его сотрудниками в Японском национальном институте здоровья в 1957 г. Сейчас канамицин почти не используют из-за высокой токсичности и распространения устойчивых микроорганизмов; вместо него назначают более современные аминогликозиды.
Гентамицин и нетилмицин — антибиотики широкого спектра действия, вырабатываемые актиномицетами рода Micromonospora, а не Streptomyces, как другие аминогликозиды. Разное происхождение препаратов отражается и в окончаниях их латинских названий (-micin у гентамицина и нетилмицина и -mуcin у других аминогликозидов). Гентамицин был впервые изучен и описан Вайнштейном и его сотрудниками в 1963 г. Препарат обладает более широким спектром действия, чем канамицин, и до сих пор используется очень часто. Тобрамицин и амикацин были внедрены в клиническую практику в 1970-х гг. Тобрамицин — один из компонентов продуцируемого Streptomyces tenebrarius небрамицинового комплекса (Higgins and Kastner, 1967). По антимикробной активности и побочному действию он близок к гентамицину. Амикацин и нетилмицин представляют собой полусинтетические аминогликозиды: амикацин — производное канамицина (Kawaguchi et al., 1972), а нетилмицин — сизомицина. Арбекацин, изепамицин и сизомицин в США не применяют, поскольку имеется множество других столь же активных, но менее токсичных препаратов, таких, как бета-лактамные антибиотики широкого спектра действия и фторхинолоны.
Химические свойства[править | править код]
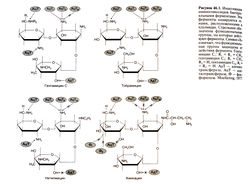
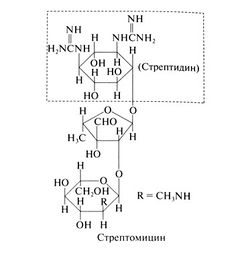
Аминогликозиды содержат остатки двух и более аминосахаров, которые соединены гликозидными связями с гексозой (аминоциклитолом), обычно занимающей центральное положение в молекуле препарата (рис. 46.1). Гексоза представлена стрептидином (у стрептомицина) или 2-дезокси-стрептамином (у остальных аминогликозидов). Таким образом, по структуре эти препараты представляют собой аминогликозидные аминоциклитолы, хотя чаще их называют просто аминогликозиды. Существует и аминоциклитол, не содержащий аминосахаров, — спектиномицин (гл. 47).
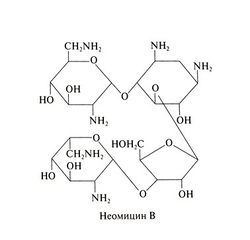
В зависимости от того, какие аминосахара входят в состав препарата, аминогликозиды делят на несколько подгрупп. У препаратов подгруппы неомицина, которая включает неомицин В и паромомицин (аминогликозид, назначаемый внутрь для лечения кишечных паразитарных инфекций), к 2-дезоксистрептамину присоединены три остатка аминосахаров. У препаратов, относящихся к подгруппам канамицина и гентамицина, таких остатков только два. Структурная формула неомицина В следующая:
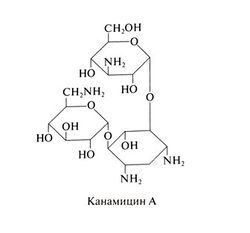
У препаратов семейства канамицина (канамицин А, канамицин В, амикацин, тобрамицин) к 2-дезоксистрептамину присоединены два остатка аминосахаров, один из которых — глкжо-замин (рис. 46.1). Структурная формула канамицина А (основного компонента препарата, выпускаемого под названием канамицин) следующая:
Амикацин — полусинтетический препарат, получаемый из канамицина А путем ацилирования аминогруппы 2-дезоксист-рептамина в первом положении 2-гидрокси-4-аминомасляной кислотой.
Препараты семейства гентамицина — гентамицины С1, С1а и С2, сизомицин и нетилмицин (1-N-этиловое производное сизо-мицина) содержат другой остаток 3-аминосахара — гарозамин (3-дезокси-С-4-метил-3-метиламино-L-арабиноза). Гентамицины С1, С1а и С2 отличаются друг от друга количеством метальных групп у второго остатка аминосахара (рис. 46.1). Различия в химической структуре, по-видимому, почти не влияют на биологическую активность этих препаратов.
Стрептомицин и дигидрострептомицин (последний больше не применяется из-за высокой ототоксичности), в отличие от других аминогликозидов, вместо 2-дезоксистрептамина содержат стрептидин, который не занимает центральное положение в молекуле препарата. Структурная формула стрептомицина следующая:
Механизм действия[править | править код]
Аминогликозиды — бактерицидные антибиотики. Их активность зависит от концентрации: чем выше концентрация антибиотика, тем быстрее гибнут бактерии. Другое характерное свойство препаратов этой группы — антибактериальное последействие: они сохраняют бактерицидную активность в течение некоторого времени после того, как сывороточная концентрация препарата становится ниже МПК. Время антибактериального последействия тоже зависит от концентрации. Благодаря таким свойствам аминогликозиды эффективны при назначении 1 раз в сутки. Механизм быстрого бактерицидного действия этих препаратов до конца не ясен, хотя их способность подавлять синтез белка и снижать точность трансляции мРНК изучена достаточно хорошо (Shannon and Phillips, 1982).
Аминогликозиды проникают в периплазматическое пространство грамотрицательных бактерий путем диффузии через поры наружной мембраны, образованные белками поринами (Nakae and Nakae, 1982). Транспорт аминогликозидов через цитоплазматическую мембрану зависит от переноса электронов в дыхательной цепи, отчасти потому, что движущей силой этого транспорта служит мембранный потенциал (внутренняя поверхность мембран бактерий заряжена отрицательно) (Bryan and Kwan, 1983). Именно этот этап поступления аминогликозидов в клетку (так называемый энергозависимый этап I) является лимитирующим. Транспорт аминогликозидов через цитоплазматическую мембрану замедляется или полностью блокируется в присутствии двухвалентных катионов (Са2+, Mg2+), в гиперосмолярной среде, при низком pH и в анаэробных условиях (в двух последних случаях причиной нарушения транспорта служит снижение мембранного потенциала). Таким образом, антимикробная активность аминогликозидов значительно снижается, например, в анаэробной среде абсцессов и в гиперосмолярной кислой моче. Внутри клетки аминогликозиды связываются с полирибосомами, нарушают считывание мРНК и вызывают преждевременное окончание трансляции, подавляя таким образом синтез белка (рис. 46.2). Образующиеся при этом аномальные белки, встраиваясь в цитоплазматическую мембрану, могут изменять ее проницаемость и ускорять проникновение аминогликозидов внутрь клетки (Busse et al., 1992). Этот этап транспорта аминогликозидов (так называемый энергозависимый этап II) изучен мало. Предполагается, что он каким-то образом связан с нарушением структуры цитоплазматической мембраны, которое, вероятно, обусловлено встраиванием аномальных белков. Наблюдаемая перед гибелью бактериальной клетки утечка небольших ионов, затем более крупных молекул и в конце концов — белков подтверждает это предположение. Постепенным разрушением цитоплазматической мембраны и нарушением других жизненно важных функций бактериальной клетки, возможно, и объясняется бактерицидное действие аминогликозидов (Bryan, 1989).
Основная мишень аминогликозидов — 308-субъединица рибосом — состоит из 21 белка и одной молекулы 16S рРНК. В связывании стрептомицина с рибосомами участвуют по крайней мере три белка, а возможно, и 16S рРНК. Изменение структуры участков связывания в значительной степени сказывается на действии стрептомицина. Например, в результате мутации, приводящей к замене Лиз42 рибосомного белка Щ на аспарагин, нарушается связывание стрептомицина с рибосомами, и бактерия приобретает устойчивость к препарату. Если же лизин в этом положении заменить на глутамин, стрептомицин становится необходимым для жизнедеятельности бактериальной клетки. Другие аминогликозиды связываются не только с 30S-, но и с 508-субъединицей рибосом, на которой имеется несколько участков связывания этих препаратов (Davis, 1988).
Аминогликозиды нарушают инициацию синтеза белка, что ведет к накоплению аномальных инициирующих комплексов, так называемых моносом —- рис. 46.2, A (Luzzatto et al., 1969). Кроме того, аминогликозиды нарушают считывание мРНК, вызывая замены аминокислот в растущей полипептидной цепи (Tai et al., 1978). У разных аминогликозидов это свойство выражено в разной степени, что, вероятно, обусловлено различиями в их сродстве к рибосомным белкам. Показано, что бактерицидная активность препарата в значительной степени зависит от его способности нарушать считывание мРНК (Hummel and Bock, 1989), но вклад этого механизма в бактерицидное действие аминогликозидов окончательно не установлен.
Устойчивость[править | править код]
Устойчивость микроорганизмов к аминогликозидам бывает обусловлена уменьшением поступления антибиотика в клетку, низким сродством препарата к рибосомам и инактивацией препарата бактериальными ферментами. В основе приобретенной устойчивости чаще всего лежит последний механизм.
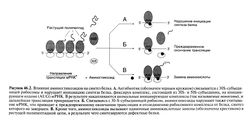
Рисунок 46.2. Влияние аминогликозидов на синтез белка. А. Антибиотик (обозначен черным кружком) связывается с ЗОS-субъединицей рибосомы и нарушает инициацию синтеза белка, фиксируя комплекс, состоящий из 30S- и 508-субъединиц, на инициирующем кодоне (AUG) мРНК. В результате накапливаются аномальные инициирующие комплексы (так называемые моносомы), и дальнейшая трансляция прекращается. Б. Связываясь с ЗО-S-субъединицей рибосом, аминогликозиды нарушают также считывание мРНК, что приводит к преждевременному окончанию трансляции и отсоединению рибосомного комплекса от белка, синтез которого не завершен. В. Кроме того, аминогликозиды вызывают одиночные аминокислотные замены (обозначены крестиком) в растущей полипептидной цепи, в результате чего синтезируются дефектные белки.
Устойчивость, обусловленная замедленным проникновением аминогликозидов в периплазматическое пространство грамотрицательных бактерий через поры наружной мембраны, встречается редко. Более распространенный механизм — инактивация препарата в пе-риплазматическом пространстве бактериальными ферментами путем фосфорилирования, аденилирования либо ацетилирования гидроксильных групп или аминогрупп (рис. 46.1). Измененный антибиотик конкурирует с неизмененным препаратом за транспорт внутрь клетки, но не связывается с рибосомами и не влияет на синтез белка. Инактивирующие ферменты (всего их более 20) кодируются плазмидными генами, которые передаются в основном в ходе конъюгации (Davies, 1994; см. также гл. 43). Широкое распространение устойчивости, переносимой плазмидами, особенно среди больничных штаммов микроорганизмов, существенно ограничило применение аминогликозидов. Амикацин более устойчив к действию бактериальных ферментов благодаря боковым радикалам (рис. 46.1), поэтому он играет важную роль в лечении некоторых больничных инфекций.
Серьезной проблемой стало распространение устойчивости, обусловленной инактивацией аминогликозидов бактериальными ферментами, среди энтерококков. В нескольких клиниках значительная доля выделенных от больных штаммов Enterococcus faecalis и Enterococcus faecium высокоустойчивы ко всем препаратам этой группы (Spera and Farber, 1992; Vemuri and Zervos, 1993). Небольшая доля устойчивых к гентамицину штаммов энтерококков чувствительны к стрептомицину, поскольку гентамицин и стрептомицин инактивируются разными ферментами. Штаммы, устойчивые к гентамицину, устойчивы и к тобрамицину, амикацину, канамицину и нетилмицину, так как все эти препараты инактивируются одним и тем же бифункциональным ферментом (Murray, 1991). В отношении устойчивых к аминогликозидам штаммов энтерококков комбинация пенициллинов или ванкомицина с аминогликозидами не оказывает синергичного бактерицидного действия. Кроме того, энтерококки приобрели плазмиды, несущие гены β-лактамаз (Murray and Mederski-Samaroj, 1983), а также плазмиды, кодирующие устойчивость к ванкомицину (Leclercq et al., 1988). Все это сильно затруднило лечение тяжелых энтерококковых инфекций. В США в отделениях реанимации распространились инфекции, которые вызваны штаммами Enterococcus faecium, устойчивыми почти ко всем известным на сегодняшний день антибактериальным средствам.
Природная устойчивость к аминогликозидам может быть обусловлена нарушением их транспорта через цитоплазматическую мембрану. Как уже упоминалось, транспорт аминогликозидов через цитоплазматическую мембрану — это активный процесс, для которого необходим кислород, поэтому облигатные анаэробы, а также факультативные анаэробы, выращенные в анаэробных условиях (Mates et al., 1983), устойчивы к этим препаратам. Сходными причинами, вероятно, объясняется природная устойчивость Stenotrophomonas maltophilia и некоторых других микроорганизмов к амикацину, а также умеренная устойчивость к аминогликозидам некоторых грамположительных кокков. Играет ли роль нарушение транспорта аминогликозидов через цитоплазматическую мембрану в развитии устойчивости у аэробных грамотрицательных бактерий, точно не установлено.
Устойчивость к аминогликозидам, обусловленная изменением строения рибосом, встречается относительно редко; исключение составляет стрептомицин. Так, в результате точечной мутации, приводящей к замене аминокислоты в одном из рибосомных белков Escherichia coli, нарушается связывание стрептомицина с рибосомами. Такие штаммы Escherichia coli высокоустойчивы к стрептомицину, но в природе не распространены. Модификация рибосом лежит в основе устойчивости к стрептомицину у 5% штаммов Pseudomonas aeruginosa, а также у половины устойчивых к этому препарату штаммов энтерококков (Eliopoulos etal., 1984). На такие штаммы энтерококков комбинация пенициллинов со стрептомицином не оказывает синергичного действия in vitro. Однако эти микроорганизмы обычно чувствительны к комбинации пенициллина с гентамицином in vitro, поскольку для гентамицина подобный механизм устойчивости не характерен.
Антибактериальная активность[править | править код]
Гентамицин, тобрамицин канамицин, нетилмицин и амикацин активны в первую очередь в отношении аэробных грамотрицательных палочек. Спектр действия канамицина, как и стрептомицина, уже, чем у других аминогликозидов. В частности, канамицин не следует назначать при инфекциях, вызванных Serratia spp. и Pseudomonas aeruginosa. Как отмечалось выше, аминогликозиды почти не действуют на облигатных анаэробов и выращенных в анаэробных условиях факультативных анаэробов. Кроме того, препараты этой группы недостаточно активны в отношении большинства грамположительных бактерий. Streptococcus pneumoniae и Streptococcus pyogenes настолько устойчивы к аминогликозидам, что гентамицин используют для выявления этих микроорганизмов в мокроте и отделяемом из носоглотки, добавляя препарат в кровяной агар. В сочетании с ингибиторами синтеза клеточной стенки (пенициллинами, ванкомицином) стрептомицин и гентамицин оказывают синергичное бактерицидное действие на чувствительные штаммы энтерококков и стрептококков. Гентамицин и тобрамицин in vitro активны в отношении более чем 90% штаммов Staphylococcus aureus и 75% штаммов Staphylococcus epidermidis. При тяжелых стафилококковых инфекциях монотерапию аминогликозидами не назначают, так как ее клиническая эффективность не доказана. Во время лечения гентамицином быстро появляются мутантные штаммы стафилококков, устойчивые к препарату. Метициллиноустойчивые стафилококки часто устойчивы и к аминогликозидам благодаря генам инактивирующих эти препараты ферментов, расположенным на трансмиссивных плазмидах.
Аэробные грамотрицательные палочки различаются по чувствительности к аминогликозидам (табл. 46.1). Возбудитель считается чувствительным, если в концентрации, создаваемой в сыворотке, антибиотик подавляет его рост, не вызывая выраженных побочных эффектов. При введении каждые 8—12 ч максимальная сывороточная концентрация гентамицина, тобрамицина и нетилмици-на составляет 4—12 мкг/мл, а амикацина и канамицина — 20—35 мкг/мл. Тобрамицин и гентамицин одинаково эффективны против большинства грамотрицательных палочек, но первый обычно более активен в отношении Pseudomonas aeruginosa и некоторых штаммов Proteus spp. Многие грамотрицательные палочки, которые устойчивы к гентамицину благодаря инактивирующим препарат ферментам, инактивируют и тобрамицин. В последние 20—30 лет число больничных штаммов, устойчивых к гентамицину и тобрамицину, неуклонно растет, причем доля устойчивых штаммов может сильно различаться даже в разных отделениях одной больницы (Cross et al., 1983). К счастью, такие штаммы сохраняют чувствительность к амикацину, а иногда и к нетилмицину, вероятно, благодаря тому, что эти препараты в меньшей степени подвержены действию бактериальных ферментов. Поэтому амикацин и нетилмицин в первую очередь показаны при больничных инфекциях.
Фармакокинетика[править | править код]
Всасывание[править | править код]
Будучи полярными соединениями, содержащими большое число положительно заряженных групп, аминогликозиды очень плохо всасываются в ЖКТ. При приеме внутрь и ректальном введении в системный кровоток поступает менее 1% дозы. Аминогликозиды не разрушаются в кишечнике и выводятся с калом в неизмененном виде. Однако у больных с почечной недостаточностью длительный прием внутрь или ректальное введение могут привести к накоплению аминогликозидов до токсической концентрации. При поражении ЖКТ (язвы, воспалительные заболевания кишечника; Breen et al., 1972) всасывание гентамицина усиливается. Аминогликозиды быстро всасываются при введении в серозные полости и при этом могут вызывать побочные эффекты (например, блокаду нервно-мышечного проведения). Токсическое действие возможно и при длительном местном лечении этими препаратами обширных ран, ожогов, кожных язв, особенно на фоне почечной недостаточности.
Все аминогликозиды быстро всасываются при в/м введении; максимальная сывороточная концентрация достигается через 30—90 мин. Такая же концентрация наблюдается через 30 мин после окончания получасовой в/в инфузии препарата в той же дозе. У тяжелых больных, особенно при шоке, всасывание после в/м инъекции может замедляться из-за плохого кровоснабжения тканей.
Таблица 46.1. Минимальные концентрации аминогликозидов, при которых подавляется рост 90% штаммов микроорганизмов (МПКэд)
|
Микроорганизм |
МПКэд, мкг/мл | ||||
|
Канамицин |
Гентамицин |
Нетилмицин |
Тобрамицин |
Амикацин | |
|
Citrobacter freundii |
8 |
0,5 |
0,25 |
0,5 |
1 |
|
Enterobacter spp. |
4 |
0,5 |
0,25 |
0,5 |
1 |
|
Escherichia coli |
16 |
0,5 |
0,25 |
0,5 |
1 |
|
Klebsiella pneumoniae |
32 |
0,5 |
0,25 |
1 |
1 |
|
Proteus mirabilis |
8 |
4 |
4 |
0,5 |
2 |
|
Providencia stuartii |
128 |
8 |
16 |
4 |
2 |
|
Pseudomonas aeruginosa |
> 128 |
8 |
32 |
4 |
2 |
|
Serratia spp. |
>64 |
4 |
16 |
16 |
8 |
|
Enterococcus faecalis |
- |
32 |
2 |
32 |
64 |
|
Staphylococcus aureus |
2 |
0,5 |
0,25 |
0,25 |
16 |
Распределение[править | править код]
Вследствие своей полярности аминогликозиды не проникают внутрь большинства клеток, а также в ЦНС и ткани глаза. Все препараты этой группы, за исключением стрептомицина, почти не связываются с альбумином плазмы. Объем распределения аминогликозидов близок к объему внеклеточной жидкости и составляет 25% безжировой массы тела (Barza et al., 1975).
Концентрации аминогликозидов в тканях и биологических жидкостях низкие. В высоких концентрациях эти препараты накапливаются только в корковом веществе почек, эндолимфе и перилимфе внутреннего уха, чем и объясняется их нефро- и ототоксичность. Хотя с желчью выводится лишь незначительное количество аминогликозидов, благодаря активной секреции их концентрация там составляет около 30% сывороточной.
В секретах дыхательных путей концентрация аминогликозидов невелика (Levy, 1986). В плевральную и синовиальную жидкости эти препараты поступают медленно, но при повторном введении могут достигнуть там почти такой же концентрации, как в сыворотке. При перитоните и перикардите облегчается проникновение препаратов в полости брюшины и перикарда.
После парентерального введения концентрация аминогликозидов в СМЖ не достигает терапевтического уровня и, по данным исследований на животных и человеке, в отсутствие воспаления мозговых оболочек составляет менее 10% сывороточной концентрации, а при менингите — до 25% (Strausbaugh et al., 1977). Для лечения менингита, вызванного грамотрицательными палочками, таких концентраций недостаточно, поэтому препараты вводят интратекально и в желудочки головного мозга. С появлением цефалоспоринов третьего поколения необходимость в применении аминогликозидов в большинстве случаев отпала. У новорожденных с менингитом интратекальное или внутрижелудочковое введение аминогликозидов не имеет преимуществ перед в/в введением из-за незрелости гематоэнцефалического барьера (McCracken et al., 1980). Аминогликозиды очень плохо проникают в водянистую влагу и стекловидное тело, поэтому при бактериальном эндофтальмите требуются местные инъекции — субконъюнкгивальные, ретробуль-барные, в стекловидное тело (Barza, 1978).
Назначение аминогликозидов на поздних сроках беременности может привести к накоплению препаратов в крови плода и околоплодных водах. У детей, чьи матери во время беременности получали стрептомицин или тобрамицин, возможно снижение слуха (Warkany, 1979). Данных о применении остальных аминогликозидов во время беременности недостаточно, поэтому беременным эти препараты назначают с осторожностью и только по строгим показаниям, если нельзя использовать антибиотики другой группы.
Дозы[править | править код]
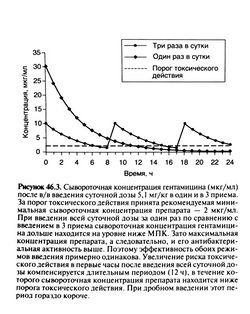
Рекомендуемые при тех или иных инфекциях дозы отдельных аминогликозидов приведены в следующих разделах главы. Суточную дозу обычно разделяют на 2—3 введения. Однако выяснилось, что введение антибиотиков 1 раз в сутки столь же эффективно и реже вызывает побочные эффекты (Veipooten et al., 1989; Gilbert, 1991; Prins etal., 1993; The International Antimicrobial Therapy Cooperative Group of the European Organization for Research and Treatment of Cancer, 1993; Chamas et al., 1997; Urban and Craig, 1997; Gilbert et al., 1998; Rybak et al., 1999). Побочное действие аминогликозидов обусловлено их накоплением во внутреннем ухе и в почках, чему способствует высокая сывороточная концентрация антибиотика и длительное лечение. Элиминация из этих органов происходит медленнее, чем из крови, а при высокой сывороточной концентрации препарата еще более замедляется (Tran Ва Huy et al., 1983). Поэтому токсичность аминогликозидов зависит от их минимальной сывороточной концентрации (Swan, 1997). Чем дольше сывороточная концентрация превышает относительно безопасный порог (рекомендованную минимальную сывороточную концентрацию), тем выше вероятность токсического действия. При введении 1 раз в сутки максимальная концентрация препарата выше, зато время, в течение которого сывороточная концентрация находится ниже порога токсического действия, больше, чем при введении 3 раза в сутки (соответственно 12 и 3 ч, рис. 46.3). Следовательно, в первом случае вероятность токсического действия меньше. С другой стороны, бактерицидная активность и антибактериальное последействие аминогликозидов зависят от их концентрации. При введении всей суточной дозы за один раз время, в течение которого сывороточная концентрация антибиотика ниже МПК, удлиняется, зато достигается более высокая сывороточная концентрация препарата. Этим, вероятно, и объясняется равная эффективность обоих режимов лечения.
Многочисленные исследования, проведенные в самых разных клинических условиях, показали, что почти все аминогликозиды при введении 1 раз в сутки не менее (а иногда и более) безопасны и столь же эффективны, как и при введении несколько раз в сутки (Barza et al., 1996; Deaney and Tate, 1996; Ferri-ols-Lisart and Alos-Alminana, 1996; Freeman and Strayer, 1996; Ali and Goetz, 1997; Bailey etal., 1997; Chamas etal., 1997; Freeman et al., 1997; Deamer, 1998). К тому же введение всей суточной дозы за один раз дешевле и удобнее. Поэтому такой способ, как правило, предпочтительнее. Исключение составляют беременность, период новорожденности, а также комбинированная терапия инфекционного эндокардита, при которой аминогликозиды назначают в низких дозах. В этих случаях равные эффективность и безопасность указанных режимов лечения не доказаны. При СКФ менее 20—25 мл/мин аминогликозиды назначают еще реже, например каждые 48 ч, во избежание накопления препарата.
У больных с СКФ меньше 80—100 мл/мин дозу аминогликозидов снижают независимо от режима введения (табл. 46.2). Если предполагаемая длительность лечения больше 3—4 сут, нужно следить за сывороточной концентрацией препарата во избежание его накопления. Монотерапию аминогликозидами назначают редко, так как они плохо проникают в ткани, а комбинированная терапия и монотерапия антибиотиками других групп дают лучший результат (Bodey et al., 1985; Leibovici etal 1997). Исключение составляют инфекции мочевых путей.
При введении 2—3 раза в сутки определяют как минимальную, так и максимальную сывороточные концентрации антибиотика. Первую измеряют непосредственно перед введением очередной дозы, а вторую — через 30 мин после в/м введения или через 30 мин после получасовой в/в инфузии. Максимальная сывороточная концентрация позволяет определить, достигает ли антибиотик терапевтического уровня в крови. Для гентамицина, нетилмицина и тобрамицина эта концентрация составляет 4—10 мкг/мл, а для амикацина и стрептомицина -15—30 мкг/мл (Gilbert et al., 1999). По минимальной сывороточной концентрации судят о накоплении препарата и риске токсического действия. Для гентамицина, нетилмицина и тобрамицина она должна быть ниже 1 —2 мкг/мл, а для амикацина я стрептомицина — ниже 5—10 мкг/мл.
Следить за сывороточной концентрацией аминогликозидов нужно и при введении 1 раз в сутки. Максимальную концентрацию измеряют не всегда (как правило, она в 3—4 раза выше, чем при дробном введении). Оценить накопление препарата в организме можно несколькими способами. Самый простой заключается в определении сывороточной концентрации препарата через 24 ч после введения. Дозу корректируют таким образом чтобы эта концентрация была ниже порога токсического действия (1—2 мкг/мл для гентамицина и тобрамицина). Но такой способ имеет ряд недостатков. Во-первых, если минимальная концентрация препарата настолько мала, что ее даже не удается определить, это означает, что в течение длительного времени (вероятно, значительно дольше половины интервала между введениями) сывороточная концентрация препарата ниже терапевтической. Во-вторых, при поддержании сывороточной концентрации, измеряемой через 24 ч после введения, на уровне 1—2 мкг/мл время, в течение которого концентрация превышает порог токсического действия, оказывается больше, чем при дробном введении (Barclay et al., 1999). Между 18 и 24 ч после введения сывороточная концентрация должна находиться в пределах от 1 до 0 мкг/мл. Более приемлем способ, при котором сывороточную концентрацию измеряют раньше чем через 24 ч после введения, а ее дальнейшую динамику определяют по номограммам. Например, если через 8 ч после введения концентрация гентамицина равна 1,5—6 мкг/мл, то через 18 ч она будет меньше 1 мкг/мл (Chambers et al., 1998). Рекомендуемая сывороточная концентрация гентамицина через 18 ч после введения составляет 1 — 1,5 мкг/мл для больных с СКФ выше 50 мл/мин и 1 —2,5 мкг/мл — для больных с СКФ ниже 50 мл/мин (Gilbert et al., 1998). Наиболее точный способ оценки накопления препарата в организме состоит в двукратном измерении сывороточной концентрации с интервалом в несколько часов (например, через 2 и 12 ч после введения). Затем рассчитывают клиренс антибиотика и подбирают дозу так, чтобы сывороточная концентрация находилась в заданных пределах.
Таблица 46.2. Коррекция дозы аминогликозидов и интервала между введениями в зависимости от СКФ
|
СКФ (клиренс креатинина), мл/мин |
Доза, % максимальной суточной дозы* |
Интервал между введениями, ч |
|
100 |
100 |
24 |
|
75 |
75 |
24 |
|
50 |
50 |
24 |
|
25 |
25 |
24 |
|
20 |
80 |
ос |
|
10 |
60 |
48 |
|
< 10 |
40 |
48 |
У взрослых максимальная суточная доза амикацина, канамицина и стрептомицина составляет I5 мг/кг, гентамицина и тобрамицина — 5,5 мг/кг, нетилмицина — 6,5 мг/кг.
За сывороточной концентрацией аминогликозидов важно следить на протяжении всего курса лечения. При угрожающих жизни инфекциях ее следует измерять несколько раз в неделю (а в случае изменения функции почек — еще чаще). Кроме того, сывороточную концентрацию обязательно определяют в течение 24 ч после изменения дозы.
Элиминация[править | править код]
Аминогликозиды выводятся главным образом путем клубочковой фильтрации; концентрация антибиотика в моче составляет 50—200 мкг/мл. Значительная часть препарата, введенного парентерально, выводится в неизмененном виде в течение суток, в основном в первые 12 ч. Т1/2 примерно одинаков для всех аминогликозидов и при нормальной функции почек равен 2—3 ч. Эти препараты, по-видимому, отчасти реаб-сорбируются в канальцах, так как почечный клиренс аминогликозидов составляет около 2/3 СКФ.
После введения одной дозы 80—90% антибиотика выводится с мочой, а остальная часть накапливается в тканях, откуда аминогликозиды выводятся гораздо медленнее, сТ1/2от30 до 700 ч (Schentag and Jusko, 1977). Через 1 —2 сут лечения скорость элиминации препарата из крови становится почти равной почечному клиренсу (почти 100% введенной дозы обнаруживают в моче), что, по-видимому, обусловлено насыщением участков связывания препарата в тканях. Из-за медленного выведения из тканей небольшое количество аминогликозидов обнаруживают в моче в течение 10—20 сут после отмены лечения. Аминогликозиды, связанные с почечной тканью, сохраняют антибактериальную активность и предупреждают бактериальные инфекции мочевых путей у экспериментальных животных даже в тех случаях, когда в крови препарат уже не определяется (Bergeron et al., 1982).
После однократного введения сывороточная концентрация препарата зависит только от объема распределения. Поскольку аминогликозиды выводятся почти исключительно с мочой, при умеренном снижении функции почек их T1/2 линейно зависит от уровня креатинина плазмы. У больных с нефункционирующими почками Т1/2 увеличивается в 20—40 раз. Поскольку и нефро-, и ототоксическое действие аминогликозидов дозозависимо, при почечной недостаточности обязательно снижают поддерживающую дозу. Можно менять дозу, интервал между введениями или и то, и другое одновременно. Убедительных данных о преимуществах того или иного способа коррекции дозы нет. Более того, ставится под сомнение принятый сейчас терапевтический диапазон аминогликозидов (McCormack and Jewesson, 1992). Чтобы как можно точнее предсказать сывороточную концентрацию препарата, насыщающую дозу лучше всего рассчитывать в миллиграммах на килограмм веса. Поскольку аминогликозиды почти не проникают в жировую ткань, при расчете нужно использовать безжировую массу тела либо идеальный вес.
Рассчитать дозу у больных с быстро изменяющейся функцией почек трудно (Lesar etal., 1982). К тому же сывороточная концентрация препарата после введений одной и той же дозы подвержена сильным индивидуальным колебаниям (Barza et al., 1975). При увеличении количества внеклеточной жидкости объем распределения аминогликозидов растет, а их сывороточная концентрация снижается. У больных муковисцидозом по неясным причинам увеличивается клиренс и снижается Tw2 аминогликозидов, а при лейкозах возрастает объем распределения (Rosenthal etal., 1977; Spyker etal., 1978). При анемии (гема-токрит < 25%) сывороточная концентрация этих препаратов выше ожидаемой, вероятно, за счет уменьшения их связывания с эритроцитами (Siber et al., 1975).
Аминогликозиды выводятся при гемодиализе и перитонеальном диализе. С помощью гемодиализа за 12 ч удаляется около 50% введенной дозы, поэтому его применяют при передозировке этих препаратов. Считается, что введение половины насыщающей дозы после каждого сеанса гемодиализа позволяет поддержать концентрацию аминогликозидов на должном уровне, но из-за влияния множества факторов этот способ, по меньшей мере, весьма неточен. При непрерывном артериовенозном гемодиализе и непрерывном веновенозном гемодиализе клиренс аминогликозидов составляет 15 мл/мин, а клиренс креатинина — 15—30 мл/мин (в зависимости от скорости тока крови).
При этом суточная доза аминогликозидов должна составлять 15—30% максимальной. Обязательно следят за сывороточной концентрацией препарата.
При перитонеальном диализе клиренс аминогликозидов ниже, чем при гемодиализе. В целом он составляет около 5— 10 мл/мин, но для разных препаратов может сильно различаться. Если больному, находящемуся на перитонеальном диализе, назначают аминогликозиды по поводу бактериального перитонита, при системном введении они вряд ли достигнут терапевтической концентрации в перитонеальной жидкости, поскольку их уровеньтам в 10 раз ниже, чем в сыворотке (Smithivaset al., 1971). Поэтому антибиотик рекомендуют добавлять в Анализирующий раствор. Насыщающую дозу вводят в/в или добавляют в диализирующий раствор. Затем переходят на поддерживающие дозы. При дробном введении препарат вводят в диализирующий раствор 1 раз в сутки, амикацин — в дозе 2 мг/кг, а гентамицин, нетилмицин и тобрамицин — в дозе 0,6 мг/кг. При постоянном введении антибиотик добавляют при каждой смене Анализирующего раствора; насыщающая доза амикацина равна 25 мг/л, поддерживающая — 12 мг/л. Для гентамицина, нетилмицина и тобрамицина насыщающая и поддерживающая дозы составляют соответственно 8 и 4 мг/л.
У взрослых и детей старше 6 мес скорость экскреции аминогликозидов одинакова. У новорожденных этих препаратов может быть намного больше. В первую неделю жизни у новорожденных весом менее 2 кг Т1/2 составляет 8—11 ч, а у новорожденных весом более 2 кг — около 5 ч (Yow, 1977). Поэтому у новорожденных особенно важно следить за сывороточной концентрацией аминогликозидов (Philips et al., 1982).
In vitro (Konishi etal., 1983)и у больных с терминальной ХПН (Blair et al., 1982) аминогликозиды могут инактивироваться пенициллинами. В этих случаях подобрать дозу еще труднее. В наименьшей степени пенициллины инактивируют амикацин.
Побочные эффекты[править | править код]
Все аминогликозиды ото- и нефротоксичны. Побочные эффекты ограничивают применение этих препаратов и затрудняют подбор дозы.
Ототоксичность[править | править код]
Любой аминогликозид способен вызвать как вестибулярные, так и слуховые расстройства. По данным исследований на животных и человеке, эти препараты накапливаются в перилимфе и эндолимфе внутреннего уха (Tran Ва Huy et al., 1983), особенно при высокой сывороточной концентрации. Обратная диффузия в кровоток происходит медленно, Т1/2 аминогликозидов для жидкостей внутреннего уха в 5—6 раз больше, чем для крови. Скорость обратной диффузии зависит от сывороточной концентрации антибиотика и достигает максимума в период, когда эта концентрация минимальна. Если уровень аминогликозида в крови все время высокий, риск ототоксичности возрастает. Вместе с тем даже однократное введение тобрамицина может привести к легкому преходящему нарушению слуха на пике сывороточной концентрации препарата (Wilson and Ramsden, 1977). Каким образом этот эффект связан с необратимым нарушением слуха, не известно.
Поскольку ототоксическое действие аминогликозидов обусловлено разрушением волосковых клеток вестибулярного и слухового анализаторов, очень чувствительных к этим препаратам, оно часто бывает необратимым (Brummett, 1983). У морских свинок, получавших гентамицин в больших дозах, наблюдалось разрушение волосковых клеток I типа в центральной части ампулярного гребешка (вестибулярный орган) и слияние отдельных волосков в гигантские волоски (Wersall et al., 1973). В сходных исследованиях, посвященных гентамицину и тобрамицину, выявлена гибель волосковых клеток спирального органа (Theopold, 1977). С увеличением дозы препарата и длительности лечения повреждение постепенно распространяется от основания улитки, где воспринимаются звуки высокой частоты, до верхушки, где воспринимаются низкие частоты. Биохимический механизм ототоксичности изучен плохо, хотя доказано, что гистологические изменения коррелируют со способностью улитки генерировать электрические потенциалы в ответ на звук. По данным экспериментальных исследований, ранние проявления ототоксичности можно устранить с помощью Са2+. После гибели волосковых клеток происходит ретроградная дегенерация преддвер-но-улиткового нерва и возникает необратимое снижение слуха. Предполагается, что аминогликозиды влияют на систему активного транспорта, участвующую в поддержании ионного состава эндолимфы (Neu and Bendush,1976). Изменения ионного состава ведут к изменению электрической активности волосковых клеток и нарушению проводимости нерва. В итоге нарушения ионного состава эндолимфы, а возможно, и сами аминогликозиды, вызывают необратимое повреждение волосковых клеток. Изучалось также взаимодействие аминогликозидов с фосфолипидами мембраны, особенно с фосфатидилинозитолом и его фосфорилированными производными — предшественниками вторых посредников, ИФ3 и ДАГ.
Выраженность стойких слуховых и вестибулярных нарушений зависит от количества поврежденных волосковых клеток и возрастает при увеличении длительности лечения. При повторном применении аминогликозидов гибнет все больше волосковых клеток, что в конце концов может привести к глухоте. Число этих клеток уменьшается с возрастом, поэтому пожилые особенно подвержены ототоксическому действию. По данным исследований на животных, этакриновая кислота и фуросемид усиливают ототоксичность аминогликозидов (Brummett, 1983). Данные о подобном эффекте фуросемида у человека не столь убедительны (Moore et al., 1984а). У больных с вызванными аминогликозидами нарушениями слуха в анамнезе риск возникновения или усугубления таких расстройств возрастает.
Хотя все аминогликозиды способны вызвать и слуховые, и вестибулярные расстройства, ототоксическое действие отдельных препаратов этой группы отчасти избирательно. Стрептомицин и гентамицин обычно вызывают вестибулярные нарушения, амикацин, канамицин и неомицин — слуховые, а тобрамицин — и те, и другие. Оценить частоту ототоксического действия трудно. По данным аудиометрии, она составляет 25% (Moore et al., 1984а) и одинакова для тобрамицина, гентамицина и амикацина. Поданным исследований на животных и человеке, нетилмицин менее токсичен по сравнению с другими аминогликозидами (Lemer et al., 1983). Тем не менее пренебрегать ототоксическим действием этого препарата не стоит: поданным одного из клинических испытаний, оно отмечалось у 10% больных (Trestman etal., 1978).
Риск вестибулярных нарушений особенно велик при использовании стрептомицина. Клинически выраженные необратимые вестибулярные расстройства возникли у 20% больных, принимавших этот препарат по поводу энтерококкового эндокардита в дозе 500 мг 2 раза в сутки в течение 4 нед (Wilson et al., 1984). У 75% больных, получавших стрептомицин в дозе 2 г/сут в течение более чем 60 сут, возникали нистагм и нарушения равновесия.
Поскольку начальные проявления ототоксичности обратимы, за больными, получающим аминогликозиды в высоких дозах или в течение продолжительного времени, нужно тщательно наблюдать. Однако тугоухость может развиться даже через несколько недель после отмены препарата.
Слуховые расстройства. Первым симптомом часто бывает высокочастотный шум в ушах. Если препарат не отменить, через несколько дней может возникнуть снижение слуха. После отмены лечения шум в ушах сохраняется от нескольких дней до 2 нед. Поскольку вначале нарушается восприятие только звуков высокой частоты (вне голосового диапазона), снижение слуха может остаться незамеченным и выявляется только при тщательной аудиометрии. В дальнейшем возникает тугоухость на звуки более низкой частоты и затрудняется восприятие речи.
Вестибулярные расстройства. Вестибулярным расстройствам может предшествовать умеренная головная боль, длящаяся 1—2 сут. Вслед за ней следует острая стадия, которая длится 1—2 нед и характеризуется тошнотой, рвотой и нарушениями равновесия. Наблюдаются головокружение в положении стоя, неустойчивость в положении сидя и стоя в отсутствие зрительного контроля, неустойчивость в позе Ромберга, изредка — маятникообразные движения туловища и спонтанный нистагм. Больной не осознает окончание движения; отклонение глаз в конце движения затрудняет фиксацию взгляда и чтение. Острая стадия заканчивается внезапно; вслед за ней возникают симптомы хронического лабиринтита. На этой стадии вестибулярные расстройства появляются при ходьбе и резких движениях, а в положении лежа отсутствуют. Наиболее яркий симптом атаксия. Хронический лабиринтит длится около 2 мес и постепенно переходит в стадию компенсации, во время которой симптомы появляются только при закрывании глаз. Компенсация происходит за счет зрения и проприоцептивной чувствительности, которые обеспечивают восприятие движений и положения тела. Хотя у молодых компенсация более полная, она не всегда достаточна для выполнения сложных координированных движений, необходимых для многих видов профессиональной деятельности. Восстановление может занять 12—18 мес; в большинстве случаев сохраняется остаточный дефект. Специфического лечения не существует, при ранней отмене препарата, до повреждения волосковых клеток, можно добиться полного восстановления.
Нефротоксичностъ[править | править код]
Легкое и, как правило, обратимое нарушение функции почек возникает у 8—26% больных, получающих аминогликозиды дольше нескольких суток (Smith et al., 1977, 1980). Нефротоксическое действие этих препаратов обусловлено их накоплением в клетках проксимальных канальцев (Aronoff et al., 1983; Lietman and Smith, 1983). Первый признак поражения проксимальных канальцев — экскреция с мочой ферментов щеточной каемки (Patel et al., 1975). Через несколько суток нарушается концентрационная способность почек, появляется легкая протеинурия, в моче обнаруживают гиалиновые и зернистые цилиндры. Еше через несколько суток снижается СКФ (Schentag et al., 1979). Считается что неолигурическая ОПН обусловлена действием аминогликозидов на дистальные отделы нефрона. По мне нию некоторых авторов, эти препараты уменьшают чув ствительность эпителия собирательных трубочек к АД1 (Appel, 1982). Изредка развивается острый канальцевый некроз. Самое распространенное нарушение — незначительное увеличение уровня креатинина плазмы; гипокалиемия, гипокальциемия и гипофосфатемия возникают очень редко. Поскольку клетки проксимальных канальцев способны к регенерации, нарушение функции почек почти всегда обратимо.
Нефротоксическое действие аминогликозидов определяется несколькими факторами. Во-первых, оно зависит от общей дозы и, следовательно, чаще возникает при длительном лечении. Поданным исследований на собаках и крысах, постоянное введение аминогликозидов сопряжено с большей нефротоксичностью, чем дробное введение (Reiner et al., 1978; Powell et al., 1983). У человека нефротоксическое действие усиливается, когда минимальная сывороточная концентрация препарата в плазме длительно превышает порог токсического действия (Keating etal., 1979).
Отдельные аминогликозиды различаются по своей нефро-токсичности. По данным экспериментов на животных, она зависит от концентрации препарата в корковом веществе почек. Неомицин, накапливающийся там в большей степени, чем другие аминогликозиды, обладает высокой нефротоксичностью, поэтому его применяют в основном местно. Наименее нефро-токсичен стрептомицин, который не откладывается в корковом веществе почек. Больше всего споров вызывает сравнительная нефротоксичность гентамицина и тобрамицина. Данные о сравнительной нефротоксичности этих препаратов, полученные в нескольких контролируемых клинических испытаниях, не совпадают (Smith et al., 1977,1980; Fong etal., 1981; Keys etal., 1981), хотя концентрация гентамицина в почках выше, чем концентрация тобрамицина. Если эти препараты и различаются по нефротоксичности, то очень незначительно. Результаты исследований, посвященных сравнительной нефротоксичности амикацина, сизомицина и нетилмицина, неоднозначны. Амфотерицин В, ванкомицин, цисплатин и циклоспорин могут усилить нефротоксичность аминогликозидов (Wood etal., 1986). Поданным нескольких исследований, то же самое можно сказать и о цефа-лотине (Klastersky et al., 1975; Wade et al., 1978). Фуросемид усугубляет нефротоксичность аминогликозидов у крыс на фоне обезвоживания (Mitchell et al., 1977), по-видимому, за счет потерь калия. В клинических исследованиях эти данные не подтвердились (Smith and Lietman, 1983).
Предполагается (хотя и не доказано), что факторами риска нефротоксического действия служат пожилой возраст, болезни печени и септический шок (Moore et al., 1984b). Следует помнить, что у пожилых оценка СКФ по уровню креатинина плазмы завышена, поэтому подбор дозы аминогликозидов только по концентрации креатинина может привести к передозировке.
Нарушение структуры и функции клеток проксимальных почечных канальцев под действием аминогликозидов обычно обратимо. Наиболее опасное последствие поражения почек — замедление выведения препарата, которое, в свою очередь, усиливает ототоксичность. Поэтому нужно следить за сывороточной концентрацией аминогликозидов, особенно при длительном лечении и применении высоких доз. Впрочем, доказательств того, что токсическое действие можно предотвратить, поддерживая максимальную и минимальную концентрации препарата ниже определенного уровня, нет. Опыт применения этих препаратов 1 раз в сутки свидетельствует, что высокая максимальная сывороточная концентрация (25 мкг/мл и более) не усиливает их токсичность.
Биохимические изменения, которые приводят к повреждению канальцевого эпителия и нарушению функции клубочков, изучены плохо. Возможно, определенную роль играет изменение структуры клеточных мембран. Аминогликозиды подавляют активность фосфолипаз, сфингомиелиназ и АТФаз, нарушают функцию митохондрий и рибосом (Silverblatt, 1982; Queener et al., 1983; Humes etal., 1984). Благодаря большому количеству положительно заряженных групп эти препараты могут взаимодействовать с отрицательно заряженными группами мембранных фосфолипидов, влияя на синтез биологически активных веществ (простагландинов) и вторых посредников (фосфоинозитидов). Нарушением метаболизма простагландинов можно объяснить взаимосвязь между повреждением канальцев и снижением СКФ. Кроме того, у животных, получавших аминогликозиды, уменьшается количество пор в эндотелии клубочков (Luft and Evan, 1980) и снижается коэффициент ультрафильтрации (Baylis et al., 1977).
In vitro кальций угнетает захват и связывание аминогликозидов щеточной каемкой почечного эпителия, а добавление кальция в пищу ослабляет нефротоксическое действие аминогликозидов у экспериментальных животных (Bennett et al., 1982). Аминогликозиды поступают в клетки почечных канальцев путем пиноцитоза и накапливаются в лизосомах (концентрация аминогликозидов там в 50 раз выше, чем в сыворотке; Aronoff et al., 1983), где тормозят метаболизм фосфолипидов. В результате фосфолипиды накапливаются в лизосомах в виде характерных слоистых структур (миелоидных телец), которые впоследствии выводятся с мочой (Silverblatt, 1982).
Блокада нервно-мышечного проведения[править | править код]
К редким побочным эффектам аминогликозидов относятся блокада нер-вно-мышечного проведения и апноэ. Анализ 83 сообщений о параличах, вызванных этими препаратами, показал, что чаще всего это осложнение вызывает неомицин (Pittinger et al., 1970). За ним следуют (в порядке убывания частоты) канамицин, амикацин, гентамицин и тобрамицин.
У человека блокада нервно-мышечного проведения обычно возникает при внутриплевральном или внутри-брюшинном введении аминогликозидов в больших дозах, но может развиться и при в/в, в/м введении и даже при приеме внутрь (Holtzman, 1976). Как правило, она наблюдается при использовании аминогликозидов на фоне общей анестезии, в сочетании с другими препаратами, блокирующими нервно-мышечное проведение, а также у больных миастенией.
Поданным экспериментов на животных, аминогликозиды тормозят высвобождение ацетилхолина из преси-наптических окончаний и снижают чувствительность постсинаптической мембраны к нему (Pittinger and Adamson, 1972; Sokoll and Gergis, 1981). Действие аминогликозидов на нервно-мышечное проведение нивелируется кальцием, поэтому для лечения этого осложнения назначают соли кальция в/в (Singh et al., 1978). Помимо кальция с переменным успехом применяли ингибиторы холин-эстеразы (эдрофоний, неостигмин). В настоящее время благодаря хорошей осведомленности врачей этот побочный эффект встречается относительно редко.
Другие неврологические нарушения[править | править код]
Стрептомицин способен вызвать поражение зрительного нерва (увеличение слепого пятна).
Реже возникает нейропатия. Она может быть обусловлена повреждением нерва при инъекции или системным токсическим действием стрептомицина. Иногда через 30—60 мин после введения препарата появляется парестезия, которая может сохраняться несколько часов (чаще всего — вокруг рта, реже — в других областях лица и в руках).
Прочие побочные эффекты[править | править код]
Аминогликозиды не относятся к сильным аллергенам: анафилактические реакции и сыпь встречаются редко. Помимо сыпи изредка возникают эозинофилия, лихорадка, лейкопения, отек Квинке, эритродермия, стоматит и анафилактический шок. При парентеральном введении аминогликозиды не вызывают псевдомембранозный колит — возможно, потому, что они не нарушают нормальную анаэробную микрофлору кишечника. Другие побочные эффекты описаны в разделах, посвященных отдельным препаратам.
Стрептомицин[править | править код]
В настоящее время стрептомицин применяют при некоторых редких инфекциях, обычно в комбинации с другими антибактериальными средствами. Поскольку из всех аминогликозидов стрептомицин наименее активен в отношении аэробных грамотрицательных палочек, он постепенно вышел из употребления и некоторое время не применялся в США. Стрептомицин вводят в/м глубоко, хотя в/в введение столь же безопасно. В/м инъекции причиняют боль; в месте введения часто образуется горячее на ощупь, болезненное уплотнение. При СКФ выше 80 мл/мин стрептомицин назначают в дозе 15 мг/кг/сут. Как правило, препарат вводят по 1000 мг 1 раз в сутки или по 500 мг 2 раза в сутки. Максимальная сывороточная концентрация составляет соответственно 50—60 мкг/мл и 15—30 мкг/мл, а минимальная — менее 1 мкг/мл и 5—10 мкг/мл. У больных с почечной недостаточностью дозу уменьшают: при СКФ более 30 мл/мин уменьшают суточную дозу пропорционально снижению СКФ; при более тяжелой почечной недостаточности необходимо корректировать и интервал между введениями (табл. 46.2).
Применение
Инфекционный эндокардит. In vitro и у экспериментальных животных стрептомицин и пенициллины усиливают бактерицидное действие друг друга в отношении энтерококков, стрептококков группы D, а также разных видов зеленяших стрептококков, входящих в состав нормальной микрофлоры полости рта. Многие авторы рекомендуют использовать эту комбинацию для лечения эндокардита, вызванного перечисленными микроорганизмами, хотя вместо стрептомицина сейчас с этой целью гораздо чаще применяют гентамицин. При энтерококковом эндокардите монотерапия бензилпенициллином неэффективна, в отличие от комбинации бензилпенициллина со стрептомицином (500 мг 2 раза в сутки) либо с гентамицином (1 мг/кг 3 раза в сутки). Если возбудитель устойчив к стрептомицину (МПК > 2000 мкг/мл), назначают гентамицин. Продолжительность комбинированной терапии составляет 4—6 нед. Если давность заболевания меньше 3 мес, достаточно 4-недельного курса (Wilson et al., 1984). Некоторые авторы во всех случаях энтерококкового эндокардита предпочитают использовать гентамицин, поскольку нефротоксическое действие — основной побочный эффект гентамицина — обратимо, а ототоксический эффект, свойственный стрептомицину, необратим. К сожалению, уже появились штаммы энтерококков, устойчивые к гентамицину (Eliopoulos et al., 1988). Поскольку гентамицин и стрептомицин разрушаются разными ферментами, небольшая часть штаммов. устойчивых к гентамицину, чувствительна к стрептомицину.
При эндокардите, вызванном пенициллиночувствительными стрептококками (МПК <0,1 мкг/мл), с успехом используют монотерапию бензилпенициллином в течение 4 нед (частота рецидивов 1—2%, Karchmer et al., 1979) комбинированную терапию бензилпенициллином и стрептомицином (0,5 г 2 раза в сутки) в течение 2 нед (частота рецидивов 1—2%, Wilson et al., 1978) или терапию бензилпенициллином в течение 4 нед, к которой в первые 2 нед добавляют стрептомицин (рецидивов не было, Wolfe and Johnson, 1974). Таким образом, врач может выбрать схему лечения в зависимости от индивидуальных особенностей больного. Например, пожилому больному с эндокардитом, вызванным пенициллиночувствительными стрептококками, лучше назначить монотерапию бензилпенициллином в течение 4 нед, поскольку у пожилых риск токсического действия стрептомицина увеличивается. При неосложненном эндокардите показан короткий, 2-недельный курс лечения (Bisno et al., 1989) При эндокардите протезированных клапанов, вызванном умеренно пенициллиноустойчивыми стрептококками (МПК > 0,2 мкг/мл) или ауксотрофными стрептококками, рекомендуется более продолжительная терапия.
Туляремия. Стрептомицин высокоэффективен при туляремии (Evans et al., 1985). Чем раньше начата антимикробная терапия, тем лучше результат, но полное выздоровление возможно и при хронической форме болезни. В большинстве случаев стрептомицин назначают в дозе 1—2 г/сут (15—25 мг/кг/сут) в течение 7—10 сут; суточную дозу разделяют на несколько введений. При туляремии успешно применяют и тетрациклины. Некоторые врачи отдают им предпочтение при легких формах болезни.
Чума. Стрептомицин — одно из самых эффективных средств лечения при всех формах чумы. Помимо стрептомицина при чуме применяют тетрациклины и хлорамфе-никол. Стрептомицин назначают в дозе 1—4 г/суг в течение 7— 10 сут; суточную дозу разделяют на 2—4 введения.
Туберкулез. Стрептомицин используют только в комбинации с одним или двумя другими противотуберкулезными препаратами, к которым чувствителен выделенный штамм. При нормальной функции почек доза составляет 15 мг/кг в/м 1 раз в сутки в течение 2—3 мес, после чего ту же дозу вводят 2—3 раза в неделю.
Гентамицин[править | править код]
Гентамицин применяют при многих тяжелых инфекциях, вызванных грамотрицательными палочками. Благодаря своей дешевизне и активности в отношении всех грамотрицательных аэробов, за исключением самых устойчивых штаммов, гентамицин предпочтительнее других аминогликозидов. Однако в некоторых больницах уже появились устойчивые к этому препарату штаммы, что может ограничить его использование.
Применение гентамицина и некоторых других аминогликозидов.
При лечении большинства перечисленных ниже инфекций гентамицин, тобрамицин, амикацин и нетилмицин взаимозаменяемы, поэтому их применение обсуждается в одном разделе. В большинстве случаев предпочтение отдают гентамицину в силу его дешевизны \ большого опыта использования.
В/м и в/в гентамицин назначают в следующих дозах: насыщющая доза — 2 мг/кг, поддерживающая — 3—5 мг/кг/сут. Ес ли препарат вводят дробно, поддерживающую дозу разделяю на 3 введения. При нормальной функции почек гентамици можно вводить в дозе 5,1 мг/кг в/в в течение 30—60 мин 1 p в сутки. Новорожденным при тяжелых инфекциях вводят 5 мг/кг/сут в 2 приема через равные промежутки времени, детям младше 2 лет — 2—2,5 мг/кг каждые 8 ч. При введении 1,7 мг/кг каждые 8 ч максимальная сывороточная концентрация составляет 4—10 мкг/мл, а при введении 5,1 мг/кг 1 раз в сутки — 16—24 мкг/мл. Следует отметить, что при использовании гентамицина в рекомендованных дозах достаточная сывороточная концентрация препарата достигается не всегда. Поэтому ее необходимо периодически измерять, особенно у тяжелых больных (см. также разделы, посвященные дозам аминогликозидов). Токсическая сывороточная концентрация гентамицина точно не установлена. Тем не менее показано, что токсическое действие развивается при сохранении минимальной сывороточной концентрации на уровне выше 2 мкг/мл дольше 10 сут.
Гентамицин, тобрамицин, амикацин и нетилмицин эффективны при многих инфекциях, но из-за токсичности длительное применение этих препаратов показано только при угрожающих жизни инфекциях, а также в случаях, когда менее токсичный препарат противопоказан или неэффективен.
Указанные антибиотики часто применяют (в том числе в комбинации с пенициллинами и цефалоспоринами) при тяжелых инфекциях, которые вызваны грамотрицательными бактериями, особенно Pseudomonas aeruginosa, Enterobacter spp., Klebsiella spp., Serratia spp., и другими видами, устойчивыми к менее токсичным антибиотикам. Это инфекции мочевых путей, сепсис, инфицированные ожоговые раны, остеомиелит, пневмония, перитонит и отит. Аминогликозиды назначают как в качестве эмпирической терапии, так и после выявления возбудителя.
Препараты этой группы в значительной степени инактивируются пенициллинами, поэтому их нельзя смешивать. Кроме того, в той или иной степени гентамицин инактивируется in vitro гепарином, амфотерицином В и цефалоспоринами.
Инфекции мочевых путей. При неосложненных инфекциях мочевых путей аминогликозиды обычно не назначают, хотя показано, что однократное введение гентамицина в дозе 5 мг/кг в/м приводит к излечению 90% неосложненных инфекций нижних мочевых путей (Varese et al., 1980). Аминогликозиды, сами по себе или в комбинации с р-лактамными антибиотиками, применяют в качестве эмпирической терапии у тяжелых больных с пиелонефритом. Если после идентификации возбудителя и определения его чувствительности выясняется, что выделенный штамм чувствителен к менее токсичным антибиотикам, аминогликозиды отменяют. Антибактериальная активность аминогликозидов значительно снижается при низком pH (Strausba-ugh and Sande, 1978) и в гиперосмолярной среде (Papapetropou-lou et al., 1983). Однако у больных с нормальной функцией почек концентрация этих препаратов в моче достаточна для уничтожения чувствительных микроорганизмов. При экспериментальном пиелонефрите у крыс терапевтический эффект аминогликозидов сохранялся в течение нескольких месяцев после отмены лечения благодаря высвобождению препарата из коркового вещества почек (Bergeron et al., 1982).
Пневмония. Пневмония, вызванная грамотрицательными палочками, встречается все чаще, особенно в стационаре (в том числе на фоне ИВЛ) и у больных с иммунодефицитом, главным образом с нейтропенией. Выбор антибактериального средства определяется чувствительностью возбудителя. Большинство возбудителей внебольничной пневмонии чувствительны к р-лактамным антибиотикам широкого спектра действия, поэтому добавлять к ним аминогликозиды обычно нет необходимости. Монотерапия аминогликозидами не очень эффективна из-за затрудненного проникновения этих препаратов в воспаленную ткань, а также из-за снижения их антибактериальной активности вследствие недостатка кислорода и низкого pH в очаге инфекции. Комбинацию аминогликозидов с β-лактамными антибиотиками применяют для эмпирического лечения больничной пневмонии втехслучаях, когда вероятный возбудитель — полирезистентные грамотрицательные аэробы. Кроме того, комбинированное лечение показано при пневмонии, вызванной Pseudomonas aeruginosa.
Во многих больницах, особенно в ожоговых и реанимационных отделениях, где широко применяют гентамицин и тобрамицин, появились штаммы Klebsiella spp., Enterobacter spp., Serratia spp., Proteus spp. и Pseudomonas spp., устойчивые к этим препаратам. Устойчивые штаммы часто выделяют у тяжелых больных с трахеостомой, иммунодефицитом, постоянными венозными или мочевыми катетерами.
При пневмонии, вызванной анаэробами или Streptococcus pneumoniae (самые частые возбудители внебольничной пневмонии), аминогликозиды неэффективны. Кроме того, монотерапия аминогликозидами безуспешна при пневмонии, вызванной аэробными грамположительными кокками (включая Staphylococcus aureus и стрептококки), иногда протекающей с абс-цедированием легкого. Таким образом, монотерапию гентамицином и другими аминогликозидами никогда не назначают при внебольничной пневмонии, а также до определения возбудителя больничной пневмонии (Kunin, 1977).
Менингит. С появлением цефалоспоринов третьего поколения, в частности цефотаксима и цефтриаксона, необходимость в назначении аминогликозидов в большинстве случаев отпала. Исключение составляет менингит, вызванный устойчивыми к Р-лактамным антибиотикам грамотрицательными бактериями (например, Pseudomonas spp. и Acinetobacter spp.). Аминогликозиды можно вводить в желудочки головного мозга в дозе 0,03 мг на 1 мл СМЖ каждые 24 ч для гентамицина или тобрамицина или 0,1 мг на 1 мл СМЖ каждые 24 ч для амикацина (McGee and Baringer, 1990). Однако, поданным одного исследования, внутрижелудочковое введение гентамицина детям с менингитом, вызванным грамотрицательными палочками, неэффективно.
Перитонит. Аминогликозиды применяют при перитоните, возникшем на фоне перитонеального диализа. Поскольку у таких больных концентрация антибиотика в перитонеальной жидкости после в/в или в/м введения может оказаться недостаточной, препарат следует добавлять в диализирующий раствор. Инфекции, вызванные грамположительными бактериями. Хотя показания к назначению аминогликозидов при таких инфекциях немногочисленны, в некоторых случаях эти препараты могут спасти жизнь. При энтерококковом эндокардите до 50% выделенных от больных штаммов устойчивы к комбинации пенициллинов со стрептомицином, но почти всегда чувствительны к комбинации пенициллинов с гентамицином. Пенициллины в сочетании с гентамицином действуют только на энтерококков, рост которых подавляется при концентрации гентамицина 500 мкг/мл; по чувствительности микроорганизмов к стандартным концентрациям гентамицина судить о синергизме аминогликозидов и пенициллинов нельзя. Двухнедельный курс гентамицина (или тобрамицина) в сочетании с нафциллином можно использовать в некоторых случаях стафилококкового эндокардита с поражением трехстворчатого клапана у инъекционных наркоманов (Chambers et al., 1988).
Сепсис. У больных с нейтропенией при подозрении на сепсис или другую инфекцию, вызванную Pseudomonas aeruginosa, назначают активные в отношении этого микроорганизма пенициллины в сочетании с гентамицином, тобрамицином, амикацином или нетилмицином. Комбинированная терапия значительно улучшила результаты лечения сепсиса, вызванного грамотрицательными бактериями, особенно на фоне нейтропении (Klastersky, 1987).
Местное применение. В виде мази гентамицин всасывается очень медленно, в виде крема — быстрее. При нанесении на обширные участки пораженной кожи (например, при ожогах) сывороточная концентрация антибиотика может достичь 4 мкг/мл, а 2—5% нанесенного препарата обнаруживают в моче.
Побочные эффекты. Побочное действие гентамицина такое же, как и у других аминогликозидов. Наиболее опасны нефротоксичность и необратимая ототоксичность. Интратекальное или внутрижелудочковое введение (см. выше) применяют редко, так как оно может сопровождаться местным воспалением и вызывать радикулопатию и другие осложнения.
Тобрамицин[править | править код]
По антимикробной активности и фармакокинетическим свойствам тобрамицин сходен с гентамицином. Тобрамицин можно назначать в/м или в/в. Кроме того, его выпускают в виде глазной мази и глазных капель. Дозы и сывороточные концентрации такие же, как у гентамицина. Токсическое действие обычно возникает, когда минимальная сывороточная концентрация препарата в течение длительного времени превышает 2 мкг/мл, что часто бывает при снижении функции почек. В этом случае необходимо уменьшить дозу.
Применение. Показания к применению тобрамицина в основном те же, что и у гентамицина. В связи с высокой активностью в отношении Pseudomonas aeruginosa тобрамицин назначают при бактериемии, остеомиелите и пневмонии, вызванных этим микроорганизмом, обычно в комбинации с активными в отношении псевдомонад β-лактамными антибиотиками.
В отличие от гентамицина, тобрамицин в комбинации с пенициллинами малоактивен в отношении многих штаммов энтерококков. Большинство штаммов Enterococcus faecium высокоустойчивы к комбинации тобрамицина с пенициллинами (Мо-elleringetal., 1979). Кроме того, тобрамицин не действует на микобактерии (Gangadharam and Candler, 1977).
Побочные эффекты. Как и другие аминогликозиды, тобрамицин нефро- и ототоксичен. По данным экспериментов на животных, тобрамицин в меньшей степени, чем гентамицин, повреждает волосковые клетки слухового и вестибулярного анализаторов, а также клетки почечных канальцев. Однако клинические данные о меньшей токсичности тобрамицина не столь убедительны.
Амикацин[править | править код]
Из всех аминогликозидов амикацин обладает самым широким спектром действия. Благодаря устойчивости к бактериальным ферментам, инактивирующим аминогликозиды, амикацин применяют в больницах, где преобладают устойчивые к гентамицину и тобрамицину штаммы. Дозы и фармакокинетические свойства амикацина такие же, как у канамицина.
Амикацин назначают в дозе 15 мг/кг/сут; суточную дозу вводят за один раз или в 2—3 приема. При почечной недостаточности дозу и интервалы между введениями корректируют. Препарат быстро всасывается при в/м введении; после инъекции в дозе 7,5 мг/кг максимальная сывороточная концентрация составляет около 20 мкг/мл. Сразу по окончании получасовой в/в инфузии препарата в той же дозе сывороточная концентрация составляет примерно 40 мкг/мл, а через 30 мин — 20 мкг/мл. Через 12 ч после введения амикацина в дозе 7,5 мг/кг сывороточная концентрация препарата обычно равна 5—10 мкг/мл. При введении в дозе 15 мг/кг 1 раз в сутки максимальная сывороточная концентрация составляет 50—60 мкг/мл, а минимальная — менее 1 мкг/мл.
Применение. В больницах, где распространены устойчивые к гентамицину и тобрамицину штаммы, амикацин — препарат выбора при лечении тяжелых больничных инфекций, вызванных грамотрицательными палочками. Кое-где использование амикацина ограничили во избежание появления устойчивых штаммов. Однако поданным, полученным в других больницах, широкое применение амикацина не увеличило частоту выявления таких штаммов (Betts etal., 1984).
Благодаря своей уникальной устойчивости к ферментам, инактивирующим аминогликозиды, амикацин активен в отношении подавляющего большинства аэробных грамотрицательных палочек, вызывающих как больничные, так и внебольничные инфекции. К ним относятся большая часть штаммов Sena tia spp., Proteus spp. и Pseudomonas aeruginosa, почти все штаммы Klebsiella spp. и Enterobacter spp., а также устойчивые к гентамицину и тобрамицину штаммы Escherichia coli. Устойчн вость к амикацину распространена преимущественно среди штаммов Acinetobacter spp., Providencia spp., Flavobacteriumspp а также представителей рода Pseudomonas, отличных от Pseudo, monas aeruginosa. Но эти возбудители встречаются редко. Как и тобрамицин, амикацин менее активен в отношении энтерококков, чем гентамицин, и потому не используется при энтерокок. ковых инфекциях. Амикацин не действует на большинство положительных анаэробных бактерий. Он активен в отнощении Mycobacterium tuberculosis (в концентрации 4 мкг/мл подавляет рост 99% штаммов). Спектр действия амикацина включает и некоторых атипичных микобактерий (Gangadharam and Candler, 1977), поэтому этот препарат применяют при вызванных ими диссеминированных инфекциях у больных СПИДом Побочные эффекты. Как и другие аминогликозиды, амикацин ото- и нефротоксичен. Чаще всего он вызывает снижение слуха.
Нетилмицин[править | править код]
Последним из аминогликозидов на рынке появился нетилмицин. По фармакокинетическим свойствам и дозам он подобен гентамицину и тобрамицину. Нетилмицин обладает широким спектром действия в отношении аэробных грамотрицательных палочек. Как и амикацин, нетилмицин не инактивируется большинством бактериальных ферментов, разрушающих аминогликозиды, и потому к нему чувствительны некоторые бактерии, устойчивые к гентамицину.
При осложненных инфекциях мочевых путей у взрослых нетилмицин применяют в дозе 1,5—2 мг/кг каждые 12 ч. При тяжелых системных инфекциях суточная доза составляет 4—6,5 мг/кг; ее вводят за один раз или в 2—3 приема. Новорожденным вводят 4—6,5 мг/кг/сут в 2 приема, детям постарше — 3—7,5 мг/кг в 2—3 приема. По распределению и элиминации нетилмицин, гентамицин и тобрамицин очень сходны. После часовой в/в инфузии в дозе 2 мг/кг максимальная сывороточная концентрация нетилмицина составляет около 11 мкг/мл (Luft et al., 1978). У взрослых Т1/2 обычно равен 2—2,5 ч; при почечной недостаточности выведение препарата замедляется.
Применение. Нетилмицин эффективен при тяжелых инфекциях, вызванных чувствительными к нему энтеробактериями или другими грамотрицательными палочками. Он активен в отношении некоторых устойчивых к гентамицину возбудителей, за исключением энтерококков (Panwalker et al., 1978).
Побочные эффекты. Как и другие аминогликозиды, нетилмицин ото- и нефротоксичен. По данным экспериментов на животных, нетилмицин менее токсичен, чем другие аминогликозиды (Luft et al., 1976), но в клинических исследованиях это пока не доказано (Trestman et al., 1978; Bock et al., 1980).
Канамицин[править | править код]
В настоящее время канамицин применяют редко, так как это один из самых токсичных аминогликозидов, а спектр его действия уже, чем у других препаратов этой группы.
Канамицин назначают парентерально и внутрь. При парентеральном введении суточная доза составляет 15 мг/кг (ее вводят 2—4 приема с равными интервалами), максимум — 1,5 г/сут Детям назначают до 15 мг/кг/сут.
Применение. Лечение. Канамицин почти вышел из употребле ния и применяется лишь в нескольких случаях. В комбинации другими противотуберкулезными препаратами его используют для лечения туберкулеза. Поскольку противотуберкулезная терапия длительна и общая доза препарата достаточно велика, риск ото- и нефротоксического действия возрастает. Поэтому канамицин назначают только тогда, когда микобактерии устойчивы к другим, менее токсичным противотуберкулезным средствам (гл. 48).
Профилактика. Канамицин можно назначать внутрь при печеночной коме (см. ниже, «Неомицин»), С этой целью его используют в дозе 4—6 г/сут в несколько приемов в течение 36—72 ч; иногда дозу увеличивают до 12 г/сут. Однако даже в столь больших дозах канамицин не всегда подавляет кишечную микрофлору.
Побочные эффекты. Побочное действие аминогликозидов при их приеме внутрь описано в следующем разделе.
Неомицин[править | править код]
Неомицин — антибиотик широкого спектра действия. МПК составляет 5—10 мкг/мл и ниже. Из грамотрицательных бактерий к нему высокочувствительны Escherichia coli, Enterobacter aerogenes, Klebsiella pneumoniae и Proteus vulgaris. Кроме того, неомицин подавляет рост таких грамположительных микроорганизмов, как Staphylococcus aureus и Enterococcus faecalis. К неомицину чувствительны и Mycobacterium tuberculosis. На Pseudomonas aeruginosa препарат не действует.
Неомицин выпускают в формах для местного применения и для приема внутрь. Раствор, содержащий неомицин (40 мг/мл) и полимиксин В (200 ООО ед/мл), используют для промывания мочевого пузыря у больных с постоянными мочевыми катетерами. Промывание осуществляют с помощью катетера; 1 мл раствора антибиотиков разводят в 1 л физиологического раствора. Это позволяет предотвратить бактериурию и бактериемию. Объем жидкости для промывания обычно составляет 1 л/сут.
Существует множество препаратов неомицина для местного применения (кремы, мази и другие лекарственные формы), в том числе комбинированных — с поли-миксином В, бацитрацином, другими антибиотиками и глюкокортикоидами. Данных о том, что такие препараты ускоряют заживление ран, нет. Преимущества препаратов, содержащих глюкокортикоиды, тоже не доказаны. Применение. Местно неомицин широко применяют при различных инфекциях кожи и слизистых, если эти инфекции вызваны чувствительными к нему микроорганизмами (инфицированные раны, в том числе ожоговые, язвы, инфекции при дерматозах). Однако полностью уничтожить возбудителя в очаге инфекции не удается.
Внутрь неомицин назначают в основном при подготовке к операциям на кишечнике (обычно в комбинации с эритромицином). При печеночной коме в отсутствие почечной недостаточности неомицин можно назначать в дозе 4— 12 г/сут в несколько приемов. На поздних стадиях печеночной недостаточности может развиться тяжелая почечная недостаточность, поэтому неомицин применяют с большой осторожностью, а при появлении признаков ототоксического действия или поражения почек отменяют. Вместо неомицина при печеночной коме чаще назначают лактулозу, так как она гораздо безопаснее. Фармакокинетика. Неомицин плохо всасывается в ЖКТ и, подобно другим аминогликозидам, выводится почками. После приема внутрь в дозе 3 г максимальная сывороточная концентрация препарата составляет всего лишь 1—4 мкг/мл. Если функция почек не нарушена, при приеме внутрь в дозе 10 г/сут в течение 3 сут сывороточная концентрация неомицина остается ниже уровня, при котором возникают системные побочные эффекты. У больных с почечной недостаточностью препарат может накапливаться. Около 97% принятой внутрь дозы не всасывается и в неизмененном виде выводится с калом. Неомицин можно назначать внутрь детям младшего возраста в дозе 100 мг/кг/сут, но длительность лечения не должна превышать 3 нед, так как неомицин все же частично всасывается, особенно при нарушении целостности слизистой ЖКТ.
Побочные эффекты. При местном применении неомицина у 6—8% больных возникают аллергические реакции, в основном сыпь. Возможны перекрестные аллергические реакции на другие аминогликозиды. Наиболее опасные побочные эффекты — поражение почек и нейросенсорная тугоухость. Так как они чаще всего наблюдаются при парентеральном введении в относительно больших дозах, препарат назначают только внутрь или местно. Однако токсическое действие описано даже при местном лечении ран 0,5% раствором неомицина у больных с нормальной функцией почек. После промывания ран и серозных полостей возможна блокада нервно-мышечного проведения и паралич дыхательных мышц.
Основные побочные эффекты неомицина при приеме внутрь — нарушение всасывания в кишечнике и суперинфекция. У больных, получавших препарат в дозе 4—6 г/сут, иногда развивается напоминающий спру синдром с поносом, стеатореей и азотореей. Возможен избыточный рост дрожжевых грибов в кишечнике, обычно бессимптомный. Прием неомицина даже в больших дозах, как правило, не влияет на уровень протромбина в крови.