Основы фармакологии: индивидуальный подход к лечению
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
ОСНОВЫ МЕДИКАМЕНТОЗНОГО ЛЕЧЕНИЯ[править | править код]
В начале XX века были приняты первые законы, регламентирующие разработку лекарственных средств и призванные гарантировать их эффективность и безопасность. Однако данные, полученные на больших группах людей, справедливы не для каждого больного. Разные больные по-разному реагируют на один и тот же препарат, поэтому каждое назначение нужно рассматривать как эксперимент, в ходе которого должна быть проверена гипотеза об индивидуальной эффективности и о безопасности лекарственного средства. Научной основой таких врачебных гипотез служат результаты контролируемых клинических испытаний, проводимых в ходе разработки лекарственных средств, и данные наблюдений после их поступления в продажу. До начала лечения следует выбрать четкие критерии эффективности: клинические данные (например, нормализация температуры, уменьшение боли) либо косвенные прогностические показатели (например, снижение АД, уровня холестерина в крови). Индивидуальный подбор схемы лечения требует от врача знания основ фармакокинетики и фармакодинамики. Реакция на лекарственное средство зависит от многих факторов: 1) возраста, 2) состояния органов, отвечающих за элиминацию препарата (печени, почек), 3) одновременного приема пищи и других препаратов, влияния прочих веществ (лекарственных взаимодействий), 4) предшествующего лечения тем же или подобным препаратом (толерантности), 5) генетических факторов, влияющих на фармакокинетику и риск побочных эффектов (фармакогенетики). В связи с индивидуальными различиями в фармакокинетике некоторых препаратов рекомендуется периодически измерять их сывороточную концентрацию. Для оценки индивидуальных особенностей фармакодинамики нужно тщательно наблюдать за реакцией на препарат, руководствуясь выбранными заранее критериями эффективности и безопасности. Одни побочные эффекты непосредственно связаны с механизмом действия препарата, и индивидуальный подход к лечению часто помогает их избежать. Причиной других могут быть многочисленные факторы, сочетание которых уникально для каждого больного. До поступления в продажу любой препарат изучается на сравнительно небольшой группе тщательно отобранных добровольцев. По этой причине редкие побочные эффекты (например, развивающиеся с вероятностью 1:1000) выявляют на доклиническом этапе не всегда; в некоторых случаях их обнаруживают только спустя несколько лет после внедрения препарата в практику. Врачи должны наблюдать за реакциями на новые препараты и сообщать о тяжелых побочных эффектах ФДА или фирме-производителю. Возможно, в будущем нам удастся глубже изучить влияние генетических и средовых факторов на действие препаратов, выявлять редкие побочные эффекты до поступления в продажу лекарственных средств и создать простые методики для индивидуального подбора схемы лечения. Все это позволит повысить безопасность медикаментозного лечения.
Терапия как наука[править | править код]
Принципы научного подхода к лечению — экспериментальной медицины — были сформулированы Клодом Бернаром более века назад, но до недавнего времени пробивали себе дорогу с трудом. Наряду с появлением все более совершенных методов диагностики лечение в значительной степени продолжало опираться на личный опыт, интуицию и традиции. Однако за последние 30 лет были разработаны принципы проведения клинических испытаний, и сегодня в основе лечения лежит научный анализ достоверных фактических данных. Таким образом, из искусства медикаментозное лечение превратилось в науку. В последнее время такой подход получил бурное развитие в виде так называемой доказательной медицины.
Основные препятствия. Одно из главных препятствий для развития научного подхода к терапии — это расхожее мнение о том, что клинические испытания бесполезны, поскольку бесконечное разнообразие больных все равно не поддается учету. Если бы это было справедливо, то такие работы и в самом деле не имели бы большого смысла. Но в действительности эта точка зрения несостоятельна.
Из всех видов медицинских исследований именно клинические испытания, то есть эксперимент, в котором мы вводим больному препарат и наблюдаем эффект, дают наиболее значимые результаты. Конечно, зарегистрировать эффект может быть непросто, ведь многие важные симптомы не поддаются прямому объективному измерению. Субъективное ощущение одышки может не соответствовать показаниям спирометрии, а во время приступа стенокардии на ЭКГ часто не бывает депрессии сегмента ST. Многие склонны преувеличивать значение объективных показателей, считая ощущения больного непригодными для научного анализа. Задача исследователя — найти способ количественной, объективной оценки этих субъективных ощущений. Сегодня признано, что такие важные симптомы, как одышка, боль, слабость, можно описать, оценить и измерить с необходимой степенью точности. Методы работы со сложными клиническими данными описаны в обзорах Feinstein (1983,1999).
Следующее препятствие — преувеличение значимости общепринятой номенклатуры заболеваний. Номенклатура формирует представление о болезни как о застывшем, а не динамичном процессе, из-за чего врачи часто считают больных с одним и тем же диагнозом однородной, а не разнородной группой — даже если патогенез заболевания не известен. Все это неизбежно приводит к шаблонному назначению «стандартных» препаратов в «стандартных» дозах. На самом же деле врач должен своевременно распознавать изменения, возникающие в ходе заболевания, и должным образом корректировать лечение. Так, под инфарктом миокарда всегда понимают вызванный ишемией очаговый некроз кардиомиоцитов, но назначая лечение конкретному больному, нужно учесть особенности гемодинамики, электрофизиологии, влияний вегетативных нервов, которые зависят от стадии, размеров и локализации инфаркта миокарда. В противном случае лечение может оказаться неэффективным, а в некоторых случаях привести к побочным эффектам, которых можно было бы избежать. В действительности за одним диагнозом обычно скрывается целый спектр состояний, имеющих разные причины и прогноз. Сравниваемые в эксперименте группы больных должны быть одинаковы по показателям, влияющим на прогноз; однако установлены далеко не все такие показатели. В подобных случаях помогает изучение реакции на препарат: оно позволяет не только выявить показатели, по которым можно судить о конечном эффекте, но и лучше понять патогенез заболевания.
Третье препятствие — ошибочное утверждение о бесполезности эмпирических данных. Так называют данные, которые основаны на простом опыте и не имеют какой-либо научной базы. Тем не менее эмпирическими наблюдениями пренебрегать не стоит. Многими успехами мы обязаны именно внимательным врачам, которые наблюдали, как то или иное вмешательство влияет на прогноз. Результаты таких наблюдений часто ложатся в основу тактики лечения, даже когда не известны патогенез заболевания и механизм действия препарата. Кроме того, они порой позволяют обнаружить новые и неожиданные свойства лекарственных средств. Благодаря эмпирическим наблюдениям пеницилламин стали применять при артрите, лидокаин — при аритмиях, пропранолол и клонидин — при артериальной гипертонии, силденафил — при импотенции. Однако необходимое условие для таких наблюдений — тщательно разработанные методики, в том числе статистической обработки результатов; в противном случае можно получить бесполезные и даже ошибочные выводы.
Клинические испытания. Основой современной доказательной медицины служат клинические испытания, планированию и проведению которых сегодня уделяется большое внимание. Все врачи должны уметь критически оценивать их результаты, поскольку именно эти результаты ложатся в основу принципов лечения. Планируя испытание, необходимо четко сформулировать рабочую гипотезу, подобрать однородные группы (основную и контрольную), значимые и чувствительные критерии эффективности. На основании количественной оценки результатов наблюдений делают окончательные выводы. Клинические испытания всегда должны быть контролируемыми, причем выбор контрольной группы не менее важен, чем основной. Предпочтительно проводить рандомизированные двойные слепые плацебо-контролируемые испытания, которые обеспечивают равное распределение неучтенных признаков между основной и контрольной группами и сводят к минимуму вероятность систематических ошибок. Однако это возможно не всегда. Так, при изучении редких или смертельных заболеваний (например, бешенства), а также у больных, которых по юридическим и этическим нормам нельзя включать в испытания (детей, беременных, больных некоторыми психическими заболеваниями), приходится прибегать к историческому контролю.
К проведению клинических испытаний предъявляют определенные требования.
- Критерии эффективности должны быть клинически значимыми и поддаваться измерению. К ним можно отнести и субъективные показатели, с помощью которых выясняют влияние лекарственного средства на качество жизни. Для этого больным основной и контрольной групп предлагают оценить свое самочувствие в баллах при помощи опросника (Guyatt et al.,1993). По возможности в качестве критериев эффективности лучше использовать показатели конечного эффекта (например, выживаемость, устранение боли), а не промежуточные, или косвенные, показатели (Fleming and DeMets, 1996; Bucher et al., 1999). К последним относятся факторы, для которых показана связьс прогнозом (например, АД, уровень холестерина в крови, число лимфоцитов CD4 при СПИДе, частота желудочковой экстрасистолии). Часто их использование позволяет уменьшить длительность испытания и объем выборки, но вместе с тем повышает вероятность ошибок. Так, поданным исследования CAST (Cardiac Arrhythmias Suppression Trial — Антиаритмическая терапия после инфаркта миокарда), энкаинид, флекаинид и морацизин снижали частоту желудочковой экстрасистолии (косвенный показатель) у больных после инфаркта миокарда, однако смертность при этом возросла (Echt et al., 1991). Критерии эффективности должны соотноситься с прогнозом.
- Основная и контрольная группы должны быть сравнимы по точности диагноза и степени тяжести заболевания; в противном случае можно найти различия там, где их нет, и наоборот. Это особенно сложно в случае малоизученных заболеваний (например, фибромиалгии, синдрома хронической усталости).
- Дозы препаратов нужно подбирать таким образом, чтобы их эффективность сравнивалась при сходном риске побочных эффектов (либо наоборот — риск побочных эффектов при сходной эффективности).
- Следует учитывать вероятный у многих больных эффект плацебо, особенно при использовании субъективных критериев эффективности; для оценки его значимости нужна контрольная группа (Temple, 1997).
- Следует заранее выяснить, готов ли каждый больной в точности соблюдать предписания врача, и в ходе испытания выполнение предписаний нужно периодически проверять. При нерегулярном приеме данные об эффективности и о риске побочных эффектов могут оказаться заниженными, даже если такие больные в случайном порядке распределяются между контрольной и основной группами.
- Планируя испытание, нужно рассчитать объем выборки, необходимый для получения статистически значимых результатов. Он зависит от того, насколько однородны изучаемые группы больных по диагнозу, прогнозу, ожидаемым лечебным и побочным эффектам. Чем выше степень неоднородности, тем больше больных нужно включить в испытание; в противном случае будет трудно обнаружить статистически значимые различия, даже если они есть. Однако результаты могут быть сомнительными даже при большом объеме выборки. Если эффект нового препарата убедительно доказан в предыдущих испытаниях, то сомнений обычно не возникает; в других же случаях нелегко бывает решить, превосходит ли он известное средство, особенно если испытание не является контролируемым.
- Иногда решающую роль при выборе контроля играют этические соображения (Passamani, 1991). Неэтично давать плацебо при угрожающих жизни заболеваниях, для которых уже существуют эффективные методы лечения; в таких случаях с ними и нужно сравнивать новые лекарственные средства.
Результаты клинических испытаний новых лекарственных средств (или «старых» по новым показаниям) не всегда подтверждаются на практике (Feinstein, 1994). Дело в том, что с целью повышения однородности групп в них часто включают больных, которые не имеют сопутствующих заболеваний и не принимают других препаратов. В испытаниях оценивают действие одного-двух препаратов, а на практике такому же больному их часто назначают гораздо больше. Клинические испытания обычно проводят на относительно небольшой группе добровольцев, и длительность приема лекарственного средства может быть меньше, чем потребуется на практике, а потому больные лучше соблюдают предписания врача. Отсюда можно сделать следующие выводы.
- Даже убедительные результаты клинического испытания могут служить для врача лишь гипотезой: как данный препарат может помочь конкретному больному. Следовательно, его назначение — эксперимент, в ходе которого эту гипотезу нужно проверить. Врач обязан наблюдать за всеми реакциями (ожидаемыми и неожиданными) и установить, связаны ли они с приемом данного лекарственного средства. Нужно помнить о том, что в клинических испытаниях часто выявляют не все эффекты препаратов. Не менее половины из них (как лечебных, так и побочных) впоследствии обнаруживают практикующие врачи.
- Если у больного не возник ожидаемый эффект, это не всегда говорит о бесполезности самого лекарственного средства. Причин снижения эффективности много: неверный диагноз, нерегулярный прием препарата, неправильный выбор дозы и кратности приема, сопутствующие заболевания, лекарственные взаимодействия, генетические и средовые факторы, влияющие на течение болезни или на действие препарата. Не нужно забывать и о том, что больной может одновременно лечиться у другого врача. Никогда нельзя приписывать улучшение только проводимому лечению, каким бы эффективным и безвредным оно ни казалось, а ухудшение — только естественному течению болезни. Это особенно сложно, если побочный эффект сходен с типичным проявлением данного заболевания (например, внезапная смерть при приеме антиаритмических средств). С другой стороны, если побочные эффекты и не возникли у данного больного, они вполне вероятны у других. Врачи, которые при назначении препаратов опираются только на собственный опыт, подвергают больных непростительному риску. Например, если врач никогда не сталкивался с апластической анемией, возникшей при приеме хлорамфеникола, это еще не означает, что такой побочный эффект не встречается. Назначая препарат, нужно руководствоваться официальными показаниями и противопоказаниями.
- Рациональное лечение основано на критическом анализе результатов клинических испытаний. Их проводят на больших группах людей, однако научный подход не менее важен и в лечении конкретного больного. Так, можно провести рандомизированное контролируемое испытание у больного со стабильной симптоматикой. При этом сравнивают препарат, эффективность которого не известна, с плацебо или другим препаратом; критерии эффективности выбирают индивидуально. Результаты такого испытания верны только для конкретного больного и только на данный момент времени (Guyatt et al., 1986).
Индивидуальный подход к медикаментозному лечению[править | править код]
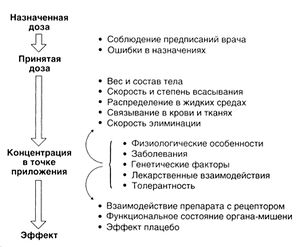
Как уже говорилось, научный подход к терапии не сводится лишь к испытаниям новых лекарственных средств у животных и добровольцев — он столь же важен и в индивидуальном подборе схемы лечения. Все врачи признают, что больные совершенно по-разному реагируют на одно и то же лечебное вмешательство. Сегодня удалось раскрыть важнейшие причины таких различий (рис. 3.1). Основные закономерности, лежащие в основе этих различий, обсуждаются также в гл. 1 и 2. Ниже мы рассмотрим, как преодолеть подобные трудности на практике (см. также Приложение II).
Особенности фармакокинетики[править | править код]
При выборе дозы препарата и кратности введения нужно учитывать, что его фармакокинетика может отличаться у разных больных и даже у одного и того же больного в разное время. Этот разброс может быть значительным, и с ним, по-видимому, связано не менее половины индивидуальных различий эффекта некоторых препаратов. Важную роль здесь играют особенности самого лекарственного средства и основной путь его элиминации. Так, фармакокинетика препаратов, выводимых в неизмененном виде с мочой, мало отличается у больных со сходным состоянием почек, а тех, которые подвергаются метаболизму, — наоборот. Если скорость метаболизма препарата (в том числе при первом прохождении через печень) высока, то у разных людей заметно отличается его биодоступность, а если низка — то скорость элиминации. В испытаниях у однояйцовых и разноя йцовых близнецов показано, что скорость метаболизма зависит в основном от генетических факторов (Penno and Vesell, 1983). Фармакокинетика многих препаратов определяется главным образом состоянием органов, отвечающих за их элиминацию. Так, клиренс дигоксина и гентамицина зависит от СКФ, а лидокаина и пропранолола — от скорости печеночного кровотока. Патология почек или печени ведет к нарушению элиминации препаратов, при этом возрастает и индивидуальный разброс других фармакокинетических параметров. В таких случаях для подбора дозы из-меряют сывороточную концентрацию препарата. Важно учитывать, что вследствие изменения чувствительности органов-мишеней (например, ЦНС) терапевтический диапазон может меняться у пожилых, а также у больных с патологией печени или почек.
Не стоит выполнять то или иное исследование только потому, что оно существует, — их гораздо больше, чем обычно требуется. Измерять сывороточную концентрацию лекарственных средств рекомендуют при наличии четких критериев. 1. Доказана связь между сывороточной концентрацией препарата и его лечебным (побочным) эффектом. 2. Фармакокинетика препарата значительно отличается у разных больных (и почти не меняется у одного и того же больного). В противном случае сывороточную концентрацию препарата можно довольно точно рассчитать, зная его дозу. 3. Трудно отслеживать лечебные и побочные эффекты препарата. Некоторые реакции можно оценить клинически (например, изменения АД или свертываемости крови), другие же контролировать гораздо сложнее. Так, действие лития при маниакально-депрессивном психозе часто наступает не сразу. Даже небольшое превышение дозы некоторых препаратов чревато опасными побочными эффектами (например, аритмии при приеме сердечных гликозидов, эпилептические припадки при приеме теофиллина); это касается и множества препаратов, используемых в химиотерапии злокачественных новообразований. Побочные эффекты других (например, антиаритмических средств) сходны с проявлениями самого заболевания. Многие препараты (например, противосудорожные и антиаритми-ческие средства) назначают для предупреждения преходящих, но угрожающих жизни проявлений заболевания. Во всех этих случаях при подборе дозы лучше ориентироваться на сывороточную концентрацию препарата. 4. Лекарственное средство имеет узкий терапевтический диапазон (см. ниже). В остальных случаях можно назначить дозу, которая заметно выше терапевтической (так обычно назначают пенициллины). Однако при подборе дозы препаратов с узким терапевтическим диапазоном (например, теофиллина) лучше ориентироваться на сывороточную концентрацию. Итак, ее измерение оправдано только при наличии перечисленных критериев. Кроме того, иногда оно помогает подтвердить нерегулярный прием препарата (возможная причина неэффективности лечения) или выявить больных с редкими особенностями элиминации лекарственных средств.
Измерение сывороточной концентрации с целью подбора дозы — один из примеров использования косвенных показателей взамен клинических. Можно применять косвенные показатели и с другими целями, например обосновать необходимость назначения другого препарата. Измерение сывороточной концентрации и наблюдение за реакцией на лекарственное средство часто помогают выявить возможные причины неэффективности лечения (подробнее см. гл. 1 и Приложение II).
Особенности фармакодинамики[править | править код]
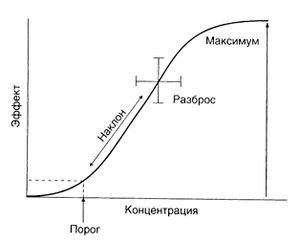
Больные могут по-разному реагировать на один и тот же препарат даже в одинаковой сывороточной концентрации; это обусловлено прежде всего индивидуальными особенностями фармакодинамики. Даже в упрощенных системах in vitro зависимость между концентрацией препарата и величиной эффекта может быть сложной (гл. 2). Как правило, она описывается кривой S-образной формы; кроме того, эта кривая может быть вогнутой или выпуклой, представлять собой прямую линию, иметь любой другой вид. Форма кривой может искажаться, если измеряемая реакция складывается из нескольких составляющих (например, изменения АД — из прямых влияний на сердце и сосуды, центральных и рефлекторных влияний). Однако в этом случае ее часто можно разложить на более простые компоненты. Полученные кривые концентрация—эффект независимо от формы характеризуются 4 показателями: порогом, наклоном, максимумом и разбросом. На рис. 3.2 эти показатели приведены на примере типичной S-образной кривой.
Описание к рис. 3.2. Кривая концентрация—эффект (приведена типичная S-образная кривая в полулогарифмических координатах: по горизонтальной оси отложен логарифм концентрации). Показаны 4 основных параметра, характеризующих такие кривые. В данном случае приведена кривая зависимости эффекта от сывороточной концентрации; сходный вид имеют и кривые зависимости эффекта от принятой дозы, или кривые доза—эффект.
Порог. Этот показатель, характеризующий расположение кривой концентрация—эффект вдоль горизонтальной оси, служит мерой активности лекарственного средства. Часто говорят о пороговой дозе, но точнее говорить о пороговой сывороточной концентрации препарата — это ближе к условиям in vitro и не зависит от индивидуальных особенностей фармакокинетики. Безусловно, активность и доза взаимосвязаны, но сама по себе активность имеет небольшую клиническую значимость, если требуемая доза безопасна. Нельзя утверждать, что чем активнее препарат, тем он лучше. Исключение составляют лекарственные средства системного действия, наносимые на кожу — они должны обладать высокой активностью, так как способность кожи к всасыванию ограничена.
Максимум. Максимальный уровень кривой концентрация—эффект соответствует наибольшей реакции, возможной при приеме данного препарата. Этот показатель называют также эффективностью (гл. 2). Он зависит от свойств лекарственного средства и рецепторно-эффекторной системы, на которую оно действует (гл. 2). На практике истинный максимальный эффект часто недостижим, так как повышение дозы ограничивается риском побочных эффектов. Очевидно, что эффективность препарата намного важнее, чем его активность. Эти показатели никак не связаны между собой, и путать их нельзя. Например, некоторые тиазидные диуретики обладают такой же или даже большей активностью, чем петлевой диуретик фуросемид, но его эффективность гораздо выше.
Наклон. Наклон кривой концентрация—эффект отражает механизм действия лекарственного средства (форма кривой описывает связывание препарата с рецепторами; гл. 2). От наклона кривой зависит тот диапазон доз, в пределах которого препарат оказывает эффект. В остальном этот показатель представляет скорее теоретический интерес.
Разброс. Один и тот же препарат (либо сходные препараты с учетом поправки на различия в активности, эффективности и наклоне кривой концентрация—эффект) в одинаковой концентрации действует на больных по-разному. Эффект может меняться даже у одного больного, поэтому кривая концентрация—эффект справедлива только для конкретного больного на данный момент времени либо является усредненной. Из рис. 3.2 видно, что у разных людей при одинаковой концентрации препарата эффект отличается, и наоборот — для достижения одинакового эффекта требуются разные концентрации.
Предпринимались попытки измерить чувствительность к препаратам, действующим на специфические рецепторы, и отчасти удалось понять, от чего она зависит. Так, чувствительность к β-адреностимуляторам может меняться при некоторых заболеваниях (например, тиреотоксикозе, сердечной недостаточности), предшествующем приеме β-адреностимуляторов или β-адреноблокаторов, способных влиять на плотность β-адренорецепторов или на рецепторно-эффекторные системы (Iaccarino et al., 1999; гл. 10). Все рецепторы подвержены влиянию внешних и внутренних факторов.
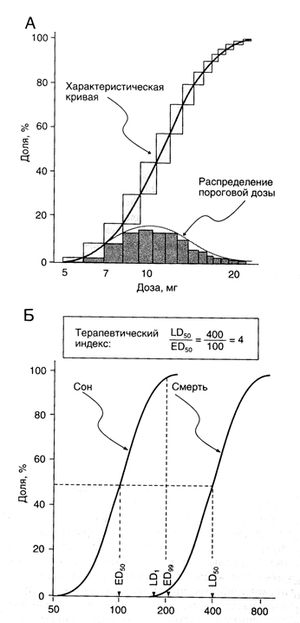
Характеристическая кривая. Наименьшая доза препарата, вызывающая у данного человека определенную реакцию, называется пороговой дозой. У разных людей пороговая доза будет разной. Если отложить на горизонтальной оси логарифм дозы, а на вертикальной — долю людей, для которых эта доза является пороговой, то получится кривая нормального распределения (говорят, что распределение пороговой дозы логарифмически-нормально, рис. 3.3, А, нижний графики Сложив доли, расположенные на данной кривой слева от каждой дозы, можно получить суммарную долю людей, для которых эта доза превышает пороговую, то есть тех, у кого эта доза вызовет реакцию. Так получается характеристическая кривая(рис. 3.3, А, верхний график). Своей S-образной формой она напоминает кривую доза—эффект (либо концентрация-эффект; рис. 3.2), однако смысл ее несколько иной. Если кривая доза—эффект показывает, как с ростом дозы растет величина реакции, то характеристическая кривая показывает, как с ростом дозы растет доля людей, у которых возникает реакция. Наклон характеристической кривой отражает разброс чувствительности к препарату; чем круче кривая, тем меньше разброс.
Описание к рис. 3.3. А. Распределение пороговой дозы. В эксперименте участвовало 100 добровольцев, для каждого из них определяли пороговую дозу. Доли лиц с разными пороговыми дозами отложены на нижнем графике, они образуют логарифмически-нор-мальное распределение. Последовательное суммирование этих долей дает характеристическую кривую (верхний график); она показывает, какая доля людей реагирует на ту или иную дозу. Б. Характеристические кривые. Животным вводили снотворное в разных дозах и оценивали реакцию. Терапевтический индекс (отношение ЩЦ к ED»,) показывает широту терапевтического действия препарата (подробнее в тексте).
Доза, вызывающая некий эффекту 50%людей, называется средней эффективной дозой — ED50 (рис. 3.3, Б). В доклинических исследованиях у животных определяют среднюю летальную дозу — LD50. Терапевтический индекс — отношение LD50 к ED50 — отражает избирательность действия препарата. В клинических испытаниях дозу препарата (а лучше концентрацию), вызывающую у больных изучаемой группы побочный эффект, можно сравнивать с дозой, вызывающей лечебный эффект — это клинический терапевтический индекс. У разных людей фармакодинамические параметры могут различаться в широких пределах, а потому доза (или концентрация) препарата, вызывающая лечебный эффект у большинства больных, как правило, превышает дозу, вызывающую у некоторых больных побочный эффект (хотя у конкретного больного терапевтический индекс может быть большим). Характеристические кривые для терапевтического и побочного эффектов могут выглядеть по-разному, создавая дополнительные сложности в вычислении терапевтического индекса. Наконец, любой препарат оказывает несколько эффектов, и терапевтический индекс для них будет разным. Так, для подавления кашля у 50% людей требуется гораздо меньшая доза кодеина, чем для обезболивания, а потому его безопасность, избирательность и терапевтический индекс гораздо выше при использовании в качестве противокашлевого препарата, чем в качестве анальгетика.
Прочие факторы[править | править код]
Помимо индивидуальных особенностей фармакокинетики и фармакодинамики, играющих основную роль в подборе схемы лечения, нужно учитывать и другие факторы, перечисленные на рис. 3.1; некоторые из них обсуждаются также в гл. 1 и Приложении 11.
Возраст[править | править код]
Как правило, в клинических испытаниях участвуют добровольцы молодого и среднего возраста. Однако в каждой возрастной группе фармакокинетика и фармакодинамика препаратов неодинакова. Следовательно, дозы и кратность приема у молодых и пожилых больных могут сильно отличаться.
Дети. Почти все препараты, используемые в педиатрии, у детей не испытывались, а выпускаемые лекарственные формы часто для них неприемлемы. Таким образом, разработка новых и рациональное использование уже применяемых препаратов у детей требуют комплексного подхода, учитывающего особенности фармакокинетики, фармакодинамики и лекарственных форм. Пока не существует общепринятых методик пересчета доз, применяемых у взрослых, на те дозы, которые безопасны и эффективны для детей. Если фирма-производитель не предоставляет информацию о дозах и кратности приема у детей, то расчет дозы, особенно для детей грудного возраста (например, путем простого пересчета доз на килограмм веса или единицу площади поверхности тела), сопряжен с высоким риском. У новорожденных (особенно у недоношенных), как правило, снижен суммарный (почечный и печеночный) клиренс лекарственных средств. Некоторые осложнения медикаментозного лечения у новорожденных обусловлены физиологическими особенностями. Так, причина серого синдрома в том, что не весь хлорамфеникол конъюгируется с глюкуроновой кислотой. Билирубиновая энцефалопатия при приеме сульфаниламидов возникает из-за того, что они вытесняют непрямой билирубин из связи с альбумином; важную роль при этом играют усиление продукции билирубина из-за разрушения фетальных эритроцитов, снижение его конъюгации, ацидоз, повышение проницаемости гематоэнцефалического барьера. Тщательные исследования фармакокинетики у новорожденных (в том числе многократное измерение сывороточной концентрации препаратов) значительно расширили наши знания в этой области и позволили повысить безопасность лечения этой группы больных.
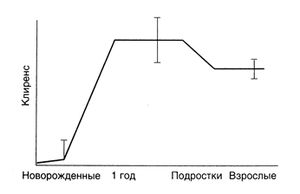
На протяжении первого года жизни механизмы, отвечающие за метаболизм лекарственных средств, формируются по-разному; на этот процесс может влиять индукция микросомальных ферментов печени (например, при приеме фенобарбитала). Онтогенез большинства изоферментов цитохрома Р450 пока мало изучен. Испытания с использованием кофеина (в качестве субстрата) показали, как меняется с возрастом активность изофермента 1А2 (рис. 3.4) (Lambert et al., 1986). В целом, та же закономерность верна и для многих других препаратов (например, теофиллина, противосудорожных средств). У грудных детей их клиренс очень мал (несмотря на заметные индивидуальные различия), но к концу первого года жизни он становится выше, чем у взрослых (в пересчете на вес), а в период полового созревания начинает снижаться (у девочек раньше, чем у мальчиков) до уровня, присущего взрослым. Механизмы, лежащие в основе этих изменений, не известны, и, возможно, остальные пути выведения препаратов формируются по-другому (deWildt et al.,1999). У новорожденных (особенно недоношенных) и подростков разброс фармакокинетических параметров максимален (как у разных больных, так и у одного и того же больного в разное время). Следовательно, для эффективного и безопасного лечения нужно тщательно подбирать дозу, из-за чего часто приходится измерять сывороточную концентрацию препаратов с узким терапевтическим диапазоном. У новорожденного фармакокинетические параметры могут очень сильно измениться даже за 7 дней, а если назначить 14-летнему ребенку препарат в той же дозе (в пересчете на килограмм веса), которую он принимал в 10 лет, возможна передозировка.
Из-за особенностей фармакодинамики у детей возможны неожиданные реакции на лекарственные средства. Например, у взрослых Н-блокаторы и барбитураты обычно оказывают угнетающее, а у многих детей — возбуждающее действие на ЦНС. Важной проблемой является влияние препаратов на физическое и умственное развитие, особенно при длительном лечении. Так, длительный прием фенобарбитала может значительно сказываться на поведении и обучаемости детей. Тетрациклин откладывается в формирующихся зубах, вызывая стойкое изменение их окраски. При длительном приеме глюкокортикоидов у детей возникают те же побочные эффекты, что у взрослых, но кроме того, возможно замедление роста. Однако некоторые препараты реже вызывают побочные эффекты у детей, чем у взрослых. Например, риск гепатотоксичности при приеме вальпроевой кислоты у детей выше, а при передозировке изониазида и, вероятно, парацетамола — гораздо ниже.
В 1997 г. Конгресс принял Акт о модернизации ФДА, один из разделов которого посвящен необходимости проведения клинических испытаний у детей. Согласно этому акту и принятому на его основании закону, ФДА может послать фирме-производителю письменный запрос на проведение таких испытаний. В том случае, если они проведены с точным соблюдением требований ФДА, фирма-производитель поощряется продлением срока действия исключительных патентных прав на 6 мес. В ходе разработки препарата нужно согласовать с ФДА план клинических испытаний у детей; конкретные требования зависят от показаний к применению. Если у детей данное заболевание протекает так же, как и у взрослых, и, судя по всему, реакция на данный препарат с возрастом не меняется, то можно использовать данные по эффективности, полученные в испытаниях у взрослых (при условии сходного режима приема). Таким образом, сведения об особенностях фармакокинетики и о безопасности препарата у детей обязательны, а сведения о его эффективности могут быть основаны на данных, полученных у взрослых. Этот новый закон позволил значительно увеличить число клинических испытаний у детей, и сейчас подобные законы обсуждаются в Европе (Conroy et al., 2000).
Лекарственные формы старых и новых препаратов часто не подходят для использования у детей. Из-за токсичности некоторых растворителей (например, растворителя сульфаниламида диэтиленгликоля) в 1938 г. был принят Закон о контроле над производством пищевых и лекарственных средств. Тем не менее в 1980-х гг. появились сообщения о возникновении так называемого гаспинг-синдрома у новорожденных после введения высоких доз препаратов, содержащих в качестве консерванта бензиновый спирт. Концентрация препаратов для в/в введения часто слишком высока, чтобы точно отмерить крошечные дозы для новорожденных. Препараты для приема внутрь нередко неприятны на вкус, а вкусовые добавки и красители могут вызвать побочные эффекты. Разные лекарственные формы одного препарата могут обладать сходной биодоступностью, но отличаться по вкусу и внешнему виду, что для детей не менее важно.
Пожилые. По мере старения меняются фармакокинетика и фармакодинамика препаратов, а потому увеличивается индивидуальный разброс доз. Изменения состава тела, функции печени и почек отражаются на фармакокинетике. Из-за снижения безжировой массы тела, содержания альбумина в сыворотке, общего содержания воды, повышения доли жировой ткани меняется распределение препаратов (в соответствии с их жирорастворимостью и степенью связывания с белками). Как следствие, увеличивается объем распределения жирорастворимых лекарственных средств. Функция почек снижается примерно вдвое, хотя и с разной скоростью. В разной степени уменьшаются печеночный кровоток и активность некоторых ферментов, катализирующих реакции метаболизма лекарственных средств. Как правило, уменьшается активность изоферментов цитохрома Р450, в то время как механизмы конъюгации почти не страдают. По этим причинам Т1/2 многих препаратов у пожилых часто возрастает, а клиренс уменьшается.
Изменения фармакодинамики не менее важны. Так, у пожилых сильнее выражен эффект препаратов, оказывающих угнетающее влияние на ЦНС. Из-за физиологических изменений, в том числе пониженной надежности регуляторных систем, риск побочных эффектов может возрастать, даже если доза назначена с учетом возрастных особенностей фармакокинетики. Примерами могут служить артериальная гипотония при приеме психотропных средств и кровоточивость при приеме антикоагулянтов.
Доля пожилых среди населения постоянно растет, к тому же обычно они страдают несколькими заболеваниями, а потому на них приходится основная доля всех потребляемых лекарственных средств (назначаемых врачом и безрецептурных). Из-за этого медикаментозное лечение пожилых чревато тяжелыми побочными эффектами и часто сопровождается лекарственными взаимодействиями. Следовательно, препараты им нужно назначать только при наличии абсолютных показаний и в минимальных эффективных дозах. Следует заранее выбрать критерии эффективности, при необходимости измерять сывороточную концентрацию, постоянно следить за тем, какие препараты получает больной, и быстро отменять те из них, которые не дают желаемого эффекта. С другой стороны, эти сложности не должны служить причиной отказа от нужных назначений. Клинические испытания показывают, что лечение хронических заболеваний (например, артериальной гипертонии, ИБС) у пожилых не менее, а зачастую даже более эффективно, чем у молодых людей (LaRosa et al., 1999). Более того, рациональное медикаментозное лечение помогает замедлить прогрессирование либо привести к обратному развитию некоторых хронических заболеваний у пожилых (например, остео-пороза, аденомы предстательной железы).
Пол[править | править код]
Полагают, что фармакокинетика и фармакодинамика препаратов может отличаться у мужчин и женщин, однако до недавнего времени в клинических испытаниях участвовали только мужчины, так как правила ФДА запрещали включать в них женщин детородного возраста. В 1990-х гг. эти правила были пересмотрены, и женщинам разрешили участвовать во всех фазах клинических испытаний. К моменту получения разрешения на выпуск нового препарата должно быть достаточно данных, чтобы оценить его фармакокинетику, фармакодинамику и безопасность как у мужчин, так и у женщин (Sherman et al., 1995; Harris etal., 1995).
Лекарственные взаимодействия[править | править код]
Для достижения желаемого эффекта или лечения сопутствующих заболеваний часто приходится назначать несколько препаратов, выбор которых должен быть обоснованным. Монотерапия помогает снизить АД лишь у немногих больных артериальной гипертонией. При сердечной недостаточности часто сочетают диуретик с вазодилататором (или сердечным гликозидом), чтобы повысить сердечный выброс и устранить отеки. При злокачественных новообразованиях, как правило, проводят полихимиотерапию, а для лечения некоторых инфекционных заболеваний требуется несколько антибиотиков. Приведенные примеры показывают, что при использовании сочетания препаратов эффективность лечения часто возрастает (например, замедляется размножение опухолевых клеток или микроорганизмов, устойчивых к действию каждого препарата в отдельности). Назначая одновременно несколько препаратов, врач должен решить, вероятны ли у данного больного лекарственные взаимодействия, и если да, то как извлечь из них пользу и избежать возможных осложнений.
Под лекарственным взаимодействием понимают влияние одного препарата на эффекты другого при одновременном применении. В результате действие одного из лекарственных средств (или обоих) ослабляется или усиливается либо возникает новый эффект, не свойственный каждому из них в отдельности.
В обзорах данных, полученных in vitro, на животных и при анализе отдельных сообщений, частота лекарственных взаимодействий нередко оказывается выше, чем в клинической практике. Из-за этого не все признают важность таких взаимодействий, однако многие лекарственные взаимодействия на самом деле имеют большое значение, и о них необходимо знать. Частота клинически значимых лекарственных взаимодействий точно не известна. По имеющимся оценкам, она составляет 3—5% при приеме нескольких препаратов и до 20% — при приеме 10—20 препаратов. В то же время госпитализированные больные обычно получают не менее 6 препаратов одновременно. В связи с недавними успехами комбинированной терапии ВИЧ (некоторые из входящих в нее препаратов влияют на активность микросомальных ферментов) интерес к лекарственным взаимодействиям возрос. Для выявления лекарственных взаимодействий нужно хорошо знать все свойства назначаемых препаратов, тщательно наблюдать за больным, приписывать необычные реакции действию препаратов, а не естественному течению болезни. Чтобы облегчить задачу врача, в фармакологический отдел больницы или поликлиники можно установить автоматизированные системы, регистрирующие все назначения. Однако эти данные будут бесполезны, если врач не осведомлен о возможных механизмах лекарственных взаимодействий; их нужно учесть еще на этапе разработки плана лечения. Взаимодействия между отдельными препаратами обсуждаются в соответствующих главах.
Обычно выделяют фармакокинетические (один препарат влияет на всасывание, распределение и элиминацию другого) и фармакодинамические взаимодействия (например, конкуренция за специфические рецепторы). Самые опасные взаимодействия встречаются при приеме препаратов с узким терапевтическим диапазоном, вызывающих тяжелые побочные эффекты; даже незначительные изменения их сывороточной концентрации сопряжены с высоким риском. Кроме того, важность лекарственных взаимодействий возрастает при тяжелых и угрожающих жизни заболеваниях.
Фармакокинетические взаимодействия. Препараты могут взаимодействовать на этапах всасывания, распределения, метаболизма, выведения — в результате повышается или снижается их концентрация в точке приложения. Из-за индивидуальных различий в фармакокинетике степень таких взаимодействий можно предсказать не всегда, но иногда она бывает весьма значительной.
Физико-химические взаимодействия лекарственных средств могут происходить еще до их попадания в кровь. Так, при смешивании некоторых препаратов для в/в введения образуется нерастворимый осадок, который не всегда замечают. В кишечнике некоторые препараты образуют комплексы с ионами металлов или адсорбируются ионообменными смолами. Например, Са2+ и другие ионы металлов, входящие в состав антацидных средств, образуют комплексные соединения с тетрациклином, которые не всасываются в ЖКТ. За счет адсорбции холестирамин препятствует всасыванию препаратов Т4, сердечных гликозидов, варфарина, глюкокортикоидов и, возможно, других препаратов. При приеме средств, влияющих на моторику желудка, может меняться скорость, а иногда и степень всасывания, но на практике это обычно не играет существенной роли. Лекарственные взаимодействия в просвете кишечника могут быть сложными и непрямыми. Так, под действием антибиотиков в ЖКТ уменьшается число бактерий, синтезирующих витамин К, а потому усиливается эффект непрямых антикоагулянтов, конкурирующих с этим витамином. Если же вместе с препаратом, который метаболизируется бактериями ЖКТ, назначить антибиотики, его всасывание может усилиться; это показано, например, для дигоксина (Lindenbaum et al., 1981).
Недавно обнаружено, что многие препараты служат субстратами для различных неизбирательных транспортных систем, присутствующих во многих клетках. Из них наиболее изучен Р-гликопротеид, но открыты и многие другие (например, переносчики органических анионов). Р-гликопротеид содержится в эпителии кишечника, почечных канальцев и желчных капилляров, эндотелии капилляров головного мозга (в составе гемато-энцефалического барьера). Он переносит лекарственные средства из энтероцитов в просвет кишечника (и тем самым препятствует их всасыванию), выводит лекарственные средства из ЦНС, транспортирует их в просвет почечных канальцев и желчных капилляров, усиливая элиминацию. Следовательно, ингибирование Р-гликопротеида отражается на всасывании, распределении и элиминации препаратов. Циклоспорин, хинидин, верапамил, итраконазол и кларитромицин могут ингибировать Р-гликопротеид, а рифампицин, по-видимому, индуцирует. Любопытно, что ингибиторы и индукторы изофермента IILA4 цитохрома Р450, вероятно, часто (хотя и не всегда) действуют подобным же образом и на Р-гликопротеид (Kim et al., 1999). За последние 10 лет достигнуты большие успехи в изучении изоферментов цитохрома Р450, а в следующем десятилетии, возможно, удастся столь же подробно изучить Р-гликопротеид и подобные ему транспортные системы.
Многие кислые препараты в значительной степени связываются с альбумином плазмы, а основные — с кислым а,-гликопротеидом. Как правило, только свободный препарат способен оказывать фармакологические эффекты и распределяться в тканях. Следовательно, вытеснение препаратов из участков связывания может отражаться на их фармакологическом действии; однако такие взаимодействия редко бывают клинически значимыми. Вытесненный препарат быстро распределяется в тканях, и чем больше объем его распределения, тем в меньшей степени возрастает сывороточная концентрация свободного препарата. Кроме того, значительная его часть подвергается метаболизму и экскреции. В итоге уровень свободного препарата постепенно снижается до исходного, и результат подобного взаимодействия часто остается незамеченным. Тем не менее доля свободного препарата по отношению к его общему количеству (свободного и связанного с белками плазмы) меняется, что следует учитывать при измерении общей сывороточной концентрации.
Некоторые препараты достигают места действия с помощью белков-переносчиков. Например, гипотензивные средства гуанетидин и гуанадрел переносятся в адренергические нейроны благодаря активному транспорту биогенных аминов. Трицик-лические антидепрессанты и некоторые адреностимуляторы препятствуют захвату этих препаратов адренергическими нейронами, тем самым подавляя их симпатолитическое действие, и ослабляют гипотензивный эффект. Р-гликопротеид и другие переносчики удаляют многие лекарственные средства из клеток-мишеней. Например, неэффективность химиотерапии злокачественных новообразований может объясняться выведением препарата из опухолевых клеток посредством Р-гликопротеида. Предпринимались попытки ингибировать Р-гликопротеид с целью повышения эффективности химиотерапии; это один из примеров целенаправленного использования лекарственных взаимодействий (Krishan et al., 1997).
При лекарственных взаимодействиях уровни препаратов могут возрастать или уменьшаться за счет индукции или торможения их метаболизма (гл. 1). Лекарственные средства могут взаимодействовать не только между собой, но и с пищевыми продуктами (грейпфрут — ингибитор изофермента IIIА4), фитопрепаратами (зверобой продырявленный — индуктор изоферментов IIIA; Fugh-Berman, 2000), другими веществами (этиловый спирт и другие органические растворители — индукторы изофермента IIE1, а табачный дым, полихлорзамещенные дифенилы — индукторы изофермента 1А2). Последствия индукции или ингибирования ферментов особенно заметны при приеме внутрь, так как после всасывания препарат попадает через воротную вену в печень и только потом — в системный кровоток. Кроме того, значительное количество изофермента IIIА4 содержится в слизистой кишечника, поэтому некоторые лекарственные средства могут подвергаться метаболизму еще до первого прохождения через печень. Следовательно, доля препарата, разрушаемого до поступления в системный кровоток, определяется активностью изоферментов цитохрома Р450, даже если его суммарный клиренс (например, пропранолола) в основном зависит от печеночного кровотока. Индукторы этих изоферментов влияют на метаболизм хинидина, глюкокортикоидов, непрямых антикоагулянтов, пероральных контрацептивов с низким содержанием эстрогенов, теофиллина, мексилетина, метадона, ингибиторов протеазы ВИЧ, некоторых β-адреноблокаторов. Знание путей метаболизма препарата и молекулярных механизмов индукции изоферментов цитохрома Р450 важно при планировании клинических испытаний, посвященных лекарственным взаимодействиям (особенности метаболизма обычно определяют на доклиническом этапе) (Yuan et al., 1999). Если in vitro обнаружено, что данный препарат метаболизируется изоферментом 1ИА4, то испытания нужно проводить именно с теми препаратами, которые ингибируют (например, кетоконазол) или индуцируют (например, рифампицин) этот изофермент. Уже разработаны подобные методики выявления лекарственных взаимодействий на уровне различных изоферментов цитохрома Р450 (с применением мидазолама или эритромицина для изоферментов подсемейства IIIA, декстрометорфана для изофермента IID6). В качестве примера, доказывающего необходимость проведения таких испытаний на ранних стадиях разработки препаратов, можно привести аритмии при одновременном приеме терфенадина (снят с производства) и кетоконазола. Кетоконазол замедляет превращение терфенадина в активный метаболит (влияя на активность изофермента 1IIA4), из-за чего возрастает концентрация токсичного исходного вещества (Peck, 1993).
Один препарат может подавлять почечную экскрецию другого, взаимодействуя на уровне систем активного транспорта. Многие из известных взаимодействий связаны с системой транспорта органических анионов; например, пробенецид замедляет выведение пенициллинов, что приводит к повышению их сывороточной концентрации и удлинению Т1/2. Это пример полезного взаимодействия. Посредством тех же механизмов пробенецид, салицилаты и фенилбутазон подавляют почечную элиминацию метотрексата, но в данном случае возрастает риск его побочных эффектов. К взаимодействиям основных препаратов на уровне транспортных систем относится замедление экскреции прокаинамида при сочетании с циметидином и амиодароном. Действуя на Р-гликопротеид эпителия почечных канальцев, хинидин, верапамил и амиодарон тормозят элиминацию дигоксина. Наконец, при приеме препаратов, влияющих на реабсорбцию натрия в проксимальных канальцах, может нарушаться выведение лития. При приеме диуретиков (вызывают гиповолемию) и НПВС (усиливают реабсорбцию натрия в проксимальных канальцах) снижается клиренс лития и возрастает его сывороточная концентрация.
Фармакодинамические взаимодействия. При таких взаимодействиях разные лекарственные вещества усиливают или ослабляют эффекты друг друга, действуя на одни и те же рецепторы либо на разные рецепторы в пределах одного органа; возможны и другие, часто сложные и непрямые механизмы фармакодинамических взаимодействий. Подобные взаимодействия описываются во многих главах этой книги. Врачи часто забывают, что почти все препараты оказывают не один, а несколько эффектов. Например, фенотиазины обладают выраженным а-адреноблокирующим действием, а многие Н1-блокаторы и трициклические антидепрессанты — заметным М-холиноблокирующим действием. Эти «второстепенные» эффекты могут стать причиной фармакодинамических взаимодействий.
Механизмы многих фармакодинамических взаимодействий изучены плохо. Так, галогензамешенные углеводороды, в том числе многие ингаляционные анестетики, повышают риск аритмогенного действия катехоламинов; про механизмы этого эффекта известно лишь то, что галогензамешенные углеводороды могут влиять на сопряжение адренорецепторов с системами внутриклеточной передачи сигнала. Хорошо известно, что прием петидина одновременно с ингибиторами МАО может приводить к эпилептическим припадкам и гипертермии, но причины этого также остаются неясными; возможно, происходит чрезмерное выделение некоего возбуждающего медиатора.
Один препарат может усиливать или ослаблять эффект другого за счет влияния на состав внутренней среды. Хорошо известный пример — гликозидная интоксикация при гипокалие-мии, вызванной приемом диуретиков.
Клиническая значимость лекарственных взаимодействий. Лекарственные взаимодействия — один из многих факторов, от которых зависит реакция больного на препарат и о которых нужно помнить при любых неожиданных эффектах. Основная задача врача — выявить такое взаимодействие и оценить его степень. Многие больные принимают безрецептурные препараты, фитопрепараты, а также препараты, назначенные другим врачом либо другому больному; все это важно выяснять при сборе анамнеза. Не следует без необходимости резко менять дозу и кратность приема, но нужно сразу отказаться от бесполезных препаратов. Лекарственные взаимодействия часто не препятствуют эффективному лечению, если своевременно скорректировать схему приема препаратов.
Комбинированные препараты[править | править код]
При одновременном назначении нескольких препаратов врачу трудно подобрать оптимальную дозу каждого из них, но еще сложнее добиться того, чтобы больной в точности соблюдал все предписания. Именно с этой целью сегодня выпускается множество комбинированных препаратов. Их применение оправдано только в том случае, если соотношение доз подходит для данного больного.
Любой комбинированный препарат в США считается «новым» и должен получить разрешение ФДА, даже если его компоненты уже используются по отдельности. Комбинированный препарат должен отвечать некоторым требованиям. При одновременном приеме его компоненты должны обладать большим лечебным эффектом, чем каждый из них в отдельности, либо таким же лечебным эффектом при меньшей частоте побочных эффектов (например, многие комбинированные гипотензивные средства). Кроме того, один препарат может быть предназначен для того, чтобы снижать риск побочных эффектов другого (например, диуретик, вызывающий почечные потери калия, сочетают с калийсберегающим диуретиком).
Эффект плацебо[править | править код]
Конечный результат медикаментозного лечения складывается из фармакологического действия препарата и неспецифического эффекта плацебо, обусловленного самим процессом лечения. Эффект плацебо выявляют при приеме неактивного вещества, но на самом деле он возникает при приеме любого препарата.
Полагают, что основой эффекта плацебо служат взаимоотношения врача и больного, значимость лечения для больного, обстановка в медицинском учреждении. Степень эффекта плацебо сильно отличается у разных людей, а также у одного человека в разное время. Обычно он проявляется изменениями настроения, симптомами, связанными с влияниями вегетативных нервов и ЦНС; они могут быть полезными либо нежелательными. В одних случаях эффект плацебо нежелателен, в других, напротив, может заметно дополнять фармакологическое действие препарата.
Плацебо — обязательный «участник» многих контролируемых клинических испытаний. В повседневной же клинической практике его роль невелика. Доверительные отношения с больным дают больше пользы, чем назначение плацебо, а уменьшение или исчезновение симптомов после приема плацебо далеко не всегда доказывает их психогенную природу.
Толерантность[править | править код]
Толерантность может возникать ко многим препаратам, особенно к опиоидам, средствам, оказывающим угнетающее действие на ЦНС, нитратам. Толерантность может распространяться на сходные препараты, особенно если они действуют на одни те же рецепторы (перекрестная толерантность). Для поддержания должного эффекта в случае развития толерантности приходится увеличивать дозу. Степень толерантности к разным эффектам препарата часто неодинакова, из-за чего может снижаться терапевтический индекс. Однако иногда толерантность возникает к побочным эффектам, приводя к повышению терапевтического индекса препарата (например, постепенное уменьшение сонливости при приеме фенобарбитала в качестве противосудорожного средства).
Механизмы толерантности изучены мало. Одной из ее причин может быть индукция микросомальных ферментов печени. Другой пример фармакокинетической толерантности — устойчивость опухолевых клеток к противоопухолевым средствам, связанная с индукцией Р-гликопротеида. К опиоидам, барбитуратам, этанолу, нитратам возникает фармакодинамическая толерантность; механизмы ее различны (например, изменение плотности, сродства и функции соответствующих рецепторов). Причина толерантности к стимуляторам высвобождения гистамина и непрямым симпатомиметикам (последние повышают высвобождение норадреналина) — истощение запасов медиатора, хотя возможны и другие механизмы. Подробнее о толерантности см. гл. 24.
Генетические факторы[править | править код]
Количественные и качественные различия в чувствительности к препаратам в значительной степени обусловлены генетическими факторами. Основные законы генетики применимы и в отношении ферментов, катализирующих реакции метаболизма лекарственных средств, белков-переносчиков, рецепторов и других белков, от которых зависит фармакокинетика и фармакодинамика. Следовательно: 1) существуют разные аллели кодирующих их генов, 2) благодаря существованию нескольких аллелей один и тот же локус может отвечать за синтез разных вариантов белка, 3) некоторые аллели не содержат функциональных последовательностей, другие же заметно влияют на метаболизм лекарственных средств, 4) у разных групп населения встречаемость разных аллелей неодинакова, а значит, фармакокинетика и риск побочных эффектов данного препарата у них могут отличаться, 5) аллели, встречающиеся с частотой 1 % и более, расценивают как полиморфизм, а остальные — как редкие врожденные нарушения метаболизма.
С генетическими факторами связаны: 1) изменения клиренса лекарственных средств (у людей с замедленным метаболизмом данного препарата риск побочных эффектов выше), 2) нарушения образования активного метаболита из препарата-предшественника, 3) нарушения фармакодинамики (например, гемолитическая анемия, возникающая под действием ряда препаратов улиц с дефицитом Г-6-ФД), 4) идиосинкразические реакции, например апластическая анемия и гепатотоксичность.
Полиморфизм изоферментов цитохрома Р450 подробно изучен (Ingelman-Sundberg et al., 1999). Так, снижение активности изофермента IID6 (в разных группах людей встречается с частотой от 3 до 10%) приводит к замедлению метаболизма многих препаратов. У больных с низкой активностью изофермента I1D6 некоторые препараты в обычных дозах (например, трициклические антидепрессанты) могут вызывать побочные эффекты, а дозы других благодаря широкому терапевтическому диапазону (например, декстрометорфана) либо наличию нескольких путей метаболизма (например, пропранолола) менять не нужно.
В процессе разработки лекарственного средства для выявления полиморфизма ферментов, участвующих в его метаболизме, проводят исследования in vitro с образцами тканей человека или рекомбинантными изоферментами цитохрома Р450. Кроме того, после предварительного генотипирования препарат однократно дают людям с разными аллельными вариантами, а затем оценивают, насколько у них различается его метаболизм. Для внедрения фармакогенетики в клиническую практику нужно разработать методики выявления разных аллелей, которые можно было бы применять в обычной клинической лаборатории. Тогда врач сможет выбрать препарат и его дозу, зная особенности метаболизма у данного больного. Это позволит также снизить риск редких, но тяжелых побочных эффектов (например, токсического влияния на печень, встречающегося с частотой 1:5000), причиной которых служит полиморфизм ферментов, участвующих в метаболизме лекарственных средств.
Как подобрать схему лечения[править | править код]
Прежде всего врач должен решить, нуждается ли больной в медикаментозном лечении, а затем — какой препарат и в какой дозе ему назначить. Врач должен быть осведомлен о том, что разные больные по-разному реагируют на препараты, и знать причины этих различий. Лечение нужно назначать на основании современных данных с учетом тяжести и стадии заболевания, сопутствующей патологии, одновременного приема других препаратов, заранее выбирая объективные критерии эффективности и безопасности. Если не сделать этого до начала лечения, то оно, скорее всего, не даст эффекта, и будет длиться дольше, чем нужно, — пока не возникнут явные побочные эффекты.
Как правило, решающую роль при выборе лечения играет уверенность врача в точности диагноза и оценке стадии и тяжести заболевания, а значит, выбор косвенно зависит от имеющихся в его распоряжении диагностических методов. Нужно выбрать наиболее подходящий препарат, основываясь на последних рекомендациях, и по возможности снизить вероятность дорогостоящей медицинской помощи в будущем. При подборе дозы и кратности приема желательно учесть индивидуальные особенности фармакокинетики (см. выше, рис. 3.1, Приложение II). В последующем режим приема можно корректировать, измеряя сывороточную концентрацию препарата, однако в первую очередь нужно ориентироваться на клиническую эффективность и безопасность.
В начале главы мы уже говорили о том, что назначение любого препарата нужно расценивать как эксперимент, а потому почти все принципы проведения клинических испытаний применимы и к лечению конкретного больного. Крайне важно заранее выбрать цель лечения. В идеале с ней должны быть тесно связаны критерии эффективности (уменьшение размеров опухоли, уничтожение бактерий), однако это не всегда возможно (например, предупреждение сердечно-сосудистых осложнений артериальной гипертонии и сахарного диабета). В таких случаях нужно использовать косвенные показатели (например, снижение АД, уровня глюкозы или холестерина в плазме). Взаимосвязь косвенных показателей с прогнозом показана в клинических испытаниях либо предполагается. Тем не менее впоследствии иногда выясняется, что в действительности такой взаимосвязи не существует (это касается, например, таких критериев, как повышение переносимости физической нагрузки при сердечной недостаточности, устранение бессимптомных желудочковых аритмий, изменение числа лимфоцитов CD4 при ВИЧ; Fleming and DeMets, 1996).
В ходе лечения нужно периодически оценивать его полезность. Ее можно определить как разницу между положительным эффектом лечения и возможными последствиями его отсутствия, с одной стороны, и побочными эффектами — с другой. Иной критерий полезности — соотношение риска и пользы (для лекарственной терапии это может быть соотношение между терапевтическим и побочными эффектами препарата). Достоверно определить полезность применения того или иного лекарственного средства нелегко, но, по крайней мере, врач и больной должны хорошо представлять, чего они ждут от лечения. Тогда больной будет в точности выполнять предписания врача (что особенно важно при длительном лечении), а врач своевременно отменит препарат в случае его недейственности и высокого риска побочных эффектов. Нужно помнить, что мнения врача, больного и его родственников о полезности проводимого лечения могут не совпадать. Так, в одном клиническом испытании гипотензивной терапии со слов врачей улучшение отмечено у всех больных, а со слов больных — только у 48%, еще 8% больных жаловались на ухудшение. По мнению же родственников, проведенное лечение было успешным только у 1% больных, а у 99% — привело к развитию побочных эффектов (Jachucket al., 1982).