Разработка новых лекарственных средств
Разработка лекарственных средств[править | править код]
Лекарства могут ухудшить здоровье
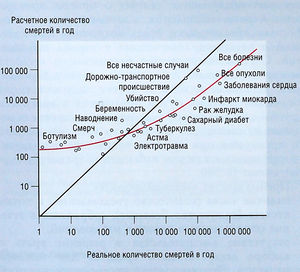
Регламент лекарственных средств — это оценка отношения польза-риск. Лекарственное вещество — это химическое соединение, применяемое для профилактики, диагностики или лечения заболеваний, а также для изменения физиологических функций организма (табл. 3.1). Лекарственный препарат — это одно или несколько лекарственных веществ, соединенных с фармакологически неактивными субстанциями, обеспечивающими их стабильность, вкус и удобство в использовании. Лекарственное вещество взаимодействует с тканями и органами и изменяет их функцию, но его эффекты не всегда желательны. Применение любого лекарства потенциально опасно, а вероятность причинения лекарством какого-либо специфического вреда и есть риск. Вероятность можно оценить в эксперименте, при наблюдении или априорно (см. рис. 3.2).
Описание к рис. 3.2 Отношение между «принимаемым риском» и «истинным риском» для 41 причины смерти. Если принимаемая и истинная частота совпадают, данные выглядят как прямая линия. Точки и кривые между ними отражают средний ответ [Kahneman D, Slovic Р and Tversky A (eds). Judgment Under Uncertainty: Heuristics and Biases. Cambridge, Cambridge: University Press; 1982].
Лекарства применяют с различными целями (см. табл. 3.1).
Таблица 3.1 Примеры различного использования лекарственных средств
|
Для предотвращения заболеваний (профилактика) |
Вакцины, например коклюшная вакцина |
|
Противомалярийные средства, такие как хлорохин | |
|
Для диагностики заболеваний |
Синтетический адренокортикотропный гормон для оценки недостаточности надпочечников |
|
Сульфат бария в гастроэнтерологии | |
|
Иоксаглат в ангиографии | |
|
Для лечения заболеваний | |
|
Симптоматическая терапия |
Ацетаминофен при головной боли |
|
Метоклопрамид при тошноте | |
|
Этиотропная терапия |
Пенициллин С для лечения стрептококковой инфекции |
|
Для изменения физиологических функций |
Оральные контрацептивы |
Регламент нужен для обеспечения эффективности, безопасности и химической чистоты лекарственных препаратов
Разработаны различные методы оценки эффективности и безопасности лекарств. В большинстве стран государственные органы регулируют как оценку, так и оборот лекарственных препаратов. В этом процессе различают два основных регулирующих этапа: утверждение клинических исследований нового препарата и разрешение на его реализацию. Основными целями регулирования являются:
- защита населения при столкновении интересов потребителей и фармацевтических компаний, ориентированных на получение прибыли;
- применение стандартов доказательства эффективности и приемлемой безопасности, что позволяет обеспечить практикующих врачей достаточно изученными лекарственными препаратами;
- обеспечение получения лекарственного препарата с приемлемой чистотой и стабильными физикохимическими свойствами после производственного процесса;
- контроль доступа населения к некоторым лекарствам, особенно к вызывающим привыкание.
Регулирование оборота лекарств было начато в США в 1906 г. с издания «Закона о доброкачественности пищевых продуктов и медицинских препаратов». Этот закон затрагивал только чистоту лекарств и был издан в ответ на публичное раскрытие фактов нечистоплотности и небрежности при изготовлении пищевых и лекарственных препаратов. Позднее трагедия с сульфаниламидами привела к созданию Управления по контролю качества пищевых продуктов и лекарств (Food and Drug Administration, FDA). Права FDA и регулирующих органов были расширены в 1960 г. после трагедии с талидомидом в Европе. Закон был дополнен требованием о необходимости получения в клинических исследованиях научно обоснованных доказательств безопасности и эффективности нового лекарственного средства до разрешения его оборота.
Необходимо помнить, что, хотя строгие нормы безопасности и эффективности являются главной целью регулирования оборота лекарств, никакая система регулирования не гарантирует отсутствие вреда от применения какого-либо препарата. Некоторые эффекты слишком редки, чтобы быть замеченными при исследовании лекарства с участием нескольких сотен или тысяч пациентов. Но отсрочка утверждения лекарства может привести к тому, что многие пациенты не получат нужное лекарство вовремя.
Таким образом, разработка и регламент лекарственных средств — это оценка относительного риска и пользы, которая не является абсолютной. Регламент не устраняет побочные эффекты применения лекарств, а лишь позволяет установить с определенной математической точностью риск и эффективность препарата. Регламентирование также привело к получению универсальной информации, которая всегда доступна для клиницистов, оценивающих достоинства новых препаратов по сравнению с существующими терапевтическими средствами. Врач должен владеть знаниями, необходимыми для правильного назначения лекарства, и отвечать за возможный риск, а регламент должен оказывать ему помощь в принятии решения.
Изучение лекарственных средств начинают с исследований на животных и продолжают в клинических условиях. С 1990-х гг. были приняты более унифицированные требования к разработке лекарств в США, Европе и Японии путем объединения различных методов. Рекомендации International Conference on the Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use стали действующим международным руководством по разработке и регулированию лекарственных средств для оценки научных и технических аспектов процесса утверждения лекарств. Эта работа официально санкционирована несколькими организациями, включая Европейскую комиссию Евросоюза (European Commission of the European Union), Министерство здравоохранения и благополучия Японии (Ministry of Health and Welfare of Japan), FDA США, а также несколькими международными научными обществами. Рекомендации утверждены и приняты руководящими органами в качестве правил производства, методов оценки аналитических работ, химической и физической стабильности продукции, проведения доклинических и клинических испытаний, установления безопасности и эффективности препаратов. Таким образом, государственные органы:
- устанавливают необходимые правила проведения клинических наблюдений применения новых лекарственных средств на основе данных, полученных в исследованиях на животных;
- устанавливают правила производства и критерии чистоты лекарств, чтобы состав и количество каждого соединения были точными;
- в определенной степени ограничивают заявления, используемые в рекламе, и перечень состояний, при которых препарат может быть назначен.