Распределение лекарственных средств
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Распределение лекарственных средств[править | править код]
Из системного кровотока лекарственное средство переходит во внесосудистое пространство и распределяется между интерстициальной и внутриклеточной жидкостью. Характер распределения зависит от физико-химических свойств препарата и ряда физиологических факторов. Скорость распределения и количество препарата, поступившего в ткань, определяются сердечным выбросом, интенсивностью местного кровотока и объемом ткани. Большинство лекарственных средств в первую очередь попадают в интенсивно кровоснабжаемые органы и ткани (печень, почки, головной мозг). Поступление препарата в другие внутренние органы, мышцы, кожу и жировую ткань происходит медленнее: для установления равновесия между концентрациями лекарственного средства в сыворотке и тканях требуется от нескольких минут до нескольких часов. Именно в этих тканях обычно находится основная часть препарата, распределенного во вне-сосудистом пространстве, так как на них приходится гораздо большая часть массы тела, чем на интенсивно кровоснабжаемые органы и ткани. Благодаря высокой проницаемости эндотелия капилляров лекарственные средства быстро проникают в интерстициальную жидкость (исключение составляют капилляры некоторых органов, например головного мозга). Таким образом, содержание вещества в той или иной ткани зависит прежде всего не от скорости транспорта через стенку капилляров, а от коэффициента распределения данного вещества между кровью и этой тканью. Важные факторы, которые влияют на поступление лекарственного средства в ткани, — растворимость препарата в жирах, а для слабых кислот и оснований — еще и градиент pH между внутриклеточной и внеклеточной жидкостью. Впрочем, этот градиент обычно невелик (pH составляет 7 и 7,4 соответственно), так что разность концентраций слабого электролита по обе стороны клеточной мембраны небольшая. Более существенную роль играет связывание препарата с белками плазмы, с одной стороны, и с компонентами тканей — с другой.
Связывание с белками плазмы[править | править код]
Многие лекарственные средства связываются с белками плазмы: преимущественно с альбумином (кислые вещества) и кислым α1-гликопротеидом (основные вещества), в гораздо меньшей степени — с другими белками плазмы. Эта связь, как правило, обратима, однако некоторые препараты (например, алкилируюшие средства) образуют с белками плазмы ковалентные связи.
Доля связанного препарата зависит от его концентрации в плазме, сродства к белкам плазмы и количества участков связывания. Соотношение между концентрациями свободного и связанного препарата определяется законом действующих масс (гл. 2). При низких концентрациях лекарственного средства (меньше Kd комплекса препарат—белок) доля связанного препарата зависит от количества участков связывания и Кd, а при высоких концентрациях (больше Kd комплекса препарат-белок) — от количества участков связывания и концентрации препарата. Таким образом, связывание с белками плазмы — нелинейный процесс, который характеризуется насыщением. Впрочем, у большинства лекарственных средств терапевтический диапазон сравнительно невелик, и в его пределах степень связывания с белками и доля свободного препарата довольно постоянны. Степень связывания с белками плазмы, приведенная в Приложении II, рассчитана именно для терапевтических концентраций лекарственных средств, за исключением специально оговоренных случаев. При различных патологических состояниях степень связывания с белками может меняться. Так, при гипоальбуминемии, обусловленной тяжелым поражением печени или нефротическим синдромом, уменьшается степень связывания кислых препаратов (соответственно возрастает доля свободного препарата). При состояниях, сопровождающихся повышением концентрации кислого α,-гликопротеида (белок острой фазы воспаления), — злокачественных новообразованиях, артрите, инфаркте миокарда, болезни Крона — увеличивается степень связывания оcновных препаратов.
Связывание с белками плазмы не избирательно, поэтому сходные по физико-химическим свойствам лекарственные средства могут конкурировать за участки связывания друг с другом и с эндогенными веществами. Так, поскольку сульфаниламиды и другие органические анионы вытесняют непрямой билирубин из связи с альбумином, при назначении на поздних сроках беременности они могут вызвать билирубиновую энцефалопатию у новорожденного. Однако роль вытеснения из участков связывания в развитии побочных эффектов преувеличена. И терапевтический, и токсический эффекты зависят от концентрации свободного препарата. Стационарная же концентрация свободного препарата меняется только при изменении скорости его поступления (количество введенного препарата в единицу времени) или клиренса (уравнение 1.1) и не зависит от степени связывания с белками плазмы (см. ниже). В то же время, если терапевтический диапазон небольшой, преходящее повышение концентрации лекарственного средства, возникающее непосредственно после введения препарата, конкурирующего с ним за участки связывания с белками, может привести к побочным эффектам. Конкурирование за участки связывания с белками нужно иметь в виду при интерпретации данных о сывороточной концентрации лекарственных средств, так как в большинстве случаев измеряется общая концентрация препарата (свободного и связанного с белками плазмы).
Важно отметить, что связывание с белками плазмы снижает концентрацию лекарственного средства в ткани-мишени, так как равновесие устанавливается между свободными фракциями препарата по обе стороны клеточных мембран. Если перенос лекарственного средства осуществляется без затрат энергии, по достижении равновесия концентрации свободного препарата во внутриклеточной жидкости и в сыворотке выравниваются. Кроме того, связывание с белками плазмы уменьшает фильтрацию лекарственного средства в почках, так как при этом концентрация свободного препарата в крови уменьшается не сразу (в клубочках фильтруется не только лекарственное средство, но и вода). Канальцевая секреция лекарственных средств, напротив, обычно не зависит от их связывания с белками плазмы, поскольку в процессе секреции снижается сывороточная концентрация свободного препарата, а это приводит к повышению диссоциации комплекса препарат—белок. Связывание с белками замедляет метаболизм лекарственных средств. Исключение составляют случаи, когда клиренс свободного препарата превышает плазмоток через орган, ответственный за элиминацию. В этом случае связывание с белками плазмы способствует доставке препарата в соответствующий орган и, следовательно, ускоряет метаболизм.
Читайте также: Связывание лекарств с белками плазмы
Связывание с компонентами тканей[править | править код]
Многие лекарственные средства накапливаются в тканях в более высоких концентрациях, чем в интерстициальной жидкости и крови. Например, при длительном лечении мепакрином (противомалярийное средство) концентрация препарата в печени может в несколько тысяч раз превышать его сывороточную концентрацию. Накопление в тканях обычно обусловлено связыванием препарата с компонентами ткани, реже — его активным транспортом из крови. Как правило, лекарственное средство обратимо связывается с макромолекулами клетки — белками (в том числе ядерными), фосфолипидами. В тканях может связываться достаточно большое количество препарата. При переходе в свободную форму препарат может высвобождаться либо непосредственно в ткань, либо в системный кровоток, откуда затем переносится в другие органы и ткани. При этом действие лекарственного средства удлиняется.
Жировая ткань[править | править код]
Многие жирорастворимые лекарственные средства накапливаются в жировой ткани, будучи растворенными в триглицеридах. У больных с ожирением жировая ткань составляет до 50% веса; даже у истощенных больных на ее долю приходится не менее 10% веса. Через 3 ч после введения тиопентала, который очень хорошо растворяется в жирах, до 70% препарата находится в жировой ткани. Из-за относительно низкой интенсивности кровотока высвобождение лекарственных средств из жировой ткани происходит медленно.
Костная ткань[править | править код]
Тетрациклины и другие лекарственные средства, образующие с ионами двухвалентных металлов комплексные соединения, а также тяжелые металлы накапливаются в костной ткани. Эти препараты адсорбируются на поверхности кристаллов минеральных веществ костной ткани, а затем встраиваются в кристаллическую решетку. В костной ткани депонируются некоторые токсичные вещества (свинец, радий). Медленно высвобождаясь в кровь, они действуют в течение длительного времени. При разрушении костного мозга кровоснабжение кости нарушается, и поступление этих веществ в кровь еще более замедляется, а повреждающее действие на костную ткань усиливается. В результате формируется порочный круг: чем интенсивнее контакт с токсическим веществом, тем медленнее оно выводится.
Перераспределение[править | править код]
Действие лекарственного средства может прекращаться не только в результате метаболизма и экскреции, но и вследствие перераспределения препарата из ткани-мишени в другие органы и ткани. Последнее особенно справедливо в отношении жирорастворимых лекарственных средств, действующих на головной мозг и сердечно-сосудистую систему, если их вводят быстро, в/в или в виде ингаляции. Так, максимальная концентрация в головном мозге тиопентала (неингаляционного анестетика) достигается уже через 1 мин после введения. По мере распределения препарата в менее интенсивно кровоснабжаемые органы и ткани (например, мышцы) сывороточная концентрация начинает уменьшаться. Параллельно уменьшается и концентрация тиопентала в головном мозге, поскольку степень связывания препарата с компонентами ткани головного мозга незначительна. Таким образом, общая анестезия наступает быстро, но столь же быстро прекращается в соответствии с изменениями концентрации препарата в головном мозге.
Проникновение в ЦНС[править | править код]
Переносу лекарственных средств в ЦНС препятствует гематоэнцефалический барьер. Эндотелиальные клетки капилляров головного мозга соединены непрерывными плотными контактами, так что лекарственные средства могут проходить сквозь клетки, но не между ними. Другой компонент гематоэнцефалического барьера — клетки глии, прилегающие к наружной поверхности капилляров. В сосудистых сплетениях желудочков мозга барьер образован эпителиальными клетками, которые также соединены между собой плотными контактами. Таким образом, проницаемость гематоэнцефалического барьера для свободных неионизированных молекул лекарственных средств тем выше, чем выше их растворимость в жирах. Эти свойства нередко используют при разработке лекарственных средств. Так, некоторые Н,-блокаторы хуже проникают в ЦНС и, следовательно, не обладают седативным действием. Появляется все больше данных о том, что лекарственные средства могут попадать в ЦНС с помощью переносчиков, которые транспортируют питательные вещества и эндогенные соединения из крови в ткань головного мозга и СМЖ. Недавно было показано, что в работе гематоэнцефалического барьера участвуют также белки-переносчики, транспортирующие вещества из эндотелиальных клеток капилляров головного мозга в кровь. Наиболее важный из них — Р-гликопротеид. Он переносит лекарственные средства из эндотелиальных клеток обратно в кровь, препятствуя проникновению этих веществ в ЦНС, и выводит препараты, проникшие туда иным путем. В головном мозге и других органах (например, в яичках), где присутствует этот транспортный белок, концентрация лекарственного средства может оказаться ниже терапевтической даже при достаточной сывороточной концентрации. Примером могут служить ингибиторы протеазы ВИЧ (Kimetal., 1998) илоперамид. Последний представляет собой опиоид с выраженным системным действием, который, однако, не обладает свойственными препаратам этой группы центральными эффектами (гл. 23). В сосудистых сплетениях желудочков мозга имеются системы активного транспорта лекарственных средств из СМЖ в кровь. Помимо активного транспорта и диффузии обратно в кровь лекарственные средства выводятся из ЦНС вместе с СМЖ, которая всасывается в арахноидальных ворсинах. В норме проницаемость гематоэнцефалического барьера для многих лекарственных средств мала, но при воспалении (менингит, энцефалит) она может повышаться. Возможно, в будущем появится возможность избирательно менять проницаемость гематоэнцефалического барьера (например, при лечении инфекций и опухолей ЦНС); пока, однако, эффективность такого подхода не доказана.
Проникновение через плаценту[править | править код]
Перенос лекарственных средств через плаценту очень важен, так как они могут вызывать пороки развития у плода. Кроме того, введение лекарственных средств непосредственно перед родами небезопасно для новорожденного. Проницаемость плацентарного барьера для лекарственных средств зависит от их жирорастворимости, степени связывания с белками плазмы и степени ионизации (последнее справедливо для слабых кислот и оснований). У плода pH крови чуть ниже, чем у матери (7—7,2 и 7,4 соответственно), поэтому основные препараты могут избирательно накапливаться в крови плода. Как и в головном мозге, в плаценте имеется Р-гликопротеид, транспортирующий многие вещества обратно в кровь матери и тем самым предохраняющий плод от их возможного токсического действия. Тем не менее почти все препараты, которые получает мать, в той или иной степени воздействуют на плод.
Объем распределения[править | править код]
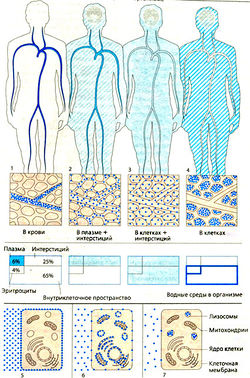
Этот второй важнейший фармакокинетический параметр характеризует распределение препарата в организме. Объем распределения (Vp) равен отношению общего содержания вещества в организме (ОСО) к его концентрации (С) в плазме или цельной крови. Объем распределения часто не соответствует никакому реальному объему. Это объем, необходимый для равномерного распределения вещества в концентрации, равной концентрации этого вещества в плазме или цельной крови.
Vp=ОСО/C (1.9)
Таким образом, объем распределения отражает долю вещества, пребывающего во внесосудистом пространстве. У человека весом 70 кг объем плазмы составляет 3 л, ОЦК — около 5,5 л, объем межклеточной жидкости — 12 л, общее содержание воды в организме — примерно 42 л. Однако объем распределения многих лекарственных средств гораздо больше этих величин. Например, если у человека весом 70 кг в организме содержится 500 мкг дигоксина, его концентрация в плазме составляет 0,75 нг/мл. Разделив общее содержание дигоксина в организме на его концентрацию в плазме, получим, что объем распределения дигоксина равен 650 л. Это более чем в 10 раз превышает общее содержание воды в организме. Дело в том, что дигоксин распределяется преимущественно в миокарде, скелетных мышцах и жировой ткани, так что его содержание в плазме невелико. Объем распределения лекарственных средств, которые активно связываются с белками плазмы (но не с компонентами тканей), примерно соответствует объему плазмы. Вместе с тем некоторые лекарственные средства находятся в плазме преимущественно в связанной с альбумином форме, но имеют большой объем распределения за счет депонирования в других тканях.
Объем распределения лекарственных средств колеблется в широких пределах в зависимости от степени связывания с белками плазмы и тканей, коэффициента распределения препарата между липидной и водной фазами и других факторов. На объем распределения влияют возраст, пол, состав тела, патологические достояния.
Процесс распределения лекарственных средств описывается с помощью ряда объемных показателей. Объем распределения лекарственного средства (уравнение 1.9) — параметр, характеризующий однокамерную фармакокинетическую модель. Согласно этой модели, организм представляет собой единую гомогенную камеру, в которую вводят лекарственное средство, мгновенно распределяющееся по всему объему камеры (Vp). При этом элиминация лекарственных средств подчиняется кинетике первого порядка (уравнение 1.3), то есть скорость элиминации препарата пропорциональна его содержанию (концентрации) в камере. Уравнение 1.10 и рис. 1.4, А описывают динамику сывороточной концентрации лекарственного вещества в рамках однокамерной модели.
C=Доза/Vn x e
где к — константа скорости элиминации (доля введенного препарата, которая удаляется за единицу времени). Константа скорости элиминации обратно пропорциональна Т1/2: к = 0,693/Т1/2.
Однокамерная модель вполне пригодна для большинства лекарственных средств, но многокамерные модели дают более точное представление о динамике сывороточной концентрации препарата. В рамках таких моделей некоторые органы и ткани выделяют в отдельные камеры. При этом динамика сывороточной концентрации описывается несколькими экспоненциальными функциями (рис. 1.4, Б).
Скорость распределения[править | править код]
Если препарат распределяется в тканях с разной скоростью, динамика его сывороточной концентрации описывается несколькими экспоненциальными функциями — даже в том случае, когда его элиминация подчиняется кинетике первого порядка. Скорость достижения равновесия между концентрациями препарата в крови и ткани зависит от интенсивности кровоснабжения ткани и коэффициента распределения препарата между кровью и тканью. В тканях, характеризующихся одинаковым отношением кровотока к коэффициенту распределения, равновесие с кровью достигается примерно с одинаковой скоростью. В результате на кривой, описывающей динамику сывороточной концентрации препарата, видна одна стадия распределения (быстрое первоначальное падение сывороточной концентрации препарата; рис. 1.4, Б). Иными словами, непосредственно после введения препарат находится в центральной камере (плазма и интенсивно кровоснабжаемые ткани), из которой он затем переходит в периферическую камеру. После достижения равновесия сывороточная концентрация препарата снижается в соответствии с экспоненциальной функцией, характеризующейся константой скорости элиминации к (рис. 1.4, Б).
Кровоснабжение тканей подвержено индивидуальным колебаниям и может меняться при некоторых физиологических и патологических состояниях. Абсолютное или относительное изменение кровоснабжения влечет за собой изменение скорости распределения лекарственных средств. Так, при шоке перфузия сердца и головного мозга сохраняется за счет ухудшения кровоснабжения других органов. Объем центральной камеры уменьшается, а периферической — растет, так как проникновение препарата в те органы, которые в норме интенсивно кровоснабжались (например, печень), замедляется. После в/в введения сывороточная концентрация препарата возрастает, увеличивается его доставка в органы, кровоснабжение которых сохранено (сердце, головной мозг), а следовательно, усиливаются и фармакологические эффекты в этих органах. Таким образом, действие лекарственного средства на разные ткани-мишени может меняться в разной степени, в зависимости от их кровоснабжения.
Многокамерные модели[править | править код]
В рамках многокамерной модели объем распределения препарата описывают с помощью двух параметров. Во-первых, объем распределения можно рассчитать как отношение клиренса к скорости снижения сывороточной концентрации препарата на стадии равновесия (константе скорости элиминации) или после соответствующего преобразования — по ПФК:
Vпфк=Сl/k= Доза/ k х ПФК (1.11)
Оценить Vn0K несложно после однократного в/в введения или приема внутрь (в последнем случае учитывают биодоступность). Большее значение, в частности для оценки изменений фармакокинетики при различных заболеваниях, имеет другой параметр — объем распределения в стационарном состоянии (Vc). Это объем, в котором должно было бы распределиться вещество по достижении стационарного состояния, если бы его концентрация в данном объеме была бы такой же, как в плазме или цельной крови. Рассчитать Vc гораздо труднее (Benet and Galeazzi, 1979), особенно если лекарственное средство принимают внутрь, зато результат не зависит от константы скорости элиминации. При изменении k Vn(t)K изменится, хотя на самом деле объем распределения может оставаться прежним. Это обусловлено тем, что скорость снижения сывороточной концентрации лекарственного средства зависит не только от клиренса, но и от скорости распределения препарата между центральной и периферической камерами. Впрочем, для расчета дозы различия между Vпфк и Vc не играют существенной роли.
Категория:
«Фармакология».
Распределение[править | править код]
Лекарственное вещество, поступающее в системный кровоток, распределяется по различным частям тела со скоростью, которая зависит от ряда факторов, включая метаболизм, экскрецию и перераспределение в организме. Чтобы попасть в ткани, лекарство должно покинуть кровоток. Как было указано ранее, большинство лекарственных веществ имеет небольшую молекулярную массу, вследствие чего они легко покидают кровоток при фильтрации через стенку капилляров. Однако скорость фильтрации может изменяться в зависимости от степени связывания лекарства с белками плазмы, такими как альбумин и а1-кислый гликопротеин.
Ожирение может влиять на распределение лекарства
Независимо от пути введения лекарственный препарат достигает тканей со скоростью, прямо пропорциональной кровотоку (табл. 4.2). В состоянии покоя кровоснабжение жировой и мышечной ткани (в мл/кг/мин) сходно. При физической нагрузке кровоток в мышцах резко возрастает. В зависимости от растворимости в липидах лекарства накапливаются в жировой и мышечной тканях в различном количестве и с разной скоростью. Таким образом, различия в соотношении между жировой и мышечной тканями у тучных и худощавых людей при одинаковой массе тела могут осложнить подбор точной дозы некоторых лекарств, если учитывать только общую массу, поскольку указанное соотношение может повлиять на уровень лекарства в плазме.
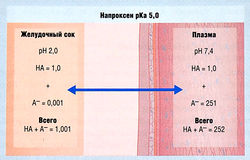
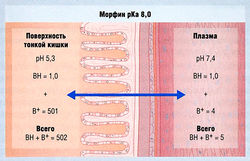
Концентрация свободного лекарства в жидкости различных компартментов организма зависит от рКа лекарства и pH жидкости
В основу расчета концентрации лекарства в тканях при состоянии равновесия положен принцип, согласно которому концентрация свободных неионизированных молекул одинакова по обе стороны клеточной мембраны. На рис. 4.4 и 4.5 изображено распределение между двумя биологическими средами кислого лекарства (напроксен) и основного лекарства (морфин) при состоянии равновесия. Видно, что:
- кислые лекарства концентрируются в плазме крови;
- основные лекарства концентрируются в тканях.
Следует отметить, что эти примеры относятся только к несвязанной фракции лекарств, растворенных в специфической биологической жидкости или ткани, и представлены в крайне упрощенном виде, особенно при сравнении с организмом как единым целым в условиях отсутствия равновесия.
Таблица 4.2 Кровоснабжение и масса органов взрослого человека
|
Перфузия |
Кровоток (мл/мин) |
Масса органа (кг) |
Кровоток (мл/кг/мин) |
|
Сердечный выброс |
5400 |
- |
- |
|
Миокард |
250 |
0,3 |
833 |
|
Печень |
1700 |
2,5 |
680 |
|
Почки |
1000 |
0,3 |
3333 |
|
ЦНС |
800 |
1,3 |
615 |
|
Жировая ткань |
250 |
10,0 |
25 |
|
Другие ткани (мышцы и т.д.) |
1400 |
55,0 |
25 |
|
Общее значение |
69,4 |
Связывание с белками плазмы — одна из причин неодинаковой общей концентрации лекарств в различных компартментах организма
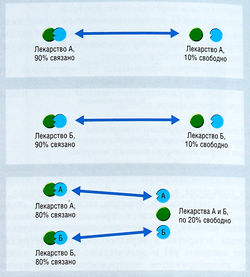
Альбумин является наиболее важным белком плазмы, связывающим кислые лекарства. Конкуренция за участки связывания, присутствующие на альбумине, приобретает клиническую значимость для лекарств, связывающихся более чем на 80%, особенно если связывание превышает 90%. При столь высокой степени связывания любое небольшое изменение величины связанной фракции приведет к значительным изменениям величины свободной фракции, т.е. фракции, от которой зависят фармакологические эффекты (рис. 4.6).
Многие основные лекарства связываются с глобулиновой фракцией (например, с а1-кислым гликопротеином). Интерпретация клинического значения этого взаимодействия осложняется тем, что данный белок представляет собой реагент острой фазы и его концентрация относительно быстро меняется и неодинакова у различных индивидов. Концентрация а1-кислого гликопротеина повышается с возрастом, при воспалительных заболеваниях и остром патологическом стрессе.
При передозировке выбор наиболее подходящей среды для определения концентрации лекарства зависит от его химических свойств
Кислые лекарства концентрируются в плазме, поэтому кровь является наиболее подходящей средой для определения их концентрации. Основные лекарства, независимо от пути их введения, целесообразно определять в просвете желудка. Диффузия основных лекарств в желудке приводит к почти полной их ионизации в этой среде. Если градиент концентрации остается постоянным, основные лекарства концентрируются в желудке до тех пор, пока не возникнет равновесие распределения неионизированной фракции. Прием бикарбоната для подщелачивания мочи может увеличить длительность действия амфетамина. В результате такого подщелачивания возрастающая фракция амфетамина в моче присутствует в неионизированной форме и быстро реабсорбируется через люминальную поверхность почечных канальцев.
Анатомические и физиологические факторы, способствующие дифференциальному распределению лекарств
Анатомическая и биохимическая природа гематоэнцефалического барьера влияет на способность лекарственных веществ проникать в головной мозг. Диффузия из капилляров мозга жестко ограничена клеточными зонулами; они усиливают барьерный эффект на пути диффузии лекарств в мозг. Однако существуют 4 области мозга, где этот барьер отсутствует: гипофиз, эпифиз, дно 4-го желудочка мозга и капилляры хориоидеи. Хориоидея содержит также транспортеры, удаляющие заряженные молекулы из спинномозговой жидкости (СМЖ). В норме СМЖ не содержит белков, поэтому концентрация лекарства в СМЖ сходна с концентрацией свободного лекарства в крови.
Все лекарства проходят через плаценту и поступают в материнское молоко (если не доказано обратное)
Лекарства диффундируют через плаценту, однако равновесие между матерью и плодом устанавливается медленнее вследствие ограниченного плацентарного кровотока. Если не доказано обратное, следует полагать, что все лекарства проходят через плаценту и поступают в материнское молоко. Клиническое значение присутствия лекарств в плаценте и молоке следует оценивать индивидуально для каждого препарата.
Фармакокинетическое пространство, в котором распределяется вещество, определяют как условный объем распределения
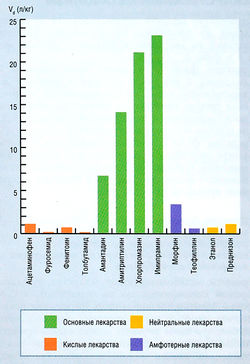
Условный объем распределения — это не анатомическое, а рассчитанное пространство. Его расчет основан на величине введенной дозы лекарства и его концентрации в плазме. Для некоторых молекул (например, этанола) условный объем распределения приближается к общему содержанию воды в организме (примерно 70% массы тела у взрослых молодых людей, не страдающих ожирением). Это может показаться неожиданным, т.к. этанол растворим в липидах и соответственно ожиданию должен распределяться и в воде, и в липидах. Поскольку вода занимает в организме наибольшее пространство, большая часть принятого внутрь этанола остается в общем объеме воды тела. Некоторые лекарства имеют условный объем распределения, значительно превышающий объем крови (рис. 4.7). Такие лекарства обычно являются основаниями, и их высокий условный объем распределения обусловлен обширным связыванием с тканями. В этих условиях почти вся введенная доза депонируется вне кровотока. Исследования на животных показали, что основные вещества часто локализуются в специфических органах (например, концентрация антивирусного препарата амантадина в печени, легких и почках в несколько раз выше, чем в крови).
Как место действия лекарства, так и масса ткани, где оно концентрируется, представляют собой факторы, которые необходимо учитывать при оценке клинического значения локализации лекарства. Сердечный гликозид дигоксин концентрируется в мышцах, и его условный объем распределения значительно превышает массу тела. Следовательно, доза дигоксина, необходимая для создания терапевтической концентрации в плазме, зависит от соотношения мышечной массы и общей массы тела. Кроме того, требуется несколько часов для установления равновесия между кровью и мышцами. Таким образом, концентрацию дигоксина в плазме непросто соотнести с терапевтическим ответом, если равновесие не достигнуто.
Распределение лекарств
- Распределение лекарств основано на принципе, согласно которому концентрация неионизированного лекарства одинакова по всему телу при установившемся равновесии
- Заряженные молекулы лекарства с трудом проникают в мозг вследствие существования гематоэнцефалического барьера, исключая ситуации, когда воспалены мозговые оболочки
- Основные лекарства концентрируются в желудке, поскольку здесь они находятся преимущественно в ионизированном виде