Рецепторы
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Рецепторы[править | править код]
Большинство рецепторов представляют собой белки. Это рецепторы гормонов, факторов роста, медиаторов, белки, участвующие в важнейших метаболических и регуляторных реакциях (дигидрофолатредуктаза, АХЭ), транспортные белки (Ыа+,К+-АТФаза), структурные белки (тубулин). В роли рецепторов могут выступать и клеточные компоненты иной химической природы, например нуклеиновые кислоты, с которыми взаимодействуют противоопухолевые средства.
Фармакологическое значение имеют рецепторы эндогенных регуляторных факторов — гормонов, медиаторов и т. д. Эти рецепторы служат мишенями для многих лекарственных средств, обычно действующих избирательно благодаря высокой специфичности рецепторов по отношению к эндогенным лигандам. Лекарственные средства, которые при связывании с рецептором воспроизводят физиологический эффект эндогенного лиганда, называются агонистами, или стимуляторами. Препараты, которые не вызывают такого эффекта, но препятствуют связыванию эндогенных лигандов, называются антагонистами, или блокаторами. Вещества, эффект которых менее выражен, чем эффект агонистов, называют частичными агонистами. Препараты, стабилизирующие рецептор в неактивированной конформации, относят к обратным агонистам (см. ниже, «Количественные аспекты взаимодействия лекарственных средств с рецепторами»).
Структурно-функциональная зависимость[править | править код]
Химическая структура препарата достаточно жестко определяет его сродство к рецепторам и внутреннюю активность. Незначительное изменение химического строения может существенно отразиться на фармакологических свойствах.
На этом в значительной мере основан синтез новых лекарственных средств. Поскольку химическая модификация необязательно отражается на всех фармакологических свойствах в равной степени, можно улучшить эффективность и безопасность препарата, повысить его избирательность, усовершенствовать фармакокинетические характеристики. Например, многие применяемые в клинике антагонисты гормонов и медиаторов были синтезированы путем химической модификации эндогенных веществ.
Зная молекулярную структуру и фармакологические характеристики достаточно большой группы родственных соединений, можно выяснить, какие химические свойства обеспечивают наилучшее взаимодействие вещества с рецептором (размеры и форма молекулы, расположение и ориентация заряженных групп и доноров водорода, участвующих в образовании водородных связей, и т. д.). С помощью методов комбинаторной химии, структурного анализа органических соединений и исследования биохимических изменений, происходящих при взаимодействии лекарственных средств с рецепторами, удалось количественно оценить зависимость между химической структурой и активностью препарата и использовать эти данные при создании новых лекарственных средств (Киш/. 1992: Schreiber, 1992). Не менее существенно и изучение чувствительности рецепторов путем направленного мутагенеза, когда в колирующих их генах заменяют отдельные нуклеотиды. Полученные таким образом данные используют для повышения избирательности лекарственных средств и их сродства к рецепторам, достижения нужных фармакологических эффектов. Путем изменения химической структуры препарата можно совершенствовать и его фармакокинетические свойства (гл. I). Еще более информативно исследование атомного строения рецепторов и комплексов лиганд—рецептор, которое проводят с помощью рентгеноструктурного анализа и магнитно-резонансной спектроскопии.
Интересно, что успехи молекулярной биологии, которые создали предпосылки для направленного синтеза лекарственных средств, дали толчок и случайному поиску новых препаратов. Из огромных баз данных по химическим веществам, полученным путем химического синтеза или в культуре микроорганизмов, измененных методами генной инженерии, выбирают вещества, обладающие фармакологической активностью. Для этого вещества исследуют в культурах клеток микроорганизмов или млекопитающих, экспрессирующих благодаря той же генной инженерии рецепторы для интересующего исследователей препарата и биохимические маркеры, позволяющие выявить активацию рецепторов. Обнаруженные таким образом вещества впоследствии совершенствуют путем химической модификации.
Точки приложения лекарственных средств[править | править код]
Поскольку действие лекарственных средств опосредовано рецепторами, точка приложения препарата определяется не только особенностями его распределения, но и локализацией рецепторов, а фармакологические эффекты зависят от функциональной значимости этих рецепторов. Фармакологические эффекты лекарственного средства, чьи рецепторы распространены во многих органах и тканях, разнообразны. Если эти рецепторы выполняют жизненно важную для клеток функцию, использовать препарат в терапевтических целях не только трудно, но и небезопасно. Тем не менее подобные препараты могут иметь большое клиническое значение. Так, сердечные гликозиды, широко применяемые при сердечной недостаточности, изменяют транспорт ионов через клеточную мембрану, от которого зависит жизнедеятельность клетки. Они обладают узким терапевтическим диапазоном и очень токсичны. Другим примером могут служить противоопухолевые средства. Если же рецепторы, с которыми взаимодействует препарат, имеются лишь на нескольких типах дифференцированных клеток, его действие более избирательно. У таких лекарственных средств побочных эффектов может быть меньше, но все же эти средства могут оказаться токсичными, если их рецепторы выполняют жизненно важную функцию. Так действуют некоторые смертельно опасные вещества (например, ботулотоксины). Не следует забывать и о том, что, даже если прямой фармакологический эффект избирателен, его последствия могут оказаться более многообразными.
Рецепторы эндогенных регуляторных факторов[править | править код]
На практике термином рецептор обозначают любой макромолекулярный компонент клетки, с которым связывается лекарственное средство. Одни из наиболее важных рецепторов лекарственных средств — клеточные белки, которые служат рецепторами для эндогенных регуляторных факторов — гормонов, факторов роста, медиаторов.
Связываясь с эндогенным лигандом, рецепторы передают поступающий от него сигнал внутрь клетки-мишени.
Каждая из этих функций — связывание лиганда и внутриклеточная передача сигнала — обеспечивается отдельным доменом рецептора — соответственно рецепторным и эффекторным. Строение и функцию этих доменов можно определить путем детального анализа молекулярной структуры рецептора или изучения дефектных рецепторов, измененных путем направленного мутагенеза. Все чаще удается исследовать и молекулярный механизм, посредством которого связывание лиганда сопряжено с клеточной реакцией. Разделение на рецепторный и эффекторный домены имеет важное биологическое значение. С одной стороны, действие разнообразных лигандов на множество рецепторов опосредуется сходными биохимическими механизмами. С другой, разные рецепторы для одного и того же лиганда могут различаться по механизмам внутриклеточной передачи сигнала.
От рецептора сигнал поступает к клеточным мишеням (эффекторным белкам) непосредственно или через промежуточные сигнальные молекулы — белки-преобразователи. Рецептор, белки-преобразователи и эффекторные белки образуют рецепторно-эффекторную систему. Ближайший в цепи передачи сигнала эффекторный белок часто представляет собой не конечный эффектор (непосредственно влияющий на клеточные функции), а фермент или транспортный белок, участвующий в образовании, транспорте либо инактивации второго посредника — иона или небольшой молекулы. Второй посредник, в свою очередь, переносит информацию к разнообразным внутриклеточным мишеням, обеспечивая их одновременную реакцию на сигнал от одного рецептора.
Рецепторы, белки-преобразователи и эффекторные белки не только передают информацию. Они также координируют сигналы, поступающие от разных лигандов, с одной стороны, и все эти сигналы с метаболическими процессами в клетке — с другой (см. ниже). Доказательство тому — относительно небольшое число биохимических механизмов передачи сигнала от множества разнообразных рецепторов. Более того, эти немногие пути передачи сигнала имеют общие сигнальные молекулы.
Действуя как катализаторы, рецепторы усиливают биологический сигнал. Благодаря этому важному свойству они служат прекрасными мишенями для лекарственных средств. Впрочем, усилителями сигнала служат не только рецепторы с ферментативной активностью, а все известные рецепторы. Действительно, при связывании одной молекулы лиганда с рецептором, сопряженным с ионным каналом, через последний проходит множество ионов. То же самое справедливо и в отношении рецепторов стероидных гормонов: одна молекула гормона запускает транскрипцию многих копий мРНК, на основе которых синтезируются многочисленные молекулы белка.
Механизм действия агонистов и антагонистов[править | править код]
Почему лекарственные средства, взаимодействующие с одним и тем же участком одного и того же рецептора, делятся на агонисты и антагонисты? Этот вопрос имеет важнейшее значение не только с точки зрения действия агонистов и антагонистов (то есть стимуляторов и блокаторов разных рецепторов), но и вообще для понимания динамической структуры белков и взаимодействия белков с лигандами. Появляется все больше данных о межатомных взаимодействиях, благодаря которым происходят конформационные изменения рецептора; большую роль играют изучение структуры свободных рецепторов и комплексов лиганд—рецептор, современные методы молекулярного моделирования и исследование функции дефектных белков.
Любой рецептор может существовать в двух состояниях — активированном и неактивированном. Тогда вопрос об агонистах и антагонистах можно поставить по-иному: каким образом свободная энергия присоединения лиганда используется для перехода рецептора в активированное состояние?
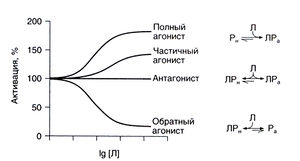
На данном рисунке Ра обозначает рецептор в активированном состоянии, Рн — в неактивированном, Л — лиганд. Активированное состояние соответствует открыванию ионного канала, стимуляции протеинкиназной активности или конформационным изменениям, позволяющим рецептору взаимодействовать с G-белком. Между активированными и неактивированными рецепторами существует равновесие. Если в отсутствие лиганда преобладает неактивированная конформация рецептора, конститутивная (не обусловленная связыванием с лигандом) активация рецепторов незначительна. Степень смещения равновесия в ту или иную сторону зависит от сродства лиганда к активированной и неактивированной конформации рецептора (рис. 2.1). Если сродство к активированной конформации выше, чем к неактивированной, лиганд смещает равновесие в сторону первой и таким образом стимулирует рецептор. Такие вещества называются агонистами. Полные агонисты обладают высоким сродством к активированной конформации рецептора; при насыщающих концентрациях препарата почти все рецепторы находятся в активированном состоянии. У частичных агонистов сродство к активированной конформации лишь незначительно выше, чем к неактивированной, и их эффект (даже в насыщающей концентрации) менее выражен, чем эффект полных агонистов. Частичные агонисты обычно сходны по структуре с полными агонистами и связываются с тем же участком рецептора. По сути все агонисты являются частичными, так как их избирательность в отношении активированной конформации рецептора не абсолютна. Вещество, которое обладает равным сродством к обеим конформациям, не сдвигает равновесие между активированными и неактивированными рецепторами и действует как конкурентный антагонист. И наконец, лиганды, обладающие большим сродством к неактивированной конформации рецептора, называются обратными агонистами (примеры обратных агонистов приведены в гл. 11 и 17). Если в отсутствие лиганда равновесие сильно смещено в сторону неактивированных рецепторов, заметить обратный агонизм и отличить его от конкурентного антагонизма довольно трудно.
Описание к рис. 2.1. Взаимодействие рецептора с лигандами. По вертикальной оси отложена степень активации рецептора в процентах от конститутивной активации, а по горизонтальной оси — десятичный логарифм концентрации лиганда. Если лиганд избирательно связывается с рецептором в активированной конформации, равновесие между активированной и неактивированной конформациями сдвигается в сторону первой и развивается соответствующий физиологический эффект. Если лиганд обладает одинаковым сродством к обеим конформациям, равновесие между ними не нарушается и степень активации рецептора не изменяется. Если лиганд избирательно связывается с рецептором в неактивированной конформации, число активированных рецепторов уменьшается. В тех случаях, когда конститутивная (не зависящая от связывания с агонистом) активация рецепторов достаточно велика и вызывает заметный эффект, такой лиганд уменьшает ее и называется обратным агонистом. Л — лиганд, Р, — рецептор в активированном состоянии, Р„ — рецептор в неактивированном состоянии.
Изучение биохимических процессов, происходящих при взаимодействии лиганда с рецептором, и функции дефектных рецепторов с измененной конститутивной активацией подтверждает справедливость приведенной выше концепции действия агонистов и антагонистов. Эта концепция легко применима к экспериментальным данным (с помощью компьютерных моделей) и помогает понять механизм действия лекарственных средств.
Классификация рецепторов в зависимости от их структуры и функции[править | править код]
В последние 20 лет одновременно с открытием множества новых рецепторов были существенно расширены наши представления о структуре рецепторов и биохимических основах их функционирования. Методами молекулярного клонирования выявлены как совершенно новые рецепторы и их лиганды, так и многочисленные изоформы ранее известных рецепторов. В настоящее время созданы базы данных, посвященные структуре определенных классов рецепторов. Рецепторы, белки-преобразователи и эффекторные белки выделены в чистом виде, а биохимический механизм их действия хорошо изучен. Их можно синтезировать с помощью молекулярно-генетических методов или в культуре клеток (бактерий, грибов), а затем исследовать также с использованием клеточных культур.
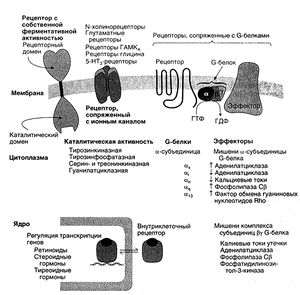
В зависимости от структуры и механизма действия рецепторы биологически активных веществ делят на несколько классов. Число этих классов невелико. На сегодняшний день мы имеем по крайней мере элементарные представления о структуре рецепторного и эффекторного доменов в каждом классе, а также о том, каким образом связывание лиганда изменяет функциональное состояние рецептора. Биохимические механизмы действия и структура рецепторов эндогенных регуляторных факторов не отличаются большим разнообразием, поэтому клетки-мишени способны интегрировать разные внешние сигналы, усиливающие или ослабляющие друг друга, и генерировать согласованную ответную реакцию. На рис. 2.2 схематически изображены структура рецепторов разных классов и компоненты, участвующие во внутриклеточной передаче сигнала (белки-преобразователи и эффекторные белки).
Рецепторы с ферментативной активностью[править | править код]
Самая большая группа рецепторов, обладающих ферментативной активностью, — это мембранные рецепторы с собственной протеинкиназной активностью. Они фосфорилируют разнообразные эффекторные белки, расположенные с внутренней стороны клеточной мембраны. В результате изменяется функция этих белков или их взаимодействие с другими белками. Одни рецепторы (их большинство) фосфорилируют тирозиновые остатки (рецепторы инсулина, многих цитокинов, пептидов, белков, регулирующих пролиферацию и дифференцировку клеток), другие — сери новые или треониновые остатки. В самом общем случие рецептор с собственной протеинкиназной активностью состоит из внеклеточного рецепторного домена, трансмембранного домена и внутриклеточного каталитического домена, обладающего протеинкиназной активностью. Отдельные рецепторы помимо каталитического домена могут иметь несколько внутриклеточных регуляторных доменов и доменов, связывающих белки. Некоторые рецепторы с собственной протеинкиназной активностью олигомеризуются при связывании лиганда.
Существует еще один класс рецепторов с протеинкиназной активностью — это рецепторы, сопряженные с протеинкиназами. Они лишены внутриклеточного каталитического домена,но при взаимодействии с агонистом связывают или активируют на внутренней поверхности мембраны внутриклеточные протеинкиназы. Таковы рецепторы нейротрофических факторов и состоящие из нескольких субъединиц антигенраспознающие рецепторы Т- и В-лимфоцитов. Последние взаимодействуют также с фосфотирозинфосфатазами. Функция других рецепторов, не имеющих внутриклеточного эффекторного домена, возможно, опосредована какими-то другими эффекторными белками.
Сходную структуру имеют и другие рецепторы с собственной ферментативной активностью. К ним относятся, например, рецепторы с собственной фосфотирозинфосфатазной активностью: их внеклеточный домен похож по аминокислотной последовательности на молекулы адгезии. Для многих рецепторов с собственной фосфотирозинфосфатазной активностью эндогенные лиганды не известны. Тем не менее, по данным генетических и биохимических исследований, проведенных на разных типах клеток, ферментативная активность этих рецепторов играет важную роль. Внутриклеточный домен рецепторов предсердного натрийуретического гормона, других натрийуретиче-ских пептидов, а также рецепторов гуанилина обладает собственной гуанилатциклазной активностью и синтезирует цГМФ, выступающий в роли второго посредника. У беспозвоночных рецепторы с собственной гуанилатциклазной активностью служат рецепторами феромонов. Возможно, существуют и другие рецепторы с собственной ферментативной активностью.
Рецепторы, сопряженные с ионными каналами[править | править код]
Рецепторы некоторых медиаторов непосредственно связаны с ионными каналами, при взаимодействии с лигандом избирательно пропускающими через клеточную мембрану те или иные ионы (хемочувствительные каналы, рецепторы-каналы, ионотропные рецепторы). Передача сигнала осуществляется путем изменения мембранного потенциала. К таким рецепторам относятся N-xoлинорецепторы, ГАМКд-рецепторы, глицина, глутаматные и аспартатные рецепторы (гл. 9, 12 и 17). Рецепторы, сопряженные с ионными каналами, состоят из нескольких субъединиц, каждая из которых несколько раз пронизывает клеточную мембрану. Благодаря симметричному расположению эти субъединицы образуют ионный канал и совместно регулируют его открывание и закрывание.
Рецепторы, сопряженные с G-белками[править | править код]
Это довольно большой класс рецепторов, которые взаимодействуют с эффекторами через G-белки (белки, связывающие ГТФ). К нему относятся рецепторы многих биогенных аминов, липидных сигнальных молекул (в частности, эйкозаноидов), разнообразных пептидных и белковых лигандов. В качестве эффекторов выступают ферменты (аденилатциклаза, фосфолипаза С) и калиевые и кальциевые мембранные каналы (рис. 2.2). Большое число и важная физиологическая роль рецепторов, сопряженных с G-белками, делает их прекрасными мишенями для лекарственных средств: на эти рецепторы действует примерно половина всех назначаемых врачами препаратов (исключая антибиотики).
Рецепторы, сопряженные с G-белками, содержат семь трансмембранных а-спиральных доменов. Участком связывания лиганда служит либо карман, который образован внеклеточными петлями, соединяющими трансмембранные домены, либо N-концевой глобулярный рецепторный домен. G-белок связывается с внутриклеточным доменом рецептора. G-белки — это гетерогримеры, состоящие из а-субъединицы, которая обеспечивает связывание с рецептором и присоединяет ГТФ, и прочного комплекса из β- и у-субъединиц. В результате взаимодействия комплекса лиганд—рецептор с G-белком а-субъединица связывает ГТФ, высвобождается и активирует эффекторные белки, а комплекс, состоящий из β- и у-субъединиц, в свою очередь, может действовать на другие эффекторные белки. G-белок остается активированным до тех пор, пока ГТФ не гидролизуется до ГДФ.
Клетка может нести на своей поверхности до 20 рецепторов, каждый из которых избирательно взаимодействует с одним или несколькими типами G-белков (у разных типов а-субъединицы различаются). Альфа-субъединица способна взаимодействовать с одним или несколькими эффекторными белками, что позволяет согласовывать сигналы от рецепторов разных лигандов с помощью одного G-белка. С другой стороны, один рецептор может запускать несколько механизмов внутриклеточной передачи сигнала, активируя несколько типов G-белков, и воздействовать на разные эффекторные белки через одну и ту же а-субъединицу. Столь сложная система дивергенции и конвергенции сигналов обеспечивает гибкую регуляцию клеточных функций (Ross, 1992).
Внутриклеточные рецепторы[править | править код]
Рецепторы стероидных и тиреоидных гормонов, кальцитриола и ретиноидов представляют собой растворимые внутриклеточные ДНК-связывающие белки, регулирующие транскрипцию определенных генов (Mangels-dorf et al., 1994). Эти рецепторы принадлежат к суперсемейству лиганд-чувствительных регуляторов транскрипции, которые относятся к факторам транскрипции. Функция факторов транскрипции регулируется посредством фосфорилирования, взаимодействия с клеточными белками, метаболитами и другими регуляторными компонентами клетки. При связывании с лигандом рецепторы образуют гетеродимеры (с гомологичными клеточными белками) или гомодимеры. Олигомеризация рецепторов с биологически активными веществами играет регуляторную роль. По структуре и механизму действия такие рецепторы весьма сходны, отчасти потому, что состоят из трех относительно независимых доменов. С-концевой рецепторный домен одновременно выполняет ингибирующую функцию: в его отсутствие оставшаяся часть молекулы может почти столь же эффективно активировать транскрипцию, как и комплекс гормон—рецептор. Связывание гормона с рецептором, видимо, устраняет ингибирующее влияние рецепторного домена. Центральный домен взаимодействует с определенными участками ДНК — гормон-чувствительными регуляторными элементами, которые стимулируют или тормозят транскрипцию соседних генов. Гормон-чувствительные регуляторные элементы ДНК специфичны по отношению к определенным рецепторам: например, во всех генах, транскрипция которых регулируется глюкокортикоидами, последовательность нуклеотидов в этих регуляторных элементах почти одинакова. Функция N-концевого домена менее изучена. В его отсутствие регулирующее действие гормон-рецепторного комплекса на транскрипцию ослабевает. Каждый из трех доменов функционирует в значительной степени независимо от двух других. Наглядный пример тому — химерные рецепторы. Их гормонсвязывающая и регуляторная активность такая же, как и у рецепторов, от которых был взят соответствующий домен.
Системы вторых посредников[править | править код]
цАМФ. В интеграции внешних сигналов участвуют также системы вторых посредников. Хотя рецепторов и белковых сигнальных молекул известно гораздо больше, чем вторых посредников, последние задействованы во множестве путей внутриклеточной передачи сигнала. К наиболее изученным вторым посредникам относятся цАМФ, цГМФ, Са2+, ИФ3, ДАГ, N0. Эта группа разнородных соединений постоянно пополняется. Вторые посредники взаимодействуют напрямую (изменяя метаболизм друг друга) или косвенно (воздействуя на одни и те же внутриклеточные мишени). Благодаря таким на первый взгляд сложным регуляторным механизмам отдельные внешние сигналы или их сочетание приводят в действие интегрированные системы вторых посредников, вызывая согласованную клеточную реакцию. Функцию вторых посредников, а также регуляцию их образования (или высвобождения), расщепления и выведения из клетки удобно рассматривать на примере цАМФ. Этот второй посредник синтезируется под действием аденилатциклазы при активации многих рецепторов, сопряженных с G-белками. Gj-белок активирует аденилатциклазу, Gj-белок — ингибирует.
Существует не менее десяти тканеспецифичных изоформ аденилатциклазы, различающихся по механизмам регуляции активности. Некоторые изоформы активируются или ингибируются комплексом из β- и у-субъединиц G-белка. Поскольку эти субъединицы общие у всех G-белков, активность аденилатциклазы могут регулировать не только Gr и Gj-белки, но и другие типы G-белков. Другие изоформы стимулируются Са2+ или Са2+-кальмодулиновым комплексом. Разница в механизмах регуляции активности аденилатциклазы (они могут включать фос-форилирование и другие регуляторные влияния) обеспечивает широкий спектр регуляторных влияний на разные клетки-мишени. цАМФ гидролизуется под действием фосфодиэстераз и выводится из клетки с помощью нескольких мембранных транспортных белков. Фосфодиэстеразы относятся к белковым сигнальным молекулам; их активность регулируется на уровне транскрипции, а также при взаимодействии со вторыми посредниками (цАМФ, цГМФ, Са2+) и другими сигнальными белками.
Как правило, цАМФ активирует протеин киназы А (цАМФ-зависимые протеинкиназы) — небольшую группу родственных белков. Эти протеинкиназы, в свою очередь, фосфорилируют не только конечные внутриклеточные мишени (ферменты, транспортные белки), но и другие протеинкиназы и прочие регуляторные белки. К последним относятся, например, факторы транскрипции. Они отвечают за опосредованную цАМФ регуляцию транскрипции генов, обеспечивая отсроченную клеточную реакцию на сигнал. Помимо активации протеинкиназ цАМФ воздействует непосредственно на мембранные катионные каналы, играющие важную роль, в частности, в функционировании обонятельных нейронов. Таким образом, сигнал от цАМФ вызывает цепь биохимических изменений в клетке-мишени.
Кальций. Еще один хорошо изученный второй посредник — внутриклеточный Са2+. Ионы Са2+ поступают в цитоплазму разными путями: по мембранным каналам (зависимым от G-белков, потенциалзависимым, регулируемым К+ либо самим Са +), а также по каналам, расположенным в особых участках эндоплазматического ретикулума и открывающимся под действием ИФ3, а в скелетных мышцах — в результате деполяризации мембраны. Удаление кальция из цитоплазмы происходит двумя путями: он поглощается эндоплазматическим ретикулумом или выводится из клетки. Са2+ передает сигналы гораздо большему числу белков, чем цАМФ — ферментам, участвующим в клеточном метаболизме, протеинкиназам, кальцийсвязывающим белкам. Последние взаимодействуют с другими конечными и промежуточными эффекторами.
Классификация рецепторов[править | править код]
Традиционно рецепторы лекарственных средств выявляли и классифицировали на основании эффектов и относительной активности действующих на эти рецепторы избирательных агонистов (стимуляторов) и антагонистов (блокаторов). Например, эффекты ацетилхолина, которые воспроизводятся при взаимодействии с холинорецепторами алкалоида мускарина и блокируются атропином, называют мускариновыми эффектами, а эффекты, которые воспроизводятся при взаимодействии с холино-рецепторами никотина, — никотиновыми эффектами. Рецепторы, которые опосредуют действие мускарина и никотина, получили название соответственно М- и N-xoлинорецепторов. Хотя подобная классификация обычно не отражает механизм действия лекарственных средств, она удобна для систематизации их эффектов. Действительно, утверждение, что лекарственное средство стимулирует рецепторы определенного типа, одновременно определяет спектр эффектов данного препарата и вещества, усиливающие или ослабляющие эти эффекты. Однако правомочность таких утверждений может меняться с обнаружением новых типов и подтипов рецепторов, открытием дополнительных механизмов действия лекарственного средства или ранее неизвестных побочных эффектов.
Подтипы рецепторов. С появлением все более разнообразных, высокоизбирательных лекарственных средств стало ясно, что ранее известные типы рецепторов делятся на множество подтипов. Существенным подспорьем в изучении новых подтипов рецепторов стали методы молекулярного клонирования, а получение рекомбинантных рецепторов облегчило создание избирательно действующих на эти рецепторы лекарственных средств. Разные, но родственные подтипы рецепторов часто (хотя и не всегда) взаимодействуют с разными агонистами и антагонистами. Рецепторы, для которых избирательные агонисты и антагонисты не обнаружены, обычно относят не к отдельному подтипу, а к изоформам одного и того же рецептора. Отдельные подтипы могут различаться и по механизмам внутриклеточной передачи сигнала. М1 - и М3-холинорецепторы, например, действуют через белок Gq, который активирует фосфолипазу С и опосредованно вызывает выброс Са2+ из внутриклеточных депо, а М2- и М4-холинорецепторы — через белок Gj, который ингибирует аденилатциклазу. Впрочем, деление рецепторов на типы и подтипы зачастую определяется не механизмом действия, а случайным выбором или устоявшимися представлениями. Так, a1, а2- и β-адренорецепторы различаются по реакции на лекарственные средства и по механизму передачи сигнала (активируют соответственно белки Gj, Gq и GJ, хотя а- и β-адренорецепторы относят к разным типам, а а1- и а2-адренорецепторы — к разным подтипам внутри одного типа. Изоформы а1-адренорецепторов — а1А, а1В и а1D — мало различаются по своим биохимическим свойствам; то же самое можно сказать и об изоформах разных подтипов p-адренорецепторов (β1,β2 и β3).
Различия между подтипами рецепторов используют для создания высокоизбирательных лекарственных средств, например препаратов, оказывающих разное действие на одну и ту же ткань благодаря связыванию с подтипами рецепторов, различающихся механизмами внутриклеточной передачи сигнала. Кроме того, лекарственные средства могут избирательно воздействовать на определенные клетки или ткани, экспрессирующие рецепторы того или иного подтипа. Чем больше избирательность лекарственного средства (по отношению к определенной ткани или по отношению к определенному эффекту), тем более благоприятно соотношение его пользы и нежелательных эффектов.
С помощью молекулярно-генетических методов были открыты не только разные изоформы рецепторов, но и гены, кодирующие новые, ранее неизвестные рецепторы. Многие из этих рецепторов уже отнесены к тому или иному известному классу, а их функция изучена с помощью соответствующих лигандов. Однако для некоторых рецепторов лиганды до сих пор не найдены. Есть надежда, что выяснение физиологических функций таких рецепторов и обнаружение эндогенных лигандов позволит разработать новые лекарственные средства для борьбы с пока неизлечимыми болезнями.
Открытие множества изоформ одного и того же рецептора, кодируемых разными генами (особенно если эти изоформы не различаются по механизмам внутриклеточной передачи сигнала и взаимодействуют с одними и теми же эндогенными лигандами), заставляет задуматься об их функции. Возможно, разнообразие генов, кодирующих разные изоформы одного рецептора, необходимо для того, чтобы независимо регулировать экспрессию рецепторов в разных клетках в соответствии с потребностями организма в разные возрастные периоды. Так или иначе, выявление лигандов, избирательно действующих на те или иные изоформы рецептора, откроет новые возможности для целенаправленного медикаментозного лечения.
Действие лекарственных средств, не опосредованное рецепторами[править | править код]
Не все лекарственные средства действуют через макромолекулярные структуры — рецепторы. Некоторые препараты взаимодействуют с небольшими молекулами или ионами, присутствующими в организме в норме либо при том или ином патологическом состоянии. Так, антациды нейтрализуют соляную кислоту в желудке. Месна (препарат, который быстро выводится почками и нейтрализует свободные радикалы) связывается с активными метаболитами некоторых противоопухолевых средств, уменьшая таким образом их побочное действие на мочевые пути (гл. 52). Действие другихлекарственных средств зависит не от их химического строения, а от их коллигативных свойств. Так, некоторые биологически малоактивные вещества (например, маннитол) можно вводить в количествах, достаточных для повышения осмоляльности биологических жидкостей, и таким образом менять распределение внеклеточной и внутриклеточной жидкости (гл. 29). С помощью этих веществ можно усилить диурез, увеличить ОЦК, устранить отек головного мозга. Кроме того, их применяют в качестве слабительных.
Некоторые лекарственные средства могут встраиваться в компоненты клетки и изменять их функции благодаря структурному сходству с входящими в состав этих компонентов веществами. Например, аналоги пуринов и пиримидинов встраиваются в нуклеиновые кислоты и используются в качестве противовирусных и противоопухолевых средств (гл. 50 и 52).