Пептид F — различия между версиями
Admin (обсуждение | вклад) |
Admin (обсуждение | вклад) (→Пептид F) |
||
| Строка 1: | Строка 1: | ||
{{Эндокринология}} | {{Эндокринология}} | ||
== Пептид F == | == Пептид F == | ||
| + | |||
| + | ''Читайте также:'' [[Гормон роста или пептиды (сравнение)|пептиды]] - виды, применение, исследования. | ||
Чтобы оценить возможные физиологические функции пептида F, очень важно понимать некоторые фундаментальные аспекты строения молекулы-предшественника проэнкефалина и ее превращений, приводящих к образованию этого пептида. Полипептид препроэнкефалин (мол. масса 30 кДа) является предшественником энкефалинов ([Met]- и (Lеu-энкефалинов), а также энкефалинсодержащих пептидов и обнаруживается в организме человека в головном мозге, тканях мозгового слоя надпочечников, активированных Т-лимфоцитах и молекулах гемоглобина (Hughes et al., 1975; Kimura ct al., 1980; Brantl etal., 1986; Zurawski et al., 1986; Martin et al., 1987: Ivanov et al., 1997; Zhao et al., 1997). | Чтобы оценить возможные физиологические функции пептида F, очень важно понимать некоторые фундаментальные аспекты строения молекулы-предшественника проэнкефалина и ее превращений, приводящих к образованию этого пептида. Полипептид препроэнкефалин (мол. масса 30 кДа) является предшественником энкефалинов ([Met]- и (Lеu-энкефалинов), а также энкефалинсодержащих пептидов и обнаруживается в организме человека в головном мозге, тканях мозгового слоя надпочечников, активированных Т-лимфоцитах и молекулах гемоглобина (Hughes et al., 1975; Kimura ct al., 1980; Brantl etal., 1986; Zurawski et al., 1986; Martin et al., 1987: Ivanov et al., 1997; Zhao et al., 1997). | ||
Текущая версия на 13:57, 27 февраля 2014
Источник:
Эндокриная система, спорт и двигательная активность.
Перевод с англ./под ред. У.Дж. Кремера и А.Д. Рогола. - Э64
Издательство: Олимп. литература, 2008 год.
Содержание
- 1 Пептид F
- 2 Совместная секреция пептида F и адреналина мозговым слоем надпочечников
- 3 Влияние занятий физическими упражнениями на выработку проэнкефалинов в мозговом слое надпочечников
- 4 Влияние занятий физическими упражнениями на пептид F в других биологических компартментах крови
- 5 Заключение
- 6 Литература
Пептид F[править | править код]
Читайте также: пептиды - виды, применение, исследования.
Чтобы оценить возможные физиологические функции пептида F, очень важно понимать некоторые фундаментальные аспекты строения молекулы-предшественника проэнкефалина и ее превращений, приводящих к образованию этого пептида. Полипептид препроэнкефалин (мол. масса 30 кДа) является предшественником энкефалинов ([Met]- и (Lеu-энкефалинов), а также энкефалинсодержащих пептидов и обнаруживается в организме человека в головном мозге, тканях мозгового слоя надпочечников, активированных Т-лимфоцитах и молекулах гемоглобина (Hughes et al., 1975; Kimura ct al., 1980; Brantl etal., 1986; Zurawski et al., 1986; Martin et al., 1987: Ivanov et al., 1997; Zhao et al., 1997).
Пептид F — энкефалинсодержащий пептид с молекулярной массой 3,8 кДа является продуктом постгрансляционных превращений препроэнкефалина, а именно серии ферментативных реакций с участием трипсина (расщепление N-конца молекулы) и карбоксипептидазы (расщепление карбоксильного конца молекулы) (Undcnfriend, Kilpatrick, 1984). В крови пептид F — наиболее часто встречающийся пептидный продукт предшественника проэнкефалина (Kilpatrick et al., 1980, 1981; Wasserman ct al., 1986). Он состоит из 37 аминокислотных остатков (аминокислотные остатки 107—140) и содержит две [Met]-энкефалиновые структуры (Lewis, 1982; Lewis, Stern, 1983), а также обладает структурным сходством с классическими опиатами (Hansen, Morgan, 1984). Опиоидные пептиды обычно выполняют в головном мозге роль нейротрасмиттеров, а [Met]- и Lеu-энкефалины являются наиболее распространенными конечными продуктами.
Интересно, что прорыв в изучении молекулы-прекурсора препроэнкефалина стал очевидным после появления сообщения с упоминанием о возможных предшественниках энкефалинов — |Met]- и Leu-энкефалинах, секреция которых происходит в мозговом слое надпочечников (Kimura t al., 1980). Обнаружение нескольких фрагментов в головном мозге еще более затруднило определение структуры молекулы-предшественника. Энкефалинсодержащие пептиды, которые образуются в ходе биохимических превращений проэнкефалина в центральной нервной системе, не могут объяснить высокого общего количества этих пептидов в системе кровообращения (Lewis, Stem, 1983). Однако в наибольших количествах Met- и Leu-энкефалины образуются в результате превращений, происходящих в центральной нервной системе (Lewis, 1982; Lewis, Stern, 1983). Открытие дополнительных фрагментов проэнкефалина в мозговом слое надпочечников привело к более точному биохимическому определению последовательности предшественника препроэнкефалина и пониманию потенциальных физиологических ответов на стресс. В то время также появилась мысль о том, что транспорт более лабильных энкефалинов происходит в составе фрагментов с большей молекулярной массой (например, пептида F), поскольку энкефалин-содержащие пептиды характеризуются значительно большим временем существования в кровеносной системе (т. с. 15—60 мин) по сравнению с небольшими [Met]- и Leu-энкефалинами (1—2 мин) (Kilpatrick et al., 1980; Kimura et al., 1980; Boarder, McArdlc, 1986).
Транспортировка пептидов с молекулярной массой 3—8 к Да в кровеносной системе облегчается наличием и их составе неэнкефалиновых участков (Boarder, McArdle, 1986), которые увеличивают время существования этих пептидов в плазме. Роль |Met|- и | Leu |-энкефалипов в периферических тканях является в лучшем случае спекулятивной из-за высокой подверженности протеазной деградации, которая происходит в течение 1—2 мин (Kraemer et al., 1997). Таким образом, большой размер пептида F наряду с большей продолжительностью существования в крови (15 — 60 мин) обеспечивает возможность для выполнения физиологических функций в периферической системе кровообращения (например, обмен информацией между различными биологическими системами организма).
Совместная секреция пептида F и адреналина мозговым слоем надпочечников[править | править код]
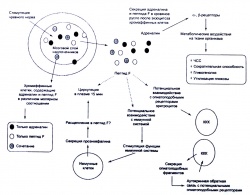
Пептид F запасется вместе с адреналином в хромаффинных гранулах клеток мозгового слоя надпочечников (Vivcros et al., 1979; Lewis, Stem, 1983). Вместе с тем механизмы биохимических связей и причины эквивалентного молярного соотношения адреналина и пептида F в хромаффинных клетках малопонятны. Взаимосвязь, обусловленная совместным местом запасания адреналина и пептида F, может обеспечивать возможный механизм раздельной секреции этих нейрогормонов клетками надпочечников в ответ на стресс. Известно, что расщепление препроэнкефалина с участием трипсина и карбоксипептидазы р в мозговом слое надпочечников происходит в течение 2 ч с момента синтеза предшественника препроэнксефалина, а также что его фрагмент — пептид F появляется в хромаффинных гранулах на протяжении 2 ч после синтеза предшественника (Wilson, 1991). Тетрабеназин, который, как показано, ингибирует поступление адреналина в запасающие везикулы, не оказывает никакого влияния на транспорт в везикулы фрагментов проэнкефалина. Более того, он способствует ассимиляции энкефалинсодержащих пептидов (Wilson, 1991). Эти исследования позволяют предполагать, что пептид F является, вероятно, не единственным продуктом, который ассимилируется хромаффинными везикулами, и что остановка процесса ассимиляции может зависеть от совместного поглощения с адреналином (Wilson, 1991).
Исследования показали, что совместная секреция адреналина и энкефалинсодержащих фрагментов может происходить в культивируемых хромаффинных гранулах надпочечников (Schultzberg et al., 1978; Livett A.R. et al., 1981). Такая совместная секреция при однотипной физиологической стимуляции также подчеркивает важность биологической роли пептида F при стрессе. Кроме того, возможно, что пептид F и адреналин обладают комплементарным воздействием на различные биологические ткани-мишени. Например, и адреналин (McCarthy, Dale, 1988) и пептид F (Hiddinga et al., 1994) оказывают модулирующее воздействие на иммунную систему. Возможно, здесь имеет место совместное действие, подобное наблюдаемому в случае других нейрогормонов и пептидов, которые накапливаются и секретируются совместно, а также обладают разнородной или однотипной биологической активностью: например, инсулин и серотонин в панкреатических р-клетках у человека (Richter et al., 1986) или нейропептид Y и норадреналин в симпатических нервных волокнах у быка (Bastiaensen et al., 1988; De Potter et al., 1988).
Адреналин является в организме основным гормоном стресса. Его биосинтез и секреция могут оказывать влияние на секрецию и появление в крови пептида F (Kraemer et al., 1985b, 1991). Наряду с необходимостью изучения механизмов превращений и накопления пептида F не менее важным является изучение механизмов биосинтеза адреналина, поскольку между этими нейрогормонами существует тесная связь. Адреналин может влиять на ферментативные превращения вновь синтезированного препроэнкефалина и, следовательно, также на совместное запасание пептида F (Wilson, 1991). Установлено, что фармакологические препараты и нейротрансмиттеры способны активировать синтез проэнкефалина в хромаффинных клетках (Wilson et al., 1982; Wilson, 1991). В частности, было обнаружено, что ингибиторы транспорта катехоламинов через везикулярную мембрану (тетрабеназин и респерин) стимулируют процессы превращений проэнкефалина и благодаря этому повышают количество энкефалинсодержащих пептидов в хромаффинных клетках. Эти данные свидетельствуют о том, что адреналин или, возможно, другие вещества в хромаффинных клетках (например, аденозинтрифосфат) могут угнетать процессы ферментативного превращения проэнкефалинов. Таким образом, функционирование подобного механизма может изменять молярное соотношение пептида F и адреналина в различных хромаффинных клетках.
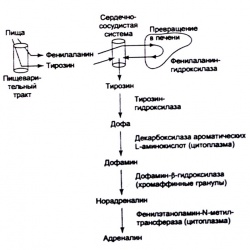
Очень важно понимать, каким образом происходит образование адреналина. Вкратце, катехоламинами называются амины, имеющие в составе молекулы 3,4-дигидроксифенильное ядро. Они являются производными аминокислоты тирозина. Образование тирозина также может происходить путем ферментативного превращения фенилаланина в печени при участии фенилаланингидроксилазы. Источник тирозина и фенилаланина — богатая белками пища. Адреналин образуется преимущественно в мозговом слое надпочечников. В то же время ферменты, необходимые для его синтеза, обнаруживаются в небольших количествах также в нейронах центральной нервной системы. Норадреналин находится преимущественно в центральной нервной системе, где он выполняет роль нейротрансмиттера в симпатических нейронах как возбуждающих, так и тормозных. Адреналин составляет около 80 % катехоламинов, синтез которых происходит при стимуляции в мозговом слое надпочечников, оставшиеся 20 % приходятся на долю норадреналина.
Исходным этапом биосинтеза адреналина является превращение тирозина в 3,4-дигидроксифснилаланин (дофа) с помощью фермента тирозингидроксилазы, фосфорилиронание и активация которой происходит при стимуляции клеток ацетилхолином. В присутствии декарбоксилазы ароматических L-аминокнслот происходит декарбоксилирование дофа с образованием дофамина. Два упомянутых выше фермента находятся в цитозоле клеток мозгового слоя надпочечников, где и происходят все эти реакции. Затем дофамин переносится в гранулы и там после гидроксилирования с участием дофамин-p-гндроксилазы, расположенной на мембране гранулы, он превращается в норадреналин. Норадреналин возвращается в цитозоль для превращения в адреналин путем метилирования, в котором принимает участие фенилэтаноламин-N-метилтрансфeраза, использующая в качестве донора метальной группы S-аденозил-L-метионин. После этого адреналин возвращается в гранулы для накопления и подготовки к секреции. Процесс транспорта зависит от энергии, поставляемой АТФазопротонным насосом. Катехоламины в гранулах образуют комплексы с АТФ и хромогранином А, что предотвращает самостоятельный выход запасаемых гормонов из гранул.
На периферии (т. с. в надпочечниках) адреналин, норадрeналин и дофамин действуют как нейрогормоны, тогда как в центральной нервной системе они выполняют функцию нейротранeмиттeров. Время полураспада адреналина в плазме составляет около 1 —2 мин. Концентрация адреналина в плазме в состоянии покоя составляет -0,05 нг-мл"1 и может возрастать во время выполнения физических упражнений до -0,27 — 4,1 нг-мл'1. Адреналин вызывает состояние эйфории, является компонентом быстрой реакции на стресс (“fight or flight response"), а также влияет на сократительную функцию сердца и скелетных мышц. Адреналин повышает ЧСС, приток крови к скелетным мышцам, увеличивает уровень метаболизма, а также способствует повышению уровня утилизации энергетических субстратов посредством стимуляции выделения глюкозы и свободных жирных кислот в кровь. Адреналин связывается с рецепторами на поверхности плазматической мембраны клетки-мишени, взаимодействуя как с а- (а1, а2), так и с бета (бета1, бета2, бета3) адренергическими рецепторами. Адреналин обладает высокой степенью сродства к Р2-рецепторам, расположенным на клетках-мишенях, которые не имеют иннервации. Такие рецепторы опосредуют выработку лактата и расширение сосудов в скелетных мышцах. Роль выброса адреналина может не совпадать с ролью пептида F, поскольку характер ответа на стресс у этих двух нейрогормонов несколько отличается (Кгаешег et al., 1985b, 1991). Это становится очевидно если результаты количественной оценки уровня этих гормонов представить в виде молярного соотношения пептида F к адреналину. Снижение молярного отношения (которое обычно наблюдается во время занятий физическими упражнениями) указывает на преобладание секреции адреналина, тогда как увеличение (обычно наблюдается в период восстановления) говорит о преобладающей секреции пептида F. Однако не следует забывать о том, что различные хромаффинные клетки могут содержать каждый нейрогормон в различном количестве (Wilson et al., 1982; Livett B.G., 1984) либо секретировать их избирательно при стимуляции. Показано, что адреналин играет более важную роль во время занятий физическими упражнениями (Kjaer et al., 1985; Brooks et al., 1988; Kjaer, Gaibo, 1988), а пептид F может иметь большее значение в период восстановления после физической нагрузки (Kracmer et al., 1985b, 1991). Различия в характере секреции могут объяснять важные биологические функции. Существует возможность, даже несмотря на совместное хранение и секрецию адреналина и пептида F в ответ на аналогичные стимулы, они могут оказывать различное физиологическое воздействие на одни и тс же биологические системы организма.
Физиологическая роль пептида F[править | править код]
Несмотря на то что пептид F содержит две последовательности Met-энкефалина, он обладает весьма слабым ответом в классических тестах на действие опиатов (Lewis, Stem, 1983), поэтому присутствие последовательностей Met-энкефалина в составе пептида F не обязательно признак наличия энкефалино-подобных функций. Участки пептида F, не имеющие отношения к энкефалину, являются определяющими в отношении его функций, поскольку могут представлять собой основные последовательности для связывания с этой молекулой.
В настоящий момент одним из наиболее важных доводов в пользу необходимости изучения характера секреции пептида F является его взаимодействие с иммунной системой (Hiddinga et al., 1994; Triplctt-McBride ct al., 1998). Кроме того, вполне возможно, что такое взаимодействие может происходить в биологических компартментах крови. Показало, что пептид F взаимодействует с in vitro с Т- и В-клетками (Hiddinga et al., 1994), а также имеет отношение к активации В-клеток и индивидуальному уровню физической подготовленности (Triplett-McBride et al., 1998).
Достаточно большая продолжительность существования пептида F в крови продлевает его биологическую способность к взаимодействию с различными компартментами крови и иммунной системы. Вместе с тем иммунная система не может быть единственным местом воздействия для пептида F. Поскольку в данном направлении исследования все еще продолжаются, могут быть обнаружены и другие ткани-мишени и места воздействия этого фрагмента проэнкефалина.
Сообщалось о возможной роли пептида F в качестве регуляторного нейрогормона иммунной системы (Hiddinga et al., 1994). В отличие от Mеt-энкефалина, который оказывает подавляющее действие на иммунную систему (Johnson et al., 1982; Marotti et al., 1993), пептид F ее стимулирует (Hidinga et al., 1994). Исследования in vitro, проведенные с использованием физиологических концентраций очищенного пептида F, продемонстрировали, что после 15 мин инкубации этого вещества с Т-клетками происходило увеличение формирующих антитела В-клеток в культуре, существенно усиливающее клеточный ответ лимфоцитов, связанный с формированием антигенспецифических антител в ответ на воздействие тринитрофенил-Фиколлом (TNP-Ficoll) в качестве антигена (51 нг-мл'1). Эксперименты на бестимусных мышах с мутацией nude (мышах с замедленным и дефективным развитием Т-клеток) показали, что пептид F непосредственно участвует в модификации иммунного ответа на клеточном уровне (т. е. активации Т-клеток), а не на гуморальном (т. е. продукция антител В-клетками). Эти результаты свидетельствуют о том, что лимфоциты могут быть возможной мишенью для пептида F и их взаимодействие приводит к усилению иммунной функции.
Методы идентификации рецептора пептида F[править | править код]
Конкурентное связывание с налоксоном. Была предпринята попытка непрямой идентификации возможного рецепторного механизма для пептида F посредством конкуренции с налоксоном (Hiddinga et al., 1994). Налоксон является антагонистом для опиатных рецепторов (например, по отношению к [ Met]-энкефалину) (Simonds, 1988). Спленоциты мышей обрабатывали либо пептидом F, либо Met-энкефалином для определения тех молекул, которое оказывают более выраженное влияние на клеточный ответ В-клеток, связанный с формированием антител. Налоксон добавляли в финальной концентрации 0,1; 1,0 и 10,0 мкмоль (т. е. в 10—1000 раз превышающей концентрацию пептида F или Met-энксфалина в плазме). При концентрации 10 нмоль очищенный пептид F и Met-энкефалин соответственно приводили к стимуляции и подавлению образования антител В-клетками. Для активации лимфоцитов антигены (1 %-е эритроциты овцы или TNP-Ficoll) добавляли к культуре в оптимальной (51 нг-мл"1) или субоптимальной концентрации (5 нг-мл"1) через 15 мин инкубации в присутствии налоксона (10 мкмоль) или пептида F (10 нмоль). Налоксон не подавлял формирование антител В-клетками, стимулированное пептидом F. Эго означает, что пептид F может взаимодействовать не с опиоидным рецептором (т. е. рецептором опиоидных пептидов) лимфоцитов, а с другим, природу которого еще предстоит установить. Met-энксфалин вызывал подавление образования антител В-клетками и этот эффект блокировался предварительной инкубацией в присутствии налоксона. Это говорит о том, что энкефалин с небольшой молекулярной массой связывается с опиатным рецептором лимфоцитов (Sibinga, Goldstein, 1988). Для ответа на вопрос, насколько важным фактором является концентрация каждого из исследованных веществ, пептид F и Met-энкефалин добавляли к культуре одновременно в эквимолярной концентрации (10 нмоль) в присутствии налоксона. [Met]-энкефалин снова вызывал подавление образования антител В-клетками, и этот его эффект подавлял налоксон. Однако пептид F стимулировал увеличение выработки антител и налоксон не устранял этого эффекта. Это еще раз предполагает возможность существования различных механизмов взаимодействия с рецепторами одной и той же иммунной клетки. Вполне вероятно, что налоксон ингибирует иммуносупрессивное действие Met-энкефалина, чем усиливает иммуностимулирующий эффект пептида F. Эти данные предполагают также, что несмотря на наличие в составе пептида F последовательностей Met-энкефалина, пептид F, вероятнее всего, не взаимодействует с опиоидными рецепторами лимфоцитов. Возможно, для связывания с рецептором большое значение имеют другие участки пептида F (Roth et al., 1989). Эта серия исследований оказалась очень успешной в определении и локализации возможных мест связывания с рецепторами и/или воздействия пептида F, которые до настоящего времени изучены недостаточно. Результаты подобного рода, а также эффекты пептида F на иммунные клетки обосновывают необходимость дальнейших исследований, поскольку пептид F был обнаружен в поддающихся оценке количествах в таком биологическом компартменте крови, как белые кровяные клетки.
Иммунохимический анализ с использованием проточной цитометрии. Со времени этих исследований в 1980-х гг. разработаны и другие методологические подходы для определения рецептора пептида F на иммунных клетках (Bush et al., 2006). Было обосновано предположение, что иммунные клетки, чувствительные к действию пептида F, должны иметь рецепторы для этого вещества. Для одновременного выявления клеток, обнаруживающих наличие рецептора к пептиду F, и характеристики этого подкласса лейкоцитов был использован метод иммунохимического анализа. Моноклональные антитела, применяемые для идентификации подклассов лейкоцитов человека, имеются в продаже. Для обнаружения пептида F антител не существует. В действительности, эти рецепторы еще даже не охарактеризованы, поэтому был использован косвенный подход с применением порточной цитометрии.
Антитело к гормону (т. е. пептиду F) использовали для обнаружения рецептора, который идентифицировали по наличию взаимодействия с гормоном. Проведена серия экспериментов, включая разнообразные контроли, направленные на оптимизацию системы и проверку ее специфичности. В этих экспериментах варьировали количество пептида F и антител к пептиду F; использовали несколько разных блокирующих буферов для снижения фонового окрашивания; а также проводили проверочные тесты первичных и вторичных антител без добавления экзогенного пептида F. В качестве отрицательного контроля была использована нормальная сыворотка кролика, полученная от нескольких различных животных. Для определения подклассов лейкоцитов использовали технику двойного мечения.
Применяя косвенный подход было обнаружено, что примерно 20—30% лейкоцитов дает позитивный сигнал с антителами на пептид F (Bush et al., 2006). Вторичные антитела не дают никакого сигнала в отсутствие первичных антител, что подтверждает их специфичность. Добавление пептида F к клеткам существенно не изменяет относительного количества клеток, связывающих антитело, что свидетельствует о практически полном насыщении рецепторов эндогенным пептидом. В то же время при использовании вместо первичных антител нормальной сыворотки кролика были получены аналогичные результаты. Маловероятно, что связывание с Fc-peцепторами происходило вследствие преинкубации с сывороткой козы или теленка с целью их блокирования. Нам не удалось добиться снижения связывания нормальной сыворотки кролика до уровня, допускающего определение специфического связывания с пептидом F (Bush et al., 2006). Необходимо проведение дальнейших исследований, направленных на обнаружение рецептора пептида F.
Влияние занятий физическими упражнениями на выработку проэнкефалинов в мозговом слое надпочечников[править | править код]
Было показано увеличение уровня пептида F во время занятий физическими упражнениями (Кгаешег et al., 1985а, 1985b, 1990а, 1991; Bush et al., 1998, 2006; Triplett-McBride et al., 1998). В трех из этих исследований сравнивали изменение уровня пептида F у мужчин с различным уровнем физической подготовленности (Кгаешег et al., 1985а, 1985b, 1992). Характер секреции пептида F у нетренированных мужчин в ответ на занятия на велоэргометре со ступенчатым увеличением нагрузки до V02peak (ступень — 8 мин) сопровождался повышением концентрации пептида F и максимальным увеличением интенсивности нагрузки примерно через 5 мин после прекращения занятия. Через 15 мин после окончания занятия наблюдалось снижение уровня пептида F, хотя и не до исходного уровня. У мужчин, ранее занимавшихся аэробными тренировками, отмечалось повышение уровня пептида F при интенсивности нагрузки около 50 % V02peak с последующим его снижением при увеличении интенсивности до 100 % V02peak и новым возрастанием через 5 мин после завершения занятия. Через 15 мин после конца занятия концентрация пептида F снижалась, хотя и не до уровня в состоянии покоя (Кгаешег et al., 1985а, 1985b). Дальнейшие исследования с участием женщин дали совершенно иные результаты (Triplett-McBride et al., 1998). В частности, несмотря на использование того же вида двигательной активности (велоэргометр), изменения содержания пептида F в ответ на физическую нагрузку были обнаружены только в группе женщин, занимавшихся ранее физическими тренировками; с максимальным значением при интенсивности нагрузки 80 %. В группе женщин с низким уровнем физической подготовленности никаких колебаний содержания пептида F при выполнении физических упражнений не наблюдалось.
Исследования изменений уровня пептида F в ответ на физические упражнения с применением гипноза показали, что секреция этого нейрогормона не контролируется сознанием (Кгаешег et al., 1992). В этом исследовании также проводили сравнение реакции у тренированных и нетренированных мужчин во время занятий на велоэргометре с интенсивностью нагрузки 25 и 50 % VO,peak. Применение гипноза заключалось во внушении испытуемым того, что они занимаются с более высокой интенсивностью, т. е. 50 и 75 % при реальной интенсивности 25 и 50 % V02peak соответственно. Достоверных различий в содержании пептида F в различных условиях (контроль по сравнению с применением гипноза), а также в состоянии покоя и во время занятий физическими упражнениями обнаружено не было, на основании чего можно предположить, что реальная интенсивность физических упражнений была недостаточной для того, чтобы повлиять на секрецию пептида F, несмотря на внушаемую более высокую интенсивность нагрузки. Другие исследования этой группы (Kraemer et al., 1987, 1988, 1990а, 1991), посвященные изучению изменений секреции пептида F у здоровых мужчин во время занятий физическими упражнениями, показали увеличение уровня этого нейрогормона в случае достаточно большой продолжительности и высокой интенсивности упражнений.
В двух исследованиях в качестве физической нагрузки также использовали занятия на велоэргометре, хотя и применяли различные программы занятий (Кгаешег et al., 1988, 1991). В 1988 г. проанализировали изменения уровня пептида F в ответ на занятия в стационарном режиме (80—85 % V02peak) до наступления утомления в сочетании с применением кофеина, а также при различном атмосферном давлении (условия над уровнем моря, краткосрочный и долговременный ответ на занятия в высокогорных условиях). Было обнаружено, что во время и после занятия на уровне моря наблюдалось наиболее высокое содержание пептида F, а минимальное содержание его отмечалось после приема кофеина при регулярных занятиях в условиях пониженного давления. Результаты этих исследований показали также, что концентрация пептида F после занятия физическими упражнениями как в случае одного, так и после регулярных занятий в условиях пониженного давления, а также после приема кофеина была более низкой по сравнению с концентрацией после занятия на уровне моря. Изменения уровня пептида F на физическую нагрузку были неоднозначными. На уровне моря достоверные различия в количественных оценках содержания пептида F до занятия, во время занятия и после занятия наблюдали только в случае приема кофеина. Для занятия при пониженном атмосферном давлении достоверные отличия были обнаружены только между содержанием пептида F до занятия и во время занятия при условии приема кофеина. В случае регулярных занятий ири пониженном давлении достоверные изменения уровня пептида F выявлены только во время занятия без приема кофеина. Авторы исследования объясняют большую часть этих различий продолжительностью регулярных тренировок при пониженном давлении (17 суток).
Еще в одном исследовании анализировали колебания уровня пептида F и катехоламинов в ответ на занятия на компьютеризированном велоэргометре до наступления утомления при различном уровне нагрузки, оценивавшейся относительно максимальной силы ног (36, 55, 73 и 100 %). Целью данной работы было сравнение характера колебаний уровня пептида F, адреналина, лактата и норадреналина. Достоверное повышение уровня пептида F наблюдали сразу после занятия с интенсивностью нагрузки 36 % максимальной силы ног, которое имело наибольшую продолжительность 3,5 мин. Достоверное увеличение содержания адреналина отмечалось сразу после занятий с интенсивностью нагрузки 35 и 55 %, а также через 15 мин после занятия с интенсивностью 100 %. Эти результаты говорят о том, что колебания уровня пептида F и адреналина часто имеют противоположную направленность при высоком уровне интенсивности упражнений. Кроме того, сразу после занятий независимо от интенсивности упражнений наблюдалось снижение уровня норадреналина: через 5 мин после выполнения упражнений с низкой и средней интенсивностью и через 15 мин после занятий с самым низким уровнем интенсивности, что свидетельствует о различиях в характере изменений уровня норадреналина и энкефалинов в ответ на физическую нагрузку. Подобный характер изменений после занятий всех уровней интенсивности упражнений наблюдали и для общего уровня лактата в крови. Несмотря на то что эти взаимосвязи нельзя считать достоверными, авторы исследования отмечают, что их результаты не согласуются с предположением о совместной секреции этих веществ хромаффинными клетками мозгового слоя надпочечников, поскольку существует возможность избирательного изменения их уровня секреции в ответ на физическую нагрузку.
Еще одно исследование было посвящено анализу изменений уровня пептида F в ответ на занятия на велоэргометре в стационарном режиме (70 % V02max) большой продолжительности (100 мин) до, во время и после акклиматизации к повышенной температуре (Кгаешег et al., 1987). Было обнаружено, что более высокий уровень пептида F при высокой температуре обусловлен снижением его расщепления до Mеt-энкефалина. Достоверных различий в уровне пептида F до и после занятия физическими упражнениями, а также между различными днями проведения теста (до, во время и после акклиматизации) обнаружить не удалось, и это послужило основанием для предположения исследователей о том, что полученные результаты могут быть обусловлены процессом деградации нейрогормона вследствие большой продолжительности занятия. В ходе другого исследования (Кгаешег et al., 1990а) было выявлено, что у здоровых мужчин во время занятия на тредмиле со ступенчатоповышающейся нагрузкой (ступень 7 мин) происходят изменения уровня пептида F, подобные наблюдавшимся в ходе проведенных экспериментах (Kraemer et al., 1985а, 1985b). Основным различием в результатах этих исследований было то, что во время занятий на тредмиле здоровых мужчин содержание пептида F достигало своего пикового значения при максимальной интенсивности нагрузки, тогда как в исследованиях 1985 г. у нетренированных мужчин максимальный уровень нейрогормона наблюдали через 5 мин после окончания занятия на велотренажере. Это можно объяснить различиями в уровне физической подготовленности участников исследования и особенностями двигательной активности: занятие на велотренажере (не связано с вертикальным перемещением массы тела в пространстве) и на тредмиле (связано с вертикальным перемещением массы тела в пространстве).
Характер выполняемых упражнений (аэробные или анаэробные) может влиять на изменения уровня пептида F. Были изучены колебания пептида F в плазме у 10 здоровых, физически активных мужчин в ответ на занятие на вслоэргометре с высокой интенсивностью нагрузки (Kraemer et al., 1992). Использовали 4 различных уровня интенсивности максимальной силы ног: 100 % (эквивалент 318 % V02max в течение 6 с); 73 % (эквивалент 230 % V02max в течение 15 с); 55 % (эквивалент 175 % V02max в течение 45 с); 36 % (эквивалент 115 % V02max в течение 180 с). В этом исследовании был обнаружен избирательный характер секреции адреналина и пептида F в ответ па физическую нагрузку (т. е. содержание адреналина возрастало, тогда как уровень пептида F снижался). При большей продолжительности упражнений (115% V02max в течение 180 с) отмечалось повышение содержания пептида F с последующим восстановлением его исходного уровня 5—15 мин спустя после прекращения выполнения упражнений. Это исследование впервые показало особенности в характере изменений уровня пептида F в ответ на выполнение упражнений анаэробного типа, в частности непродолжительных упражнений на велоэргометре или силовых упражнений с высокой интенсивностью. Эти результаты продемонстрировали, что продолжительность и/или объем упражнений могут влиять на концентрацию пептида F в плазме.
Силовые упражнения по своей сути являются анаэробными. В двух исследованиях изучали изменения уровня пептида F в ответ па силовые упражнения (Bush et al., 1998; Fry et al., 1998): в одном — изменения пептида F в случае перетренировки. Оценку исследуемых лиц проводили после занятия силовыми упражнениями с высокой интенсивностью (перетренировка), сравнивая их с лицами, занимавшимися силовыми упражнениями по низкоинтенсивной тренировочной программе (контроль). Тренировочные занятия с высокой интенсивностью включали выполнение 10 повторений упражнения “приседание” с нагрузкой 1ПМ ежедневно на протяжении двух недель, а тренировочные занятия с низкой интенсивностью — выполнение приседаний с нагрузкой 50 % 1ПМ 1 раз в неделю в течение двух недель и тестирование 1ПМ 1 раз в неделю в течение двух недель. Тестирование с максимальной нагрузкой проводили в начале, середине и в конце 2-недельного тренировочного периода. Участники исследования выполняли повторения непрерывно с нагрузкой 70 % 1ПМ до наступления утомления. Никаких изменений в концентрации пептида F в плазме в ответ на острую физическую нагрузку или перетренировку обнаружено не было. Возможно, что выполнение программы занятий с высокой интенсивностью (перетренировка) сопровождалось адаптационными изменениями в хромаффинной системе мозгового слоя надпочечников. Отсутствие изменений уровня пептида F в ответ на этот тин тренировочного воздействия может быть обусловлено влиянием ингибирующих факторов, оказывающих негативное воздействие на биосинтез проэнкефалинов в хромаффинных клетках (Wilson etal., 1982; Livett B.G., 1984; Wilson, 1991) либо подавлением экзоцитоза пептида F хромаффинными клетками.
Перетренировка может вызывать ослабление функции иммунной системы (Mackinnon, 1992). Силовая тренировка с высокой интенсивностью нагрузки негативно влияет на здоровье и иммунную систему организма, поскольку в ходе таких занятий повышается уровень таких обладающих имуносупрессивным действием гормонов, как кортизон и адреналин (Kuipers, Keizer, 1988; Fry et al., 1991, 1994). Отсутствие повышения концентрации пептида F в плазме в случае перетренировки может оказывать дополнительное негативное влияние на иммунную систему. В такой ситуации уровень пептида F в плазме недостаточный для устранения последствия негативного воздействия на иммунную систему кортизона или адреналина (Kuipers, Keizer, 1988; Fry et al., 1991, 1994).
В другом исследовании использовали программу занятий силовыми упражнениями, включавшую 16 подходов. Мужчины, занимавшиеся ранее силовой тренировкой, выполняли по четыре подхода для каждого из упражнений: жим грудью, тягу в наклоне, брюшной пресс и приседания с нагрузкой 10 ПМ и 15 ПМ. В обоих случаях при нагрузке 10 и 15 ПМ сразу после тренировочного занятия наблюдалось снижение концентрации пептида F в плазме. Через 15 мин после выполнения силовых упражнений с нагрузкой 10 ПМ (но не 15 ПМ) происходило повышение уровня пептида F. Возможно, различия в характере ответных изменений концентрации пептида F вызваны более высокими усилиями, необходимыми для выполнения упражнений с нагрузкой 10 ПМ. В обоих случаях (при нагрузке 10 и 15 ПМ) через 4 ч после окончания тренировочного занятия наблюдалось повышение уровня пептида F на 80 %. Результаты этого исследования свидетельствуют о том, что повышение уровня пептида F в крови может иметь важное значение в восстановительный период после выполнения силовых упражнений со средним уровнем нагрузки благодаря потенциальной стимуляции функции иммунной системы во время репарации поврежденной мышечной ткани (Friden et al., 1983; McCully, Faulkner, 1985; Round et al., 1987; Fielding et al., 1991; Nieman et al., 1995; McBride et al., 1998). В контрольной группе повышения уровня пептида F через 4 ч после тренировочного занятия силовой направленности не наблюдали. Этот результат был довольно удивительным. Можно предположить, что причины этого кроются в повышении выработки и/или секреции пептида F в мозговом слое надпочечников, либо связыванием пептида F с рецепторами в тканях мишенях сразу после секреции.
При исследовании акклиматизации лиц зрелого возраста к повышенным температурам было обнаружено снижение Met-энкефалина в плазме (Kraemer et al., 1987), которое могло быть обусловлено усилением процессов деградации этого пептида в крови либо уменьшением его образования из молекулы предшественника. Энкефалин и опиаты, секреция которых происходит во время стресса (Viveros, Wilson, 1983) и занятий физическими упражнениями (Howlett et al., 1984; Farell et al., 1987), могут принимать участие в ослаблении последствий стрессового воздействия на организм. Складывается впечатление, что существуют достоверные различия в концентрации ферментов, отвечающих за гидролиз энкефалинов, которые являются причиной более высокого их уровня у лиц с более высоким уровнем физической подготовленности (Jaskowski et al., 1989).
Исследования последствий выполнения физических упражнений до наступления утомления выявили повышение уровня Met-энкефалина в плазме и показали, что его величина определяется интенсивностью упражнений (Sommers et al., 1990). Известно, что секреция Met-энкефалина происходит параллельно с секрецией адреналина в надпочечниках (Viveros et al., 1979; Wilson et al., 1982; Wilson, 1991). В исследовании, посвященном изучению характера параллельной секреции Met-энкефалина и адреналина, с использованием физической нагрузки, возрастающей от 70 до 120 % V02max, максимальный уровень адреналина наблюдали через 1 мин после прекращения занятия, в то время как максимальный уровень Met-энкефалина в плазме обнаруживали при средней интенсивности упражнений, при наибольшей интенсивности упражнений наблюдалось его снижение, а через 1 мин после прекращения занятия содержание Met-энкефалина возвращалось к исходному уровню (Boone et al., 1992). Таким образом, как и пептид F, Met-энксфалии по характеру секреции в ответ на физическую нагрузку отличается от адреналина.
Перетренировка определяется как увеличение объема и/или интенсивности нагрузки, которое приводит к снижению физической работоспособности (Fry et al., 1991). Для исследования состояния перетренировки мужчинам зрелого возраста, занимавшимся ранее силовой тренировкой, было предложено выполнять приседания с отягощением, равным 100 % 1 ПМ, на протяжении 2-недельного периода, что привело к снижению у них показателя 1 ПМ и возникновению состояния перетренировки (Fry et al., 1998). В состоянии перетренировки происходило снижение уровня тестостерона и кортизола в плазме, в то же время концентрация СТГ не изменялась. В ответ на выполнение упражнений с высокой интенсивностью в соответствии с программой занятий, приводящей к перетренировке, уровень адреналина повышался (Fry et al., 1994), однако никаких изменений уровня пептида F в состоянии перетренировки не наблюдалось (Fry et al., 1998). Это может свидетельствовать о том, что физическая нагрузка на организм при выполнении силовых упражнений с высокой интенсивностью превосходит возможности секреции пептида F хромаффинными клетками мозгового слоя надпочечников.
Влияние занятий физическими упражнениями на пептид F в других биологических компартментах крови[править | править код]
Существуют сообщения о том, что в случае активации лимфоцитов стимулятором секреции является предшественник проэнкефалина (Roth et al., 1989). Лимфоциты различаются по своему происхождению и особенностям созревания. Они представляют собой подкласс лейкоцитов, включающий Т- и В-клетки, размер которых варьирует в диапазоне 6—10 мкм и которые составляют 20—25 % всех лейкоцитов крови. Эти клетки занимают одно из важных мест в иммунном ответе, в число их функций входят распознавание антигенов, выработка антител к чужеродным антигенам, выработка лимфокинов, цитотоксическое действие и хранение информации о встречавшихся ранее антигенах. Образуются Т-лимфоциты в костном мозге и созревают в тимусе, тогда как В-лимфоциты образуются и созревают в костном мозге и у плода — в печени. Зрелые лимфоциты размножаются при перемещении их в организме во вторичных лимфоидных органах.
Примерно 1—2 % общего количества лимфоцитов циркулируют с кровью в системе кровообращения, что обеспечивает высокую вероятность их столкновения с любыми чужеродными клетками, попадающими в кровь. Во время нахождения в кровеносной системе фрагменты проэнкефалина (например, пептид F) могут взаимодействовать с этими иммунными клетками. В зависимости от своей функции Т-лимфоциты делятся на Т-хелперы и Т-киллеры (Т-лимфоциты, обладающие цитотоксическим действием); В- и Т-лимфоциты различаются по своим функциям в иммунной реакции организма, обеспечивая гуморальный и клеточный иммунитет. Основой клеточного иммунитета является взаимодействие на клеточном уровне и состоит он главным образом в уничтожении чужеродных веществ или антигенов. Гуморальный иммунитет заключается в выработке антител (т. е. иммуноглобулинов), обладающих способностью распознавать антигены (Sigal, Ron, 1994). Очень важно понимать различия, существующие между этими двумя системами иммунного ответа (Hiddinga et al., 1994). В частности, взаимодействие пептидных фрагментов проэнкефалина и Т-клеток вызывает заметный клеточный иммунный ответ, который затем приводит к развитию гуморальной реакции (увеличению количества В-клеток, формирующих антитела).
На основании данных, характеризующих взаимодействие между пептидом F и иммунными клетками (Hiddinga et al., 1994), был разработан план экспериментов, направленных на обнаружение пептида F в белых клетках крови. Было установлено, что прогрессивная физическая нагрузка приводит к повышению концентрации пептида F в плазме (Кгаешег et al., 1985b, 1991). Восемь здоровых мужчин (21,0 ± 1,0) занимались аэробными упражнениями на велоэргометре с интенсивностью 80 % V02max после чего находились в состоянии покоя. Образцы крови отбирали перед началом, в середине, в момент окончания занятия и через 5, 15, 30 и 60 мин после окончания занятия. Как и в предыдущих исследованиях, здесь наблюдалось индуцированное физической нагрузкой увеличение уровня пептида F в плазме через 5 мин после прекращения занятия (Кгаешег et al., 1985а, 1985b). Уникальной особенностью этого исследования было изучение содержания пептида F во фракции белых клеток крови в состоянии покоя после физической нагрузки. Через 30 мин после окончания занятия физическими упражнениями наблюдали снижение количества пептида F (р 0,05) во фракции белых клеток крови. Можно предположить, что на ранних стадиях восстановительного периода после физической нагрузки (5 — 15 мин после прекращения занятия) пептид F связывается с рецепторами иммунных клеток, после чего происходит его интернализация. Это и является возможной причиной снижения его количества через 30 мин после окончания занятия. Присутствие пептида F, обнаруживаемое через 30 мин во фракции белых клеток крови, может быть обусловлено насыщением рецепторов пептида F иммунных клеток.
После занятия физическими упражнениями наблюдалось изменение соотношения концентрации пептида F в плазме крови и во фракции белых клеток крови. Возможно, это обусловлено переходом пептида F из фракции белых клеток крови в плазму либо полным насыщением лимфоцитарных рецепторов пептида F после физической нагрузки (т. е. в момент окончания занятия и через 5 и 15 мин после этого). Эти результаты свидетельствуют о возможном взаимодействии между пептидом F и клетками иммунной системы и влиянии физической нагрузки на содержание пептида F в этих биологических компартментах крови. Эти данные были получены в рамках использования модели аэробной двигательной активности. Было бы интересно провести аналогичное исследование срочного эффекта силовых упражнений на содержание пептида F. Результаты рассмотренного выше исследования подтверждают необходимость изучения содержания пептида F во фракции белых кровяных клеток, а также его изменений в этом биокомпартменте крови после выполнения силовых упражнений, поскольку это может стимулировать секрецию цитокинов, оказывающих не только паракринное, но также и аутокринное воздействие на активированные клетки иммунной системы, позволяющее усиливать экспрессию рецептора для последующей стимуляции (Sigal, Ron, 1994). Несмотря на то что рецептор пептида F до сих пор не обнаружен, вполне вероятно, что этот пептид способен связываться с клетками крови (иммунными клетками). Эритроциты имеют рецепторы для других пептидных гормонов, в частности инсулина и инсулиноподобного фактора роста I (Horuk et al., 1993; Hagino et al., 1994). He исключена также вероятность того, что пептид F может взаимодействовать с этими же рецепторами красных клеток крови либо с еще охарактеризованными опиоидными рецепторами.
В другом исследовании (Bush et al., 2006) изучали реакцию организма мужчин в возрасте 22 ± 0,9 года на силовую тренировку, которая включала 6 подходов приседаний, выполнявшихся на тренажере Смита (Smith-squat machine) с нагрузкой 10 ПМ. Образцы крови для определения содержания пептида F отбирали в исходном состоянии, в момент прекращения занятия и через 15 мин после него. Биокомпартменты крови различались по концентрации пептида F, при этом наибольший уровень пептида (р < 0,05) наблюдался в плазме крови как в исходном состоянии, так и в период восстановления после нагрузки (рис. 16.8). Кроме того, концентрация пептида F во фракции белых клеток крови была выше, чем во фракции эритроцитов (рис. 16.8). Такое соотношение концентраций наблюдалось не только в состоянии покоя, оно сохранялось и после занятий физическими упражнениями.
Концентрация пептида F во фракции белых клеток крови возрастала наряду с заметным увеличением их общего количества. Во время периода восстановления происходило существенное увеличение количества (примерно на 50 %) молекул пептида F на одну белую клетку крови, что свидетельствует о возможном значении взаимодействия пептида F с лейкоцитами. Возможность взаимодействия пептида F с белыми клетками крови подтверждается его способностью связываться с поверхностными мембранными рецепторами иммунных клеток (Sibinga, Goldstein, 1988) и подвергаться последующей интернализации, что приведет к снижению детектируемого пептида F как в плазме, так во фракции лейкоцитов. Увеличение количества молекул пептида F, связанных с иммунными клетками в период восстановления, можно объяснить следующими причинами: а) увеличением экспрессии поверхностных рецепторов иммунной клетки либо б) увеличением выработки и секреции пептида F мозговым слоем надпочечников или клетками иммунной системы, что проявляется в виде повышения концентрации пептида F во фракции лейкоцитов. Изменения детектируемого количества пептида F во фракции эритроцитов может отображать сдвиг в его содержании во всех трех биокомпартментах крови. Однако физиологическая роль изменений содержания пептида F во фракциях белых и красных клеток крови пока остается неясной.
Заключение[править | править код]
Основным механизмом активации выработки и секреции гормонов мозговым слоем надпочечников является стимуляция со стороны нервной системы. Пептид F представляет собой энкефалинсодержащий пептид, который секретируют аффинные клетки мозгового слоя надпочечников. Показано, что секреция пептида F происходит вместе с адреналином во время занятий физическими упражнениями (Kraemer et al., 1985а, 1985b, 1987, 1988, 1990а, 1991, 1992; Bush et al., 1998, 2006; Triplett-McBride, 1998). В то же время секреция этих двух веществ во время и после занятий физическими упражнениями может иметь различный характер (Kraemer et al., 1985b, 1990a, 1991). Следует отметить, что характер секреции пептида F во время и после интенсивной физической нагрузки отличается также у мужчин с различным уровнем физической подготовленности (Kraemer et al., 1985а, 1985b). Биологические функции пептида F в большинстве своем остаются неизвестными, однако установлено, что пептид F может оказывать позитивное влияние на активацию и функции Т-клеток иммунной системы (Hiddinga et al., 1994). Он способствует активации Т-хелперов in vitro и, следовательно, может опосредованно стимулировать увеличение выработки антител В-клетками (Hiddinga et al., 1994). Вместе с тем эти эффекты еще не исследованы in vivo. Мы только начинаем приближаться к осознанию сложности и глубины взаимодействия эндокринной и иммунной систем. Некоторые исследователи предпринимали попытки изучения взаимной регуляции этих систем (Stein et al., 1985; Bateman et al., 1989). Было показано, что Т-клетки имеют рецепторы к энкефалинам (Wybran et al., 1979) и, очевидно, имеют специфические рецепторы пептида F (Hiddinga et al., 1994). Кроме того, было продемонстрировано, что Т-клетки могут синтезировать и секретировать небольшие энкефалинсодержащие пептиды для ауторегуляции собственной функции (Blalock, 1992). Таким образом, вполне возможно, что одна из главных ролей пептида F заключается в стимуляции функции иммунных клеток, направленной на противодействие и уравновешивание подавляющих эффектов других эндокринных гормонов, таких, как кортизол и адреналин. В то время как модуляция содержания эндогенного пептида F может оказывать влияние на различные ткани-мишени, то механизмы регуляции функции мозгового слоя надпочечников, и прежде всего концентрация пептида F, имеет непосредственное отношение к реакции на стресс (физические упражнения).
Литература[править | править код]
- Bastiaensen, Е., Miserez, В. & De Potter, W. (1988) Subcellular fractionation of bovine ganglion stellatum: co-storage of noradrenaline, Met-enkephalin and neuropeptide Y in large ‘dense-cored’ vesicles. Brain Research 442(1), 124-130.
- Bateman, A., Singh, A., Krai, T. & Solomon, S. (1989) The immune-hypothalamic-pituitary-adrenal axis. Endocrine Reviews 10, 92-112.
- Blalock, J.E. (1992) Production of peptide hormones and neurotransmitters by the immune system. Chemical Immunology 52, 1-24. Blalock, J.E. (1994) The syntax of immune-neuroendocrine communication. Immunology Today 15(11), 504-511.
- Boarder, M.R. & McArdle, W. (1986) Breakdown of small enkephalin derivatives and adrenal peptide E by human plasma. Biochemical Pharmacology 35, 1043-1047.
- Boone, J.B., Sherraden, Т., Pierzchala, K., Berger, R. & Van Loon, G.R. (1992) Plasma Met-enkephalin and catecholamine response to intense exercise in humans. Journal of Applied Physiology 73(1), 388-392.
- Brantl, V., Gramsch, C, Lottspeich, F. et al. (1986) Novel opioid peptides derived from hemoglobin: hemorphins. European Journal of Pharmacology 125, 309-310.
- Brooks, S., Bunin, J., Cheetham, M.E. et al. (1988) The responses of the catecholamines and р-endorphin to brief maximal exercise in man. European Journal of Applied Physiology 57, 230-234.
- Bush, J.A., Kraemer, W.J., Mastro, A.M. et al. (1998) Exercise and recovery responses of adrenal medullary neurohormones to heavy resistance exercise. Medicine and Science in Sports and Exercise 31(4), 554-559.
- Bush, J.A., Kraemer, W.J. & Mastro, A.M. (under review) Peptide F immunoreactivity in different circulatory biocompartments after exercise stress (Peptides, in review).
- Coupland, R.E. (1965) The Natural History of the Chromaffin Cell. Longman, London.
- Coupland, R.E. (1972) The chromaffin system. In: Catecholamines: Handbook of Experimental Pharmacology, vol. 33 (Blaschko, H. & Muscholl, E. eds.). Springer-Verlag, Berlin: 16-39.
- De Potter, W.P., Dillen, L., Annaert, W. et al. (1988) Evidence for the co-storage and co-release of neuropeptide Y and noradrenaline from large dense cored vesicles in sympathetic nerves of the bovine vas deferens. Synapse 2(2), 157-162.
- Farrell, P.A., Gustafson, A.B., Morgan, W.P. & Pert, C.B. (1987) Enkephalin, catecholamines, and psychological mode alterations: effect of prolonged exercise. Medicine and Science in Sports and Exercise 19, 347-353.
- Fielding, R.A., Meredith, C.A., O'Reilly, K.P. et al. (1991) Enhanced protein breakdown after eccentric exercise in young and old men. Journal of Applied Physiology 71, 674-679.
- Friden, J., Sjostrom, M. & Ekblom, B. (1983) Myofibrillar damage following intense eccentric exercise in man. International Journal of Sports Medicine 4(3), 170-176.
- Fry, A.C., Morton, A.R. & Keast, D. (1991) Overtraining in athletes, an update. Sports Medicine 12, 32-65.
- Fry, A.C., Kraemer, W.J., Van Borselen, F. et al. (1994) Catecholamine responses to short-term high-intensity resistance exercise
overtraining. Journal of Applied Physiology 77. 941*946
- Fry. A.C., Kraemer, WJ. & Ramsey. L.T. (1998) Pituitary adrenalgonadal responses to high-intensity resistance exercise overtraining. Journal of Applied Physiology 8S(6). 2352-2359.
- Genuth, S.M. (1988) The adrenal glands. In: Physiology (Berne, K M. & Levy, M.N.. eds). C.V. Nlosby Co . St. Louis, Ml: 950-982.
- Magi no, H., Shii, K., Yokono, K. et al. (1994) Enzyme-1 inked immunosorbent assay method for human autophosphorylated insulin receptor: applicability to insulin-resistant states. Diabetes 43(2), 274-280.
- Hansen, P.E. & Morgan, B.A. (1984) Structure*activity relationships in enkephalin peptides. In: The Peptides: Analysis, Synthesis, Biology (Udenfied, S. & Meienhofer, j. eds.). Academic Press, New York: 269-275.
- Hiddinga, HJ., Katzenstein, G.E., Middaugh, C.R. & Lewis, R.V. (1990) Secondary structure characteristics of proenkephalin peptides E, B, and F. Neurochemical Research 15(4), 393-399.
- Hiddinga, H.J., Isaak, D.D. & Lewis, R.V. (1994) Enkephalin-containing peptides processed from proenkephalin significantly enhance the antibody-forming cell responses to antigens. Journal of Immunology 152, 3748-3759.
- Horuk, R., Colby, T.J., Darbonne, W.C., Schall, TJ. & Neote, K. (1993) The human erythrocyte inflammatory peptide (chemokine) receptor. Biochemical characterization, solubilization, and development of a binding assay for the soluble receptor. Biochemistry 32, 5733-5738.
- Howlett, T.A., Tomlin, S., Ngahfoong, L. et al. (1984) Release of P-endorphin and met-enkephalin during exercise in normal women: response to training. British Mcdical Journal 288, 1950-1952.
- Hughes, J., Smith, T.W. Kosterlitz, H. et al. (1975) Identification of two related pentapeptides from the brain with potent opiate agonist activity. Nature 258, 577-579.
- Ivanov, V.T., Karelin, A. A., Philippova, M.M., Nazi mo v, I.V. & Pletnev, V.Z. (1997) Hemoglobin as a source of endogenous bioactive peptides: the concept of tissue-specific peptide pool. Biopolymers 43, 171-188.
- Jaskowski, M.A., Jackson, A.S., Raven, P.B. & Caffrey, J.L. (1989) Enkephalin metabolism: effect of acute exercise stress and cardiovascular fitness. Medicine and Science in Sports and Exercise 21(2), 154-160.
- Johnson, H.M., Smith, E.M., Torres, B.A. & Blalock, J.E. (1982) Regulation of the in vitro antibody response by neuroendocrine hormones. Proceedings of the National Academy of Sciences 79, 4171-4174.
- Kaplan, N.R. (1988) The adrenal glands. In: Textbook of Endocrine Physiology (Griffin, J.E. & Ojeda, S.R., eds.). Oxford University Press, New York: 245-272.
- Katzenstein, G.E., Lund, D., Schultz, P. & Lewis, R.V. (1987) Target tissue distribution of the proenkephalin peptides F, E, and B. Biochemical and Biophysical Research Communications 146, 1184-1190.
- Kilpatrick, D.L., Lewis, R.V., Stein, S. & Udenfriend, S. (1980) Release of enkephalins and enkephalin-containing polypeptides from perfused beef adrenal glands. Proceedings of the National Academy of Sciences USA 77(12), 7473-7475.
- Kilpatrick, D.L., Taniguchi, Т., Jones, B.N., Stern, A.S. & Shively, J.E. (1981) A highly potent 3200 dalton adrenal opioid peptide that contans both a [Metl- and [Leu]-enkephalin sequence. Proceedings of the National Academy of Sciences of the United States of America 78, 3265-3268.
- Kimura S., Lewis, R.V., Stern, A.S. et al. (1980) Probable precursors of ILeulenkephalin and [Metjenkephalin in adrenal medulla: peptides of 3-5 kilodaltons. Proceedings of the National Academy of Sciences USA 77, 1681-1685.
- Kjaer, M. & Galbo, H. (1988) Effect of physical training on the capacity to secrete epinephrine. Journal of Applied Physiology 64, 11-16.
- Kjaer, М., Christensen, N.J., Sonne, B., Richter, E.A. & Galbo, H. (1985) Effect of exercise on epinephrine turnover in trained and untrained male subjects. Journal of Applied Physiology 59, 1061-1067.
- Кгаешег, W.J., Noble, В., Culver, В. & Lewis, R.V. (1985а) Changes in plasma proenkephalin peptide F and catecholamine levels during graded exercise in men. Proceedings of the National Academy of Sciences of the United States of America 82, 6349-6351.
- Kraemer, W.J., Noble, B., Robertson, K. & Lewis, R.V. (1985b) Response of plasma proenkephalin peptide F to exercise. Peptides 6 (suppl. 2), 167-169.
- Kraemer, WJ., Armstrong, L.E., Marchitelli, L.J., Hubbard, R.W. & Leva, H. (1987) Plasma opioid peptide responses during heat acclimation in humans. Peptides 8, 715-719.
- Kraemer, WJ., Rock, P.B., Fulco, C.S. et al. (1988) Influence of altitude and caffeine during rest and exercise on plasma levels of proenkephalin peptide F. Peptides 9, 1115-1119.
- Kraemer, WJ., Diazdos, J.E., Gordon, S.E. et al. (1990a) The effects of graded exercise on plasma proenkephalin peptide F and catecholamine responses at sea level. European Journal of Physiology 61, 214-217.
- Kraemer, WJ., Marchitelli, L., Gordon, S.E. et al. (1990b) Hormonal and growth factor responses to heavy resistance exercise protocols. Journal of Applied Physiology 69(4), 1442-1450.
- Kraemer, WJ., Patton, J.F., Knuttgen, H.G. et al. (1991) Effects of high-intensity cycle exercise on sympathoadrenal-medullary response patterns. Journal of Applied Physiology 70(1), 8-14. Kraemer, WJ., Lewis, R.V., Triplett, N.T. et al. (1992) Effects of hypnosis on plasma proenkephalin peptide F and perceptual and cardiovascular responses during submaximal exercise. European Journal of Applied Physiology 65, 573-578.
- Kuipers, H. & Keizer, H.A. (1988) Overtraining in elite athletes: review and directions for the future. Sports Medicine 6, 79-92.
- Lewis, R.V. (1982) Enkephalin biosynthesis in the adrenal medulla. In: Regulatory Peptides: from Molecular Biology to Function, vol. 33 (Costa, E. & Trabucchi, М., eds.). Raven Press, New York: 167-174.
- Lewis, R.V. & Stem, A.S. (1983) Biosynthesis of the enkephalins and enkephalin-containing polypeptides. Annual Review of Pharmo-cology and Toxicology 23, 353-372.
- Lewis, R.V., Stem, A.S., Rossier, J.t Stein, S. & Udenfriend, S. (1979) Putative enkephalin precursors in bovine adrenal medulla. Biochemical and Biophysical Research Communications 89, 822-829.
- Livett, A.R., Dean, D.M., Whelan, L.G., Udenfriend, S. & Rossier, J. (1981) Co-release of enkephalin and catecholamines from cultured adrenal chromaffin cells. Nature 289, 317-319.
- Livett, B.G. (1984) Adrenal medullary chromaffin cells in vitro. Physiological Review 64, 1103-1161.
- McBride, J.M., Kraemer, WJ., Triplett-McBride, N.T. & Sebastianelli, W. (1998) The effect of resistance exercise on free radical production. Medicine and Science in Sports and Exercise 30(1), 67-72.
- McCarthy, D.A. & Dale, M.M. (1988) The leukocytosis of exercise: a review and model. Sports Medicine 6, 333-363.
- McCully, K.K. & Faulkner, J. (1985) Injury to skeletal muscle fibers of mice following lengthening contraction. Journal of Applied Physiology 59, 119-121.
- Mackinnon, L.T. (1992) Current Issues in Exercise Science Series: Exercise and Immunology. Human Kinetics, Champaign, IL.
- Marotti, Т., Rabatic, S., Gabrilovac, J. (1993) A characterization of the in vivo immunomodulation by Met-enkephalin in mice. International Journal of Immunopharmacology 15(8), 919-926. Martin, J., Prustowskv, M.B. & Angeletti, R.H. (1987) Preproenkephalin mRNA in T-cells, macrophages, and mast cells. Journal of Neuroscience Research 18, 82-87.
- Nieman, D.C., Henson, D.A., Sampson, C.S. et ah (1995) The acute immune response to exhaustive resistance exercise. International Journal of Sports Medicine 16(5), 322-328.
- Richter, G., Ballmann, M. & Conlon, J.M. (1986) Effect of strepto-zotocin administration upon the serotonin content of the pancreas and small intestines of the rat. Hormone and Metabolic Research 18(10), 663-665.
- Roth, K.A., Lorenz, R.G., Unanue, R.A. & Weaver, C.T. (1989) Nonopiate active proenkephalin-derived peptides are secreted by T helper cells. FASEB Journal 3(12), 2401-2406.
- Round, J.M., Jones, D.A. & Cambridge, G. (1987) Cellular infiltrates in human skeletal muscle: exercise induced damage as a model for inflammatory muscle disease? Journal of the Neurological Sciences 82, 1-11.
- Schultzberg, М., Lund berg, J. М., Hokfelt, T. et al. (1978) Enkephalin-like immunoreactivity in gland cells and nerve terminals of the adrenal medulla. Neuroscience 3, 1169-1186.
- Sibinga, N.E.S. & Goldstein, A. (1988) Opioid peptides and opioid receptors in ceils of the immune system. Annual Review of Immunology 6, 219-249.
- Sigal, L.H. & Ron, Y. (1994) Cytokines. In: Immunology and Inflammation, Basic Mechanisms, and Clinical Consequences (Sigal, L.H. & Ron, Y., eds). McGraw-Hill, New York: 482-490.
- Simonds, W.F. (1988) The molecular basis of opioid receptor function. Endocrine Review 9, 200-212.
- Sommers, D.K., Loots, J.M., Simpson, S.F. et al. (1990) Circulating met-enkephalin in trained athletes during rest, exhaustive treadmill exercise and marathon running. European Journal of Clinical Pharmacology 38(4), 391-392.
- Stein, М., Keller, S.E., Schleiter, SJ. (1985) Stress and immunomodulation: the role of depression and neuroendocrine function. Journal of Immunology 135(2) (suppl.), 827-833.
- Triplett-McBride, N.T., Mastro, A.M., McBride, J.M. et al. (1998) Plasma proenkephalin peptide F and human В cell responses to exercise stress in fit and unfit women. Peptides 19(4), 731-734.
- Udenfriend, S. & Kilpatrick, D.L. (1984) Proenkephalin and the products of its processing: chemistry and biology. In: The Peptides: Analysis, Synthesis, and Biology (Udenfriend, S. & Meienhofer, J., eds), vol. 6. Academic Press, Orlando, FL: 25-67.
- Viveros, O.H. & Wilson, S.P. (1983) The adrenal chromaffin ceil as a model to study the cosecretion of encephalin and catecholamins. Journal of Autonomic Nervous System 7, 41-58.
- Viveros, O.H., Diliberto, EJ., Hazum, E. & Chang, EJ. (1979) Opiate-like materials in the adrenal medulla: evidence for storage and secretion with catecholamines. Molecular Pharmacology 16, 1101-1108.
- Wasserman, K, Beaver, W. & Whipp, B. (1986) Mechanisms and pattern of blood lactate increase during exercise in man. Medicine and Science in Sports and Exercise 18, 344-352.
- Wilson, S.P. (1991) Processing of proenkephalin in adrenal chromaffin cells. Journal of Neurochemistry 57(3), 876-881.
- Wilson, S.P., Chang. KJ. & Viveros, O.R. (1982) Proportional secretion of opioid peptides and catecholamines from adrenal chromaffin cells in culture. Journal of Neuroscience 2(8), 1150-1156.
- Wybran, J., Appelbroom, Т., Famaey, J.P. & Govaert, A. (1979) Suggestive evidence for receptors for morphine and methionine* enkephalin on normal human blood T lymphocytes. Journal of Immunology 123, 1068-1070.
- Yanagihara. N.. Oishi, Y., Yamamoto, H. etal. (1996) Phosphorylation of chromogranin A and catecholamine secretion stimulated by elevation of intracellular Ca2' in cultured bovine adrenal medullary cells. Journal of Biological Chemistry 271(29), 17 463-17 468.
- Zhao, Q., Garreau. I., Sannier, F. & Piot, J.M. (1997) Opioid peptides derived from hemoglobin: hemorphins. Biopolymers 43(2), 75-98.
- Zurawski, G., Benedik, М., Kamb, BJ. et al. (1986) Activation of mouse T-helper cells induces abundant preproenkephalin mRNA synthesis. Science 232, 772-775.