Рецепторы, связанные с G-белками — различия между версиями
Admin (обсуждение | вклад) |
Dormiz (обсуждение | вклад) |
||
| Строка 1: | Строка 1: | ||
| + | {{Шаблон:Наглядная фарма}} | ||
| + | == Механизм действия G-белок-связанных рецепторов == | ||
| + | |||
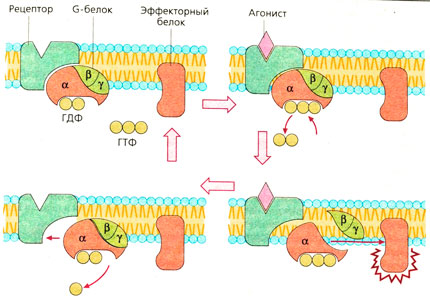
| + | Механизм передачи сигнала одинаков у всех G-белок-связанных [[Рецепторы|рецепторов]] (А). После присоединения [[Агонисты и антагонисты рецепторов|агониста]] к рецептору изменяется конформация рецепторного белка. а-Субъединица отдает ГДФ и присоединяет ГТФ, затем отделяется от двух других субъединиц, вступает в контакт с эффекторным белком и изменяет его функциональное состояние. И β, и у-субъединицы способны связываться с эффекторными белками. а-Субъединица обеспечивает медленный гидролиз связанного ГТФ до ГДФ. Ga-ГДФ не имеет сродства к эффекторным белкам и вновь воссоединяется с β, у-субъединицами (А). | ||
| + | |||
| + | G-Белки могут диффундировать (латерально) в мембрану; они не связаны с определенным типом рецепторов. Тем не менее между типами рецепторов и типами G-белков имеется взаимосвязь (Б). а-Субъединицы G-белков различаются по сродству и типу воздействия на эффекторные белки. Ga-ГТФ Gg-белка стимулирует аденилатцик-лазу, в то время как Ga-ГТФ Gj-белка ее ингибирует. К G-белок-связанным рецепторам относятся мускариновые холинорецепторы, рецепторы к норадреналину, адреналину, допамину, гистамину, морфину, простагландинам, лейкотриенам и другим веществам и гормонам. | ||
| + | |||
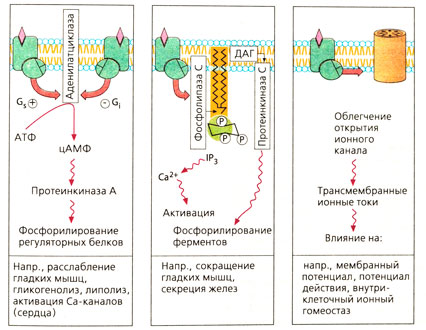
| + | Эффекторными белками для G-белка являются аденилатциклаза (АТФ - внутриклеточный переносчик цАМФ), фосфолипаза С (фосфатидилинозитол -> внутриклеточные переносчики инозитолтрифосфат и диацилглицерин) и некоторые белки ионных каналов (Б). | ||
| + | |||
| + | От концентрации цАМФ в клетке зависит множество функций, так как цАМФ повышает активность протеинкиназы А, которая фосфорилирует регуляторные белки. Кроме того, повышение концентрации цАМФ приводит к расслаблению гладкой мускулатуры, повышению силы сердечных сокращений, усилению гликогенолиза и липолиза. Фосфорилирование белков Са-каналов способствует их открытию при деполяризации мембраны. Необходимо | ||
| + | отметить, что цАМФ инактивируется фосфодиэстеразой. Поэтому ингибиторы этого фермента поддерживают высокую клеточную концентрацию цАМФ и оказывают сходное с адреналином действие. | ||
| + | |||
| + | Кроме того, рецепторный белок может фосфорилироваться и вследствие этого теряет способность активировать G-белок. Данный механизм лежит в основе снижения чувствительности клетки в результате длительной стимуляции рецептора под действием агониста. | ||
| + | |||
| + | Активация фосфолипазы С приводит к расщеплению фосфолипидов мембран (фосфатидилинозитол-4,5-бифосфата) с образованием инозитолтрифосфата (1Р3) и диацил глицерина (ДАГ). Инозитол стимулирует выход Са2+ из депо, что ведет к сокращению гладкой мускулатуры, расщеплению гликогена или экзоцитозу. Диацилглицерин стимулирует протеинкиназу С, которая фосфорилирует определенные серин- и треонинсодержащие ферменты. | ||
| + | |||
| + | Некоторые G-белки воздействуют на белки каналов и способствуют открытию каналов. Таким образом активируются К+-каналы (действие ацетилхолина на синаптическом уровне; влияние опиоидов на передачу возбуждения в нервных клетках). | ||
| + | |||
| + | [[Image:Naglydnay_farma55.jpg|А. Действие агонистов черев G-белки]] | ||
| + | [[Image:Naglydnay_farma56.jpg|Б. G-белки, внутриклеточные переносчики и эффекты]] | ||
| + | |||
== Системы вторичных мессенджеров, связанных с G-белками. == | == Системы вторичных мессенджеров, связанных с G-белками. == | ||
[[Image:Tab1_2.jpg|300px|thumb|right|Система рецепторов, связанных с G-белками]] | [[Image:Tab1_2.jpg|300px|thumb|right|Система рецепторов, связанных с G-белками]] | ||
Текущая версия на 16:51, 26 октября 2014
Источник: «Наглядная фармакология».
Автор: X. Люльман. Пер. с нем. Изд.: М.: Мир, 2008 г.
Содержание
Механизм действия G-белок-связанных рецепторов[править | править код]
Механизм передачи сигнала одинаков у всех G-белок-связанных рецепторов (А). После присоединения агониста к рецептору изменяется конформация рецепторного белка. а-Субъединица отдает ГДФ и присоединяет ГТФ, затем отделяется от двух других субъединиц, вступает в контакт с эффекторным белком и изменяет его функциональное состояние. И β, и у-субъединицы способны связываться с эффекторными белками. а-Субъединица обеспечивает медленный гидролиз связанного ГТФ до ГДФ. Ga-ГДФ не имеет сродства к эффекторным белкам и вновь воссоединяется с β, у-субъединицами (А).
G-Белки могут диффундировать (латерально) в мембрану; они не связаны с определенным типом рецепторов. Тем не менее между типами рецепторов и типами G-белков имеется взаимосвязь (Б). а-Субъединицы G-белков различаются по сродству и типу воздействия на эффекторные белки. Ga-ГТФ Gg-белка стимулирует аденилатцик-лазу, в то время как Ga-ГТФ Gj-белка ее ингибирует. К G-белок-связанным рецепторам относятся мускариновые холинорецепторы, рецепторы к норадреналину, адреналину, допамину, гистамину, морфину, простагландинам, лейкотриенам и другим веществам и гормонам.
Эффекторными белками для G-белка являются аденилатциклаза (АТФ - внутриклеточный переносчик цАМФ), фосфолипаза С (фосфатидилинозитол -> внутриклеточные переносчики инозитолтрифосфат и диацилглицерин) и некоторые белки ионных каналов (Б).
От концентрации цАМФ в клетке зависит множество функций, так как цАМФ повышает активность протеинкиназы А, которая фосфорилирует регуляторные белки. Кроме того, повышение концентрации цАМФ приводит к расслаблению гладкой мускулатуры, повышению силы сердечных сокращений, усилению гликогенолиза и липолиза. Фосфорилирование белков Са-каналов способствует их открытию при деполяризации мембраны. Необходимо отметить, что цАМФ инактивируется фосфодиэстеразой. Поэтому ингибиторы этого фермента поддерживают высокую клеточную концентрацию цАМФ и оказывают сходное с адреналином действие.
Кроме того, рецепторный белок может фосфорилироваться и вследствие этого теряет способность активировать G-белок. Данный механизм лежит в основе снижения чувствительности клетки в результате длительной стимуляции рецептора под действием агониста.
Активация фосфолипазы С приводит к расщеплению фосфолипидов мембран (фосфатидилинозитол-4,5-бифосфата) с образованием инозитолтрифосфата (1Р3) и диацил глицерина (ДАГ). Инозитол стимулирует выход Са2+ из депо, что ведет к сокращению гладкой мускулатуры, расщеплению гликогена или экзоцитозу. Диацилглицерин стимулирует протеинкиназу С, которая фосфорилирует определенные серин- и треонинсодержащие ферменты.
Некоторые G-белки воздействуют на белки каналов и способствуют открытию каналов. Таким образом активируются К+-каналы (действие ацетилхолина на синаптическом уровне; влияние опиоидов на передачу возбуждения в нервных клетках).
Системы вторичных мессенджеров, связанных с G-белками.[править | править код]
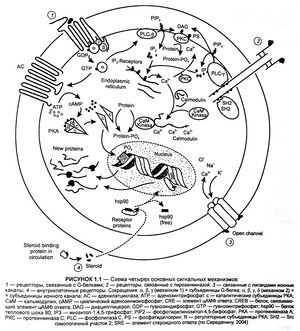
В таблице приведены примеры подобных рецепторных систем. Очевидно, что большое количество первичных мессенджеров регулируют лишь несколько вторичных. Таким образом, следует понимать, что специфичность действия первично связывающихся лигандов определяется локализацией рецептора на определенных клетках, в которых вторичные мессенджеры вызывают экспрессию белков, специфичных для данной клетки.
Рецепторы, связанные с G-белками[править | править код]
Открыто более 1000 генов, кодирующих рецепторы, связанные с G-белками. Эти рецепторы являются мономерными гликопротеинами с относительно сходным аминокислотным составом. Для них характерны 7 доменов, имеющих в составе полипептидной цепи гидрофобные аминокислоты. Эти домены образуются петлями внутри мембраны с одним концом, выступающим наружу, а другим -внутрь цитоплазмы.
Эндогенные лиганды связываются на внешнем участке рецептора. Небольшие по размеру, например амины, присоединяются к участкам внутри различных трансмембранных областей, тогда как крупные, например полипептиды, менее способные проникать в гидрофобные регионы, связываются на экстраклеточной петле N-концевого участка рецептора.
G-Белки присоединяются к внутриклеточному сегменту рецептора внутри 3-й петли между 5-м и 6-м регионами. Хотя механизм эффекта, возникающего при соединении с агонистом, не до конца ясен, предполагается, что этот акт стабилизирует рецептор в конформации, позволяющей ему взаимодействовать с тримером G-белков, активируя их и последующие эффекторные события.
Эффект агониста обычно имеет лишь ограниченную продолжительность, что определяется несколькими процессами. Большинство связанных с G-белкам и рецепторов имеет остатки серина и треонина в цитоплазматической петле и в С-концевом участке, которые могут быть фосфорилированы несколькими киназами, что ограничивает взаимодействие между рецептором и G-белком. Данный процесс называется десенситезацией рецептора и позволяет клетке ответить на весьма широкие диапазоны концентраций, стимулирующих экстраклеточных агентов. После продолжительного воздействия агониста число рецепторов на плазматической мембране может также регулироваться процессом интернализации (осуществляемым в некоторых случаях катаболизмом), или down-регуляцией рецептора. Хотя вызывающие ее сигналы не ясны, представляется, что они отличны от контролирующих десенситезацию.
G-Белки[править | править код]
Осуществляют трансдукцию сигнала от мембранных рецепторов к эффекторным ферментам и ионным каналам. Каждый из этих белков состоит из трех отдельных субъединиц, обозначаемых α, β, у в порядке снижения молекулярной массы; α-субъединица тримера связывает гуаниннуклеотиды и является главным посредником влияния G-белков на их эффектор. Основной функцией β- и γ-субъединиц тримера является поддержка взаимодействия α-субъединицы с плазматической мембраной и рецепторами, однако они способны и к прямой регуляции эффектора.
G-белки, участвующие в трансмембранном переносе сигнала, регулируются общими механизмами. На рисунке представлен их цикл активации и инактивации. В базальном состоянии три субъединицы G-белков связаны вместе и с гуанозиндифосфатом (ГДФ), присоединенным к α-субъединице. Когда агонист соединяется с рецептором, ГДФ отделяется, и освободившееся на α-субъединице место занимается гуанозинтрифосфатом (ГТФ), в избытке присутствующем в цитоплазме.
Появление этой связи стимулирует G-белки, в результате α-субъединица отделяется от рецептора и от β, γ-субъединиц и связывается с эффектором. Спустя несколько секунд имеющаяся в α-субъединице ГТФаза гидролизует связанную ГТФ до ГДФ, что приводит к инактивации субъединицы. Связанная с ГДФ α-субъединица отделяется от эффектора и вновь ассоциируется с β-, γ-комплексом G-белков, становясь способной к новому циклу активации рецептором.
Функциональные различия между членами семейства G-белков первично определяются отличиями в α-субъединицах. Номенклатура G-белков изначально строилась в соответствии с их функцией. Так, обозначения Gs и Gi приняты для стимулирующих и ингибируюших аденилатциклазу G-белков соответственно. Обозначение Gi было введено раньше, когда впервые открытый в сетчатке G-белок назывался трансдуцином.
Несовершенство этой номенклатуры стало очевидным после выделения и клонирования G-белков с невыясненной функцией. Так появились обозначения Go, Gq , затем G11, G12 и др. Некоторые G-белки экспрессируются лишь в определенных типах клеток и высокоспециализированы, например Gt обнаружен только в палочках и колбочках сетчатки, где активирует цГМФ-специфичную фосфодиэстеразу. Другие G-белки, наоборот, экспрессируются в большинстве тканей и имеют множественную функцию, например, Gi присутствует в большинстве клеток, ингибируя аденилатциклазу, но способен и к прямому воздействию на некоторые ионные каналы.
Влияние большинства G-белков на эффекторы — стимулирующее, однако некоторые их ингибируют. Например, G0 ингибирует Са2+-каналы в мозге и сердце; Gs стимулирует, a Gi ингибирует аденилатциклазу. Последние два G-белка в свою очередь регулируются различными группами рецепторов, которые часто представлены в одной клетке. Результат одновременной активации стимулирующих и ингибирующих рецепторов — уменьшение и смягчение аденилатциклазного ответа.
Эта двойная регуляция в дополнение к взаимодействию других следующих за белками компонентов сигнальной системы обеспечивает интегрированный ответ клетки на многочисленные стимулы.
Эффекторные ферменты, регулируемые G-белками. Из трех компонентов, обеспечивающих сопряженное с G-белками проведение сигнала, эффекторные звенья наиболее сложно изучать на молекулярном уровне. Только недавно некоторые из ферментов этого звена были изолированы и клонированы.
Эффекты гормональных и нсйромелиаторных рецепторов чаще всего реализуются через аденилатциклазу и фосфолипазу С. Другие ферменты, такие, как фосфолипаза А2, продуцирующая арахидоновую кислоту, также, по-видимому, регулируются G-белками, однако эти реакции до конца не ясны.
Аденилатциклаза и цАМФ как вторичный мессенджер[править | править код]
Циклический АМФ (цАМФ) синтезируется из АТФ встроенными в плазматическую мембрану аденилилциклазными ферментами.
Представляется, что эти ферменты являются большими полипептидами, содержащими два кластера из шести трансмембранных сегментов, разделяющих два сходных каталитических домена. Имеется, по крайней мерс, восемь форм аденилатциклазы. Все они стимулируются Gsα, но отличаются по чувствительности к ингибирующему влиянию Gα-стимуляции кальцийзависимым кальмодулином (calcium/calmodulin) и по эффекту β, у-субъединиц G-белков. Эти дополнительные регуляторы дают возможность интеграции многих сигналов, влияющих на различные системы вторичных мессснджеров внутри одной клетки.
Циклический АМФ проявляет свой эффект в клетке, в основном активируя цАМФ-зависимые протеинкиназы (протеинкиназа А, РКА). Эти тетрамерные ферменты состоят из двух регуляторных и двух каталитических субъединиц. Ферменты активируются, когда две молекулы цАМФ присоединяются к каждой регуляторной субъединице, освобождая каталитические субъединицы из тетрамера. Освободившиеся субъединицы катализируют перенос фосфатной группы из АТФ на специфические сериновые или треаниновые остатки белков-мишеней. Среди них могут быть ферменты, которые участвуют в метаболических процессах клетки, и белки, регулирующие транскрипцию гена. Хорошо изучен, например, активируемый цАМФ метаболический путь, составляющий каскад ферментативных активаций, ведущий к распаду гликогена в печени. Активированная протеинкиназа А фосфорилирует фосфорилазную киназу (phosphorylase kinase), которая в свою очередь фосфорилирует гликогенфосфорилазу — фермент, катализирующий распад гликогена.
Действие цАМФ на транскрипцию генов опосредуется катализируемым протеинкиназой А фосфорилированием белка, известного под названием cAMP response clement-binding protein (CREB), который присоединяется к специфическим коротким последовательностям ДНК, известным как cAMP response elements (CRE). CREB присоединяется к CRE, будучи фосфорилированным протеинкиназой А, что стимулирует транскрипцию генов, содержащих CRE в регуляторных зонах.
Фосфолипаза С и фосфолипидные вторичные мессенджеры[править | править код]
Представители семейства G-белков сопрягают различные рецепторы с группой ферментов, известных как фосфолипазы с-р. Эти ферменты относятся к большому семейству фосфолипаз, субстратом для которых являются инозитолфосфолипиды. Сигнальная трансдукция через этот путь влечет последовательность молекулярных событий, сходных с наблюдаемыми при активации адеиилатциклазы. Связывание агониста с рецептором активирует G-белок, который в свою очередь присоединяется к фосфолипазе на внутренней поверхности плазматической мембраны. Активированная липаза быстро превращает фосфатидилинозитолбифосфат (PIP2) в инозитолтрифосфат (IP3) и диацилглицерол. Обе эти молекулы действуют как вторичные мессен-джеры двумя различными путями: IP3 — небольшая водорастворимая молекула, способная быстро диффундировать в цитоплазму и присоединяться к 1РЗ-зависимым кальциевым каналам в гладком эндоплазматическом ретикулуме, освобождая запасы кальция в цитозоль.
Увеличение концентрации Са2+ в цитоплазме инициирует волну Са2+-зависимых реакций в клетке, многие из них опосредуются специфическими Са2+-связывающими белками, из которых наиболее распространен кальмодулин. Са2+-кальмодулин регулирует ряд ферментов, включая Са2+-зависимую АТФазу плазматической мембраны, которая выкачивает кальций из клетки, и, как было сказано раньше, некоторые типы адеиилатциклазы. Большинство эффектов кальция в клетке является результатом активации группы протеинкиназ, известных как Са2+-кальмодулинзависимые протеинкиназы. Эти киназы фосфорилируют сери-новые и треониновые остатки различных белков. Таким образом, вновь физиологический ответ на активацию фосфолипидного вторичного мессенджера в каждой клетке зависит именно от экспрес-сирующихся в ней белков, являющихся мишенью Са2+-кальмодулинкиназ.
Другим молекулярным продуктом гидролиза PIP2 фосфолипазой С является диацилглицерол. Эта липидная молекула остается в плазматической мембране, где совместно с фосфатидилсерином активирует некоторых членов другого семейства серин-треониновых кипаз, известных как протеинкиназа С. Эти растворимые киназы переметаются в мембрану в ответ на увеличение кальция в пи го юле (вызванное освобождением IP3) и затем активируются комбинированным воздействием Са2+ диацилглицерола и фосфатидилсерина. Будучи активированными, эти киназы фосфорилируют специфические для клетки группы субстратных белков, которые включают многие ионные каналы, рецепторы и другие киназы, что в результате увеличивает генную транскрипцию.
Другие процессы сигнальной транедукции, регулируемые G-белками. В дополнение к описанным ферментам совсем недавно было показано, что G-белки также модулируют и активность вольтажзависимых ионных каналов. Как видно из таблицы, многие гормоны и нейромедиаторы регулируют как вторичные мессенджеры, так и ионные каналы, активируя один G-белок. В частности, Gt стимулирует как аденилатциклазу, так и некоторые типы Са2+-каналов.
Очевидно, дальнейшее выяснение механизмов прямой и обратной регуляции рецепторных систем сигнальной транедукции является одной из важнейших научных задач будущего.