Средства, влияющие на кроветворение — различия между версиями
Dormiz (обсуждение | вклад) (→Читайте также) |
Kron (обсуждение | вклад) |
||
| Строка 334: | Строка 334: | ||
== Читайте также == | == Читайте также == | ||
*[[Кроветворная система]] | *[[Кроветворная система]] | ||
| + | *[[Кровь]] | ||
*[[Лечение анемии]] | *[[Лечение анемии]] | ||
*[[Гемостатики (коагулянты, ингибиторы фибринолиза)]] | *[[Гемостатики (коагулянты, ингибиторы фибринолиза)]] | ||
*[[Препараты для лечения железодефицитной анемии]] | *[[Препараты для лечения железодефицитной анемии]] | ||
*[[Препараты для лечения мегалобластной анемии]] | *[[Препараты для лечения мегалобластной анемии]] | ||
Текущая версия на 14:02, 30 января 2015
Содержание
Средства, влияющие на кроветворение и процессы свертывания крови[править | править код]
Среди лекарственных средств, влияющих на систему крови, различают следующие группы.
- Средства, влияющие на кроветворение ( см. Ростовые кроветворные факторы)
- Препараты, влияющие на эритропоэз.
- Средства, воздействующие на лейкопоэз.
- Средства, влияющие на свертывание крови
- Средства, повышающие свертывание крови (коагулянты).
- Средства, снижающие свертывание крови (антикоагулянты ):
- Средства, влияющие на фибринолиз
- Фибринолитические средства.
- Средства, угнетающие фибринолиз.
- Средства, влияющие на агрегацию тромбоцитов.
Средства, влияющие на кроветворение[править | править код]
Кровь — это одна из тканей внутренней среды, содержащая в своем составе форменные элементы (эритроциты, лейкоциты, тромбоциты) и жидкую плазму (белки, факторы гемокоагуляционной и антигемокоагуляционной систем, и пр.) Элементы крови имеют непродолжительную жизнеспособность: лейкоциты, тромбоциты — несколько дней, эритроциты — 100 дней. Обновление состава крови осуществляется в костном мозге. Главная роль в этом процессе принадлежит нуклеиновым кислотам.
Кровь осуществляет ряд важнейших функций:
- дыхательную — транспорт кислорода от легочных альвеол к органам и тканям и транспорт углекислоты от тканей к легким;
- алиментарную — перенесение питательных веществ (глюкозы, аминокислот, жирных кислот и др.) от органов пищеварения, депонирования или органов, где они синтезируются, к тканям;
- экскреторную — перенесение конечных продуктов обмена веществ (мочевины, мочевой кислоты, креатинина и др.) к почкам и другим органам;
- гомеостатическую — обеспечение стабильности внутренней среды;
- регуляторную — обеспечение транспорта гормонов, медиаторов, нейропептидов, метаболитов и веществ, используемых для их синтеза;
- терморегулируюшую — обеспечение постоянства температуры тела;
- защитную — обеспечение защиты организма от инфекций за счет антител, лизоцима, других факторов.
Нарушение функций крови при ее заболеваниях отрицательно сказывается на деятельности многих органов и систем. Нарушения процессов кроветворения занимают видное место среди нозологических единиц заболеваний и требуют лекарственной коррекции. Стимуляторы кроветворения обладают широким спектром действия: ускоряют регенерацию форменных элементов крови, стимулируют эритро- и лейкопоэз, повышают резистентность организма к инфекциям и вирусам, ускоряют процессы регенерации и выздоровления, что обусловливает их широкое применение в практической медицине. Стимуляторы кроветворения отвечают также требованиям спортивной медицины и фармакологии, поскольку их можно успешно применять в целях коррекции функционального состояния спортсменов в условиях физической нагрузки.
Препараты, влияющие на эритропоэз[править | править код]
Основная функция эритроцитов состоит в переносе кислорода от легких к органам и тканям, что обеспечивается наличием в них гемоглобина. Уменьшение в крови эритроцитов и (или) гемоглобина приводит к развитию анемии, а резкое увеличение их — к эритремии (полицитемии).
Нарушение режима тренировок, режима питания, чрезмерные нагрузки являются предпосылками колебаний эритропоэза. Анемии у спортсменов могут быть связаны с кровопотерями при травмах, а у спортсменок — с обильными менструациями.
Средства, влияющие на эритропоэз, стимулируют синтез гемоглобина и образование эритроцитов, увеличивая их количество в единице объема крови. Эта группа препаратов рассматривается как противоанемические средства. В зависимости от этиологии и патогенеза для лечения анемий используют разные фармакологические средства. Важно помнить о том, что анемии нередко сопутствуют разным заболеваниям, поэтому следует устранить причину, вызвавшую заболевание.
Анемии разделяются на четыре основные группы[править | править код]
Нормобластическая (железодефицитная) анемия характеризуется недостаточным количеством эритроцитов с пониженным содержанием гемоглобина. При этом продуцируются нормальные зрелые эритроциты, но цветной показатель крови низкий, поэтому ее называют гипохромной анемией.
Мегалобластическая анемия отличается тем, что количество эритроцитов уменьшается, определяются пойкилоциты, незрелые формы, которые содержат повышенное количество гемоглобина. Цветной показатель повышен, отсюда название — гиперхромная анемия. При этой анемии имеется дефицит витамина В12 и (или) фолиевой кислоты.
Гипопластическая анемия характеризуется недостаточным количеством нормальных эритроцитов с пониженным содержанием гемоглобина; нарушена регенерация костного мозга.
Гемолитическая анемия отличается повышенным разрушением нормальных эритроцитов, наблюдается недостаточная активность Г-6—ФДГ.
Среди перечисленных анемий наиболее распространена железодефицитная, она же стоит на первом месте в мире среди других заболеваний. По данным ВОЗ, такая анемия наблюдается у 700 млн человек, чаще всего встречается у тех контингентов населения, у которых повышена потребность в железе. Анемии составляют 65 % всех заболеваний органов кроветворения, а железодефицитная анемия (ЖДА) — 85 % всех видов анемий. Латентный дефицит железа (ЛДЖ) встречается у 24 % практически здоровых юношей, 30 % спортсменов, у 9 из 10 беременных, а в зонах радиационного влияния частота анемий возрастает в 3—4 раза. Эти анемии наблюдаются у 30—70 % детей и подростков, у 30—40 % женщин.
По данным Академии наук США, в жизни каждого человека можно выделить несколько периодов, когда потребность организма в железе особенно велика и его дефицит становится главной причиной анемий.
1. Детям в возрасте от 6 мес до 4 лет необходимо много железа, поскольку их основная пища — молоко — отличается низким его содержанием, а в связи с ростом и развитием запасы железа в организме быстро истощаются.
2. Подростки нуждаются в большом количестве железа для удовлетворения потребностей растущего организма.
3. Организм женщин детородного возраста имеет повышенную потребность в железе, чтобы восполнить потери крови во время месячных.
4. Во время беременности у будущей матери возрастает возможность развития железодефицитной анемии. Железо необходимо и самому плоду для выработки собственных эритроцитов.
Дефицит железа нередко возникает при многих заболеваниях, в частности острых и хронических отравлениях гемолитическими ядами, после гастрэктомии, при тяжелых заболеваниях ЖКТ, некоторых наследственных заболеваниях, при кровопотерях.
Главная роль в лечении гипохромных анемий принадлежит препаратам железа.
Фармакокинетика препаратов железа[править | править код]
Железо — незаменимый микроэлемент (биометалл), который выполняет в организме важную роль, оно входит в состав комплексных соединений. Различают клеточное и внеклеточное железо (табл. 2.18). Его запасы в организме составляют 3—6 г (у мужчин 50 мг-кг-1, у женщин 35 мг-кг"1 массы тела). В организме взрослого человека массой 70 кг содержится 4,5 г железа, что составляет 0,0065 % массы тела.
Около 70 % общего количества железа входит в состав гемоглобина, остальное находится в костном мозге, селезенке, мышцах, печени.
Гемоглобин (Нв) — главный компонент эритроцитов, благодаря которому осуществляется основная функция крови — перенос кислорода. По химическому строению гемоглобин принадлежит к хромопротеинам и имеет в своем составе железосодержащую простетическую группу — гем и белок (глобин). За открытие строения гемоглобина Перутц, немец по происхождению, эмигрировавший в Англию, получил в 1962 г. Нобелевскую премию. В организме здорового человека существует постоянное равновесие между образованием и распадом эритроцитов.
Благодаря механизмам регуляции, в нормальных условиях обеспечивается стабильный уровень эритроцитов в крови. Максимальное влияние на эритропоэз оказывает количество кислорода в органах и тканях. В этом процессе большое значение имеет эритропоэтин, образующийся преимущественно в почках (90 %).
Препараты железа следует назначать за 1,5 ч до еды или через 2 ч после нее. Обмен железа в организме регулируется в первую очередь его усвоением. Всасывание неорганических солей железа может происходить в любом отделе ЖКТ, начиная с двенадцатиперстной кишки; там и в начальном отделе тонкого кишечника абсорбируется основная его часть. В условиях дефицита зона его всасывания распространяется на нижние отделы кишечника. На всасывание железа влияют многочисленные факторы. Активность всасывания зависит от лекарственной формы: лучше всасываются препараты железа в жидкой лекарственной форме. Состояние микрофлоры кишечника влияет на всасывание и фармакологическую активность железа.
Для всасывания ион железа должен восстановиться, т. е. перейти из трехвалентной степени окисления в двухвалентную. Восстановление начинается в желудке и продолжается в тонком кишечнике. Ионизация железа в желудке осуществляется под действием соляной кислоты при рН = 5 При понижении кислотности всасывание железа из продуктов питания может уменьшиться. Восстанавливающие агенты, такие, как аскорбиновая кислота, сукцинат, SH-группы аминокислот (цистеин) и белков, присутствующие в пище, превращают окисное железо в закисное, двухвалентное, способствуя его абсорбции. Стимулируют всасывание также кислота янтарная, кислота пировиноградная, соли меди, марганца, фруктозы. Всасывание железа из пищи животного происхождения в 2—4 раза выше, чем из растительной. При этом "мясной фактор" положительно влияет на всасывание негемового железа, в частности из растений. Содержание железа и аскорбиновой кислоты в различных продуктах представлено в таблице 2.19. Сульфатные соли железа и комплексы железа с аминокислотами способствуют максимальному всасыванию железа. Наибольшее влияние на всасывание железа оказывает серин. При дефиците пиридоксина всасывание железа также повышается несмотря на повышение его уровня в плазме.
Аскорбиновая кислота, в частности, образует с железом специальный комплекс, растворимый в щелочной среде тонкой кишки. Считают, что положительное влияние мяса на всасывание негемового железа обусловлено образованием в процессе пищеварения мяса специальных транспортных систем для усвоения железа, а также связывания полостных факторов, замедляющих его всасывание.
К факторам, уменьшающим всасывание железа, относятся фосфаты, оксалаты, таннин, фитаты. Диета при латентном дефиците железа и железодефицитной анемии должна включать также медь, марганец, цинк и кобальт. Медь входит в состав цитохромоксидазы и дифенолоксидазы, стимулирует синтез гемоглобина, переход ретикулоцитов в эритроциты. Марганец также влияет на синтез гемоглобина, стимулирует окислительные процессы в организме. Цинк способствует образованию гемоглобина и эритроцитов, кобальт входит в состав цианокобаламина, повышает всасывание железа в кишечнике.
Антациды (кальция карбонат, аммония и магнезии гидроксид) уменьшают всасывание железа, возможно, нейтрализуя кислотность желудочного сока. Всасывание железа уменьшается при использовании его препаратов во время или сразу после принятия пиши. Уменьшается всасывание железа при частичной гастрэктомии и массивных резекциях кишечника, кахексии, инфекционных заболеваниях.
Секрет поджелудочной железы оказывает ингибирующее действие на всасывание железа, при хронических панкреатитах и циррозе печени этот процесс значительно усиливается. Панкреатин сдерживает чрезмерное всасывание железа.
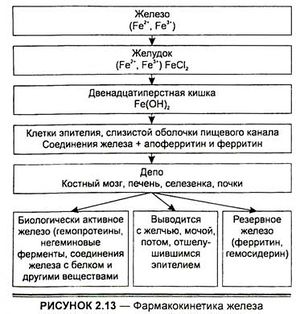
Всасывание железа зависит как от формы железа, так и от абсолютного его количества и осуществляется путем активного транспорта или пассивной абсорбции. Активный транспорт осуществляется с участием ферментных механизмов или переносчиков (рис. 2.13). Железо, всосавшееся в закисной форме, в ворсинках тонкого кишечника переходит в фосфат оксида железа.
Этот комплекс соединяется с апоферритином в ворсинках эпителия с образованием ферритина. Всасывание железа зависит от количества апоферритина: если он полностью насыщен и превращен в ферритин, всасывание прекращается.
Пассивная абсорбция состоит из диффузии железа через кишечные ворсинки, возможна также в комплексе с такими аминокислотами, как глицин и серии. Этот процесс происходит преимущественно при поступлении железа в дозах, превышающих его содержание в продуктах питания.
После всасывания железо циркулирует в крови в связанном состоянии с (З-глобулином (трансферрином). В норме уровень железа в плазме колеблется в пределах 66—146 мкг-мл"' и зависит от дефицита железа, который сопровождается снижением его уровня в сыворотке и повышением возможности связывать железо.
Ежедневные потери железа у человека составляют 35 мг, основная часть этого количества (21 мг) приходится на нормальный процесс разрушения эритроцитов. Железо, выделяющееся из разрушенных красных кровяных клеток крови, опять утилизируется. Злокачественные новообразования, инфекции, воспаление и уремия уменьшают утилизацию железа.
Около 30 % общего содержания железа в организме находится в депо. Это количество жизненно необходимо, поскольку железодефицитная анемия не проявляется до тех пор, пока полностью не используется депонированное железо. Оно депонируется в форме ферритина и гемосидерина в костном мозге, печени, селезенке и других местах, где доминируют элементы ретикулоэндотелиальных структур. Как ферритин, так и гемосидерин могут быть источником железа в синтезе гема при дефиците железа.
В течение суток из организма экскретируется 0,51 г железа, оно теряется также с десквамирующими элементами кожи и выпадающими волосами. Экскреция железа с мочой составляет 0,1 мг-сут-1, но она увеличивается при протеинурии и перенасыщении железом.
Лечение железодефицитных анемий следует начинать только после установления диагноза и выяснения причин, вызвавших заболевание.
Железосодержащие препараты имеют в своем составе соли двухвалентного (Fe2+) и трехвалентного (Fe3+) железа. Соединения Fe2< характеризуют свойства слабого восстановителя, а соединения Fe3+ — слабого окислителя.
По химическому строению соединения железа условно подразделяют на две группы:
а) простые, легко ионизирующие соли — ферроцены, или металлоорганические хелатные соединения;
б) сложные — полинуклеарные гидроксильные соединения — комплексы.
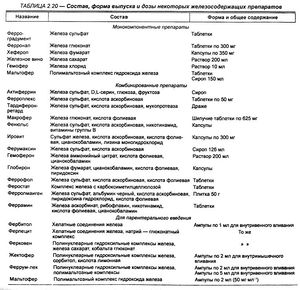
Препараты простых солей железа применяют только перорально, а хелатные соединения и полинуклеарные гидроксильные комплексы — внутримышечно и внутривенно. В лечении железодефицитных анемий лучше использовать соли двухвалентного железа с хорошей биодоступностью. Преимущество отдается препаратам с высоким содержанием железа и добавками, содержащими аскорбиновую, янтарную, фумаровую кислоты, аминокислоты, мукопротеазу и др. (табл. 2.20).
Такие препараты, применяемые внутрь, имеют определенные преимущества, а именно:
- разнообразие лекарственных форм — таблетки, драже, капсулы, капли, эликсиры, удобные для всех возрастных категорий больных;
- рационально подобранный состав лекарственной формы обеспечивает возможность увеличения биологической доступности железа;
- наличие в составе препаратов витаминов, органических кислот, ферментов способствует уменьшению побочных эффектов железа и улучшению его всасывания;
- пероральный путь введения — это естественный путь поступления железа в организм.
Для лучшего всасывания железа необходимо достаточное количество свободной соляной кислоты для растворения и диссоциации в применяемых препаратах, т. е. для растворения солей железа и перевода в диссоциированную форму, а также для восстановления ионов Fe3+ в Fe2+, которое лучше усваивается. Поэтому при недостаточной секреторной функции желудка препараты железа следует использовать вместе с желудочным соком или разведенной соляной кислотой. Белки слизистой оболочки желудка и кишечника образуют с железом комплексы, что способствует его всасыванию.
Средства, влияющие на кроветворение группы ферроценов имеют ограниченное применение, поскольку, несмотря на хорошее усвоение, они обладают свойством депонироваться в жировой ткани, что нежелательно. Хелатные соединения железа малотоксичны, но у них короткий период полувыведения, а полинуклеарные гидроксильные комплексы железа нельзя применять внутрь, их назначают только внутримышечно или внутривенно.
Для определения ориентировочной курсовой дозы препаратов железа для парентерального введения предложено ряд формул. Однократное парентеральное введение препарата не должно превышать 100 мг элементарного металла в связи с невозможностью его полного усвоения.
При внутривенном введении препаратов железа микроэлемент только через 12—24 ч начинает поступать в эритроциты. Активность всасывания железа при внутримышечном введении зависит от комплекса железа с другими компонентами. Например, в первые сутки всасывается только 50 мг комплекса железа с декстрином, остальное — в последующее время. При передозировке железо начинает откладываться во внутренних органах, что приводит к развитию гемосидероза.
При назначении препаратов внутрь нужно придерживаться необходимого режима дозирования: в организм должно поступить не менее 20—30 мг Fe2+ в сутки. Примерно 30 % находится в депо — ферритин, гемосидерин. Это может обеспечить доза 100 мг в пересчете на Fe2*. Если пациент хорошо переносит препарат, дозу увеличивают. Максимальная суточная доза составляет 300—400 мг (больше не всасывается). Суточную дозу делят на 3—4 приема, а если железо плохо переносится — на 6—8 приемов.
Первые признаки положительного действия препаратов железа при пероральном лечении гипохромной анемии появляются через несколько дней в виде ретикулоцитоза. Через 2—4 нед наблюдается увеличение гемоглобина в крови на 1 г-л"1 в сутки.
Лечение длительное, иногда 2—3, а нередко и 4—6 мес. Длительность лечения ЖДА этими препаратами определяется показателями нормализации периферической крови и содержанием сывороточного железа. Если нормализация состава периферической крови наступает в течение 1—2 мес (т. е. содержание гемоглобина у мужчин достигает 140—180 г-л-1, у женщин — 120— 140 г-л"1), лечение продолжают еше 1 мес, но уже в меньших дозах — 60—80 мг элементарного железа в сутки.
При длительном кровотечении применяют поддерживающую терапию по 20—40 мг элементарного железа ежедневно в течение недели; после каждого 3—4-недельного перерыва — повторно в течение недели.
Среди препаратов для принятия внутрь раньше широко использовали железа лактат, железа сульфат, железо восстановленное. В настоящее время их применяют редко в связи с наличием отрицательных свойств. Преимущество отдается феррамиду, ферроцерону и комбинированным препаратам, содержащим железа сульфат.
Феррамид — комплексное соединение железа с никотинамидом применяют при постгеморрагической анемии и ЖДА любого генеза (по 100 мг 3 раза в день в течение 3—4 нед).
Ферроцерон — натриевая соль ортокарбоксибензолферроцерона, назначается по 300 мг 2 раза в сутки после еды при ЖДА любого генеза. Препарат хорошо переносится.
Феррокаль — таблетки, содержащие железа сульфат (200 мг), кальция фруктозодифосфат (100 мг) и церебролецитин (200 мг). Применяют при лечении ЖДА, общем упадке сил после инфекционных заболеваний, операционных вмешательств (2—6 табл. 3 раза в день после еды).
Конферрон — капсулы, содержащие 250 мг сульфата железа и 35 мг диоксидсульфосукцината натрия, обладающего определенной поверхностной активностью и обеспечивающего хорошее всасывание железа и увеличение терапевтического эффекта при получении 1—2 капсул 3 раза в день после принятия пищи.
Инъекционные препараты железа применяют после обширных резекций тонкой кишки, при нарушении всасывания в кишечнике, когда необходимо ускорить этот процесс, например, перед оперативным вмешательством, а также при хронических кровопотерях, когда потеря железа превышает пероральное поступление.
Ранферрон — активный комбинированный препарат, содержащий в 1 капсуле железа фумарат (305 мг), фолиевую кислоту (0,75 мг), витамин В,, (5 мкг), аскорбиновую кислоту (75 мг) и цинка сульфат (5 мг).
Препарат успешно используется при разного рода железодефицитных и фолиеводефицитных анемиях по 1 капсуле 2—3 раза в сутки или по 3—4 ч. ложки эликсира в сутки.
Фербитол —водный раствор железосорбитолового комплекса, содержащего около 50 % железа, применяют при ЖДА различной этиологии ежедневно по 2 мл (внутримышечно!) в течение 15— 30 дней. Переносится препарат хорошо, только в отдельных случаях возможна тошнота. Противопоказан при гемохроматозе, нарушениях функций печени и при остром нефрите.
Ферковен — комбинированный препарат для внутривенного введения. Содержит железа сахарат, кобальта глюконат и раствор углеводов. Наличие кобальта способствует активации эритропоэза. Вводят в вену очень медленно: в первые 2 дня по 2 мл, потом по 5 мл. После ликвидации дефицита железа в организме лечение гипохромной анемии продолжают препаратами для перорального применения. После первых инъекций ферковена, как и при передозировке, возможны гиперемия лица и шеи, чувство стеснения за грудиной, боль в пояснице. Эти проявления исчезают после введения под кожу аналгетика и атропина сульфата (0,5 мл 0,1 %-го раствора).
Феррум-лек — препарат для внутривенного и внутримышечного введения. Для внутримышечных инъекций он содержит трехосновное железо в комплексе с мальтозой, для внутривенных — железа сахарат. Внутримышечно вводят по 4 мл через день, а внутривенно — в 1-й день 2,5 мл (содержимое 0,5 ампулы), на 2-й — 5 мл, на 3-й день — 10 мл, потом по 10 мл 2 раза в неделю. Разводят изотоническим раствором натрия хлорида в соотношении 1:2.
Появление через несколько дней ретикулоцитоза свидетельствует о положительном действии препаратов железа. Через 2—4 нед отмечается увеличение гемоглобина в крови на 1 г-л"1 в сутки.
Длительность лечения ЖДА этими препаратами определяется показателями нормализации периферической крови и содержания сывороточного железа. В Украине применяют также актиферин, тарунгрерон.
Побочные эффекты. После приема внутрь могут возникать тошнота, рвота, снижение аппетита. Это объясняется способностью препаратов железа легко диссоциировать с образованием свободных ионов железа, которые могут денатурировать белки микроворсинок слизистой оболочки пищеварительного тракта с развитием раздражения и воспаления. Железо может вызывать запор вследствие связывания сероводорода в кишечнике. Возможна и диарея, когда при взаимодействии железа с сероводородом образуется серное железо — соединение, которое раздражает стенку кишки. Иногда появляются металлический привкус во рту, темное окрашивание кала, темная кайма на зубах или потемнение их вследствие связывания с сероводородом. При длительном применении возможно развитие инсомии, тахикардии, высыпаний на коже. При парентеральном введении препаратов железа может возникать боль в месте инъекции, в пояснице, сдавливание в груди, аллергические реакции — крапивница, лихорадка, артралгия, иногда анафилактический шок, коллапс.
Препараты двухвалентного железа могут повреждать мембранные структуры, способствовать освобождению и активации биологически активных веществ, микросомальных ферментов в связи с их прооксидантными свойствами и способностью инициировать свободнорадикальные реакции, приводить к повреждению органов и тканей. Поэтому для предупреждения таких осложнений в состав некоторых препаратов вводят вещества с антиоксидатным действием и стимуляторы абсорбции железа.
В последнее время появились препараты, содержащие железо в микродиализных гранулах или специфические матрицы, что способствует постепенному освобождению железа из препарата, обеспечивает хорошее всасывание и усвоение (например, ферро-градумент).
При остром отравлении препаратами железа используют специфический антидот — дефероксамин, который выпускают в ампулах по 0,5 г сухого препарата. Для связывания невсосавшегося железа его применяют внутрь — 5—10 г (содержимое 10—20 ампул); для внутримышечного введения используют 10 %-й раствор, растворив содержимое ампулы в 45 мл воды для инъекций. Внутримышечно препарат вводят из расчета 60— 80 мг на 1 кг массы тела.
Для лечения гипохромных анемий кроме железосодержащих препаратов используют также средства, влияющие на кроветворение содержащие кобальт, в частности, коамид. Они также стимулируют кроветворение, способствуют усвоению железа организмом, синтезу гемоглобина и пр.
Коамид — комплексное соединение кобальта и никотинамида, может использоваться с препаратами железа. Легко абсорбируется, содержится в костном мозге, печени, почках, в белках плазмы крови, эритроцитах. Выводится почками, а также с содержимым кишечника.
Фармакодинамика. Способствует усвоению железа и его подключению к метаболическим процессам. Стимулируя выработку эритропоэтина, активирует эритропоэз. Повышает синтез аминокислот, активность сукцинатдегидрогеназы, цитохромоксидазы, увеличивает содержание в тканях РНК и ДНК.
Вводят подкожно 1 мл 1 %-го раствора 1 раз в сутки, можно применять порошок внутрь по 100 мг 3 раза в сутки.
Побочные эффекты: изредка — тошнота, головокружение.
При лечении гипохромных анемий назначают ряд витаминов и тяжелых металлов.
Аскорбиновая кислота (ее включают в ряд препаратов железа) образует комплексы с железом, хорошо усваивающиеся в кишечнике. Восстанавливает трехвалентное железо в двухвалентное, чем также способствует его усвоению и препятствует раздражению слизистой оболочки кишечника.
Витамин Е активирует синтез гема, тормозит пероксидное окисление липидов клеточных мембран эритроцитов, предотвращая клеточный гемолиз и продлевая период существования.
Пиридоксин может нормализовать кроветворение у больных с сидеробластной анемией (врожденной и приобретенной). У таких больных нарушается синтез гемоглобина и обнаруживается накопление железа в перинуклеарных митохондриях эритроидных клеток.
Рибофлавин косвенно способствует синтезу глобина, чем тоже увеличивает образование гемоглобина.
Меди сульфат назначают при ее дефиците, наблюдаемом у плохо питающихся детей раннего возраста. Медь способствует всасыванию железа в кишечнике и включению железа в гемоглобин, являясь составной частью гемостимулина.
В последние десятилетия клиницисты все чаще встречаются с анемией, возникающей при хронической почечной недостаточности (ХПН), применении высоких доз цитостатиков и в терминальной стадии злокачественных опухолей, которая не поддается традиционным методам лечения (препараты железа, витамин В12, фолиевая кислота). Вместе с тем количество случаев такого вида анемии прогрессивно растет в связи с драматическим увеличением заболеваемости сахарным диабетом, одним из осложнений которого является ХПН, онкологическими заболеваниями и расширением применения высокодозовой химиотерапии для их лечения. Результаты исследований свидетельствуют, что такой вид анемии обусловлен недостатком в организме цитокина эритропоэтина (ЭПО). Благодаря развитию ДНК-технологии стало возможным производить синтетические рекомбинантные препараты ЭПО.
История использования рекомбинантного эритропоэтина человека началась в 1977 г., когда впервые в очищенном виде он был выделен из мочи человека. В 1983 г. сотрудниками компании "Amgen" впервые был получен рекомбинантный препарат ЭПО путем внедрения человеческого гена ЭПО в овариальные клетки китайских хомячков. В 1985 г. рекомбинантный человеческий ЭПО (эпоэтина) впервые был назначен с лечебной целью больному и получен хороший терапевтический эффект. С 1987 г. в Европе впервые стал доступен рекомбинантный ЭПО. Именно с этого года и началось применение ЭПО в спорте. За период 1987—1990 г. отмечено несколько смертельных случаев среди голландских и бельгийских велосипедистов, которые связывают с использованием ЭПО. В 1988 г. Международная федерация лыжного спорта включает ЭПО в список допинговых средств, а в 1989 г. Food and Drug Administration, государственный орган США, контролирующий производство и распространение лекарств в стране, разрешает производство рекомбинантного ЭПО. В 1990 г. применение ЭПО было запрещено МОК. В 1993-1994 г. ИА-АФ внедряет процедуру забора крови на восьми соревнованиях розыгрыша Кубка мира, в 1997 г. Международный союз велосипедистов и Международная федерация лыжного спорта утверждают процедуру выборочного тестирования по крови перед началом соревнований, установив предельно допустимые уровни гематокрита и гемоглобина. Хотя превышение установленных показателей не является основанием для дисквалификации, однако проведение этой процедуры направлено на защиту организма спортсмена от возникновения возможных осложнений, связанных с повышенным содержанием гемоглобина и повышенным гематокритом. В 1998 г. разоблачение случаев использования ЭПО на велогонке "Тур де Франс" было широко освещено средствами массовой информации. В 1999 г. были интенсифицированы исследования по разработке надежного метода обнаружения ЭПО к Играм Олимпиады в Сиднее.
Эндогенно образуемый ЭПО представляет собой гликолизированный гликопротеин. Молекула ЭПО состоит из 60 % аминокислот и 40 % углеводов. ЭПО принадлежит к семейству цитокинов, т. е. гормоноподобных иммуномодуляторов, играющих роль межклеточных медиаторов при иммунном ответе и многих других физиологических и патологических реакциях. В организме человека ЭПО образуется преимущественно в почках, в основном в перитубулярных интерстициальных фибробластах коры, отчасти в печени (только 10—15 % общей продукции). ЭПО является одним из центральных регуляторов образования эритроцитов в организме млекопитающих, первичным медиатором нормальной физиологической реакции на гипоксию. Основная особенность ЭПО — контроль пролиферации и дифференцировки клеток-предшественников эритроидного ряда в костном мозге. Регуляция эритропоэза — сложный механизм, в котором кроме ЭПО участвуют и другие ростовые факторы. Так, в норме он вместе с интерлейкинами 1, 3, 4 и гранулоцитарномакрофагальным колониестимулирующим фактором стимулирует дифференцировку прогени-торных клеток для эритроцитарной колониеформирующей единицы. Высокие концентрации эритропоэтина могут непосредственно влиять на нормобласты и способствовать раннему выходу ретикулоцитов в кровь.
Другая важная особенность ЭПО — это свойство предотвращать апоптоз эритроидных клеток-предшественников на поздних стадиях развития путем торможения их фагоцитоза макрофагами.
Среди препаратов ЭПО в медицинской практике наиболее широко используют Эпоэтина (эпоген, рекормон) при анемиях, обусловленных ХПН, ревматоидным артритом, злокачественными опухолями, СПИДом, при анемии у недоношенных новорожденных. ЭПО часто сочетают с препаратами железа, иначе возникает его недостаток из-за быстрого расходования на синтез гемоглобина во вновь образовавшихся эритроцитах, и эффективность ЭПО резко снижается. Для увеличения терапевтического эффекта рекомендуют назначать его одновременно не только с препаратами железа, но и с фолиевой кислотой, цианокобаламином и пиридоксином.
Побочные эффекты: возможны головная боль, артралгия, гиперкалиемия, аплазия костного мозга.
Эффект развивается через 1—2 нед, нормализация кроветворения — через 8—12 нед. Если не ликвидировать ХПН, эффект ЭПО через 3 нед после отмены препарата исчезает. Больным мегалобластной В.,-дефицитной анемией назначают цианокобаламин (вит. В.,). Такая анемия характеризуется угнетением процессов синтеза гемоглобина и образованием эритроцитов мегалобластического типа. Несмотря на возрастание содержания гемоглобина в каждом эритроците, общее количество его в крови снижается в связи с уменьшением количества эритроцитов.
Цианокобаламин — это кристаллический порошок рубиново-красного цвета, сложная структура, включающая атом кобальта. В природе он синтезируется сине-зелеными водорослями, бактериями, актиномицетами, в организме человека и животных вырабатывается микрофлорой кишечника. Поступает в организм с продуктами животного происхождения (печень, яйца, молочные продукты). Суточная потребность составляет 2 мкг.
Фармакокинетика. Всасывание витамина В12 возможно только при наличии в желудке гастромукопротеина — внутреннего фактора Кастла, который секретируется париетальными клетками слизистой оболочки желудка. В комплексе с гастромукопротеином витамин В12 достигает дистальных отделов слепой кишки, где ресорбируется через высокоспецифический рецепторно-транспортный механизм. В кровь цианокобаламин поступает в свободном состоянии и до 93 % его соединяется с глобулином. Из крови он переходит в печень, где превращается в активную форму — кобамамид, который входит в состав многих ферментов. Незначительная часть его поступает в различные ткани и лейкоциты. Из печени он проникает в кишечник и снова всасывается. Активность всасывания зависит от структуры и функции слизистой, которая поддерживается фолиевой кислотой. Резерв цианокобаламина и его кофермента в печени достаточен для того, чтобы удовлетворить потребность в нем в течение 2—3 лет.
При парентеральном введении витамина более 50 % его выводится почками и только 6—7 % через кишечник, после перорального приема почками выделяется 1—2 %, тогда как большая часть оказывается в кале.
Фармакодинамика. Мегалобластическая анемия характеризуется течением гемопоэза по мегалобластическому типу (эритробласт — гиперхромный мегалоблает — мегалоцит), дегенеративными изменениями в нервной системе (головной и спинной мозг, периферические нервы), изменениями эпителиальной ткани, особенно ЖКТ. Цианокобаламин стимулирует переход мегалобластического типа кроветворения в нормобластический, снижает процессы гемолиза эритроцитов. Эритропоэтический эффект циано-кобаламина обусловлен влиянием на процессы обмена. Совместно с фолиевой кислотой он принимает участие в синтезе пуриновых и пиримидиновых оснований, вследствие чего усиливается синтез нуклеиновых кислот, далее активируется синтез метионина — белка, донора мобильных метальных групп для образования холина, креатина, нуклеиновых кислот, необходимых для ге-мопоэза. Цианокобаламин принимает участие в обмене жиров, в частности, в синтезе миелина и других липопротеинов, а также в углеводном обмене, способствует активному накоплению этиловых соединений, положительно влияет на функцию печени, нервной системы, обладает им-муномодулирующим воздействием и др.
Показания к применению: злокачественная мегалобластная анемия (авитаминоз В|2), другие формы анемии — гипохромная (в сочетании с фолиевой кислотой), гипопластическая, лучевая болезнь, трофические и воспалительные заболевания центральной и периферической нервной системы (полиневриты), резекция тонкого кишечника, длительные кишечные инфекции, заболевания желудка и кишечника с нарушением всасывания, реконвалесценция после тяжелых истощающих заболеваний.
Цель лечения мегалобластной анемии цианокобаламином состоит не только в нормализации картины крови и ликвидации клинических проявлений заболевания, но и в максимальном восполнении депо этого витамина. Для этого цианокобаламин сначала вводят внутримышечно по 100—1000 мкг ежедневно или через день в течение 1—2 нед (период насыщения), затем проводят поддерживающую терапию: препарат в тех же дозах вводят один раз в месяц в течение всей жизни. Положительный результат такого лечения отмечается уже через 2—3 сут в виде ретикулоцитоза, полная нормализация кроветворения наблюдается в конце 1—2-го месяца лечения.
Побочные эффекты: аллергические реакции, повышенная возбудимость, тахикардия, боль в области сердца, липидная инфильтрация печени.
Существует также фолиеводефицитная или макроцитарная анемия, развивающаяся при увеличении потребности организма в фолиевой кислоте, например, повышенные физические нагрузки в спорте, беременность. Макроцитарная анемия характеризуется появлением в крови больших эритроцитов (макроцитов), богатых гемоглобином, но общее количество их резко уменьшено. Эффективным средством лечения этого заболевания является фолиевая кислота.
Фолиевая кислота (вит. Вс) содержится в листьях растений, печени, грибах. Впервые она была выделена в 1941 г., химическое строение установлено в 1945 г. Молекулу составляют птеридин, парааминобензойная и глютаминовая кислоты. В пищевых продуктах содержится в конъюгированной форме (полиглютамат). Во многих тканях имеется фермент, расщепляющий конъюгаты фолиевой кислоты. Суточная потребность человека — 50 мкг фолиевой кислоты или 400 мкг полиглютамата. Запасы фолиевой кислоты в организме достаточны для жизнедеятельности в течение нескольких месяцев. Провоцируют возникновение дефицита фолиевой кислоты некоторые противосудорожные средства (дифенин), оральные контрацептивы, изониазид и др., нарушая ее абсорбцию в ЖКТ. Дефицит фолиевой кислоты проявляется в виде макроцитарной анемии.
Фармакокинетика. Фолиевая кислота из пищевых продуктов свободно и полностью всасывается в проксимальном отделе тонкого кишечника (около 50—200 мкг-сут-1)- Содержание в крови через 36 ч составляет 92—98 %. Почти 87 % содержится в эритроцитах, остальное — в плазме крови. Из крови поступает в печень, где депонируется и превращается в активные формы. Около 50 % препарата выделяется почками, остальное — кишечником.
Фармакодинамика. В организме фолиевая кислота под влиянием фолатредуктазы превращается в тетрагидрофолиевую кислоту, ее активную форму, которая принимает участие в синтезе пуриновых оснований, необходимых для образования РНК и ДНК, метионина, серина, играющего существенную роль в кроветворении. Благодаря участию в нуклеиновом обмене, кислота фолиевая также стимулирует лейкопоэз, обладает рано-заживляющим эффектом, оказывает положительное влияние на кроветворение. Характеризуется липотропными свойствами, снижает содержание жира в печени, регулирует обмен и содержание холина в плазме и печени.
Показания к применению: макроцитарная анемия, анемии и лейкопении, вызванные химическими соединениями и ионизирующим излучением, анемии, возникающие в связи с резекцией желудка, алиментарная макроцитарная анемия новорожденных. При мегалобластной анемии назначают с цианокобаламином. (Изолированное ее применение при этой патологии приводит к нарастанию патологических изменений со стороны спинного мозга.)
Очень важным является профилактическое применение фолиевой кислоты за 1 мес до запланированной беременности и в I триместр беременности для предупреждения аномалий развития плода, в частности, дефектов нервной трубки (spina bifida).
В профилактических целях кислоту фолиевую назначают внутрь по 0,02—0,05 мг ежедневно, а в лечебных — 5 мг в сутки в течение 20—30 дней. Уже в первую неделю лечения наблюдается увеличение уровня гемоглобина в крови, полная коррекция анемии происходит в течение 1—2 мес.
Больным различными формами анемий, заболеваниями печени, атрофическим гастритом назначают препарат свежей печени большого рогатого скота, витогепат.
Витогепат — прозрачная жидкость желтого цвета, содержит цианокобаламин, кислоту фолиевую и другие биологически активные вещества. Вводят внутримышечно по 1—2 мл в день.
Гипопластическая и гемолитическая формы анемий тяжело поддаются лечению. Важно установить причину и устранить этиологический фактор. Из лекарственных средств используют цианокобаламин, кислоту фолиевую, аскорбиновую, никотиновую и другие витамины — тиамин, рибофлавин, пиридоксин. Применяют также переливание крови, пересадку костного мозга.
Для лечения больных анемией широко используют фитопрепараты. Растения и их препараты богаты разнообразными биологически активными веществами и микроэлементами, они повышают стойкость к неблагоприятным влияниям, общую активность организма и гемопоэз.
Плоды земляники лесной содержат кислоты аскорбиновую и фолиевую, пектины, сахара, соли железа, кобальта, кальция, марганца, фосфора и др.
Смородина черная содержит кислоту аскорбиновую, рутин, тиамин, каротин, пектины, сахара, органические кислоты, калий, железо (почти 10 мг в 100 г) и др.
Названные плоды используют в натуральном виде, сиропах, компотах и др.
Плоды шиповника содержат кислоту аскорбиновую, рутин, рибофлавин, филохинон, токоферол, органические кислоты, пектины, сахара, флавоновые глюкозиды, соли железа, марганца, магния и др. Применяют преимущественно в виде настоя 1:20.
Применение в практике спортивной подготовки. В спорте, где физические нагрузки давно уже вышли за пределы, хотя бы отдаленно доступные просто физически развитому человеку, переоценить влияние состояния всей системы кровоснабжения на спортивный результат просто невозможно.
Повышение уровня гемоглобина на 10—30 % приводит к такому значительному приросту результатов и спортивной работоспособности, что может выступить в качестве основной причины победы. Безусловно, для повышения содержания гемоглобина наибольшее применение нашли разрешенные стимуляторы кроветворения (церулоплазмин), особенно в циклических видах спорта, ориентированных на общую и силовую выносливость. Вместе с тем ставшие популярными в последнее время методики предельного развития саркоплазматической и митохондриальной гипертрофии дают основания для использования этих групп препаратов в силовых видах спорта. Увеличение числа красных кровяных клеток при сохранении реологических свойств крови (т. е. текучести) приводит к увеличению снабжения тканей кислородом и питательными веществами, а также выраженной стимуляции обменных, в частности анаболических, процессов в организме спортсмена. Это дает почву для резкого роста спортивных результатов.
Препараты эритропоэтина при лечении анемии у спортсменов вводятся подкожно, и начальная дозировка их составляет порядка 20 ME на 1 кг массы тела 3 раза в неделю, либо 10 ME на 1 кг массы тела ежедневно. В случае недостаточной эффективности препарата каждые 4 нед доза может увеличиваться на 20 ME на 1 кг массы тела 3 раза в неделю (60 ME на 1 кг в неделю). При внутривенном введении начальная дозировка составляет 40 ME на 1 кг массы тела 3 раза в неделю, через 4 нед доза может быть удвоена. Независимо от способа введения максимальная дозировка не должна превышать 300 единиц на 1 кг массы тела в неделю. В дальнейшем поддерживающую дозу подбирают таким образом, чтобы гематокрит не превышал 45 %. При назначении препаратов эритропоэтина необходимо учитывать, что крайне важно обеспечить организм адекватным количеством всех основных питательных веществ (макронутриентов), а также витаминов, минералов, особенно железа, витамина В12 и фолиевой кислоты.
При несанкционированном применении ЭПО в спорте вследствие нарушения реологических свойств крови и агрегационной способности эритроцитов и тромбоцитов активируется тромбообразование. В профессиональном велоспорте, где очень широко применяют препараты ЭПО, уровень гематокрита в 50 % и выше служит основанием для снятия участника со старта.
В профессиональном спорте препараты эритропоэтина часто применяют в сочетании со станозолоном, инсулином и гормоном роста, однако следует помнить о том, что препараты ЭПО отнесены к допинговым, поэтому следует воздержаться от их использования.
Кроме препаратов эритропоэтина для стимуляции кроветворения могут использоваться и другие, незапрешенные, лекарственные средства: различные препараты железа, витамина В12, кислота фолиевая, метилурацил, нуклеинат натрия, церулоплазмин. Вместе с тем эффективность их использования изучена недостаточно.
Ингибиторы эритропоэза[править | править код]
Данная группа лекарственных средств применяется для лечения эритремий (полицитемий). С этой целью используют имифос, радиоактивные изотопы фосфора (32Р) и др. Эти препараты угнетают кроветворную функцию костного мозга, что приводит к уменьшению количества эритроцитов в крови, устранению клинических проявлений заболевания.
Стимуляторы лейкопоэза[править | править код]
Известно, что лейкоциты выполняют в организме защитную функцию, они поглощают высокомолекулярные вещества, которые проникли во внутреннюю среду — белки, токсины, а также умершие клетки, минеральные частички.
Нарушения лейкопоэза, сопровождающиеся уменьшением количества лейкоцитов, могут возникать вследствие токсического воздействия на костный мозг больших доз ядовитых и лекарственных веществ (бензол, арсен, противоопухолевые средства, производные пиразолона и др.), ионизирующего излучения и пр. Лейкопения может развиться при лечении сульфаниламидными препаратами, левомицетином, производными фенотиазина, диакарбом, бутадионом, тубазидом и др., вследствие лучевых поражений.
Агранулоцитоз связывают с нарушением синтеза нуклеиновых кислот и белка, необходимых для построения клеток. При заболеваниях, сопровождающихся лейкопенией (гранулоцитопенией), применяют стимуляторы лейкопоэза, т. е. препараты, ускоряющие продуцирование лейкоцитов в костном мозге и восстанавливающие их нормальное количество в крови. К ним принадлежат производные пиримидина, дериваты нуклеиновых кислот. Первые исследования их влияния на процессы регенерации и лейкопоэз проведены М. В. Лазаревым и его учениками.
За последние годы для лечения заболеваний, сопровождающихся резкой лейкопенией, начали использовать препараты, являющиеся аналогами эндогенных миелоидных факторов роста, созданные с использованием метода генной инженерии.
Различают стимуляторы лейкопоэза при легких и тяжелых формах нарушений лейкопоэза.
При легких формах лейкопений применяют производные пиримидина — метилурацил (метацин) и пентоксил (превращающийся в организме в метилурацил). Оба препарата стимулируют синтез нуклеиновых кислот, белков, деление клеток, лейкопоэз, регенерацию тканей, например, у больных с ожогами, переломами костей, длительно не заживающими ранами, язвами желудка и двенадцатиперстной кишки, повышают неспецифическую и специфическую резистентность организма. Однако во время инфекции их нельзя назначать, так как они могут быть утилизированы микроорганизмами, что будет способствовать делению последних и дальнейшему развитию инфекционного заболевания.
Побочные эффекты: прием этих препаратов может сопровождаться возникновением аллергических реакций в виде сыпей, головными болями, головокружением. При более тяжелых формах лейкопений, возникающих, например, при лечении больных цитостатиками и лучевой терапией, применяют синтетический препарат лейкоген и рекомбинантные или очищенные человеческие колониестимулирующие факторы.
Лейкоген — производное тиазолидиндекарбоновой кислоты, он стимулирует лейкопоэз при тяжелых его нарушениях, при агранулоцитозе, возникшем по разным причинам. Препарат противопоказан при лимфогранулематозе и лейкозах.
Натрия нуклеинат — натриевая соль нуклеиновой кислоты, полученная гидролизом дрожжей, стимулирует деятельность костного мозга, в частности лейкопоэз, ускоряет регенерацию, активизирует фагоцитарную активность макрофагов и факторов неспецифического иммунитета, функцию лимфоцитов и пр.
Граноцит (ленограстим) — рекомбинированный человеческий гранулоцитарный колониестимулирующий фактор, участвующий в продукции гранулоцитов, макрофагов, мегакариоцитов. Он индуцирует освобождение фанулоцитов из костного мозга, повышая их число в периферической крови, активирует фагоцитоз и цитотоксичность зрелых гранулоцитов.
Граноцит устраняет миелосупрессию у больных, получающих цитостатики, укорачивает длительность лейкопении, в результате чего у больного повышается неспецифическая резистентность, реже возникают (или не возникают совсем) вторичные инфекции.
Его начинают вводить на следующий день после окончания курса химиотерапии (до нее и во время этой терапии граноцит назначать нельзя) подкожно или внутривенно 1 раз в сутки, продолжительность лечения до 25 дней. Необходим контроль числа лейкоцитов в крови.
Побочные эффекты: лейкоцитоз, тромбоцитопения, иногда боли в мышцах и костях, боль в месте инъекции.
Лейпоген (филграстим) — гранулоцитарный колониестимулирующий фактор человека, высокоочищенный препарат. По механизму действия, показаниям к применению и нежелательным эффектам сходен с граноцитом. Его не рекомендуют назначать при тяжелых заболеваниях почек и печени.
Лейкомакс (молграмостин) — рекомбинированный гранулоцитарно-макрофагальный, колониестмулирующий фактор, увеличивает образование колоний и пролиферацию гранулоцитов, моноцитов, макрофагов, стимулирует фагоцитарную и цитотоксическую функцию зрелых гранулоцитов в отношении бактерий и клеток злокачественных опухолей. Применяют при различных нейтропениях, апластической анемии, пересадке костного мозга, лейкопениях, связанных с инфекцией (СПИД). Вводят подкожно или внутривенно через 27 ч после окончания курса химиотерапии. Дозы и режим применения зависят от характера заболевания.
Побочные эффекты: нарушение функции желудочно-кишечного тракта (тошнота, рвота, анорексия, диарея, боли в животе), судороги, миалгии, головные боли, головокружения, парезы, спутанность сознания из-за повышения внутричерепного давления, нарушений мозгового кровообращения. Могут возникать нарушения функции сердечно-сосудистой системы, артериальная гипотензия, сердечная аритмия, сердечная недостаточность, отек легких, повышение капиллярной проницаемости, отеки, экссудативный перикардит. Возможны аллергические реакции в виде сыпей, зуда.
Средства для угнетения лейкопоэза[править | править код]
При лейкозах используют противобластомные средства — меркаптотурин, метотрексат, миелосан, хлорбутин, винбластин, винкристин и др.
Формы выпуска препаратов[править | править код]
- Ferri sulfas — порошок в хорошо закупоренных банках
- Ferramidum — таблетки по 0,1 г
- Ferroceronum — таблетки по 0,1 и 0,3 г
- Ferrocalum — комбинированные таблетки
- Ferroplex — комбинированные драже
- Ferbitolum — герметически закрытые флаконы по 2 мл
- Fercovenum — ампулы по 5 и 10 мл
- Ferrum Lek — ампулы по 2 мл (для внутримышечных инъекций) и ампулы по 5 мл (для внутривенных инъекций)
- Erythropoetinum — флаконы
- Coamidum — ампулы по 1 мл 1 %-го раствора
- Cyanocobalaminum — ампулы по 1 и 2 мл 0,003; 0,01; 0,02 %-го и 0,05 %-го раствора
- Acidum folicum — таблетки по 0,001 и 0,002 г
- Natrii nucleinas- порошок по 100 г во флаконах темного стекла
- Pentoxylum — таблетки по 0,025 и 0,2 г
- Methyluracilum — таблетки по 0,5 г; суппозитории ректальные по 0,5 г; 10 %-я мазь
- Leucogenum — таблетки по 0,02 г
- Molgramostimum — лиофилизированный порошок по 50, 150, 300, 400, 500 и 700 мкг во флаконах
- Filgrastimum — порошок по 0,3 и 0,48 мг во флаконах