Ось гипоталамус-гипофиз-яички — различия между версиями
Ars (обсуждение | вклад) (→Регуляция функции семенников) |
Ars (обсуждение | вклад) (→Регуляция функции семенников) |
||
| Строка 12: | Строка 12: | ||
Функция семенников регулируется с помощью группы механизмов прямой и обратной связи, которые функционируют на уровне гипоталамуса, гипофиза и семенников. Так, волнообразная секреция [[Гонадорелин|гонадолиберина]] (гонадотропин-рилизинг гормона) стимулирует секрецию ЛГ и ФСГ, которая в свою очередь регулируется путем цепи обратной связи с участием половых гормонов, включая половые стероиды, а также ингибин и активин. | Функция семенников регулируется с помощью группы механизмов прямой и обратной связи, которые функционируют на уровне гипоталамуса, гипофиза и семенников. Так, волнообразная секреция [[Гонадорелин|гонадолиберина]] (гонадотропин-рилизинг гормона) стимулирует секрецию ЛГ и ФСГ, которая в свою очередь регулируется путем цепи обратной связи с участием половых гормонов, включая половые стероиды, а также ингибин и активин. | ||
| − | Тестостерон может превращаться в [[Эстрогены|эстрогены]] под влиянием [[Ароматаза|ароматазы]]. {{Wow}} | + | Тестостерон может превращаться в [[Эстрогены|эстрогены]] под влиянием [[Ароматаза|ароматазы]]. {{Wow}} Преимущественно эстрогены, а не тестостерон подавляют [[ось гипоталамус-гипофиз-яички]] и снижают секрецию эндогенного тестостерона, при введении экзогенных препаратов.<ref>Kelly MJ, Qiu J, Rønnekleiv OK (2005-01-01). "Estrogen signaling in the hypothalamus". Vitamins and Hormones. 71: 123–45. doi:10.1016/S0083-6729(05)71005-0. PMID 16112267.</ref> |
== Секреция гонадолиберина гипоталамическими нейронами == | == Секреция гонадолиберина гипоталамическими нейронами == | ||
Версия 14:55, 29 октября 2016
Источник:
Эндокриная система, спорт и двигательная активность.
Перевод с англ./под ред. У.Дж. Кремера и А.Д. Рогола. - Э64
Издательство: Олимп. литература, 2008 год.
Содержание
- 1 Регуляция функции семенников
- 2 Секреция гонадолиберина гипоталамическими нейронами
- 3 Секреция гонадотропина в гипофизе
- 4 Обратная связь в регуляции секреции лютеинизирующего и фолликулостимулирующего гормонов
- 5 Секреция лютеинизирующего и фолликулостимулирующего гормонов в онтогенезе в разные периоды жизни человека
- 6 Секреция, транспорт и метаболизм тестостерона
- 7 Биохимические пути, связывающие энергетический баланс и репродуктивную систему
- 8 Взаимосвязь между характером питания, воспроизводством потомства и половым созреванием
- 9 Нарушения репродуктивной функции при острых и хронических заболеваниях
- 10 Изменения уровня тестостерона во время двигательной активности
- 11 Литература
Регуляция функции семенников

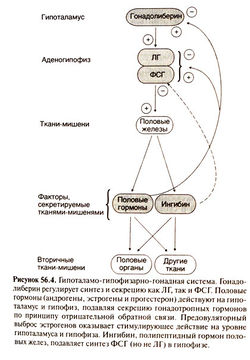
Ось гипоталамус-гипофиз-яички (гипогаламо-гипофизарно-гонадная система) - это гормонально взаимосвязанная система органов. Семенники (яички) млекопитающих являются местом формирования половых клеток и выработки андрогенов (Rommerts, 2004). Тестостерон — стероид, который содержит 19 атомов углерода и секретируется семенниками, представляет собой андроген, преобладающий у большинства млекопитающих. Тестостерон играет важную роль в размножении млекопитающих: необходим для поддержания половой функции, развития половых клеток и вторичных половых органов. У взрослых животных он оказывает дополнительное воздействие на мышечную и костную ткани, кроветворные процессы, свертываемость крови, уровень липидов в плазме крови, метаболизм углеводов и белков, психосексуальные и когнитивные функции. Во время формирования пола у плода млекопитающих тестостерон приводит к маскулинизации структур Вольфа и вызывает формирование внешних гениталий в виде мошонки и пениса. Кроме того, повышение уровня тестостерона в период полового созревания стимулирует соматический рост и вирилизацию у мальчиков.
Выработка андрогенов в семенниках регулируется главным образом лютеинизирующим гормоном (ЛГ), тогда как для формирования половых клеток требуется скоординированное действие фолликулостимулирующего гормона (ФСГ) и высокой внутри-семенниковой концентрации тестостерона, который вырабатывается клетками Лейдига под влиянием ЛГ (Rommerts, 2004). Паракринное взаимодействие между клетками Сертоли и половыми клетками также является важным компонентом регуляции сперматогенеза, хотя точная роль клеток Сертоли в регуляции развития половых клеток плохо понятна.
Функция семенников регулируется с помощью группы механизмов прямой и обратной связи, которые функционируют на уровне гипоталамуса, гипофиза и семенников. Так, волнообразная секреция гонадолиберина (гонадотропин-рилизинг гормона) стимулирует секрецию ЛГ и ФСГ, которая в свою очередь регулируется путем цепи обратной связи с участием половых гормонов, включая половые стероиды, а также ингибин и активин.
Тестостерон может превращаться в эстрогены под влиянием ароматазы. ![]() Преимущественно эстрогены, а не тестостерон подавляют ось гипоталамус-гипофиз-яички и снижают секрецию эндогенного тестостерона, при введении экзогенных препаратов.[1]
Преимущественно эстрогены, а не тестостерон подавляют ось гипоталамус-гипофиз-яички и снижают секрецию эндогенного тестостерона, при введении экзогенных препаратов.[1]
Секреция гонадолиберина гипоталамическими нейронами
Миграция нейронов, продуцирующих гонадолиберин, в процессе развития плода. Нейроны, продуцирующие гонадолиберии, происходят из области обонятельной пластинки (Schwanzel-Fukuda, Pfaff, 1989)и мигрируют вдоль обонятельных нервов в передний мозг и затем в место своего окончательного расположения в гипоталамусе. Такая упорядоченная миграция гонадолиберинпродуцирующих нейронов требует скоординированного действия молекул, определяющих направление адгезионных белков, таких, как продукт гена KALIG-1 и рецептор роста фибробластов, а также ферментов, которые помогают нейрональным клеткам прокладывать свой путь в межклеточном пространстве. Мутация любого из этих белков может воспрепятствовать процессу миграции и привести к возникновению дефицита гонадолиберина. У группы пациентов нарушение такой онтогенетической миграции гонадолиберинпродуцирующих нейронов в их окончательное место локализации в гипоталамусе приводит к заболеванию, которое носит название идиопатического гипогонадотропного гипогонадизма, которое характеризуется дефицитом гонадолиберина и нарушением секреции гонадотропина гипофизом (Legouis et al., 1991).
Гипоталамус как интегрирующий центр мужской репродуктивной системы является интегрирующим центром репродуктивной системы и координирует регуляторные сигналы из высших центров и сигналы обратной связи из гонад (Knobil, 1980; Crowley et al., 1991). В гипоталамус поступает информация из центральной нервной системы, которая отражает влияние эмоций; стресса, света, обонятельных стимулов, температуры и других внешних факторов. Сигналы обратной связи от гонад включают стероидные гормоны (тестостерон и эстрадиол) и белковые гормоны (ингибин и активин).
Регуляция ЛГ и ФСГ волнообразной секрецией гонадолиберина. Гонадолиберин представляет собой главный регулятор секреции гонадотропина и увеличивает секрецию ЛГ и ФСГ клетками гипофиза как in vitro, так и in vivo. Волнообразный характер секреции гонадолиберина имеет важное значение для поддержания нормальной секреции ЛГ и ФСГ гипофизом (Belchetz et al., 1978; Knobil, 1980; Shupnik, 1990; Crowley et al., 1991; Weiss et al., 1992). Непрерывное введение гонадолиберина или применение длительно действующих агонистов гонадолиберина приводит к снижению секреции ЛГ и ФСГ — явлению, известному как негативная регуляция(Belchetz et al., 1978; Knobil, 1980). Xaрактер секреции гонадолиберина (амплитуда и частота секреторных выбросом) определяет количественный и качественный состав сскретируемых гонадотропинов (Belchetz et al., 1978; Haiscnleder et al., 1988, 1991; Kim ct al., 1988a, 1988b; Yuan et al., 1988; Shupnik, 1990; Weiss ct al., 1992). Заметное увеличение частоты выбросов гонадолиберина также приводит к утрате чувствительности гонадотропных клеток и последующему уменьшению секреции ЛГ и ФСГ (Belchetz et al., 1978; Merccr et al., 1988; Shupnik, 1990). Электрофизиологическая активность гипоталамических нейронов, продуцирующих гонадолиберин, взаимосвязана с его периодическими секреторными выбросами.
Периодическое применение гонадолиберина индуцирует транскрипцию гена LH-р in vitro (Wicrman ct al., 1989; Shupnik, 1990; Weiss ct al., 1992). Непрерывное введение гонадолиберина усиливает транскрипцию только а-гена, но не генов Р-субъединицы ЛГ или ФСГ (Haiscnleder ct al., 1988). Периодическое применение гонадолиберина также изменяет полиаденилиронание мРНК составляющей ЛГ (Weiss ct al., 1992). Частота стимуляции гонадолиберином имеет важное значение для дифференциальной регуляции генов LH-Р и FSH-бета (Haiscnlcdcrct al., 1988). Болес высокая частота усиливает a-гены и LH-бета, a более низкая — FSH-бета, что стало основанием для предположения о том, что изменения частоты выбросов гонадолиберина могут быть одним из механизмов регуляции выработки двух функционально различных гонадотропинов с помощью одного гипоталамического рилизинг-гормона (Haiscnlcdcr et al., 1988). Непрерывная инфузия гонадолиберина или применение агониста гормона приводит к снижению уровня мРНК LH-p, в то время как уровень мРНК LH-a остается повышенным (Haiscnlcdcr ct al., 1988; Kim ct al., 1988a. 1988b; Yuan ct al.. 1988).
Значительная часть информации в отношении физиологии секреции гонадолиберина была получена при исследовании волнообразного характера изменений уровня ЛГ и ФСГ у мужчин и женщин в норме, а также при изучении эффектов гормонзамещающей терапии с использованием гонадолиберина у больных с идиоматическим гипогонадотронпым гипогонадизмом (Urban ct al., 1988; Crowley ct al., 1991). Исследования таких пациентов с гипоталамическим дефицитом гонадолиберина показывают, что периодическое внутривенное введение этого гормона в количестве 25 нг-кг'1 позволяет воспроизвести нормальную волнообразную секрецию ЛГ со всеми се особенностями (Crowley ct al., 1991). Пиковый уровень гонадолиберина после внутривенного введения такой дозы гормона (500- 1000 пг-мл4) напоминает тот, который можно обнаружить у приматов в случае прямого забора крови из портальной системы гипофиза (Crowley ct al., 1991). У мужчин с идиоматическим гипогонадотрониым гипогопадизмом оптимальный интервал между повышениями уровня гонадолиберина составил 2 ч (Crowley et al., 1991). Увеличение частоты пульсов гонадолиберина ведет к прогрессивному снижению чувствительности к гонадолиберину ЛГ-продуцируюших нейронов (Rebar et al., 1976). Снижение частоты пульсов гонадолиберина или увеличение интервала между ними повышает амплитуду последующего секреторного выброса ЛГ. Существует линейная зависимость между логарифмом дозы пульса гонадолиберина и количеством секретируемых ЛГ, ФСГ и свободной а-составляющей (Spratt et al., 1986; Whitcomb et al., 1990). У взрослых мужчин амплитуда повышения уровня ЛГ в ответ на гонадолиберии значительно превышает амплитуду повышения уровня ФСГ.
Интенсивный забор крови у здоровых мужчин и женщин выявил обширный набор характеристик волнообразного изменения уровня ЛГ (Urban et al., 1988). Средние характеристики показателей колебаний уровня ЛГ у мужчин, по данным одного из недавних исследований (Urban ct al., 1988), выглядят следующим образом; интервал между секреторными выбросами 55 мин, продолжительность пиков ЛГ 40 мин, амплитуда пиков ЛГ 37 % от исходного уровня (увеличение на 1,8 mLU-мл-1)- Значительная вариабельность параметров изменений уровня ЛГ у здоровых мужчин и женщин в норме обусловливает необходимость предосторожностей при интерпретации небольших отклонений в частоте и амплитуде колебаний гормона. Частота забора крови и подход, используемый для количественной оценки параметров колебаний уровня гормона, могут оказывать значительное влияние на вероятность их ошибочной оценки (Urban et al., 1988).
Влияние гонадолиберина на гонадотропные клетки осуществляется посредством их связывания со специфическими мембранными рецепторами, которое приводит к агрегации рецепторов и кальцийзависимому выделению ЛГ (Conn ct al., 1981, 1982).
Секреция гонадотропина в гипофизе
Функциональное строение и развитие гипофиза
Обширные данные иммуноцитологических исследований свидетельствуют о том, что секреция ЛГ и ФСГ в гипофизе происходит в клетках одного типа (Moricrty, 1973; Kovacs ct al., 1985). Гонадотропы — клетки, секретирующие ЛГ и ФСГ, составляют примерно 10 — 15 % от общего количества клеток аденогипофиза (передней доли гипофиза) (Moricrty, 1973; Kovacs et al., 1985) и располагаются рассеянно по всему аденогипофизу вблизи кровеносных капилляров. Они легко обнаруживаются в гипофизе плода и неполовозрелых особей (Childs ct al., 1981), однако их количество до момента полового созревания остается небольшим. Кастрация приводит к увеличению количества, а также размера гонадотропных клеток. Клетки аденогипофиза происходят от общих мультипотентных клеток или клеток-предшественников. Генетический анализ мутаций, взаимосвязанных с нарушениями функции гипофиза, возникающими в процессе развития организма, позволили обнаружить молекулярные механизмы развития гипофиза и выделения отдельных клеточных линии (Ingraham et al., 1988; Scully, Rosenfield, 2002). Развитие эмбриона гипофиза и различных типов его клеток управляется скоординированной во времени экспрессией ряда транскрипционных факторов, содержащих гомеодомен. Три гомеобокссодержащих гена Lbx3, Lbx4 и Titfl играют важную роль в раннем органогенезе (Scully, Rosenfeld, 2002). Для клеточной специализации и пролиферации дифференцированных клеток необходима экспрессия транскрипционных факторов Pitl и Propl: Pitl содержит в своем составе POU-снецифический и ДНК-связывающий POU-гомеокомпонент (Scully, Rosenfeld, 2002). Ген Propl кодирует транскрипционный фактор с одним ДНК-связывающим компонентом. Мутации Pitl ассоциированы с дефицитом соматотропного гормона (СТГ), тиреотропного гормона (ТТГ) и пролактина, а мутации Propl помимо дефицита СТГ, пролактина и ТСГ связаны с недостатком ЛГ и ФСГ. Экспрессии Propl и Pitl предшествует экспрессия гена HESX1, мутации в котором связаны с септоптической дисплазией и пангипопитуитаризмом (Parks et al., 1999).
Биохимическое строение и молекулярная биология ЛГ и ФСГ
Семейство гипофизарных гормонов, имеющих гликопротеидную природу, включает ЛГ, ФСГ, ТСГ и хорионический гонадотропин (ХГ) (Sairam, 1983; Ryan ct al., 1987; Gharib ct al., 1990). Все эти гормоны являются гетеродимерами, состоящими из а- и P-составляющих. Первичная последовательность р-составляющих ЛГ, ФСГ, ТТГ и ХГ различных видов практически идентична, биологическая специфичность гормонов определяется разнородными P-составляющими. Значительная гомология между двумя составляющими свидетельствует об их общем происхождении от общего предкового гена. Каждая субъединица в отдельности не обладает биологической активностью, они могут оказывать какое-либо воздействие только после формирования гетеродимера. В составе гетеродимера они соединяются дисульфидными связями, расположение цистеиио-вых остатков имеет большое значение для правильной укладки и формирования трехмерной структуры гликопротеида (Sairam, 1983; Ryan et al., 1987; Gharib et al., 1990); a-составляющая ЛГ содержит две углеводные цепи, связанные с остатками аспарагина, тогда как в состав p-составляющая их может входить одна или две (табл. 21.1) (Baezinger, 1990); P-составляющая ХГ, кроме того, содержит О-связанные олигосахариды, которых нет в составе димера ЛГ (Cole ct al., 1984). Несмотря на то что свободные несвязанные а-субъединицы сскрстируются гипофизом в кровяное русло, принято считать, что секреция свободных P-составляющих таким путем практически не происходит. Возникновение хорионического гонадотропина как самостоятельного гонадотропина в ходе эволюционного развития произошло сравнительно недавно (Komfeld, Kornfcld, 1976; Fiddcs ct al., 1984). В отличие от ЛГ, который можно обнаружить в гипофизе значительного числа видов, ХГ найден только в плаценте некоторых видов млекопитающих, а именно у лошадей, бабуинов и человека (Fiddcs et al., 1984); а- и p-составляющие ЛГ и ФСГ кодируются различными генами (Fiddes et al., 1984). Кластер генов p-составляющие ЛГ-ХГ у человека включает семь ХГ-подобных генов, один из которых — ген liLH-бета (Fiddes ct al., 1984). Общая организация гена р-субъединицы ЛГ, состоящего из четырех экзонов и трех нитронов, подобна строению генов р-субъединиц других гликопротеидных гормонов.
Регуляторная роль ЛГ
Секреция тестостерона клетками Лейдига находится под контролем ЛГ, который связывается с рецепторами, сопряженными с G-белком, на клетках Лейдига и активирует сигнальный путь циклического аденозинмонофосфата (цАМФ). Рецептор лютеинизирующего гормона-хориопического гонадотропина (ЛГ-ХГ-рецептор) характеризуется гомологией с другими рецепторами, сопряженными с G-белком, такими, как родопсин, адренергические, ФСГ- и ТТГ-рецепторами(McFarland et al., 1989; Sprengel et al., 1990). Рецепторы, сопряженные с G-белком, представляют собой трансмембранные белки, обладающие общим структурным мотивом, включающим семь проникающих через мембрану доменов. Эти семь доменов расположены на карбоксильном конце молекулы, который содержит также небольшой участок с цитоплазматической локализацией. В его последовательности находятся несколько сериновых и треониновых остатков, которые могут подвергаться фосфорилированию (McFarland et al., 1989; Sprengel et al., 1990).
Лютеииизирующий гормон стимулирует активность фермента, расщепляющего боковые цепи, (side-chain cleavage enzyme) (Simpson, 1979; Mori, Marsh, 1982) — фермента, ассоциированного с цитохромом Р450, который катализирует превращение {холестерина в прегненолон, ограничивающий скорость этапа биосинтеза тестостерона. Этот гормон увеличивает поступление холестерина к ферменту, расщепляющему боковые цепи, таким образом, увеличивая эффективность реакции превращения холестерина в прегненолон (Simpson, 1979; Mori, Marsh, 1982). Регуляторный белок стероидогенеза (steroidogenesis acute regulatory protein, STAR) делает холестерин доступным для комплекса, расщепляющего боковые цепи, и регулирует скорость биосинтеза тестостерона (Clark, Stocco, 1996). Периферический рецептор бензодиазипина, митохондриальный белок, связывающий холестерин, который принимает участие в транспорте холестерина и представлен в большой концентрации на внешней митохондриальной мембране, также предлагается на роль активного регулятора процесса стероидогеиеза. К долговременным эффектам ЛГ относятся стимуляция экспрессии генов и синтеза ряда ключевых ферментов пути биосинтеза стероидов, включая фермент, расщепляющий боковые цепи, 3-р-гидроксистероид дегидрогеназу, 17-а-гидроксилазу и 17,20-лиазу (Simpson, 1979; Mori, Marsh, 1982). Несмотря на то что ЛГ активирует также сигнальный путь фосфолипазы С, остается неясным, насколько это имеет важное значение для ЛГ-опосредованной стимуляции выработки тестостерона. Кроме того, в контроле стероидогеиеза в клетках Лейдига принимают участие инсулиноподобный фактор роста I; белки, связывающие инсулиноподобный фактор роста; ингибины, активины, трансформирующий фактор роста-p, эпидермальный фактор роста, интсрлейкин-1, основной фактор роста фибробластов, гонадолиберии, вазопрессин и еще одна группа плохо охарактеризованных митохондриальных белков.
Регуляторная роль ФСГ у самцов млекопитающих
ФСГ связывается со специфическими рецепторами клеток Сертоли и стимулирует выработку ряда белков, в числе которых ингибинподобные пептиды, трансферрин, андрогенсвязывающий белок, рецептор андрогенов и 7-глутамилтранспептидаза. Вместе с тем роль ФСГ в регуляции процесса сперматогенеза остается малопонятной. Преобладает точка зрения, согласно которой ЛГ действует на клетки Лейдига, стимулируя выработку в большом количестве тестостерона (Boccabella, 1963; Steinberger, 1971; Sharpe, 1987). Затем тестостерон влияет на сперматогонии и сперматоциты, инициируя процесс их мейотического деления. Предполагается, что ФСГ необходим для спермогенеза, т. е. процесса созревания, в котором спсрматиды развиваются в зрелые сперматозоиды. Однако данные экспериментов на животных и исследований пациентов с идиопатическим гипогонадотропным гипогонадизмом после лечения гонадотропинами показывают, что ФСГ играет более сложную роль в поддержании количественно нормального сперматогенеза.
У крыс и нечеловекообразных приматов тестостерон сам по себе может поддерживать сперматогенез в случае применения после удаления гипофиза или перерезания ножки гипофиза (Marshall et al., 1983; Sharpe et al., 1988; Stager et al., 2004). Однако, если тестостерон применяется спустя некоторое время (через несколько недель или месяцев) после подобной операции, его эффективность в отношении восстановления сперматогенеза существенно снижается. Сперматогенез, который поддерживается у самцов грызунов и нечеловекообразных приматов с удаленным гипофизом путем введения тестостерона, является качественно, но не количественно нормальным (Marshall et al., 1983; Sharpe et al., 1988; Stager et al., 2004). Более эффективной для повторной инициации сперматогенеза по сравнению с тестостероном оказалась его комбинация с ФСГ (Stager et al., 2004). Таким образом, несмотря на то что ЛГ сам по себе может поддерживать или повторно инициировать сперматогенез, для количественно нормальной продукции спермы необходим ФСГ.
У мужчин, у которых дефицит ЛГ и ФСГ возник в препубертатном возрасте, ЛГ или хорионический гонадотропин человека сами по себе не могут инициировать сперматогенез (Bardin et al., 1969; Matsumoto et al., 1983, 1984; Finkel etal., 1985). Однако если дефицит гонадотропинов развивается после того как у пациента произошло половое созревание, ЛГ и чХГ могут самостоятельно инициировать повторно качественно нормальный сперматогенез (Finkel et al., 1985). Таким образом, ФСГ необходим для инициации процесса сперматогенеза, но после его начала для его поддержания достаточно высоких доз тестостерона. Этот факт позволяет предполагать, что ФСГ может принимать участие в определенном виде “программирования", происходящем в период полового созревания, после чего ЛГ может самостоятельно поддерживать процессы развития и созревания половых клеток.
Концентрация андрогенов в семенниках намного выше, чем в сыворотке крови. Однако касательно высокого уровня тестостерона в семенниках существуют достаточно разноречивые мнения (Sharpe, 1987; Sharpe etal., 1988; Stager etal., 2004). Например, стимулирующий эффект экзогенного тестостерона па сперматогенез у крысы не связан с пропорциональным увеличением его внутрисемеиникового уровня. У взрослых обезьян с удаленным гимофизом или после введения антагоиистов гонадолиберина, которым вводили тестостерон, наблюдается прямая зависимость между уровнем тестостерона в семенниках и сперматогенезом (Stager et al., 2004). Метод посмертного сбора тканей семенников влияет на оценки внутрисеменииковой концентрации тестостерона (Stager et al., 2004). Таким образом, взаимосвязь между внутрисеменниковой концентрацией тестостерона, ФСГ и сперматогенезом остается малопонятной. Рецепторы андрогенов обнаруживаются на клетках Сертоли и перитубулярных клетках, на некоторых клетках Лейдига и эндотелиальных клетках небольших артериол. В то же время нам неизвестно о наличии рецепторов андрогенов на половых клетках. Принято считать, что влияние андрогенов на сперматогенез опосредовано через клетки Сертоли, хотя возможно, что тестостерон может также непосредственно действовать на развитие половых клеток. Тестостерон влияет па секрецию белков как сферическими спсрматидами, так и клетками Сертоли. Максимальная экспрессия рецепторов андрогенов наблюдается в стадии VI—VII сперматогенного эпителия, тестостерон регулирует апоптоз половых клеток в зависимости от стадии их развития.
Для трансдукции сигнала ФСГ к половым клеткам требуется участие клеток Сертоли, поскольку рецепторы ФСГ имеются на этом типе клеток, но отсутствуют на половых клетках. Рецептор ФСГ также представляет собой полипептид, сопряженный с G-белком, состоящий из гликозилированиого внеклеточного домена, который соединяется с С-концевым участком, содержащим 7 трансмембранных участков (Sprengel et al., 1990).
Обратная связь в регуляции секреции лютеинизирующего и фолликулостимулирующего гормонов
Обратная регуляция с помощью тестостерона
Тестостерон занимает важное место в регуляции секреции гонадотропинов у самцов посредством обратной связи. У ряда экспериментальных животных после кастрации резко повышается уровень ЛГ и постепенно ФСГ (Yamamoto et al., 1970; Badger et al., 1978). После кастрации повышается уровень мРНК ЛГ-а и I (Gharib et al., 1986) и ФСГ-р (Gharib et al., 1987), при этом изменения содержания ФСГ-а выражены в гораздо меньшей степени.
Посткастрационное повышение содержания ЛГ в сыворотке крови и уровня мРНК ЛГ-р обусловлено как изменением количества гонадотропных клеток, так и гипертрофией отдельных гонадотропов (Childs et al., 1987). Введение тестостерона, начатое сразу после кастрации или вскоре после нее, может ослаблять посткастрационный рост уровня мРНК ЛГ-а и -р, a также уровня ЛГ в сыворотке крови, однако незначительно влияет на уровень мРНК ФСГ-р (Gharib et al., 1986, 1987).
Тестостерон оказывает комплексное влияние на секрецию и синтез ФСГ
Суммарный эффект in vivo применения тестостерона у мужчин в норме заключается в снижении уровня ФСГ в сыворотке крови (Swerdloff et al., 1979; Winters et al., 1979). Однако прямое воздействие тестостерона на выделение ФСГ на уровне гипофиза стимулирующее (Steinberg, Chowdhury, 1977; Bhasin et al., 1987; Gharib et al., 1987). В культуре изолированных клеток гипофиза тестостерон увеличивает выделение ФСГ в среду (Steinberg, Chowdhury, 1977). Это сопровождается увеличением уровня мРНК ФСГ-р в 3—4 раза (Gharib et al., 1990). У интактных самцов мыши при блокировании действия гонадолиберина путем применения его антагониста тестостерон повышает уровень ФСГ дозозависимым образом (Bhasin et al., 1987). Показано, что у кастрированных животных, которым вводили антагонист гонадолиберина, введение тестостерона в постепенно увеличивающихся дозах сопровождается ростом уровня ФСГ в сыворотке крови. Эти данные показывают, что стимулирующий эффект тестостерона на уровень ФСГ в сыворотке крови опосредован не столько воздействием на гонадальный ингибитор ФСГ, сколько непосредственным влиянием на уровне гипофиза. Тестостерон повышает уровень мРНК ФСГ-р, но не ЛГ-р. В то же время у интактных самцов животных тестостерон подавляет стимулированную гонадолиберином секрецию ФСГ, что в результате приводит к снижению уровня ФСГ в сыворотке крови.
При введении человеку и крысам тестостерон в норме подавляет секрецию ЛГ (Santen, 1975; Matsumoto et al., 1984; Veldhuis et al., 1984). Такие подавляющие эффекты проявляются преимущественно на гипоталамическом уровне — это заключение подтверждает факт снижения тестостероном частоты секреторных выбросов ЛГ у мужчин с нормальными гонадами (Matsumoto, Bremncr, 1984; Schcckter et al., 1989; Finkclstcin et al., 1991a). Андрогены не оказывают прямого воздействия на уровень мРНК ЛГ-р в монослойной культуре клеток гипофиза крысы. Сходным образом у самцов крыс после введения антагониста гонадолиберина введение тестостерона, в постепенно увеличивающихся дозах, приводит только к росту уровня мРНК ФСГ-р, но не мРНК ЛГ-р (Bhasin et al., 1987). В отличие от крыс у людей, больных идиоматическим гипогонадотропным гипогонадизмом, амплитуда колебаний ЛГ, вызванных и поддерживаемых периодическим введением гонадолиберина, уменьшается после введения тестостерона, что свидетельствует о том, что у человека тестостерон оказывает дополнительное воздействие на уровне гипофиза, ослабляя секрецию ЛГ в ответ на стимуляцию гонадолиберином (Matsumoto et al., 1984; Schekter et al., 1989; Finkelstein et al., 1991a). Эти исследования показывают, что у мужчин тестостерон или один из его метаболитов ингибируют секрецию гонадотропина на уровне гипофиза и гипоталамуса.
Ингибирующий эффект тестостерона опосредован непосредственно тестостероном и опосредованно его метаболитами — эстрадиолом и дигидротестостероном. Применение ингибиторов ароматазы или 5-а-редуктазы сопровождается увеличением концентрации ЛГ, что согласуется с представлениями о роли эстрадиола и дигидротестостерона в усилении ингибирующего воздействия тестостерона в цепи обратной связи (Santen, 1975; Finkelstein et al., 1991b; Gormley, Rittmaster, 1992). Однако применение не поддающегося ароматизации андрогена дигидротестостерона также подавляет секрецию ЛГ в соответствии с предположением о том, что ароматизация тестостерона не обязательна для опосредования его ингибирующих эффектов на секрецию ЛГ (Santen, 1975). Точно так же не является существенной для подавления тестостероном секреции ЛГ и 5-а восстановление тестостерона (Gormley, Rittmaster, 1992). Воздействие тестостерона на гипоталамическом уровне осуществляется при участии опиатэргических путей (Veldhuis et al., 1984).
Подавление с помощью обратной связи эстрогенами
Эстрогены могут оказывать как стимулирующее, так и подавляющее влияние на синтез и секрецию гонадотропина в зависимости от дозы, продолжительности воздействия и присутствия или отсутствия гонадолиберина и влияния других физиологических факторов. Эксперименты на животных показывают, что стимулирующий эффект эстрогенов на синтез и секрецию гонадотропина in vivo осуществляется непосредственно на уровне гипофиза, тогда как ингибирование происходит на уровне гипоталамуса (Neill et al., 1977; Clarke, Cummins, 1982; Zmeili et al., 1986; Saade et al., 1989; Shupnik et al., 1989; Yamaji et al., 1992). Применение эстрогенов приводит к снижению частоты ритмических колебаний уровня ЛГ, что предполагает воздействие на уровне гипоталамуса (Shupnik et al., 1989). Обработка эстрадиолом срезов гипоталамуса ослабляет экспрессию мРНК гонадолиберина (Hall, Miller, 1986). Наконец, транскрипция всех трех субъединиц гонадотропина негативно регулируется эстрадиолом in vivo, даже несмотря на то, что его прямое воздействие на гипофиз in vitro имеет стимулирующий характер (Neill et al., 1977; Clarke, Cummins, 1982; Saade et al., 1989). Эстрадиол снижает амплитуду колебаний ЛГ у здоровых мужчин и мужчин с дефицитом гонадолиберина, которым вводят гонадолиберин (Finkelstein et al., 1991b). Эти исследования предоставляют доказательства того, что у мужчин эстрадиол ингибирует синтез и секрецию ЛГ, действуя преимущественно на уровне гипофиза.
Ингибины, активины и фоллистатины
Гипотеза, согласно которой пептид гонадального происхождения селективно регулирует секрецию ФСГ была выдвинута более 70 лет назад (McCulIagh, 1932), однако структура ингибинподобных пептидов была окончательно охарактеризована лишь в 1985 г. (Ling et al., 1985; Buiger, Igarashi, 1988; Vale et al., 1988; Ying, 1988). Ингибины представляют собой димерные белки, в состав которых входит одна общая а-составлякмцая и одна или две p-составляющих: РА или Рв. Гетеродимеры а:Рд формируют ингибин А, а гетеродимеры а:Рв — ингибин В (Vale et al., 1988). Ингибины А и В в равной степени подавляют секрецию ФСГ, хотя преобладающей формой ингибина в крови у мужчин является ингибин В. Кроме того, составляющие РА способны формировать гомодимеры, называемые активин А, или гетеродимеры с составляющими бета — активин АВ (Mason et al., 1985). Оба активина, А и В, стимулируют секрецию ФСГ in vitro.
Ингибинподобные белки широко распространены в различных органах и обладают значительной гомологией с членами семейства белков, которое включает Мюллеровскую ингибирующую субстанцию, трансформирующий фактор роста-p, белки костной ткани, а также комплекс генов decapentaplegic у дрозофилы (Vale et al., 1988; Ying, 1988),— все они играют важную роль регуляторов роста и дифференцировки в различных тканях. Однако активин взаимодействует с эритропоэтином, стимулируя эритропоэз. Кроме того, активин является важным регулятором генов, содержащих гомеобокс. В семенниках он регулирует увеличение количества сперматогониев (Mather et al., 1990).
Роль ингибинов в организме взрослых самцов животных остается неясной
Исследования с использованием иммунонейтрализации на крысах показали, что введение антиингибиновой сыворотки приводит к увеличению уровня ФСГ только у самок либо у самцов препубертатного возраста, но не у взрослых самцов (Rivier et al., 1986). Эти данные ставят под вопрос роль ингибина in vivo как регулятора ФСГ у взрослых самцов. Впоследствии было показано, что после разрушения клеток Лейдига у взрослых самцов крысы с помощью специфического токсина этандиметансульфоната использование антиингибиновой сыворотки приводит к росту уровня ФСГ в сыворотке крови (Culler, Negro-Vilar, 1990). Этот результат показывает, что в обычных условиях у взрослых самцов более важную роль в регуляции ФСГ играет тестостерон и влияние ингибина можно обнаружить только при снижении уровня тестостерона. Действительно, используя специфические, двунаправленные методы исследования была установлена обратная взаимосвязь между уровнем ингибина В и уровнем ФСГ в крови у здоровых мужчин и женщин, а также у мужчин с нарушениями развития половых клеток.
Хотя согласно первоначальной гипотезе ингибин рассматривался в качестве селективного ингибитора ФСГ, при определенных условиях он может также регулировать уровень ЛГ (Vale et al., 1988). Однако и ФСГ, и ЛГ регулируют выработку ингибина клетками Сертоли у самцов крысы и человека (McLachlan et al., 1988; Keman ct al., 1989; Krummen et al., 1989); и ФСГ, и ЛГ повышают уровень мРНК ингибина-а (Krummen et al., 1989, 1990). Влияние ФСГ на продукцию субъединиц ингибина осуществляется при участии цАМФ (Najmabadi et al., 1993).
Фоллистатины представляют собой еще один класс ингибиторов ФСГ (Ueno et al., 1987), который включает гликозилированные полипептиды, обладающие гомологией с панкреатическим секреторным ингибирующим белком и эпидермальным фактором роста человека (hEFR). Зрелый фоллистатин состоит из четырех доменов, три из них по последовательности очень схожи между собой, а также с hEFR и PSTI. Физиологическая роль фоллистатинов неизвестна, все большее количество данных указывает, что их действие может заключаться преимущественно в подавлении секреции ФСГ. Фоллистатины являются потенциальными ингибиторами продукции эстрогена в гранулезных клетках и могут связывать активин. Кроме того, они могут выступать в роли связывающих белков для других росторегулирующих белков, например миостатина.
Активины регулируют функцию гонад у мужчин и женщин (Vale et al., 1988). В семенниках активины усиливают стимулированную ЛГ выработку тестостерона, в то время как ингибины ее подавляют. В клетках гранулезного слоя активины повышают активность ароматазы, но ингибируют синтез прогестерона (Vale et al., 1988; Ying, 1988). Активин В может также действовать в качестве аутокринного/паракринного посредника в гипофизе и модулировать экспрессию гена FSH-а.
Секреция лютеинизирующего и фолликулостимулирующего гормонов в онтогенезе в разные периоды жизни человека
Развитие плода. Гонадолиберии обнаруживается в гипоталамусе плода уже через 6 недель после начала беременности (Lee Р.А., 1988). На 10-й неделе развития эмбриона в гипофизе содержатся детектируемые количества Л Г и ФСГ, а на 11 — 12-й неделе могут быть обнаружены изменения уровня ЛГ в ответ на гонадолиберин. Уровень ЛГ и ФСГ достигает своего пикового значения примерно на 20-й неделе (Clements et al., 1980; Lee P.A. 1988). Во второй половине беременности происходит постепенное снижение уровня ЛГ и ФСГ в сыворотке крови. Механизм этого явления неизвестен, однако оно может быть обусловлено некоторыми факторами, действующими во второй половине беременности. Усиление секреции половых стероидов гонадами плода, повышение уровня эстрогенов в материнском организме, а также формирование механизмов отрицательной обратной связи — все это может вносить свой вклад в тоническое ингибирование гипоталамуса и гипофиза половыми стероидами (Winter et al., 1975; Sizonenko, 1979).
Плацентарный хорионический гонадотропин играет важную роль в стимуляции выработки андрогенов семенниками эмбриона в ранний период беременности (Lee Р.А., 1988). Повышенный уровень андрогенов необходим для дифференцировки структур Вольфа у зародышей мужского пола. Кроме того, ФСГ стимулирует дифференцировку и развитие семенных канальцев. Эти данные согласуются с тем фактом, что у лиц, больных идиопатическим гипогонадотропным гипогонадизмом, происходит нормальная дифференцировка Вольфовых протоков и внешних гениталий, поскольку плацентарный хорионический гонадотропин стимулирует семенники плода к выработке достаточных количеств андрогенов, даже при отсутствии гипофизарного ЛГ и ФСГ. Однако из-за дефицита ФСГ у этих пациентов наблюдается недоразвитие или задержка развития семенных канальцев. В частности, во второй половине беременности от уровня андрогенов, который в этот период регулируется гипофизарным ЛГ, зависит опускание семенников (Husmann, 1991).
Постнатальный период и детские годы. После родов уровень ЛГ и ФСГ вновь повышается, хотя и не надолго (Winter et al., 1975; Sizonenko, 1979). В первые 6 месяцев постпатальной жизни ЛГ и ФСГ выявляются в крови в детектируемых количествах (Winter et al., 1975). В этот короткий период реактивации гипоталамо-гипофизарной системы можно наблюдать ритмический характер секреции ЛГ и ФСГ (Winter et al., 1975; Jakachi et al., 1982). Уровень ЛГ и ФСГ в сыворотке крови достигает пика к возрасту 2—3 месяцев и затем снижается до необнаруживаемых количеств к 9—12 месяцам, подобные изменения происходят и с уровнем тестостерона. Таким образом, этот короткий период послеродовой жизни, когда содержание гонадотропина и половых стероидов еще не снизилось до минимума, предоставляет возможность для оценки функционирования гипоталамо-гипофизарно-гонадальной системы.
В детском возрасте гипоталамо-гипофизарно-гонадальная система находится в состоянии бездействия до наступления пубертата (Lee Р.А. et al., 1976; Apter et al., 1978). Вместе с тем гипофиз и семенники сохраняют способность реагировать на гонадолиберин и хорионический гонадотропин. Реакция гипофиза на стимуляцию гонадолиберином в препубертатном возрасте относительно ослаблена. Кроме того, в это время гонадолиберии стимулирует более значительное повышение уровня ФСГ по сравнению с ЛГ. Это отличает детей от взрослых, у которых однократная стимуляция гонадолиберином вызывает более выраженное повышение уровня ЛГ. Во время полового созревания происходит повышение уровня ЛГ и ФСГ (Sizonenko, 1979). Активация секреции ФСГ предшествует усилению секреции ЛГ. Для ранних стадий пубертата характерна ритмическая секреция ЛГ во время сна (Jakachi et al., 1982).
Использование высокочувствительного двунаправленного иммунорадиометрического, иммунофлуориметрического и хемилюминесцентного анализа показало, что, начиная с возраста 7 лет и до завершения полового созревания организма, средняя концентрация Л Г увеличивается более чем в 100 раз, ФСГ — в 7 раз, а эстрадиола — в 12 раз (Apter et al., 1989). Повышение уровня ФСГ происходит постепенно, в то время как уровень ЛГ возрастает очень резко. Изменения ФСГ предшествуют росту концентрации ЛГ. Механизмы контроля низкого уровня гонадолиберина в детском возрасте и запуска его секреции при наступлении пубертата остаются неизвестными.
Изменения репродуктивной функции при старении. Существует общее мнение о том, что при старении организма уровень тестостерона в сыворотке крови мужчин прогрессивно снижается (рис. 21.6) (Pirke, Doerr, 1973; Dai et al., 1981; Gray et al., 1991; Simon et al., 1992; Zmuda et al., 1997; Ferrini, Barret-Connor, 1998; Harman et al., 2001; Feldman et al., 2002; Matsumoto, 2002). Почти у 25 % мужчин в возрасте старше 70 лет уровень тестостерона в сыворотке крови находится в диапазоне, характерном для гипогонадизма (Harman et al., 2001). Поскольку с возрастом происходит увеличение уровня глобулина, связывающего половые гормоны (sar hormone binding globulin, SHBG), снижение свободного и биодоступного тестостерона при старении более значительное по сравнению со снижением уровня общего тестостерона (Pirke, Doerr, 1973; Tenover et al., 1987; Ferrini, Barret-Connor, 1998; Harman et al., 2001). Суточный ритм секреции тестостерона, который наблюдается у молодых мужчин, с возрастом заметно ослабевает. Несмотря на то что в последние десятилетия жизни происходит снижение среднего уровня общего, свободного и биодоступного тестостерона, у многих мужчин старшего возраста содержание его в сыворотке крови остается в пределах нормы. Уровень эстрадиола и эстрона в крови либо не изменяется, либо немного возрастает вследствие усиления процессов ароматизации андрогена в эстроген в периферических органах (Pirke, Doerr, 1973; Ferrini, Barret-Connor, 1998).
На возрастные изменения репродуктивных гормонов накладывается дополнительное влияние сопутствующих заболеваний, изменения состава тела и приема лекарственных препаратов. Несмотря на то что данные о взаимосвязи возраста и уровня андрогенов в сыворотке крови по сути являются преимущественно результатами констатирующих исследований, возрастное снижение уровня тестостерона было подтверждено также в нескольких лоигитудиналь-ных исследованиях (Zmuda et al., 1997; Harman ct al., 2001; Feldman et al., 2002). Некоторые из этих работ подвергались критике за выбор мужчин старшего возраста, состояние здоровья которых было лучше, чем у основной части населения. Однако даже после внесения поправки на заболеваемость, время отбора крови для анализа, вариабельность методов анализа и влияние принимаемых лекарств, уровень тестостерона у мужчин старшего возраста ниже по сравнению с молодыми мужчинами.
Возрастное снижение уровня тестостерона происходит вследствие дефектов на всех уровнях гипоталамо-гипофизарно-гонадальной системы. Секреция андрогенов в семенниках мужчин старшего возраста ослаблена из-за нарушений на уровне половых желез. Это подтверждается повышением уровня ФСГ и Л Г (Kaufman, VErmeulen, 1997; Morlcy et al., 1997; Feldman et al., 2002), ослаблением реакции тестостерона на хорионический гонадотропин и снижением массы клеток Лейдига у мужчин старшего возраста (Longcope, 1973). У мужчин старшего возраста также повышен уровень свободной а-субъединицы в крови (Harman et al., 1982).Секреция ЛГ у пожилых мужчин происходит менее регулярно но сравнению с молодыми (Pincus et al., 1997). У пожилых мужчин также наблюдается ослабление синхронности между секрецией ЛГ и тестостерона (Pincus et al., 1997). Таким образом, старение организма сопровождается нарушениями регуляторных механизмов обратной связи, осуществляющих контроль потока информации между компонентами гипоталамо-гипофизарно-семенниковой системы, а также изменением установившегося характера ритмической секреции гормонов (Pincus et al., 1997).
Секреция, транспорт и метаболизм тестостерона
Секреция тестостерона. У самцов большинства видов млекопитающих 95 % тестостерона в системе кровообращения является результатом его секреции в семенниках. Семенники взрослого мужчины в течение суток секретируют 3—10 мг тестостерона (Horton, 1978). Прямая секреция ею надпочечниками и превращение адростендиопа в периферических органах в сумме дают еще 500 мкг тестостерона в сутки. Семенники человека продуцируют лишь небольшое количество дигидротестостерона (примерно 70 мкг в сутки), основная масса этого гормона в крови является результатом его образования из тестостерона (Longcope, Fineberg, 1985).
Тестостерон вырабатывается в семенниках гетерогенной группой клеток, куда входят зрелые клетки Лейдига, их предшественники и незрелые клетки Лейдига (Prince, 2001). Исследования гипогонадотропных мышей показали, что развитие клеток Сертоли и Лейдига у плода не зависит от гонадотропинов, однако их присутствие необходимо для нормальной дифференциации и пролиферации популяции зрелых клеток Лейдига. У мужчин 46,XY с инактивирующей мутацией рецептора Л Г наблюдается неоднозначность при формировании половых органов, выраженная в различной степени, и отсутствие клеток Лейдига, что указывает на важную роль ЛГ в регуляции развития клеток Лейдига (Dufau, 1988; Huhtaniemi, Toppari, 1995). Количество клеток Сертоли после рождения регулируется гонадотропинами.
Транспорт андрогенов в организме: 98 % тестостерона, циркулирующего в системе кровообращения, связано с белками плазмы — глобулином, связывающим половые гормоны (SHBG), и альбумином (Vermeulen, 1988; Rosner, 1991); SHBG связывает тестостерон с гораздо большей чувствительностью по сравнению с альбумином. Лишь 0,5—3,0 % тестостерона находится в несвязанном состоянии. Хотя согласно общепринятой точке зрения только несвязанная фракция обладает биологической активностью, гормон, связанный с альбумином, легко диссоциирует в капиллярах и также может обладать биодоступностью (Pardridge, 1987). Было показано, что связанные с альбумином и SHBG андрогены представляют основной пул биодоступного гормона в системе кровообращения для семенников или простаты (Pardridge, 1987). Более того, эти исследователи считали, что комплекс SHBG — половой стероид может практически свободно проникать из крови через барьерную систему в семенники и через плазматическую мембрану простаты. Эту точку зрения разделяют не все (Pardridge, 1987).
Гликопротеин SHBG, синтезируется в печени и обладает высокой чувствительностью к тестостерону и эстрадиолу (Vermeulen, 1988; Rosnr, 1991). Продукция SHBG в печени регулируется инсулином, ти-реоидными гормонами, пищевыми факторами, а также соотношением андрогенов и эстрогенов; принимает участие в транспорте половых стероидов в плазму, и его концентрация является основным фактором, регулирующим их распределение между связанным с белком и свободным состояниями. Концентрация SHBG в плазме снижается после применения андрогенов, при ожирении, гипсрипсулинизме и нефротическом синдроме (Roner, 1991). И наоборот, прием эстрогенов, гипертироидизм, многие виды воспалительных заболеваний и старение сопровождаются повышением уровня SHBG. Локус, ассоциированный с концентрацией SHBG, в геноме негроидной и европеоидной рас был картирован в положении lq44, в геноме негроидной расы взаимосвязь с концентрацией этого глобулина обнаруживают несколько дополнительных локусов, что свидетельствует о мультигенной регуляции уровня SHBG (Larrea et al., 1995). Связывание тестостерона с SHBG или альбумином не имеет важного значения для его действия — крысы с дефицитом SHBG и альбумина фертильны, у них наблюдается нормальное поведение при спаривании.
Метаболизм тестостерона происходит главным образом в печени (50—70 %), хотя процессы деградаций отмечаются также и в других периферических тканях, в частности в простате и коже. Тестостерон поступает в печень из крови и подвергается там серии химических реакций с участием 5-а- и 5-р-рсдуктаз, 3-а- и 3-р-гидроксистероиддегидрогеназ и 17-(3-гидроксистероиддегидрогеназы, в результате которых он превращается в андростерон, этио-холанолон (оба эти метаболита неактивны), а также в дигидротестостерон и 3-а-андростандиол. Перед экскрецией в почках эти соединения подвергаются глюкуропидации или сульфатации. Свободные и связанные андростерон и этиохоланолон являются основными метаболитами тестостерона, обнаруживаемыми в моче.
Тестостерон как прогормон: роль дигидротестостерона и эстрадиола в опосредовании действия андрогенов. Тестостерон подвергается химическим превращениям во многих периферических тканях в активные метаболиты — 17-р-эстрадиол и 5-а-дигидротестостерои (Wilson et al., 1993; Grumbach, Auchus, 1999). Ароматизация A-кольца превращает его 17-р-эстрадиол. Однако восстановление двойной связи ст-4 может превращать тестостерон в 5-а-дигидротестостерон. Действие тестостерона во многих тканях осуществляется посредством этих метаболитов, например, эффект тестостерона на резорбцию трабекулярной костной ткапи, половую дифференциацию головного мозга, уровень липидов в плазме крови, развитие атеросклероза и некоторые типы поведения опосредован его превращением в эстроген (Grumbach, Auchus, 1999). Исследования на мышах с мутацией гена а-рецептора эстрогена, Р-рецептора эстрогена или ароматазы позволяют лучше понять роль эстрогенов в организме самцов млекопитающих (Jones et al., 2000). У этих моделей с дефицитом эстрогенов наблюдаются существенные нарушения сперматогенеза и способности к оплодотворению, повышенный уровень тестостерона и ЛГ, снижение массы костной ткани и увеличение жировых отложений, что свидетельствует о важном значении эстрогенов в регуляции костной массы, гонадотропина, состава тела и сперматогенеза (Smith et al., 1994; Carani et al., 1997). Существуют сообщения о редких случаях инактивирующих мутаций гена ароматазы CYPI9 у человека (Carani et al., 1997). У женщин с мутацией гена CYP19 наблюдается маскулинизация, неспособность к половому развитию, повышенные уровни андрогенов, ЛГ и ФСГ, поликистоз яичников и высоким рост. У мужчин с мутацией гена ароматазы CYP19 отмечается остеонороз, ускорение обменных процессов в костной ткани, задержка слияния эпифиза, высокий рост, а также повышенный уровень тестостерона и пониженный — эстрадиола (Carani et al., 1997).
Охарактеризованы два изофермента 5-а-редуктазы стероидов (Wilson et al., 1993; Russel, Wilson, 1994); 5-а-рсдуктаза стероидов типа 1 экспрессируется во многих типах соматических тканей, имеет оптимум pH 8.0, ген этого фермента картирован в хромосомном локусе 5р15; 5-а-рсдуктаза стероидов типа 2 экспрессируется в простате и других тканях половых органов, имеет оптимум pH 5.0, се ген расположен в локусе 2р23 (Wilson t al., 1993). У мышей с отсутствием гена 5-а-редуктазы типа 1 наблюдается недоразвитие шейки матки и нарушения родового процесса (Wilson et al., 1993).
Чтобы тестостерон мог оказывать воздействие на предстательную железу и сальные железы, необходимо восстановление его 5-а до дигидротестостерона. Дигидротсстостерон играет роль в патофизиологии доброкачественной гиперплазии простаты и андрогенной алопеции (Wilson et al., 1993). Изофермент типа 2 является преобладающей в простате формой и принимает участие в патофизиологии доброкачественной гипертрофии простаты, гирсутизма и, возможно, облысения у мужчин. Во время эмбрионального развития тестостерон контролирует дифференцировку Вольфовых протоков в эпидидимис, выносящие канальцы и семенные пузырьки. Для формирования структур из урогенитального синуса и полового бугорка, таких, как мошонка, пенис и губчатая часть мужского мочеиспускательного канала, также требуется дигидротестостерон. Несмотря на то что и тестостерон, и дигидротестостерон оказывают анаболические эффекты на мышечную ткань, активность 5-а-редуктазы в скелетной мышце очень низкая или отсутствует и неизвестно, является ли восстановление тестостерона до дигидротестостерона обязательным условием для опосредования эффектов андрогенов на мышцы. Точно так непонятным остается вопрос, какой именноа андроген — тестостерон или дигидротестостерон влияет на половую функцию мужчин.
Обширная информация о роли дегидротестостерона была получена в результате исследований больных с аутосомным рецессивным дефицитом 5-а-редуктазы стероидов. У детей мужского пола с 46.XY заболеванием при рождении присутствуют нормальные внутренние мужские половые органы, включая I семенники, при этом у них наблюдаются отклонения в формировании наружных половых органов, или наличие женских половых органов (Cai et al., 1993; Mcndonca ct al., 1996). В период полового созревания у таких больных наблюдается частичная вирилизация и нормальное развитие мышечной системы (Cai et al., 1993). У многих, но не у всех, лиц с 46,XY нарушением формируется мужская гендерная идентификация, даже если они воспитывались как девочки. Особенности их развития свидетельствуют о том, что тестостерон сам но себе способен стимулировать психосексуальное поведение, либидо, развитие в эмбриональном состоянии Вольфовых протоков, формирование мускулатуры, огрубение голоса, сперматогенез, а также оволосение в подмышечных впадинах и на лобке. Вместе с тем дигидротестостерон необходим для формирования и роста предстательной железы, формирования наружных половых органов, мужского типа оволосения лица и тела либо развития мужского типа облысения. Все лица с дефицитом 5-а-редуктазы, изученные к настоящему времени, характеризовались наличием мутации в гене 5-а-редуктазы стероидов типа 2 — формы фермента, преобладающей в тканях предстательной железы (Cai ct al., 1993; Mcndonca ct al., 1996).
Механизм действия андрогенов. Большая часть эффектов тестостерона и дигидротестостерона опосредованы связыванием этих стероидов с внутриклеточным рецептором андрогенов, который действует как лигандзависимый транскрипционный фактор (Zhou ct al., 1994; Lee D.K., Chang, 2003). Сродство связывания с рецептором андрогенов у тестостерона в два раза меньше по сравнению с дигидротестостероном, несмотря на то, что максимальная связывающая способность рецептора для обоих этих андрогенов одинакова. Комплекс рецептора с дигидротестостероном характеризуется более высокой термостабильностыо и меньшей скоростью диссоциации. Это может обеспечивать более высокие возможности дигидротестосторона в осуществлении эффектов андрогена в некоторых андрогенчувствнтельных тканях, таких, как предстательная железа.
Рецептор андрогенов характеризуется гомологией с другими ядерными рецепторами, включая рецепторы глюкокортикоидов, прогестерона и минералкортикоидов (Zhouct al., 1994; Lee D.K., Chang, 2003). Преобладающая форма рецептора андрогенов содержит в своем составе 919 аминокислотных остатков, имеет молекулярную массу 110—114 «Да и состоит из трех консервативных функциональных доменов: стероидсвязывающего домена, ДНК-связывающero домена и домена, активирующего транскрипцию. Наиболее консервативным из них является центральный цистеинбогатый ДН К-связьшающий домен. Единственная копия гена рецептора занимает участок протяженностью 90 тпн в хромосомном локусе Xq 11 —12. В отсутствие своего лиганда белок рецептора андрогенов распределяется в ядре и цитоплазме. Связывание андрогена с рецептором заставляет его перемещаться в ядро — за перемещение в ядро и функцию трансактивации отвечает аминокислотная последовательность, расположенная между 617 — 633 аминокислотными остатками рецептора. Существуют разрозненные свидетельства того, что некоторые эффекты андрогенов могут быть опосредованы через мембранные рецепторы иными путями, не затрагивая геном.
Связывание рецептора с андрогеном приводит к конформационным изменениям этого белка. Существуют также данные, свидетельствующие о том, что связывание антиандрогенов с рецептором может вызвать другой тип конформационных изменений (Zhou et al., 1994; Lee D.K., Chang, 2003). Рецептор андрогенов может использовать два трансактивационных домена, AF, и AF, соответственно. Трансактивационный компонент AF, (включая и так называемые регионы 1 и 5) расположен в аминоконцевой части рецептора, тогда как AF2 находится в его карбоксиконцевом, гормонзависимом компоненте. В интактном рецепторе и AF,, и AF, являются гормонзависимыми и подвержены влиянию коактиваторов ядерного рецептора. В то же время в укороченном рецепторе андрогенов, утратившем гормонсвязывающий домен, AF, становится конститутивно активным. Связывание гормона с рецептором приводит к образованию комплекса с тканеспецифическими коактиваторами и ко-рспрсссорами, определяющими специфичность действия гормона.
Мутации в гене рецептора андрогенов связаны с обширным спектром фенотипических нарушений (Brinkman, 2001). Лица с полным отсутствием чувствительности к андрогенам, которое наблюдается при мужском псевдогермафродитизме, характеризуются наличием наружных женских половых органов, слепого влагалищного кармана и хорошо развитых грудных желез. У больных с другими мутациями рецептора андрогенов может быть мужской фенотип и менее выраженные нарушения, такие, как гипоспадня, гинекомастия н бесплодие (McPhaul et al., 1993).
Длина повторов CAG и GCC в экзоне 1 гена рецептора андрогенов взаимосвязана с транскрипционной активностью белка рецептора. Отклонения в длине поли глутаминового тракта в экзоне 1 рецептора андрогенов связана со спинальной и бульбарной мышечной атрофией, известной также под названием болезни Кеннеди. Хотя в некоторых исследованиях сообщалось о взаимосвязи полиморфизма длины поли глутаминовых и полиглициновых трактов с мужским бесплодием и риском рака простаты, подтвердить ее существование окончательно не удалось (Casclla et al., 2001).
Биохимические пути, связывающие энергетический баланс и репродуктивную систему
Еще со времен античности людям известно о тесной взаимосвязи энергетического баланса и характера питания с функцией репродуктивной системы у мужчин и женщин. Начало полового созревания, продолжительность репродуктивного периода, количество потомства и возраст наступления менопаузы, — все эти показатели связаны с массой и составом тела, в частности с количеством жировых отложений (Frisch, McArthur, 1974; Van Der Spruy, 1985; Frisch, 1989; Foster, Nagatani, 1999). Для нормальной репродуктивной функции необходимо оптимальное питание: как ограничение калорийности рациона питания и последующее снижение массы тела, так и чрезмерное потребление пищи и ожирение ведут к нарушениям репродуктивной функции. Временные особенности полового созревания значительно сильнее связаны с развитием и ростом тела человека, чем с хронологическим возрастом (Penny et al., 1978; Frisch, 1989). В царстве животных в периоды нехватки пищи небольшие животные с небольшой продолжительностью жизни могут даже не успевать достичь половой зрелости до наступления смерти (Foster, Nagatani, 1999). У животных с более продолжительным сроком жизни при отсутствии должного питания может происходить задержка полового созревания. Недостаточное питание, обусловленное голоданием, нарушениями питания и физическими нагрузками, приводит к снижению массы тела, а также изменениям его состава и уровня гормонов, которые могут нарушать репродуктивную функцию (Penny et al., 1978; Bates et al., 1982; Rock et al., 1996). Как правило, снижение массы тела и изменения его состава, обусловленные недостаточным питанием, связаны с ослаблением секреции гонадотропина, снижение уровней ЛГ и ФСГ также коррелирует со степенью уменьшения массы тела (рис. 21.7) (Penny et al., 1978). Вместе с тем при кахексии, связанной с хроническими заболеваниями, такими, как синдром приобретенного иммунодефицита, может наблюдаться и гипогонадотропный и гипергонадотронный гипогонадизм (Arver et al., 1999). В целом все эти наблюдения предоставляют веские доказательства того, что энергетический баланс является важным фактором, определяющим функцию репродуктивной системы у всех млекопитающих.
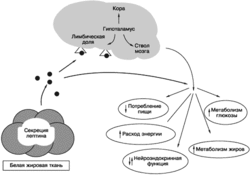
Нам неизвестна точная природа биохимических путей, объединяющих энергетический метаболизм и репродуктивную систему, два неотъемлемых элемента биологических систем, определяющих выживание любого вида. Согласно наиболее распространенной гипотезе, медиаторами метаболических сигналов, регулирующих гипоталамическую секрецию гонадолиберина, являются лептин и нейропептид Y (Aubert et al., 1988; Clarke, Henry, 1999; Cunningham et al., 1999; Foster, Nagatani, 1999). Лептин — продукт гена ожирения ob — представляет собой гормон, циркулирующий в системе кровообращения, который секретируется клетками жировой ткани и обладает центральным действием, осуществляя регуляцию активности эффекторной системы центральной нервной системы, которая отвечает за поддержание энергетического баланса (Schwartz et al., 1999). Лептин стимулирует секрецию ЛГ путем активации синтазы оксида азота в гонадотропных клетках (McCann et al., 1988) и подавляет секрецию нейропептида Y. Нейропептид Y оказывает тоническое подавляющее воздействие на секрецию лептина и гонадолиберина. Лептин также стимулирует продукцию оксида азота (NO) в медиобазалыюм гипоталамусе, NO стимулирует секрецию гонадолиберина гипоталамическими гонадолиберинсекретирующими нейронами (McCann et al., 1988). Полученные в последнее время данные свидетельствуют о существовании дополнительных регуляторных путей, в числе которых и энергетический гомеостаз, связанный с галаниноподобным пептидом (GALP), потребление пищи и секреция го-иадолиберина в гипоталамусе (см. рис. 21.7) (Seth et al., 2004). Суммарный эффект действия лептина заключается в стимуляции гипоталамической секреции гонадолиберииа (Schwartz et al., 1999).
Ограничение энергетической ценности рациона питания у млекопитающих ассоциировано со снижением уровня лептина и последующим падением уровня ЛГ (Schwartz et al., 1999). Введение лептина голодающим мышам восстанавливает подавление секреции гонадотропина, которое сопутствует недостатку питания (Schwartz et al., 1999). Однако мутантные мыши ob/ob с дефицитом лептина характеризуются гипогонадотропным гипогоиадизмом и бесплодием, а введение таким мышам лептина восстанавливает у них секрецию гонадотропина и способность к оплодотворению (Mohamed-Ali et al., 1998; Schwartz et al., 1999). Таким образом, энергетический дефицит и снижеиие массы тела связаны с нарушением секреции гонадолиберина, которое отчасти обусловлено изменениями активности нейропептида Y, гала-нинподобного пептида (GALP) и последующего снижения секреции лептина. Хотя установлено, что лептин — важный метаболический фактор, объединяющий энергетический баланс и репродуктивную систему, остается неясным, является ли он первичным сигналом для запуска секреции гонадолиберина в начале полового созревания. Все большее количество данных свидетельствует о том, что лептин необходим, но не достаточен для инициации пубертата.
Взаимосвязь между характером питания, воспроизводством потомства и половым созреванием
Голодная зима в Дании. Во время Второй мировой войны с октября 1944 г. по май 1945 г. германская армия ограничила поставку продовольствия в ряд городов Дании (рис. 21.8), что привело к существенному снижению среднесуточного потребления пищи до уровня менее 1000 ккал (Stein et al., 1973). Исследования показали, что у 50 % женщин, подвергшихся голоданию, развилась аменорея, снизилась частота зачатий, а также возрос уровень перинатальной смертности, врожденных пороков развития и шизофрении (Stein et al., 1973). Таким образом, оптимальное потребление энергии с пищей является важным условием нормальной способности к воспроизведению потомства и пренатального развития плода.
Взаимосвязь массы тела и фертильности в племени Кунг Сан. Племя Кунг Сан (Kung San), обитающее в Ботсване, занимается охотой и питается дарами природы (Van Der Walt et al., 1978). Масса тела у мужчин и женщин племени изменяется на протяжении года в зависимости от наличия пищи. В летние месяцы, изобильные пищей, масса тела у них увеличивается, а в зимние месяцы — достигает минимальных значений. Количество родов в племени достигает пика 9 месяцев спустя после пика массы тела (Van Der Walt et al., 1978). Это еще один пример того, как наличие пищи регулирует способность к воспроизведению потомства в природе.
Миннесотский эксперимент по изучению последствий голодания. В конце 40-х годов в кампусе Университета Миннесоты был проведен эксперимент по изучению последствий голодания, в котором приняли участие 32 добровольца. Энергетическая ценность их рациона питания во время проведения эксперимента равнялась примерно 1600 ккал день"1 (6,688 МДж день-1), что составляет около двух третей нормальных энергетических потребностей (Keys et al., 1950). Участники эксперимента потеряли в среднем 23 % начальной массы тела, более 70 % жировой ткани и 24 % нежировой ткани. Снижение энергетической ценности рациона питания и последующая потеря массы тела сначала привели к утрате либидо и уменьшению количества секрета предстательной железы, а также подвижности и жизнеспособности спермы. Уменьшение продукции спермы наблюдалось уже при снижении массы тела примерно на 25 % ниже нормального значения для данного роста. Восстановление нормальной массы тела сопровождалось восстановлением репродуктивной функции.
Нарушения репродуктивной функции при острых и хронических заболеваниях
У мужчин с хроническими заболеваниями часто наблюдается дефицит андрогенов, определяемый как снижение уровня тестостерона. Так, даже после появления мощной антивирусной терапии недостаток андрогенов продолжает оставаться общим осложнением после ВИЧ-инфекции. В одном из исследований 150 ВИЧ-инфицированных мужчин, посещавших нашу клинику в 1997 г., примерно у одной трети уровень общего и свободного тестостерона в сыворотке крови находился на уровне, характерном для гипогонадизма (Arver et al., 1999). Другие исследования также отмечали значительную распространенность гипогонадизма у ВИЧ-инфицированных мужчин (Dobs et al., 1996; Grinspooon et al., 1996). Проведенное обследование ВИЧ-инфицированных мужчин показало, что у многих из них уровень тестостерона снижен до 20 % (Reitschei et al., 2000). Таким образом, дефицит андрогенов продолжает оставаться широко распространенным явлением у ВИЧ-инфицированных мужчин.
По результатам нашего исследования, у 20 % ВИЧ-инфицированных мужчин с низким уровнем тестостерона наблюдался повышенный уровень ЛГ и ФСГ, т. с. гинергонадотропный гипогонадизм (Arver et al., 1999). Такую картину можно объяснить первичной дисфункцией семенников у этих больных. У остальных 80 % уровень ЛГ и ФСГ был нормальным либо пониженным. У мужчин с гипогонадотронным гипогонадизмом был либо центральный дефект на уровне гипоталамуса или гипофиза, либо двойной дефект, затрагивающий и семенники и гипоталамо-гипофизарные центры. Патофизиология гипогопадизма при ВИЧ-инфекции достаточно сложна и включает дефекты на различных уровнях гипоталамо-гипофизарно-семенииковой системы.
В одном из проведенных недавно исследований было показано, что у мужчин с хроническим обструктивным заболеванием легких понижен уровень общего и свободного тестостерона (Casaburi et al., 1996). Подобным образом гипогонадизм очень часто встречается у больных раковыми заболеваниями, с последней стадией почечной недостаточности, находящихся на гемодиализе, а также при заболеваниях печени (Handelsman, Dong, 1993; Singh etal., 2001). В работах прежних лет сообщается о том, что две трети мужчин с последней стадией почечной недостаточности имеют низкий уровень общего и свободного тестостерона (Handelsman, Dong, 1993). Согласно результатам более позднего исследования, из 39 мужчин с последней стадией почечной недостаточности, находившихся на гемодиализе и не больных сахарным диабетом, у 24 уровень общего свободного тестостерона был ниже нижнего предела нормального диапазона (Singh et al., 2001). У мужчин на гемодиализе с высокой частотой встречается нарушение половой функции и сперматогенеза (Handelsman, Dong, 1993). Кроме того, у таких больных происходит снижение мышечной массы и увеличение массы жировой ткани, а также наблюдается заметное снижение мышечной силы и физических возможностей (Kopple, 1999; Johansen etal., 2001). Хотя известно, что дефицит андрогенов может вносить свой вклад в комплексную патофизиологию нарушения половой функции и саркопении у мужчин па гемодиализе, ничего не известно о том, могут ли эти физиологические сдвиги быть обращены назад с помощью заместительной гормональной терапии.
Патофизиология гипогонадизма при хронических заболеваниях представляет собой многофакторное явление — дефекты могут возникать на всех уровнях гипоталамо-гипофизарно-семенниковой системы (Bross et al., 1998). Неправильное или недостаточное питание, медиаторы и продукты системного воспалительного ответа, лекарственные препараты, такие, как кетоконазол, и нарушения обменных процессов, обусловленные системными заболеваниями, — все это может вносить свой вклад в снижение выработки тестостерона.
Низкий уровень тестостерона коррелирует с плохим прогнозом прохождения заболевания. Низкий уровень тестостерона коррелирует с неблагоприятным прогнозом течения заболевания у ВИЧ-инфицированных мужчин. Уровень тестостерона в сыворотке крови у мужчин, которые теряли массу тела, был ниже по сравнению с теми, у кого масса тела оставалась стабильной (Coodlcy et al., 1994). Лонгитудинальные исследования ВИЧ-инфицированных мужчин-гомосексуалистов выявили прогрессивное снижение уровня тестостерона в сыворотке крови, гораздо более выраженное у ВИЧ-инфицированных мужчин с развивающимся синдромом приобретенного иммунодефицита (СПИД). Снижение уровня тестостерона в сыворотке крови ВИЧ-инфицированных мужчин происходило в начале цепочки событий, завершавшихся истощением (Dobs et al., 1996). Уровень тестостерона у них коррелировал с мышечной массой и способностью выдерживать физические нагрузки (Grinspoon et al., 1996). Несмотря на то что у больных с ВИЧ-инфекцией может происходить снижение массы как жировой, так и мышечной ткани, именно снижение последней является важным аспектом уменьшения массы тела, связанной с истощением. У ВИЧ-инфицированных мужчин часто встречается нарушение половой функции. В случае увеличения продолжительности их жизни хрупкость организма и нарушение половой функции мо|ут стать одними из важных аспектов вопросов обеспечения качества жизни.
Точно так мышечная масса, сила и другие показатели, а также физическая работоспособность заметно снижены у больных на гемодиализе (Johansen et al., 2001). Способность переносить физическую нагрузку ослаблена (Kopple, 1999; Johansen et al., 2001), максимальное потребление кислорода понижено почти в 2 раза по сравнению с расчетным уровнем для здоровых индивидуумов] Несмотря на комплексность этиологии саркопении и терминальной стадии почечной недостаточности, снижение уровня тестостерона, которое вносит свой вклад в потерю мышечной массы и развитие различных нарушений, является потенциально обратимым.
Изменения уровня тестостерона во время двигательной активности
Данные литературных источников в отношении влияния физических упражнений на функцию семенников в определенной степени разноречивы, поскольку проведенные исследования существенно различаются по типу, виду, интенсивности и продолжительности физических упражнений. Более того, только в нескольких работах проводился контроль влияния калорийности рациона питания и исходного уровня двигательной активности, поэтому неудивительно, что у мужчин, занимавшихся физическими упражнениями, отмечалось как увеличение, так и уменьшение уровня тестостерона в крови. Эти мужчины существенно отличаются от женщин, у которых интенсивные занятия аэробными физическими упражнениями сопровождаются устойчивыми нарушениями менструального цикла и выработкой продукции овариальных эстрогенов (Frisch, Revelle, 1970; Mahna et al., 1973; Warren, 1980; Baker et al., 1981; Veldhuis et al., 1985; Loucks et al., 1989; Cumming, 1996). У девушек, занимающихся балетными танцами и выполняющих значительные физические нагрузки, часто наблюдается задержка менархе (Frisch et al., 1980). Такие нарушения регулярности менструального цикла, ослабленная секреция гонадотропина и повышенный уровень кортизола часто отмечаются у женщин, занимающихся бегом (Baker et al., 1981; Villanueva et al., 1986). В то же время данные литературных источников в отношении влияния занятий физическими упражнениями на репродуктивную функцию у мужчин более разрозненны и менее однозначны (MacConnie et al., 1986; Scarda, Burge, 1998).
В широком смысле тренировочные режимы можно разделить на использующих упражнения па выносливость и выполняющих силовые упражнения. Несмотря на то что уровень тестостерона в сыворотке крови может повышаться в преддверии спортивных состязаний или выполнения упражнений на выносливость, авторы большинства исследований сходятся в том, что упражнения на выносливость средней интенсивности оказывают слабый или клинически незначительный эффект на уровень тестостерона в крови (Scarda, Burge, 1998; Smiilos et al., 2003). Однако тренировочные упражнения на выносливость с очень высоким уровнем физической нагрузки, примером которых является бег на длинные дистанции, особенно в сочетании со значительным расходом энергии и снижением массы тела, вызывают падение уровня тестостерона в сыворотке крови (Remes et al., 1979; Hakkincn ct al., 1985; MacConnie et al., 1986; Dressendorfer, Wade, 1991; Skarda, Burge, 1998). Например, у мужчин, которые занимаются бегом и пробегают еженедельно в среднем около 92 км, плотность костной ткани поясничных позвонков на 10 % ниже по сравнению с контрольной группой мужчин, не занимающихся бегом (Frost, 1992). В общем, между длиной пробегаемой дистанции и плотностью костной ткани поясничных позвонков и бедренной кости наблюдается отрицательная корреляция: чем больше длина пробегаемой дистанции, тем больше энерготраты и тем ниже плотность костной ткани. В одном из сообщений, посвященном результатам исследования мужчин, участвующих в 15-дневной гонке на 400 км, отмечалось заметное снижение уровня тестостерона и повышение уровня кортизона (Dressen-А dorfer, Wade, 1991). После этого неудивительно, что наиболее низкий уровень тестостерона наблюдается у новобранцев в армии, проходящих интенсивную тренировку в подготовительных лагерях.
Заслуживает внимания то, что у мужчин, пробегающих еженедельно 20 —30 км, плотность костной ткани выше но сравнению с их сверстниками из контрольной группы, не занимавшихся бегом (Frost, 1992; Burrows et al., 2003). Существуют также аналогичные сообщения о том, что у лиц, занимающихся греблей, плотность минеральной ткани более высокая по сравнению с теми, кто ведет малоподвижный образ жизни. В другом исследовании плотность костной ткани у спортсменов, занимающихся троеборьем, и лиц из контрольной группы, ведущих малоподвижный образ жизни, была одинаковой. Таким образом, физические упражнения на выносливость ниже среднего и среднего уровня интенсивности могут оказывать положительное действие на плотность минеральной ткани и при этом практически не влиять на уровень тестостерона. Чрезмерно интенсивные упражнения на выносливость понижают уровень тестостерона и уменьшают плотность костной ткани (Heinonen et al., 1995; Burrows ct al., 2003).
Существует единое мнение в отношении того, что у бегунов на длинные дистанции возможен значительный дефицит энергии и недостаток питания, которые могут сами по себе влиять на плотность костной ткани независимо от действия физической нагрузки на уровень тестостерона (Burrows et al., 2003). Действительно, в некоторых исследованиях высказывается предположение, что только поведение, которое влечет за собой недостаточное питание, связано со снижением плотности костной ткани и увеличением риска переломов. Более того, отдельные разрушительные эффекты снижения половых гормонов на плотность костной ткани мо1ут компенсироваться непосредственным положительным воздействием физических упражнений и двигательной активности на костный аппарат.
Было высказано предположение, что эффект физических упражнений на плотность костной ткани в значительной степени зависит от силы, которая прикладывается к конечностям во время занятий (Frost, 1992). Фрост допускал, что только тренировочные режимы, при которых силы, прикладываемые к конечностям, превышают некоторый пороговый уровень и способны вызвать реакцию ремоделирования костной ткани, в то время как бег на длинные дистанции, при котором силы, воздействующие на конечности, относительно невелики (всего в 5 —10 раз превышают массу тела) и поэтому не стимулируют увеличения плотности костной ткани. Согласно этой гипотезе, величина нагрузки на кость имеет гораздо более важное значение по сравнению с видом двигательной активности или продолжительностью занятия, следовательно, у бегунов на марафонские дистанции или солдат, проходящих подготовку в тренировочных лагерях, вследствие значительного дефицита энергии можно ожидать снижения уровня тестостерона и отсутствия уравновешивающих его последствия положительных эффектов нагрузки на костный аппарат, а в целом более низкой плотности костной ткани.
В проведенных ранее исследованиях не было обнаружено никаких изменений и только небольшое повышение содержания общего тестостерона в сыворотке крови в результате занятий силовыми упражнениями (Remes et al., 1979; Truls ct al., 2000; Ahtiaincn ct al., 2003). Небольшие изменения концентрации тестостерона, о которых сообщалось в некоторых работах, не сохранялись после завершения занятий. В действительности отдельные исследователи отмечали факт значительного снижения уровня свободного тестостерона во время восстановления после физической нагрузки. Концентрация SHBG во время занятий силовыми упражнениями существенно не изменялась. В некоторых работах сообщалось об увеличении величины соотношения тестостерона к кортизолу во время прогрессивной тренировки, направленной на максимальное увеличение силы. Индивидуальный гормональный ответ на выполнение силовых упражнений характеризуется значительной вариабельностью.
Литература
- Ahtiainen, J.P., Pakarinen, А., Кгаешег, W.J. & Hakkinen, К. (2003) Acute hormonal and neuromuscular responses and recovery to forced vs. maximum repetitions multiple resistance exercises. International Journal of Sports Medicine 24(6), 410—418.
- Apter, D., Pakarmen, A. & Vihko, R. (1978) Serum prolactin, FSH and LH during puberty in girls and boys. Acta Pacdiatrica Scandinavica 67, 417 — 423.
- Apter, D., Cacciatore, B., Alfthan, H. & Stenmain, U.-H. (1989) Serum LH concentrations increase 100-fold in females from 7 years of age to adulthood, as measured by time-resolved immunofluoro-metric assay. Journal of Clinical Endocrinology and Metabolism 68, 53 - 57.
- Arver, S.A., Sinha-Hikim, I., Beall, G. et al. (1999) Dihdrotestoste-rone and testosterone levels in HIV-infected men. Journal of Andrology 20, 611 —618.
- Aubert, M.L., Pierroz, D.D., Gruaz, N.M. et al (1998) Metabolic control of sexual function and growth: role of neuropeptide Y and lep-tin. Molecular and Cellular Endocrinology 140, 107—113.
- Badger, T.M., Edcox, C.E., Meyer, E.R., Bell, R.D. & Cicero, T.J. (1978) Simultaneous changes in tissue and serum levels of LH, FSH and LH/FSH releasing factor after castration in the male rat. Endocrinology 102, 136—141.
- Baenziger, J.U. (1990) The asparagine-linked ohgosaccharides of the glycoprotein hormones. In: Glycoprotein Hormones (Chin, W.W. & Boime, L., eds.). Serono Symposia, Norwell, MA: 11 — 18.
- Baker, E.R., Mathur, R.S., Kirk, R.S. & Williamson, H.O. (1981) Female runners and secondary amenorrhea: correlation with age, parity, mileage, and plasma hormonal and sex-hormone building concentrations. Fertility and Sterility 36, 183 — 189.
- Bardin, C.W., Ross, G.T., Rifkind, A.B., Cargille, CM. & Lipsett, M.B. (1969) Studies of the pituitary Leydig cell axis in young men with hypogonadotropic hypogonadism and hyposmia. Comparison with normal men, prepubertal boys and hypopituitary patients. Journal of Clinical Investigation 48, 2046 — 2056.
- Bates, G.W., Bates, S.R. & Whitworth, N.S. (1982) Reproductive failure in women who practice weight control. Fertility and Sterility 37, 373 - 378.
- Belchetz, P.E., Plant, T.M., Naka, Y., Keogh, E.J. & Knobil, E. (1978) Hypophyseal responses to continuous and intermittent delivery of hypothalamic GnRH. Science 202, 631 —643.
- Bhasin, S., Fielder, T.J. & Swerdloff, R.S. (1987) Testosterone selectively increases serum FSH but not LH in GnRH antagonist treated male rats: evidence for differential regulation of LH and FSH secretion. Biology of Reproduction 37, 55—59.
- Boccabella, A.V. (1963) Reinitiation and restoration of spermatogenesis with testosterone propionate and other hormones after a long term posthypophysectomy regression period. Endocrinology 72, 787-798.
- Brinkmann, A.O. (2001) Molecular basis of androgen insensitivity. Molecular and Cellular Endocrinology 179(1 —2), 105—109.
- Bross, R., Casaburi, R., Storer, T.W. & Bhasin, S. (1998) Androgen effects on body composition and muscle function: implications for the use of androgens as anabolic agents in sarcopenic states. Bailliere's Clinical Endocrinology and Metabolism 12(3), 365 —378.
- Brass, R., Singh, A.B. & Bhasin, S. (2000) In: Atlas of Clinical Endocrinology: Human Nutrition and Obesity (Heber, D., ed.). Blackwell Science, Philadelphia, PA.
- Burger, H.G & Igarashi, M. (1988) Inhibin: definition and nomenclature, including related substances. Journal of Clinical Endocrinology and Metabolism 66, 885 — 886.
- Burrows, М., Nevill, A.M., Bird, S. & Simpson, D. (2003) Physiological factors associated with low bone mineral density in female endurance runners. British Journal of Sports Medicine 37(1), 67 - 71.
- Cai, L.Q., Zhu, Y.S., Katz, M.D. et al (1996) 5a-reductase-2 gene mutations in the Dominican Republic. Journal of Clinical Endocrinology and Metabolism 81(5), 1730— 1735.
Carani, C, Qin, K., Simoni, M. et al (1997) Effect of testosterone and estradiol in a man with aromatase deficiency. New England Journal of Medicine 337(2), 91-95.
- Casaburi, R., Goren, S. & Bhasin, S. (1996) Substantial prevalence of low anabolic hormone levels in COPD patients undergoing rehabilitation. American Journal of Respiratory and Critical Care Medicine 153, A128.
- Casella, R., Madura, M.R., Lipshultz, L.I. & Lamb, D.J. (2001) Significance of the polyglutamine tract polymorphism in the androgen receptor. Urology 58(5), 651—656.
- Childs, G.V., Ellison, D.G., Foster, L. & Ramaley, J.A. (1981) Postnatal maturation of gonadotropes in the male rat pituitary. Endocrinology 109, 1683 — 1693.
- Childs, G. V., Llovd, J.M., Unabia, G. et al (1987) Detection of LHb mRNA in individual gonadotropes after castration: use of a new in situ hybridization method with a photo biotinylated complementary RNA probe. Molecular Endocrinology (Baltimore, Md) 1, 926—932.
- Clark, B.J. & Stocco, D.M. (1982) STAR. A tissue specific acute mediator of steroidogenesis. Trends in Endocrinology and Metabolism 91, R1-R6.
- Clarke, I.J. & Cummins, J.T. (1999) Direct pituitary effects of estrogen and progesterone on gonadotropin secretion in the ovariec-tomized ewe. Neuroendocrinology 39, 267 — 274.
- Clarke, I.J. & Henry, B.A. (1999) Leptin and reproduction. Biology of Reproduction 4, 48—55.
- Clements, J.A., Reves, F.L., Winter, J.S.D. & Faiman, C. (1980) Ontogenesis of GnRH in the human fetal hypothalamus. Proceedings of the Society for Experimental Biology and Medicine 163, 437 - 444.
- Cole, L.A., Perini, F., Birken, S. & Ruddon, R. (1984) An oligosac-chande of the О-linked type distinguishes the free from the combined form of hCG a subunit. Biochemical and Biophysical Research Communications 122, 1260—1267.
- Conn, P.M., Chafouleas, J.C., Rogers, D.C. & Means, A.R. (1981) Gonadotropin releasing hormone stimulates calmodulin redistribution in rat pituitary. Nature 292, 264 — 265.
- Conn, P.M., Rogers, D.C. & McNeil, R. (1982) Potency enhancement of gonadotropin-releasing hormone agonist GnRH-mediated microaggregation stimulates gonadotropin release. Endocrinology 111, 335 - 337.
- Coodley, G.O., Loveless, M.O., Nelson, H.D. & Coodley, M.K. (1994). Endocrine function in HIV wasting syndrome. Journal of Acquired Immune Deficiency Syndromes and Human Retrovirology 7, 46-51.
- Craig, B.W., Brown, R. & Everhart, J. (1989) Effects of progressive resistance training on growth hormone and testosterone levels in young and elderly subjects. Mechanisms of Ageing and Development 49(2), 159—169.
- Crowley, W.F., Jr., Whitcomb, R.W., Jameson, J.L. et al (1991) The neuroendocrine control of human reproduction in the male. Recent Progress in Hormone Research 47, 27—62.
- Culler, M.D. & Negro-Vilar, A. (1990) Destruction of testicular Leydig cells reveals a role of endogenous inhibin in regulating follicle-stimulating hormone secretion in the adult male rat. Molecular and Cellular Endocrinology 70, 89 — 98.
- Cumming, D. (1996) Exercise-associated amenorrhea, low bone mineral density and oestradiol replacement therapy. Archives of Internal Medicine 156, 2193 - 2195.
- Cunningham, M.J., Clifton, D.K. & Steiner, R.A. (1999) Leptin’s actions on the reproductive axis: perspectives and mechanisms. Biology of Reproduction 60, 216—222.
- Dai, W.S., Kuller, L.H., LaPorte, R.E. et al. (1981) The epidemiology of plasma testosterone levels in middle-aged men. American journal of Epidemiology 114, 804 — 816.
- Dobs, A.S., Few, W.L., Blackman, M.R. et al. (1996) Serum hormones in men with human immunodeficiency virus-associated wasting. Journal of Clinical Endocrinology and Metabolism 81, 4108—4112.Ы
- Dressendorfer, R.H. & Wade, C.E. (1991) Effects of a 15-d race on plasma steroid levels and leg muscle fitness in runners. Medicine and Science in Sports and Exercise 23(8), 954 — 958.