Омега-5 жирные кислоты: научный обзор — различия между версиями
Lukuv (обсуждение | вклад) (Новая страница: «== Омега-5 ПНЖК и другие компоненты граната в спортивной медицине == '''Авторы''': д.м.н. Алек…») |
(нет различий)
|
Версия 12:48, 8 января 2017
Содержание
- 1 Омега-5 ПНЖК и другие компоненты граната в спортивной медицине
- 2 Омега-5 гранатовая (пуниковая) кислота (ГК) из масла зерен граната (МЗГ)
- 3 Экспериментальные и клинические исследования МЗГ и ГК
- 4 Комбинированные формы МЗГ и ГК в программах снижения веса
- 5 Гранатовый сок и экстракт
- 6 Исследования гранатового сока (ГС) и экстрактов мякоти граната (ГЭ) в спортивной медицине
- 7 ГЭ с высоким содержанием нитратов (коммерческий продукт NITRO2GRANIT™)
- 8 Литература
Омега-5 ПНЖК и другие компоненты граната в спортивной медицине
Авторы: д.м.н. Александр Дмитриев, врач-эндокринолог Алексей Калинчев
Омега-5 гранатовая (пуниковая) кислота (ГК) из масла зерен граната (МЗГ)
Источниками БАДов, применяемых в спортивной медицине, является как сок (ГС) и экстракт (ГЭ) граната, которые получают путем отжима мякоти (об этом будет написано во второй части данного обзора), так и масло из зерен граната (МЗГ, PSO - Pomegranate Seed Oil). И если сок и экстракт обладают антиоксидантными (антиокислительными) свойствами за счет полифенолов, то масло зерен граната (зерна ранее, как правило, шли в отходы) на 70-80% содержит гранатовую кислоту (ГК), участвующую в регуляции липидного обмена.
Исследования масла зерен граната (МЗГ - PSO) интенсивно развивались с 2007 года, и сейчас можно с уверенностью говорить о значительных перспективах основного компонента МЗГ - ГК в клинической и спортивной медицине. Только за период с 2007 по 2014 год опубликовано 15 обзорных статей в крупных научных журналах. ГК (гранатовая, пуниковая кислота - punicic acid) составляет 55-82% от общего содержания жирных кислот в МЗГ (в зависимости от сорта и места произрастания) и является полиненасыщенной жирной кислотой (омега-5 ПНЖК). Другие жирные кислоты (ЖК) представлены пальмитиновой (4%), олеиновой (6%) и линолевой (6,5%) кислотами. Сама ГК является изомером конъюгированной формы альфа-линоленовой кислоты – омега-5 длинноцепочечной ПНЖК (см. далее в обзоре). Важными компонентами МЗГ граната являются также: особая форма витамина Е (гамма-токоферол, а не как обычно, альфа-токоферол) и растительный эстроген (17-альфа-эстрадиол). На сегодняшний день МЗГ – основной источник получения омега-5 ПНЖК - ГК.
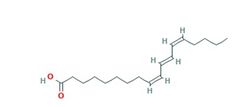
Химическая структура ГК
ГК (также называемая трихозаниевой кислотой - trichosanic acid) – ПНЖК с химической формулой Cis-9,trans-11,cis-13-оctadecatrienoic acid или 9-cis,11-trans,13-cis-octadecatrienoic acid. Получила название от источника – масла зерен граната (Punica granatum, seed oil). Содержится также в семенах Трихозанта змеевидного (обиходное название «змеиная тыква») - травянистой лианы, культивируемой в тропических и субтропических областях Южной и Юго-Восточной Азии и Австралии.
Характеристика и состав масла зерен граната
Самым значимым в клиническом плане компонентом МЗГ, как уже отмечалось, является ГК (гранатовая, пуниковая кислота) – РА C18:3 – 9c, 11t, 13c – позиционный и геометрический изомер α-линоленовой кислоты (LNA, C18:3 – 9c, 12c, 15c). Ее структура содержит две cis-двойные связи и одну trans-двойную связь, роль которых важна в понимании влияния ГК на физиологические процессы. По данным W.Elfalleh и соавторов (2011), уже установленные антиоксидантные и антилипидемические свойства МЗГ делают его претендентом на одно из ключевых мест в классификации природных протекторов для применения во многих областях медицины. Хотя методы выделения и идентификации конъюгированных ЖК хорошо отработаны, именно для РА такие исследования очень редки. В зависимости от места произрастания, содержание РА широко варьирует (от 55 до 81% от общего содержания жирных кислот в МЗГ - I.L.P.de Melo и соавт., 2014). Наиболее качественным и стандартизированным по ГК продуктом считается МЗГ, полученное путем холодного прессования отходов производства гранатового сока (ГС) из пульпы граната (I.L.P. de Melo и соавт., 2016). С помощью метода газовой хроматографии установлено, что такое МЗГ содержит ГК в узких пределах 50-55%. Путем обогащения доля ГК в общем количестве жирных кислот может быть доведена до 80%. Важной отличительной чертой МЗГ является наличие высоких уровней токоферола (табл.1).
Таблица 1. Содержание токоферолов и фитостеролов в масле зерен граната (МЗГ) и препарате сравнения – льняном масле (ЛМ) в мг/100 г (I.L.P. de Melo и соавт., 2016). Остальные объяснения в тексте.
Токоферолы (мг/100 г)
| α-токоферол | β-токоферол | γ-токоферол | δ-токоферол | Всего | |
|---|---|---|---|---|---|
| ЛМ | 0,93 ± 0,01** | 18,2 ± 1,9* | 32,0 ± 3,4** | 1,4 ± 0,01** | 53,4 ± 5,3** |
| МЗГ | 3,8 ± 0,08* | 1,0 ± 0,01** | 153,2 ± 2,45* | 17,0 ± 1,65* | 175 ± 3,5* |
| Р | <0,01 | <0,01 | <0,01 | <0,01 | <0,01 |
Фитостеролы (мг/100 г)
| Кампестерол | β-ситостерол | Стигмастерол | Другие | Всего | |
|---|---|---|---|---|---|
| ЛМ | 66 ± 2,4** | 138 ± 4* | 11 ± 0,5** | 113 ± 3,7** | 328 ± 11** |
| МЗГ | 49 ± 1,6 | 374 ± 1,4 | 12 ± 0,7* | 104 ± 7,4* | 539 ± 11* |
| Р | <0,01 | <0,01 | 0,05 | 0,01 | <0,01 |
Как видно из таблицы 1, уровни всех токоферолов в МЗГ во много раз выше, чем в льняном масле (ЛМ). Однако, в данном исследовании не выявлено высоких уровней альфа-токоферола, как отмечалось в предшествующей литературе (например, 300 мг/100 г), а доминирующей формой был гамма-токоферол (153 мг/100 г). Существуют, видимо, различия между МЗГ из разных источников, что требует предварительного анализа на содержание альфа-токоферола в конкретном масле. Так, W.Elfalleh и соавторы (2011) обнаружили в МЗГ граната из Туниса преимущественно альфа-токоферол (более 53% от общего количества токоферолов). В их работе также отмечена прямая корреляция между высокими уровнями токоферолов в МЗГ и его антиоксидантной активностью (способностью связывать свободные кислородные радикалы). Среди фитостеролов МЗГ доминирующим был бета-ситостерол. I.L.P. de Melo и соавторы (2016) исследовали также химическую стабильность к окислению МЗГ при сопоставлении с ЛМ (см. графики ниже), что является важным показателем в практическом плане (хранение сырья, производство и др. процессы доставки до конечного потребителя).
Как видно из рис.2, МЗГ демонстрирует хорошую устойчивость к окислению по сравнению с льняным маслом (ЛМ), несмотря на высокий уровень ненасыщенных жирных кислот, что облегчает процесс производства и хранения. К недостаткам готовых форм омега-5 ПНЖК (ГК) следует отнести высокую себестоимость: из 500 кг граната получается всего 1 кг МЗГ.
Экспериментальные и клинические исследования МЗГ и ГК
Наиболее масштабные и качественные исследования клинических свойств МЗГ выполнены в последние годы в Иране и Индии – странах-производителях высококачественных сортов граната, а также в России и США. Это нашло отражение в ряде обзоров (M.Abidov и соавт., 2010; Jasuja N.D. и соавт., 2012; S.Mirzaee, 2014; M.T.Boroushaki и соавт., 2016; P.Aruna и соавт., 2016 и др.).
Метаболизм ГК в норме и при патологии
Является незаменимой ПНЖК. В рандомизированном контролируемом исследовании G.F.Yuan и соавторов (2009) изучены поступление и метаболизм ГК у 30 молодых здоровых людей. ГК принималась внутрь в дозе содержащей 3 г в день в форме триацилглицеролов в течение 28 дней. Контрольная группа получала то же количество подсолнечного масла. Через 28 дней концентрация ГК в плазме крови повышалась с 0 до 0,47%, а в мембранах эритроцитов – с 0 до 0,37%. При этом происходила химическая трансформация ГК с образованием более насыщенной формы - cis9,trans11-18:2 (сама ГК - cis9,trans11,cis13-18:3). Других изменений состава тела, профиля липидов не обнаружено, что, естественно, связано с отсутствием исходных нарушений физиологии и биохимии организма.
В условиях исходно нарушенного метаболизма, в частности, ожирения, ГК проявляет свои положительные свойства. Существует достаточно ограниченное количество научных исследований метаболических эффектов омега-5 ПНЖК. Однако некоторые моменты можно считать установленными. Так К.Koba и соавторы (2002, 2007) в экспериментальных условиях наблюдали снижение висцерального жира (в брюшной полости под диафрагмой) после 4-х недель приема пищи, обогащенной омега-5 ПНЖК (концентрация в экспериментальной диете 0,12-1,2%). Такое уменьшение обычно трудноустраняемого жира носило дозо-зависимый и время-зависимый характер. Параллельно изменялся и профиль липидов: снижался общий холестерол и уровень триглицеридов в печени. Важной особенностью омега-5 ПНЖК (ГК) являлась способность снижать чувствительность организма к нагрузке атерогенными («вредными») жирными кислотами, т.е. повышалась переносимость жировой нагрузки (L.Yang и соавт., 2005). В двойном-слепом плацебо-контролируемом исследовании у людей с исходно повышенным уровнем триглицеридов в крови прием омега-5 ПНЖК приводил к их существенному снижению (P.Mirmiran и соавт., 2010). R.Hontecillas и соавторы (2009) показали, что диета, обогащенная ГК (62 мг/день) ускоряет метаболизм глюкозы в крови, нормализует ее уровень в условиях экспериментального ожирения. B.K.McFarlin и соавторы (2009) выявили способность омега-5 ПНЖК повышать чувствительность тканей к инсулину и снижать риск развития диабета 2 типа. В эксперименте подтверждены противовоспалительные свойства ГК (A.Caligiani и соавт., 2010). К сожалению, в настоящее время отсутствуют прямые данные о сочетанном влиянии омега-5 ПНЖК (ГК) и физических нагрузок на состав тела, биохимию крови и другие показатели функционального состояния тренирующихся лиц. Интересным и перспективным представляется дальнейшее исследование эффектов омега-5 ПНЖК в условиях повышенных физических нагрузок различного типа.
Комбинированные формы МЗГ и ГК в программах снижения веса
Ксантиген (Xanthigen)
Ксантиген представляет собой комбинированный препарат ГК и фукоксантина (антиоксидант из группы астаксантина в виде экстракта из бурых морских водорослей - самый распространеный каротиноид – см. подробнее в обзоре по антиоксидантам-каротиноидам).
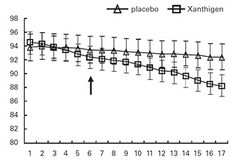
В работе M.Abidov и соавторов (2010) исследованы эффекты Ксантигена и его отдельных компонентов на вес тела, жировую массу, липиды печени, биохимию крови и расход энергии в покое (REE) у 151 женщины с ожирением и неалкогольными заболеваниями печени. Исследование проводилось в течение 16 недель и было рандомизированным двойным-слепым и плацебо-контролируемым. Применялась формула Ксантигена-600/2,4 мг (300 мг масла зерен граната с содержанием ГК 70% + 300 мг экстракта бурых морских водорослей, содержащих 2,4 мг фукоксантина). Через 16 недель (рис.3) наблюдалось достоверное снижение веса тела (минус 4,9-5,5 кг), окружности талии, содержания жира в печени, активности печеночных ферментов, триглицеридов сыворотки крови и С-реактивного белка. Сам фукоксантин (> 2.4 мг) и другая формула Ксантигена с меньшим содержанием активных веществ – Ксантиген-400/1,6 мг (200 мг масла зерен граната с содержанием ГК 70% + 200 мг экстракта бурых морских водорослей, содержащих 1,6 мг фукоксантина) достоверно увеличивали REE по сравнению с плацебо. Таким образом, Ксантиген способствует потере веса, снижает общее содержание жира в организме и в печени, улучшает функцию печени и увеличивает расход энергии в покое у женщин с ожирением. Авторы делают заключение о целесообразности включения Ксантигена в качестве пищевой добавки в нутриционную программу контроля веса у женщин.
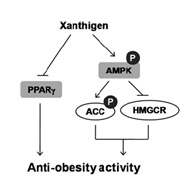
Исследование Ch-S.Lai и соавторов (2012) показало, что возможными механизмами жироснижающего эффекта Ксантигена является мощное и дозо-зависимое подавление накопления липидов в адипоцитах, превышающее действие каждого из двух компонентов БАДа (фукоксантина и ГК) в отдельности. Ксантиген нарушает деятельность ключевых транскрипторных факторов адипогенеза – (PPAR)γ, CCAAT, (C/EBP) β, C/EBPδ и синтазы жирных кислот (FAS). Кроме того, Ксантиген стимулирует сигнальную функцию инсулина. Суммарно, Ксантиген подавляет дифференциацию адипоцитов и накопление липидов посредством множества связанных между собой механизмов, что обеспечивает устойчивость и эффективность лечения ожирения (рис.4).
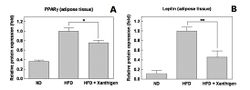
В эксперименте было показано, что Ксантиген ослабляет эффект высокожировой диеты, вызывающей ожирение (K.M. Choi и соавт., 2014), способствует снижению веса и жировой массы, а ведущими механизмами защитного влияния этого БАДа являются: 1) угнетение экспрессии PPARγ в жировой ткани, что ведет с торможению дифференциации адипоцитов; 2) снижение уровней лептина в сыворотке крови и жировой ткани; 3) активация AMPK-сигнальных путей в жировой ткани (АМРК – важный регулятор липидного и энергетического обмена), что угнетает липогенез и синтез ЖК, но усиливает окисление ЖК и транспорт глюкозы (рис.5 и 6).
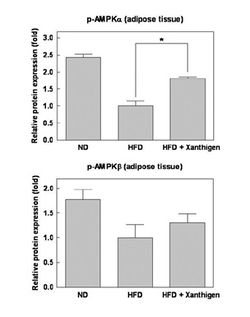
Кроме того, в совсем свежем исследовании K-M.Kim и соавторов (2016) показано, что Ксантиген по-разному изменяет энергетический и метаболический баланс в бурой (энергетический, расходный пул) и белой (резервный пул, депо) жировой ткани, усиливая процессы дифференцировки клеток бурого жира, и окислительные процессы в белом жире. По определению R.Randell (2013), Ксантиген, экстракт зеленого чая, некоторые другие растительные регуляторы жирового обмена и их комбинации (табл. 2) в сочетании с физическими нагрузками являются наиболее эффективными средствами нутритивной стратегии снижения веса и лечения ожирения (уровень доказательности «В»).
Пост-тренировочные комплексы с ГК
МЗГ включено в ряд пост-тренировочных комплексов для ускоренного восстановления после физических нагрузок. Эти составы базируются на принципах, разработанных в Гарвардском институте,и обосновывают сочетанное применение пластических (протеины, аминокислоты), энергетических (углеводы) и каталитических (фармаконутриенты) компонентов восполнения потерь при интенсивных тренировках. Для примера, состав одного из таких комплексов: 35 г смеси (одна порция) содержит изоляты whey-протеина и белка гороха, казеин, ВСАА (лейцин, валин и изолейцин в соотношении 2:1:1) в сумме 23 г; экстракт зерен граната (ГК – омега-5 ПНЖК) 650 мг; Кверцетин 300 мг. Сочетание изолятов белков животного и растительного происхождения с казеином обеспечивают равномерное поддержание уровней аминокислот в плазме крови в течение всего периода восстановления и их адекватный качественный состав. Задача ГК в составе смеси сводится к оптимизации расхода жиров в постнагрузочном периоде (максимальное их использование как источника энергии и подключение жировых депо к этому процессу). Подобные смеси применяются внутрь в 200 мл воды или сока, приготовление в шейкере) в течение 30 минут после тренировки.
Таблица 2. Готовые комбинированные формы с ГК из масла зерен граната
| Наименование, производитель | Форма | Состав 1 капсулы | Рекомендуемые дозы |
|---|---|---|---|
| Ксантиген (Xanthigen®), PoliNat | Капсулы по 200 мг | Масло зерен граната (стандартизация по ГК 70%) 100 мг + экстракт бурых водорослей (стандартизация по фукоксантину 1,275 мкг на дозу) 100 мг | 1 капсула 3 р/день за 15-30 мин до еды Курс 16 недель |
| КсантиЛин (XanthiLean), Herbal Magic Clinical | 90 капсул по 200 мг | Ксантиген 200 мг | 1 капсула 3 р/день за 15-30 мин до еды Курс 16 недель |
| ФукоТин (FucoThin), Garden of Life | 90 капсул по 200 мг | Ксантиген 200 мг | 1 капсула 3 р/день за 15-30 мин до еды Курс 16 недель |
| КсантиТрим (XanthiTrim), Pure Encapsulations | 60 капсул на основе МСТ | Ксантиген 300 мг + Экстракт зеленого чая (без кофеина) 150 мг | 2 капсулы в день за 15-20 мин до еды Курс 16 недель |
Примечания: ГК – гранатовая (пуниковая) кислота. Ксантиген снижает содержание жира в организме, увеличивая расход энергии в покое, что обеспечивает эффект в течение 16 недель; сочетание с физической нагрузкой ускоряет и увеличивает потерю жировой массы (требует комплекса регулярных физических упражнений по рекомендации врача и тренера). Xanthigen® - торговая марка National Bioscience Corp.
Гранатовый сок и экстракт
Качественный и количественный состав гранатового сока (ГС)
Наряду с омега-5 ПНЖК (ГК) из масла зерен граната (МЗГ), в спортивной нутрициологии достаточно широко используются соки, экстракты и комбинированные составы из пульпы (мякоти) граната. Анализ состава сока различных сортов граната, поставляемых в Россию из Азербайджана (один из доминирующих на рынке) проведен в работе З. М. Гасанова и соавторов (2015).
Таблица 3. Химический состав и количественные показатели фенольных соединений плодов двух сортов граната у различных сортов граната (в % от общего содержания фенолов)
| Компонент | Молекулярный вес | Период определения мин | Бала Мюрсал мг/кг | Ени Гюлоша
мг/кг |
|---|---|---|---|---|
| Галлол глюкозид | 429 | 53,3 | 3,1 | следы |
| Галлоловая к-та | 633 | 43,9 | 12,7 | 33,7 |
| Пединкалагин | 463 | 58,7 | 18,5 | 9,2 |
| Пиникалагин | 345 | 58,0 | 5,8 | следы |
| Р-кумаровая к-та | 169 | 17,6 | 4,5 | 3,7 |
| Галлоил-NNRR-гексоза | 331 | 15,9 | 1,9 | 1,8 |
| Сирингетил гексозид | 463 | 58,5 | 5,5 | 4,1 |
| Гранатин | 325 | 37,3 | 0,6 | 0,5 |
| Эллаговая к-та | 783 | 33,8 | 1,5 | 1,4 |
| (+) катехин 492 | 34,2 | 112,3 | 88,6 | |
| (-) эпикатехин | 557 | 35,1 | 64,4 | 54,5 |
| Общее количество фенольных соединений в % | 1 | 0,92 | ||
| Аскорбиновая кислота мг% | 6,4 | 7,6 | ||
| Растворимые сухие вещества % | 16,2 | 17,4 | ||
| Общие сахара % | 12,8 | 15,2 | ||
| Инвертные сахара % | 11 | 14 | ||
Как видно из таблицы 3, активными действующими веществами ГС являются флавоноиды, антоцианы, фенолкарбоновые кислоты, стильбены и процианидины. Общее содержание сухих растворимых веществ колеблется в пределах 15,8-18,3%. Среди фенольных соединений доминируют (+)-катехин, (-)-эпикатехин, пединкалагин и галлоловая кислота, которые и определяют основные физиологические эффекты ГС.
Исследования гранатового сока (ГС) и экстрактов мякоти граната (ГЭ) в спортивной медицине
Влияние ГС и ГЭ на физическую форму спортсменов, а также молодых нетренированных лиц, наиболее интенсивно исследовалось в последние несколько лет.
Влияние ГС на показатели физической готовности у молодых нетренированных лиц
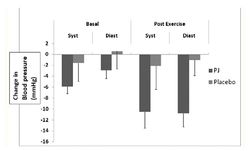
В работе E.A.S.Al-Dujaili и соавторов (2016) отработана схема применения чистого гранатового сока (ГС - 500 мл в день со средним содержанием полифенолов 1685 мг/л) в условиях физических нагрузок продолжительностью 30 минут на уровне 50% максимальной интенсивности. В рандомизированном одиночном-слепом плацебо-контролируемом исследовании в параллельных группах использовался тест на беговой дорожке, в котором приняли участие здоровые физически активные мужчины и женщины (n=24) на фиксированной обычной диете. После выполнения контрольного (базового) 30-минутного теста на беговой дорожке в течение 6 дней участники получали ежедневно по 500 мл ГС, контрольная группа получала эукалорический раствор в том же объеме. Регистрировались следующие показатели: антропометрические данные (рост, вес, охват талии); индекс массы тела (ИМТ); содержание в моче кортизола и кортизона и их соотношение (индекс активности фермента 11β-гидрокси-стероид-дегидрогеназы) как показатель изменения периферического метаболизма кортизола; реактивные субстанции тиобарбитуровой кислоты (TBARS) в моче для оценки уровня оксидативного стресса; артериальное давление (АД). В результате курсового применения ГС отмечено достоверное снижение систолического и диастолического АД как в исходном состоянии, так и после физической нагрузки (рис.7). Параллельно снижались уровни TBARS в моче примерно на 16%. Наиболее радикальные отличия между группой с ГС и плацебо-группой выявлены по таким показателям как кортизол, кортизон и их соотношение в моче. Из таблицы 4 видно, что под влиянием ГС достоверно снижается уровень кортизола (в среднем на 30%), в то время как в группе плацебо отмечается тенденция к его повышению (на 15%). Уровень кортизона, наоборот, под влиянием ГС достоверно повышается (на 68%), а в группе плацебо - не изменяется. Сходная динамика наблюдалась и при анализе соотношения кортизол/кортизон: достоверное снижение показателя более, чем в 2 раза, в группе с ГС, но без изменений в группе плацебо.
Таблица 4. Содержание кортизола и кортизона (нмол/день), реактивных субстанций тиобарбитуровой кислоты (TBARS, мкмол/день) и соотношение кортизол/кортизон в моче участников исследования E.A.S.Al-Dujaili и соавторов (2016) до и после 6 дней приема 500 мл/день ГС (n = 12) или 500 мл плацебо (n = 12).
| Параметр | Группа 500 мл ГС До | Группа 500 мл ГС После | Плацебо 500 мл До | Плацебо 500 мл После |
|---|---|---|---|---|
| TBARS мкмол/день | 31.2 ± 10.6 | 26.5 ± 9.8* | 27.1 ± 8.4 | 28.7 ± 10.7 |
| Кортизол (нмол/день) | 179.4 ± 53.2 | 125.6 ± 43.5* | 166.6 ± 71.5 | 191.2 ± 93.7 |
| Кортизон (нмол/день) | 112.2 ± 40.4 | 187.6 ± 90.2* | 125.5 ± 49.5 | 136.4 ± 53.8 |
| Кортизол/кортизон | 1.598 ± 1.1 | 0.669 ± 0.55** | 1.33 ± 0.44 | 1.41 ± 0.48 |
Примечания: ГС – гранатовый сок. Остальные объяснения в тексте. * P < 0,05 и **P < 0,01.
Авторы делают заключение, что ежедневное употребление гранатового сока в течение 6 дней при физических нагрузках средней интенсивности у молодых здоровых лиц уменьшает влияние оксидативного стресса и умеренно снижает систолическое и диастолическое давление. Потенциальными механизмами данных эффектов может являться снижение уровней кортизола в организме под влиянием полифенольных соединений ГС, повышение устойчивости к действию свободных кислородных радикалов, образующихся в процессе физических нагрузок.
Эффективность полифенольных соединений (эллагитаннины) в составе экстракта граната в отношении восстановления силы скелетной мускулатуры после эксцентрических упражнений изучалась в работе J.R.Trombold и соавторов (2010). Физически активные мужчины были рандомизированы в две группы, первая из которых получала ГЭ, а вторая – плацебо, - в течение 9 дней. Для создания условий возникновения отсроченной болезненности мышц (delayed-onset muscle soreness – DOMS) испытуемые выполняли два цикла (сета) из 20 максимальных эксцентрических сгибаний в локтевом суставе на одной руке. Через 2, 24, 48, 72 и 96 часов после нагрузки измерялись: максимальная изометрическая сила сгибания в локтевом суставе и болезненность мышц; креатин-киназа в сыворотке крови, миоглобин, интерлейкин-6 и С-реактивный белок, - с последующим сравнением с исходными показателями. В обеих группах через 2 часа после физической нагрузки отмечалось падение мышечной силы (в среднем до 72% от исходных величин) с последующим восстановлением через 96 часов (до 91% от исходных величин). Однако, в группе, получавшей ГЭ уже через 48 часов после нагрузки уровень восстановления составил 85,4%, а в группе с плацебо только 78,3%. Через 72 часа эти показатели составили 88,9% и 84%, соответственно. Авторы сделали заключение, что полифенолы в составе ГЭ достоверно улучшают процесс восстановления изометрической силы (на 13-18%) в течение 2-3 дней после эксцентрических физических нагрузок.
D.R.Machin и соавторы из той же лаборатории (2014) исследовали дозо-зависимость эффектов ГС на восстановление мышечной силы нетренированных лиц после эксцентрических изометрических силовых упражнений. В исследовании приняло участие 45 мужчин, периодически приходящих в зал для улучшения физической формы. Они были рандомизированы в три группы: 1) прием ГС один раз в день; 2) прием ГС два раза в день; 3) прием плацебо. Прием ГС или плацебо продолжался 8 дней. На 4-й день проводилась тестировочная сессия, состоящая из 20 минут бега по дорожке и 40 максимальных эксцентрических сгибаний в локтевом суставе. До нагрузки и через 2, 24, 48, 72 и 96 часов после нее регистрировались показатели мышечной силы, болезненности мышц и концентрации миоглобина сыворотки крови. По сравнению с плацебо, в группах с приемом ГС изометрическая сила была достоверно выше на всех постнагрузочных этапах (ускорение восстановления в среднем на 15-20%) . Однако между группами с приемом ГС один раз в день и два раза в день достоверных различий по всем показателям обнаружено не было. Авторы исследования предлагают схему приема ГС один раз в день в дозе 650 мг (в пересчете на полифенолы – 95,5% эллагитанинов + 3,5% эллаговой кислоты) в составе концентрата гранатового сока в течение 4-8 дней перед каждой тренировочной сессией высокой интенсивности для ускорения восстановления после нагрузки в мышцах верхних и нижних конечностей у слабо тренированных лиц (любителей). Увеличение дозы до 1300 мг нецелесообразно.
Влияние ГС на показатели физической готовности у тренированных лиц
В работе J.R.Trombold и соавторов (2011) изучено влияние ГС на восстановление силы скелетных мышц после эксцентрических упражнений у тренированных лиц (регулярные тренировки в течение каждой недели). В рандомизированном перекрестном исследовании приняло участие 17 мужчин. Для оценки влияния пищевых добавок (ГС или плацебо; 250 мл 2 раза в день в течение 15 дней) на отсроченное развитие болезненности мышц (DOMS) участники выполняли 3 сета из 20 максимальных эксцентрических сгибаний в локтевом суставе на одной руке и 6 сетов из 10 эксцентрических разгибаний в коленном суставе на одной ноге. Как и в их же исследовании на нетренированных лицах, оценивались: максимальная изометрическая сила сгибания и разгибания, болезненность мышц, - до нагрузочного цикла, и через 2, 24, 48, 72, 96 и 168 часов после нагрузки. Сила сгибания в локтевом суставе в группе, принимавшей ГС, была достоверно выше со 2-го по 168 час после нагрузки по сравнению с плацебо. Параллельно снижалась в группе с ГС и болезненность мышц руки через 48 и 72 часа после нагрузки. Однако, в мышцах ног таких различий не обнаружено. Эти результаты показывают наличие эргогенного эффекта у ГС при однократном приеме в отношении мышц верхних конечностей у тренированных лиц в процессе выполнения эксцентрических упражнений.
В работе A.Ammar и соавторов (2016) впервые была предпринята попытка оценить влияние натурального ГС на показатели работы всех мышечных групп тела у профессиональных спортсменов. Тренировочная сессия состояла из основных олимпийских движений в тяжелой атлетике: рывок, взятие штанги на грудь, взятие штанги на грудь в обязательный сед и толчок. После постепенного увеличения весов вплоть до получения неудачной попытки в рывке и толчке, выполнялось пять сетов каждого вида упражнений (например, две попытки при 85% от 1-RM с тремя повторами на одну попытку; три попытки при 90% от 1- RM с двумя повторами на одну попытку) с пассивным 5-минутным восстановительным периодом между ними. В предварительной серии работ с тяжелоатлетами, готовящимися к Олимпийским Играм в Рио, эти авторы показали (А.Ammar и соавт.,2014, 2015) что сразу после выполнения вышеописанной тренировочной сессии в интенсивном режиме немедленно повышаются в крови маркеры мышечных повреждений, оксидативного стресса и воспаления. Величина этих биохимических сдвигов наиболее выражена утром по сравнению с послеобеденной и вечерней тренировочными сессиями. Выяснилось, что 48 часов отдыха недостаточно для полного восстановления по большинству параметров, особенно после утренней сессии.
В работе использовался натуральный ГС, приготовленный из свежих гранатов за 48 часов до начала исследования с последующим замораживанием и хранением при -4°C. Никаких консервантов не добавлялось. Каждые 500 мл сока содержали 2,56 г всех полифенолов, 1,08 г ортодифенолов, 292,6 мг флавоноидов и 46,75 мг флавонолов.. Плацебо представлял собой имитацию ГС (коммерческий напиток с лимонной кислотой и натуральным ароматизатором ГС) без антиоксидантов, витаминов и полифенолов. Ежедневная доза напитков составляла 500 мл (2 × 250 мл в день) в течение 5 или 15 дней до интенсивных тренировок.
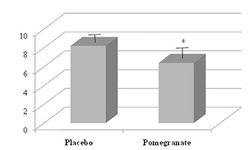
Полученные результаты показали, что на фоне ГС прирост силовых показателей (рис.8) как по максимально поднимаемому весу, так и по сумме весов за тренировочную сессию, составил в среднем 8,3%, в то время как в группе с плацебо только 3,26%. Субъективные ощущения тяжести нагрузки (RPE) и отсроченная болезненность мышц (DOMS) как в верхних, так и в нижних конечностях, также снижались под влиянием ГС (рис.9 и 10).
В данной работе также подробно исследовано влияние ГС на биологические показатели профессиональных спортсменов до и после тренировочной сессии. Все эффекты ГС были разделены на немедленные (острые) и отсроченные. Немедленные эффекты ГС. ГС достоверно уменьшал пре- и постнагрузочные подъемы температуры тела, сердечного ритма (-4,5%), систолического давления (-1,8%), глюкозы (-10,6%) и креатинина плазмы. В постнагрузочном периоде на фоне ГС практически отсутствовали гематологические сдвиги, характерные для контрольной группы (снижение лейкоцитов, нейтрофилов и эритроцитов – на 8-11%, и повышение тромбоцитов – на 25%). ГС снижал быструю биохимическую реакцию маркеров воспаления и мышечных повреждений как в пре-, так и в пост-тренировочный период. Отсроченные эффекты ГС. В период после 48 часов после нагрузки, ГС быстрее, чем плацебо, нормализовал систолическое АД, сердечный ритм, уровень глюкозы и креатинин в плазме крови. Гематологические параметры восстанавливались также быстрее на фоне ГС, равно как и снижались маркеры воспаления и повреждения мышц по сравнению с группой плацебо (ускорение в диапазоне 6-12%). Авторы исследования делают заключение, что потребление гранатового сока (ГС) в дозах 250 мл два раза в день за 48 часов до и во время тренировочной сессии в тяжелой атлетике оказывают отчетливое эргогенное действие, повышая силовые показатели по общему поднятому весу в сумме олимпийских движений (+8.3%) и максимальному весу в одиночном движении (+3.26%), снижая субъективные ощущения тяжести нагрузки (на 4,4%) и болезненности мышц (на 13,4%). Дополнительно, ГС редуцирует немедленные и отсроченные физиологические, гематологические и биохимические реакции на нагрузку в тяжелой атлетике, ускоряет восстановление мышц (на 8-11%).
ГС в спортивных видах, требующих выносливости. В рандомизированном двойном-слепом плацебо-контролируемом многоцентровом исследовании (E.Fuster-Muñoz и соавт., 2016) принял участие 31 профессиональный игрок трех спортивных клубов Испании. Оценивался эффект ГС на уровень оксидативного стресса в ответ на интенсивные продолжительные тренировки по биохимическим показателям крови: маркеры стресса (карбонилы протеина и малоновый альдегид - MDA), С-реактивный белок и sE-селектин. Участники были рандомизированы в три группы: 1) получала 200 мл/день ГС (n = 10) более 21 дня; 2) получала 200 мл того же сока, но разведенного 1:1 с водой (ГСР, n=11); 3) контрольная группа (К, n = 10). В ответ на нагрузку в контрольной группе повышались показатели оксидативного стресса, в то время как на фоне ГС и ГСР они либо не изменялись, либо снижались. Однако, уровень лактата крови в группе ГС повышался, что может косвенно указывать на необходимость сочетания ГС с БАДами, снижающими лактатную нагрузку на организм во время тренировок. Таким образом, курсовое 21-дневное применение 200 мл гранатового сока в день снижает проявления оксидативного стресса в ответ на физические нагрузки на выносливость, но для снижения лактата крови требует комбинирования с соответствующими БАДами (например, НМВ, бета-аланин).
ГЭ с высоким содержанием нитратов (коммерческий продукт NITRO2GRANIT™)
NITRO2GRANIT™ - комбинированный продукт, содержащий 50% полифенолов экстракта граната (ГЭ) и экстракт свеклы. Целью создания данной комбинации являлось потенциальное увеличение эргогенного действия за счет сочетания полифенолов (повышение устойчивости к окислительному стрессу в процессе физической нагрузки, снижение мышечных повреждений и ускорение восстановления) и нитратов (снижение потребности в кислороде и увеличение выносливости, см. главу «Донаторы оксида азота»).
В работе M.N.Melvin и соавторов (2014) моделировалась ситуация с увеличением потребности скелетной мускулатуры в кислороде и энергетических субстратах в процессе физической нагрузки. Комбинированная пищевая добавка Nitro2Granit (полифенолы ГС и нитраты свеклы) потенциально может увеличивать продукцию окиси азота и повышать эффективность тренировки. Авторами проведено рандомизированное двойное-слепое плацебо-контролируемое перекрестное исследование эффектов однократного влияния комбинированной пищевой добавки на кровоток, диаметр сосудов и физическую готовность у регулярно тренирующихся лиц. 19 мужчин и женщин (средний возраст 22,2 года, рост 174,8 см, масса тела 71,9 кг) проходили тест на беговой дорожке с нагрузкой до полного истощения (до добровольного отказа) для определения максимального потребления кислорода и пика скорости движения (PV). Через 24-48 часов участники были рандомизированы в две группы: 1) 1000 мг NITRO2GRANIT™; 2) плацебо. Регистрировались исходные показатели кровотока в плечевой артерии и через 30 минут после приема пищевых добавок, а также традиционные функциональные показатели в процессе тестирования на беговой дорожке. Через 7-10 дней «отмывочного» периода те же группы менялись ролями в получении либо плацебо, либо экстракт граната (перекрестный характер исследования). В результате, в группе с ГЭ+экстракт свеклы через 30 минут отмечено значительное дополнительное (плюс к влиянию самой физической нагрузки) увеличение кровотока в плечевой артерии и расширение сосудов по сравнению с плацебо-группой. Существенно улучшались функциональные показатели прохождения теста, увеличивалось время наступления истощения. Авторы делают заключение, что однократный прием ГЭ в дозе 1 г (с повышенным содержанием нитратов в виде комплекса с экстрактом свеклы в качестве донатора оксида азота) за 30 минут до тренировки является эффективным способом дополнительного увеличения кровотока в работающих мышцах (расширение сосудов), и улучшения переносимости физических нагрузок. ГЭ с повышенным содержанием нитратов оказывает отчетливый немедленный эргогенный эффект при субмаксимальной беговой нагрузке за счет повышения кровотока.
В работе E.J.Roelofs и соавторов (2015), опубликованной в журнале Международного Общества Спортивного Питания, исследовался эффект однократного применения ГЭ на показатели анаэробных упражнений, сосудистый кровоток и расширение сосудов при нагрузке (FMD), а также насыщение крови кислородом (SP02), частоту сердечных сокращений (HR), и кровяное давление (BP). 19 физически активных мужчин (средний возраст 22,1 ± 1,9 года, рост 170,4 ± 12,4 см, вес 68,7 ± 15,9 кг) приняли участие в рандомизированном двойном-слепом плацебо-контролируемом перекрестном исследовании с разделением на две группы: 1) 1000 мг ГЭ (True Pomegranate Extract, Stiebs Nature Elevated, Madera, CA) или 2) плацебо (PL; 95% мальтодекстрин) в капсулах. Прием добавок проводился за 30 мин до спринт-теста с определением пика и средней мощности на велоэргометре (10 6-секундных максимальных спринта с нагрузкой 65 г/кг веса тела с 30-секундным пассивным восстановлением). В работе использовался неинвазивный метод FMD - Flow Mediated Vasodilatation (потоко-опосредованная вазодилатация) плечевой артерии для оценки сосудистых параметров, а также регистрация ЧСС, насыщения крови кислородом и артериальное давление. Все параметры оценивались до и через 30 минут после приема ГЭ, а также перед физической нагрузкой, сразу после нее и через 30 минут. Через 7 дней «отмывочного» периода те же участники проходили тест с другим БАДом (плацебо или ГЭ). В группе, получавшей ГЭ, пик мощности был достоверно выше во время 5-го спринта по сравнению с плацебо с сохранением такой тенденции к 7-ому спринту. Параллельно под влиянием ГЭ отмечалось большее увеличение дилятации сосудов и усиление кровотока по сравнению с плацебо. Отличий в изменениях насыщения крови кислородом, частоты сердечных сокращений и артериального давления между группами не наблюдалось. Результаты показывают потенциальную возможность улучшения физической формы тренирующихся лиц (эргогенный эффект) при однократном приеме ГЭ в форме капсул в дозе 1000 мг за 30 минут до нагрузки за счет увеличения доставки кислорода и субстратов к работающим скелетным мышцам. ГЭ может включаться в состав пред-тренировочных комплексов вместе с другими эргогенными веществами с иным механизмом действия.
ГЭ с высоким содержанием нитратов в составе пред-тренировочных комплексов в Кроссфите. В работе J.J.Outlaw и соавторов (2014) произведена оценка эффективности белково-углеводной смеси (БУС) с включением ГЭ (БУС+ГЭ), на показатели физической готовности тренирующихся в КроссФите лиц, при ее приеме до и после физической нагрузки. Исследовались изменения состава тела, показатели выполнения специфических для КроссФита упражнений, аэробную и анаэробную способность постоянно тренирующихся лиц после 6 недель приема БУС+ГЭ до и после высокоинтенсивной разноплановой физической нагрузки. В рандомизированном открытом 6-недельном исследовании приняли участие 29 человек (13 мужчин и 16 женщин, средний возраст 32 года, вес 79 кг, % жировая масса 22%). Участники регулярно тренировались по программе КроссФита не менее трех раз в неделю в течение полугода, не имели проблем со здоровьем, и не принимали каких-либо пищевых добавок в последние три месяца до исследования. Они были рандомизированы в две группы: 1) БУС+ГЭ и 2) плацебо. Предтренировочная порция пищевой добавки (БУС+ГЭ), принимаемая за 30 минут до начала каждой тренировочной сессии, включала: 19 г БУС (Pursuit Rx Pre-Workout, Dymatize Nutrition, Dallas, TX); ГЭ (NITRO2GRANIT™); стандартизированные экстракты вишни, свеклы и зеленого чая (AssuriTEA™, Kemin, Dubuque IA); экстракт черного чая (InnovaTEA® , Kemin, Dubuque IA). Эта же БУС (Dymatize Nutrition), состоящая из whey-протеина (20 г) и углеводов (40 г) принималась участниками исследования сразу же после тренировочной сессии. Дозировки для женщин и мужчин различались в два раза: женщины принимали две мерные ложки смеси (составляют одну порцию из 20 г белка и 40 г углеводов), разведенные в 250 мл воды; мужчины – четыре мерные ложки смеси (составляют две порции из 40 г белка и 80 г углеводов), разведенные в 500 мл воды. После каждой КроссФит-сессии участники заполняли опросники для оценки субъективных ощущений тяжести нагрузки (RPE) и уровня отсроченной болезненности мышц (DOMS). В конце каждой недели в группе с пищевыми добавками дополнительно заполнялся опросный лист для оценки возможных побочных эффектов принимаемых БАДов. Тестирование участников включало две нагрузочные сессии в течение дня – WOD1 и WOD2. WOD1 (время выполнения в сек) включала: 500 метров гребли на тренажере (row), 40 бросков набивного мяча в цель (40 wall balls), 30 отжиманий (push-ups), 20 запрыгиваний на ящик (box jumps), и 10 выбросов штанги с максимальной быстротой. После 20 минутного отдыха выполнялась WOD2 (регистрировалось количество выполненных повторов): бег на 800 метров (run “buy in”) с последующим максимальным количеством из 5-и Бёрли, 10-и гиревых махов (Kettlebell swings) и 15-и «воздушных» приседаний (air squats) в течение 15 минут. До (исходные данные) и после всех нагрузок выполнялись стандартные тесты на физическое состояние на велотренажере (Wingate-тест). Полученные результаты свидетельствуют об отчетливом эргогенном влиянии стандартной комбинированной добавки белково-углеводной смеси, обогащенной омега-5 ПНЖК-полифенолами и донаторами оксида азота, на показатели физической готовности в КроссФите (увеличение мощности и поддержание VO2max).
Таблица.5. Примеры готовых коммерческих форм БАДов из различных частей граната
| Наименование, производитель | Форма | Состав | Рекомендуемые дозы |
|---|---|---|---|
| Full Spectrum Pomegranate, Life Extension | 30 гелевых капсул | Экстракт из пульпы, семян и цветков | Пищевая добавка 1-2 капсулы в день |
| Pomegranate Fruit Extract, Life Extension | 30 растительных капсул | Экстракт из пульпы, полифенолы граната | Пищевая добавка 1-2 капсулы в день |
| Standardized Pomegranate, Nature’s Way | 60 капсул | 85% полифенолов | Пищевая добавка 1-2 капсулы в день |
| Pomegranate from the seed, NeoCell 90 капсул | 1000 мг экстракта зерен граната в 1 капсуле | Пищевая добавка, 1-2 капсулы в день | |
| Pomegranate Extract, Source Naturals | Таблетки 500 мг | 240 штук | Пищевая добавка 1-2 таблетки в день |
| Pomegranate 500 mg | Таблетки 500 мг 120 штук | 40% эллаговой кислоты | Пищевая добавка 1-2 таблетки в день |
| Pomegranate Seed Oil, Mountain Rose Inc. | Флаконы 60 мл | Экстракт зерен граната. Гранатовая кислота 78%, линолевая 7%, остальные – до 100% | Пищевая добавка, а также наружно |
| Pomegranate Seed Oil, Cardea | Флаконы 25 и 100 мл | Экстракт зерен граната. Гранатовая кислота 75-80%, линолевая 6%, остальные – до 100% | Пищевая добавка, а также наружно |
| Pomegranate Seed, Fushi Virgin Organic | Флаконы 50 мл | Экстракт зерен граната. Гранатовая кислота 75-80%, линолевая 6% | Пищевая добавка, а также наружно |
Литература
- Гасанов З.М., Набиев A.A., Гаджиев З.В., Асланова M.С. Сортовое разнообразие и содержание биологически активных веществ в плодах граната. Современное садоводство. 2015, 1, 72-78.
- Abidov M., Ramazanov Z., Seifulla R., Grachev S. The effects of Xanthigen in the weight management of obese premenopausal women with non-alcoholic fatty liver disease and normal liver fat. Diabetes Obes.Metab., 2010, 12(1):72-81
- Al-Dujaili E.A.S., Good G., Tsang C. Consumption of Pomegranate Juice Attenuates Exercise - Induced Oxidative Stress, Blood Pressure and Urinary Cortisol/Cortisone Ratio in Human Adults. EC Nutrition 4.6 (2016): 982-995.
- Ali K., Che-Man Y.B., Roberts T.H.. Physico-chemical properties and fatty acid profile of seed oils from pomegranate (Punica granatum L.) extracted by cold pressing. Eur. J. Lipid Sci. Tech., 2014, 116:553–562.
- Ammar A., Chtourou H., Trabelsi K. et al. Temporal specificity of training: intra-day effects on biochemical responses and Olympic-Weightlifting performances. J.Sports Sci., 2014, 33(4):358-368.
- Ammar A., Chtourou H., Hammouda O. et al. Acute and delayed responses of C-reactive protein, malondialdehyde and antioxidant markers after resistance training session in elite weightlifters: Effect of Time of day. Chronobiol.Int., 2015, 32(9):1211-1222.
- Ammar A., Turki M., Chtourou H. et al. Pomegranate Supplementation Accelerates Recovery of Muscle Damage and Soreness and Inflammatory Markers after a Weightlifting Training Session. PLOS ONE | DOI:10.1371/journal.pone.0160305, 2016, 19 pp.
- Arao K., Wang Y., Inoue N., Hirata J., Cha J., Nagao K., Yanagita T. Dietary effect of pomegranate seed oil rich in 9cis, 11trans, 13cis conjugated linolenic acid on lipid metabolism in obese, hyperlipidemic OLETF rats. Lipids Health Dis., 2004, 3: 24.
- Aruna P., Venkataramanamma D., Kumar Singh A., Singh, R.P. Health Benefits of Punicic Acid: A Review. Comprehensive Reviews in Food Science and Food Safety, 2016, 15(1): 16-27.
- Boroushaki M.T., Mollazadeh H., Afshari R. Pomegranate seed oil: A comprehensive review on its therapeutic effects. IJPSR, 2016, 7(2): 430-442.
- Caligiani A., Bonzanini F., Palla G. et al. Characterization of a potential nutraceutical ingredient: Pomegranate (Punica granatum L.) seed oil unsaponifiable fraction. Plant Foods for Human Nutrition, 2010, 65: 277-283.
- Choi K.M., Jeon Y.S., Kim W. et al. Xanthigen Attenuates High-fat Diet-induced Obesity through Down-regulation of PPARγ and Activation of the AMPK Pathway. Food Sci. Biotechnol., 2014, 23(3): 931-935.
- Dadashi S., Mousazadeh M., Emam-Djomeh Z., Mousavi S.M.. Pomegranate (Punica granatum L.) seed: a comparative study on biochemical composition and oil physicochemical characteristics, Biochemical composition of pomegranate seed oil. Int. J. Adv. Biol. Biomed. Res. 2013, 1:351–363.
- De Melo I.L.P., de Carvalho E.B.T. et al. Characterization of constituents, quality and stability of pomegranate seed oil (Punica granatum L.). Food Science and Technology, 2016, 36(1): 132-139.
- De Melo I.L.P., de Carvalho E.B.T. et al. Pomegranate Seed Oil (Punica Granatum L.): A Source of Punicic Acid (Conjugated α-Linolenic Acid). J.Human Nutrition and Food Science, 2014, 2(1): 1024-1035.
- Elbandy M.A., Ashoush I.S.. Phytochemicals in pomegranate seeds and their effect as hypolipidemic agent in hypercholesterolemic rats. World J. Dairy Food Sci., 2012, 7:85–92.
- Elfalleh, W., Ying, M., Nasri, N., Sheng-Hua, H., Guasmi, F., Ferchichi, A. Fatty acids from Tunisian and Chinese pomegranate (Punica granatum L.) seeds. International Journal of Food Sciences and Nutrition, 2011, 62(3), 200-206.
- Fuster-Muñoz E., Roche E., Funes L. et al. Effects of pomegranate juice in circulating parameters, cytokines, and oxidative stress markers in endurance-based athletes: A randomized controlled trial. Nutrition, 2016, 32(5):539-545.
- Guangmin L., Xiang X., Qinfeng H., Yanxiang G. Supercritical CO2 extraction optimization of pomegranate (Punica granatum L.) seed oil using response surface methodology. LWT - Food Sci. Tech., 2009, 42:1491–1495.
- Habibnia M., Ghavami M., Ansaripour M., Vosough S. Chemical evaluation of oils extracted from five different varieties of Iranian pomegranate seeds. J. Food Biosci. Tech., 2012, 2:35–40.
- Hennessy A.A., Ross R.P., Devery R., Stanton C. The health promoting properties of the conjugated isomers of α-linolenic acid. Lipids. 2011, 46(2):105-119.
- Hontecillas R., O’Shea M., Einerhand A. et al. Activation of PPAR gamma and alpha by punicic acid ameliorates glucose tolerance and suppresses obesity-related inflammation. J. Am.Coll.Nutr., 2009, 28: 184-195.
- Iwabuchi M., Kohno M.J., Imamura J. Delta12-oleate desaturase-related enzymes associated with formation of conjugated trans- delta11, cis- delta13 double bonds. J. Biol. Chem., 2003, 278:4603–4610.
- Jasuja N.D., Saxena R., Chandra S., Sharma S. Pharmacological characterization and beneficial uses of Punica Granatum. Asian J. Plant Sci., 2012, 11(6): 251-267.
- Kim K-M., Kim S-M., Cho D-Y. et al. The Effect of Xanthigen on the Expression of Brown
Adipose Tissue Assessed by 18F-FDG PET. Yonsei Med.J., 2016, 57(4):1038-1041.
- Lai Ch-S., Tsai M.L., Badmaev V. et al. Xanthigen Suppresses Preadipocyte Differentiation and Adipogenesis through Down-regulation of PPARγ and C/EBPs and Modulation of SIRT-1, AMPK, and FoxO Pathways. J. Agric. Food Chem., 2012, 60 (4):1094–1101.
- Lansky E., Harrison G., Froom P., Jiang W. Pomegranate (Punica granatum) pure chemicals show possible synergistic inhibition of human PC-3 prostate cancer cell invasion across Matrigel". Invest. New Drugs, 2005, 23 (2): 121–122.
- Lesot P., Serhan Z., Billault I.. Recent advances in the analysis of the site-specific isotopic fractionation of metabolites such as fatty acids using anisotropic natural-abundance 2H NMR spectroscopy: application to conjugated linolenic methyl esters. Anal Bioana.l Chem., 2011, 399:1187–1200.
- Machin D.R., Christmas K.M., Chou T-H. et al. Effects of Differing Dosages of Pomegranate Juice Supplementation after Eccentric Exercise. Hindawi Publishing Corporation Physiology J.,2014, Article ID 271959, 7 pp.
- May P. Supercritical pomegranate seed extract helps maintain good health. Innovative Food Tech., 2014, 62:34–36.
- McFarlin B.K., Strohacker K.A., Kueht M.L. Pomegranate seed oil consumption during a period of high-fat feeding reduces weight gain and reduces type 2 diabetes risk in CD-1 mice. Br.J.Nutr., 2009; 102:54-59.
- Melvin M.N., Trexler E.T., Roelofs E.J. The effects of pomegranate extract on blood flow, vessel diameter, and exercise tolerance. J.Int.Soc.Sports Nutr., 2014, 11(Suppl 1): P4.
- Miranda J., Arias N., Fernández-Quintela A., del Puy Portillo M. Are conjugated linolenic acid isomers an alternative to conjugated linoleic acid isomers in obesity prevention? Endocrinol. Nutr. 2014, 61(4):209-219.
- Mirmiran P., Fazeli M.R., Asghari G. et al. Effect of pomegranate seed oil on hyperlipidaemic subjects: a double-blind placebo-controlled clinical trial. Br.J.Nutr., 2010, 104: 402-406.
- Mirzaee S. Studying seed and oil physicochemical characteristics of four Iranian pomegranate (Punica granatum L.) varieties. Int.J.BioSci., 2014, 4(8): 78-86.
- Outlaw J.J., Wilborn C.D., Smith-Ryan A.E. et al. Effects of a pre-and post-workout protein-carbohydrate supplement in trained crossfit individuals. SpringerPlus, 2014, 3:369-376.
- Randell R. Factors affecting fat oxidation in exercise. A thesis submitted to The University of Birmingham. School of Sport and Exercise Sciences College of Life and Environmental Studies University of Birmingham, June 2013.
- Roelofs E.J., Hirsch K.R., Trexler E.T. et al. The effects of pomegranate extract on anaerobic
exercise performance & cardiovascular responses. J.Intern.Soc.Sports Nutr., 2015, 12(Suppl 1):P56.
- Trombold J.R., Barnes J.N., Critchley L., Coyle E.F. Ellagitannin consumption improves strength recovery 2-3 d after eccentric exercise. Med.Sci.Sports Exerc., 2010,42(3):493-498.
- Trombold J.R., Reinfeld A.S., J.R.Casler, E.Coyle. The Effect of Pomegranate Juice Supplementation on Strength and Soreness after Eccentric Exercise. J.Strength Cond.Res., 2011, 25(7):1782-1788.
- Tsuzuki T., Kawakami Y., Abe R. Conjugated linolenic acid is slowly absorbed in rat intestine, but quickly converted to conjugated linoleic acid. J. Nutr. 2006, 136 (8): 2153–2159.
- Viladomiu M., Hontecillas R., Lu P., Bassaganya-Riera J. Preventive and Prophylactic Mechanisms of Action of Pomegranate Bioactive Constituents. Hindawi Publishing Corporation, Evidence-Based Complementary and Alternative Medicine. v. 2013, Article ID 789764, 18 pages
- Yang L., Leung K.Y., Cao Y. et al. Alphalinolenic acid but not conjugated linolenic acid is hypocholesterolaemic in hamsters. Br.J.Nutr., 2005, 93: 433-438.
- Yuan G.F., Sinclair A.J., Li D. Incorporation and metabolismof punicic acid in healthy young humans. Mol. Nutr. Food Res., 2009, 53, 1336 – 1342.
- Yuan G.F., Chen X.E., Li D. Conjugated linolenic acids and their bioactivities: a review. Food Funct., 2014, 25, 5(7):1360-1368.