Карнитин (медицинское применение) — различия между версиями
Admin (обсуждение | вклад) (→Дилатационная кардиомиопатия и ИБС) |
Lukuv (обсуждение | вклад) (→Читайте также) |
||
| Строка 64: | Строка 64: | ||
*[[Элькар]] | *[[Элькар]] | ||
*[[Биологически активные добавки]] | *[[Биологически активные добавки]] | ||
| + | *[[L-карнитин: научный обзор]] | ||
Версия 05:19, 6 февраля 2017
Источник:
Клиническая фармакология по Гудману и Гилману, том 4.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Карнитин
Историческая справка
Присутствие в мышцах азотистого соединения, карнитина, было обнаружено в 1905 г. После того как Франкель с сотр. выявили его роль в качестве ростового фактора для мучных червей (личинок хрущака), Фритц и Бремер в конце 1950-х гт. установили участие карнитина в окислении длинноцепочечных жирных кислот.
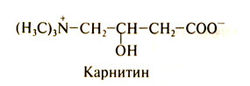
Строение
Структурная формула карнитина (y-N-триметил-Р-гидроксимасляной кислоты) следующая:
Только L-карнитин синтезируется в тканях и обладает биологической активностью.
Фармакологическое действие
Введение l-карнитина здоровым людям не оказывает заметного влияния, и прием внутрь до 15 г/сут этого вещества обычно хорошо переносится. Напротив, введение d,l-карнитина может вызывать синдром, напоминающий миастению, — вероятно, из-за ингибирующего действия d-карнитина на транспорт и функцию биологически активного l-карнитина.
Физиологические функции
Карнитин участвует главным образом в окислении жирных кислот; он способствует также аэробному обмену углеводов, ускоряет окислительное фосфорилирование и облегчает экскрецию некоторых органических кислот (Rebouche, 1992). Его функции определяются следующими обстоятельствами.
- В организме присутствует ряд карнитинацилтрансфераз, катализирующих взаимопревращение эфиров жирных кислот с КоА и карнитином в цитозоле и в мембранах митохондрий.
- Эфиры жирных кислот с КоА и карнитином термодинамически эквивалентны, поэтому направление реакции зависит только от относительных концентраций реагирующих соединений.
- В митохондриальных и клеточных мембранах расположены специфические транслоказы. В митохондриальных мембранах транслоказы легко переносят свободный карнитин и его эфиры в обоих направлениях, тогда как транслоказы апикальной поверхности клеток почечных канальцев транспортируют только свободный карнитин и почти исключительно из просвета канальцев. Свойства мембранных транслоказ других клеток изучены хуже. Тем не менее известно, что эти белки транспортируют свободный карнитин в клетки, а ацилкарнитины (особенно короткоцепочечные) — из клеток.
- Эфиры жирных кислот с КоА, образующиеся в цитозоле, не переносятся через мембраны; эти эфиры ингибируют ферменты цикла Кребса и окислительного фосфорилирования. Поэтому окисление жирных кислот требует образования ацил-карнитинов и их переноса в митохондрии, где вновь образуются, а затем метаболизируются эфиры КоА. При снижении Р02 карнитин поддерживает в митохондриях соотношение между свободным КоА и его эфирами, оптимальное для окислительного фосфорилирования и метаболизма ацетил-КоА. Поэтому карнитин снижает образование лактата и увеличивает работоспособность сердечной и скелетных мышц при их ишемии (Goa and Brogden, 1987).
При наследственной недостаточности одной из ацил-КоА-дегидрогеназ карнитин способствует удалению соответствующей органической кислоты из клеток и крови, поскольку ацил-карнитин, попадая из митохондрий в кровь и мочу, не реабсор-бируется в почечных канальцах. Такое вымывание ацилкарни-тинов из клеток и крови чревато развитием относительного дефицита карнитина.
Симптомы дефицита
Первичный дефицит карнитина наиболее ярко проявляется при некоторых редких наследственных заболеваниях. В таких случаях резко нарушается жировой обмен, что сопровождается отложением жира в мышцах и дисфункцией сердечной и скелетных мышц. Существуют генерализованная и миопатическая формы первичного дефицита карнитина. При генерализованной форме снижается уровень карнитина в плазме, мышцах и печени. Симптомы непостоянны, но обычно включают мышечную слабость, дилатационную кардиомиопатию, нарушение функций печени и процессов кетогенеза, а также гипогликемию голодания. При миопатической форме отмечается в основном мышечная слабость. При биопсии выявляется жировая инфильтрация мышечных волокон и снижение в них концентрации карнитина. Однако его концентрация в плазме остается нормальной (20—70 мкмоль/л). В основе многих случаев первичного дефицита карнитина может лежать нарушение транспорта карнитина в мышцы в сочетании с плохой его реабсорбцией в почках (Treem et al., 1988).
Известны и вторичные формы дефицита карнитина. Они характерны для патологии почечных канальцев, сопровождающейся избыточной экскрецией карнитина, и для ХПН, при которой его чрезмерным потерям способствует гемодиализ. Поскольку карнитин усиливает экскрецию органических кислот, его дефицит может иметь место у больных с врожденными нарушениями обмена веществ, характеризующимися повышением концентрации таких кислот в крови. Биохимические и клинические признаки дефицита карнитина иногда отмечаются и при полном парентеральном питании. Добавление карнитина в таких случаях снимает симптомы дефицита.
Потребность
У взрослых людей потребность в карнитине удовлетворяется его поступлением с пищей и тем его количеством, которое синтезируется в организме, главным образом в печени и почках. Однако у маловесных новорожденных и недоношенных высок риск дефицита карнитина. Для нормального развития такие дети должны получать много жиров; благотворное действие оказывает и введение экзогенного карнитина (Rebouche, 1992). Карнитин синтезируется из лизиновых остатков различных белков. Реакция начинается с образования 6-N-три-метиллизина в присутствии S-аденозилметионина (Rebouche, 1991). На разных этапах ферментативного синтеза карнитина необходимо присутствие четырех компонентов пиши: аскорбиновой и никотиновой кислот, пиридоксина и железа. Потребление в пищу только дробленого зерна и других источников растительного белка может приводить к дефициту карнитина. Суточная потребность в карнитине не установлена.
Пищевые источники. Основными пищевыми источниками карнитина служат мясо и молочные продукты. Злаки лишены карнитина и содержат сравнительно мало его аминокислотных предшественников — лизина и метионина.
Всасывание, обмен и экскреция
Поступающий с пищей l-карнитин всасывается в кишечнике преимущественно с помощью переносчика; с увеличением количества l-карнитина переносчик насыщается, и доля всосавшегося вещества уменьшается. Карнитин попадает в большинство клеток с помощью активного транспорта; d-карнитин также транспортируется и может конкурентно подавлять поглощение l-карнитина. В организме карнитин слабо метаболизируется и выводится с мочой в основном в виде ацилкарнитинов. Более 90% неэтерифицированного карнитина обычно реабсорбируется в почечных канальцах (Goa and Brogden, 1987).
Применение
В 1986 г. ФДА одобрило применение левокарнитина (препарата карнитина) при первичном дефиците карнитина. Затем было разрешено применение этого препарата при первичном и вторичном дефицитах карнитина, обусловленных генетическими факторами, а также в качестве профилактического и лечебного средства у находящихся на диализе больных с терминальной ХПН. В большинстве случаев достаточно принимать левокарнитин по 1—3 г/сут внутрь дробно во время еды; в/в вводят 40—100 мг/кг. Детям левокарнитин назначают по 50—100 мг/кг/сут внутрь во время еды; максимальная доза — 3 г/суг.
Первичный дефицит карнитина
Основу лечения генерализованной формы первичного дефицита карнитина составляет диета с высоким содержанием углеводов и низким содержанием жиров. Многократно испытывали эффект добавок карнитина при миопатической и генерализованной формах дефицита, но результаты оказались неоднозначными. У некоторых больных после приема карнитина в дозе до 4 г/сут наблюдалось резкое улучшение, но у других эффект отсутствовал. Улучшение не удается связать с биохимическими сдвигами. Тем не менее при первичном дефиците карнитина всегда следует проверить эффективность левокарнитина.
Гемодиализ
Дефицит карнитина в скелетных мышцах и, вероятно, в миокарде иногда наблюдается при хроническом гемодиализе. Прием левокарнитина внутрь уменьшает степень дефицита и устраняет такие симптомы, как слабость и спазмы мышц (Bellinghieri et al., 1983). Карнитин может улучшать и функцию сердца у больных, находящихся на гемодиализе (Fagher et al 198S), но эти результаты более противоречивы.
Дилатационная кардиомиопатия и ИБС
Сердце получает основную часть энергии за счет окисления жирных кислот. Поскольку карнитин играет важнейшую роль в энергетическом метаболизме здорового сердца, а при дефиците этого вещества развивается дилатационная кардиомиопатия, исследователи предположили, что причиной некоторых случаев дилатационной кардиомиопатии может быть именно дефицит карнитина Кроме того, ишемия миокарда вызывает снижение уровня карнитина в сердце и накопление в нем эфиров длинноцепочечных жирных кислот с КоА и карнитином; ацилкарнитины могут играть роль в патогенезе сердечных аритмий. Введение левокарнитина улучшает работоспособность больных с ИБС и может быть полезно при сердечной недостаточности (Ghidini et al. 1988). Ишемия скелетных мышц сопровождается сходными нарушениями липидного и карнитинового обмена, а введение левокарнитина может повысить переносимость ходьбы у больных, страдающих перемежающейся хромотой (Brevetti et al. 1999). Кроме того, левокарнитин улучшает прогноз при инфаркте миокарда (Singh et al., 1996). Хотя эти данные и обнадеживают, лечебное действие карнитина при таких состояниях нуждается в подтверждении.