Кортикостероиды — различия между версиями
Zabava (обсуждение | вклад) (→Структурно-функциональная зависимость) |
Talk (обсуждение | вклад) |
||
| (не показаны 2 промежуточные версии 2 участников) | |||
| Строка 3: | Строка 3: | ||
== Гормоны коры надпочечников == | == Гормоны коры надпочечников == | ||
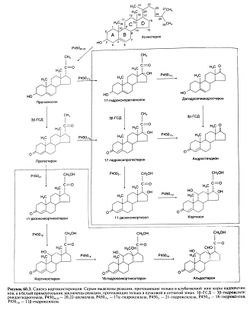
| − | Кора [[Надпочечники|надпочечников]] синтезирует стероидные гормоны двух классов: кортикостероиды, относящиеся по химической структуре к С21-стероидам, и | + | Кора [[Надпочечники|надпочечников]] синтезирует стероидные гормоны двух классов: '''кортикостероиды''', относящиеся по химической структуре к С21-стероидам, и [[андроген]]ы, относящиеся к С19-стероидам (рис. 60.3)[[Image:Gm60 3.jpg|250px|thumb|right|Рисунок 60.3. Синтез кортикостероидов]]. Традиционное деление кортикостероидов на [[глюкокортикоиды]] и минералокортикоиды отражает их преобладающее физиологическое действие соответственно на углеводный обмен и [[Водно-солевой и минеральный обмен у детей|водно-электролитный баланс]]. У человека основной глюкокортикоид — [[кортизол]], а основной минералокортикоид — [[альдостерон]]. Величины суточной секреции у человека наиболее важных кортикостероидов — кортизола и альдестерона — и их нормальные сывороточные концентрации указаны в табл. 60.1.[[Image:Gmt60_1.jpg|250px|thumb|right|Таблица 60.1. Суточная секреция и сывороточная концентрация основных кортиростероидов]] Раньше считали, что в сутки образуется 20 мг кортизола, но, как показали более поздние исследования, эта величина ближе к 10 мг (Esteban et al., 1991). |
У женщин кора надпочечников служит также важным источником андрогенов, но при надпочечниковой недостаточности введение одних лишь глюко- и минералокортикоидов увеличивает среднюю продолжительность жизни до нормальной. Иными словами, надпочечниковые андрогены не являются жизненно необходимыми. Однако уровень дегидроэпиандростерона (главного надпочечникового андрогена) изменяется с возрастом, достигая максимума на третьем десятилетии жизни, а затем постепенно снижаясь. Кроме того, при многих хронических заболеваниях концентрация дегидроэпиандростерона в плазме крайне низка. На основании этого было выдвинуто предположение, что прием дегидроэпиандростерона может хотя бы отчасти смягчить симптомы старения. Обсуждалась необходимость применения дегидроэпиандростерона при первичной и вторичной надпочечниковой недостаточности. По данным одного исследования, добавление дегидроэпиандростерона (50 мг внутрь один раз в сутки утром) к стандартной схеме заместительной терапии надпочечниковой недостаточности у женщин улучшает самочувствие и усиливает половое влечение (Arlt et al., 1999). | У женщин кора надпочечников служит также важным источником андрогенов, но при надпочечниковой недостаточности введение одних лишь глюко- и минералокортикоидов увеличивает среднюю продолжительность жизни до нормальной. Иными словами, надпочечниковые андрогены не являются жизненно необходимыми. Однако уровень дегидроэпиандростерона (главного надпочечникового андрогена) изменяется с возрастом, достигая максимума на третьем десятилетии жизни, а затем постепенно снижаясь. Кроме того, при многих хронических заболеваниях концентрация дегидроэпиандростерона в плазме крайне низка. На основании этого было выдвинуто предположение, что прием дегидроэпиандростерона может хотя бы отчасти смягчить симптомы старения. Обсуждалась необходимость применения дегидроэпиандростерона при первичной и вторичной надпочечниковой недостаточности. По данным одного исследования, добавление дегидроэпиандростерона (50 мг внутрь один раз в сутки утром) к стандартной схеме заместительной терапии надпочечниковой недостаточности у женщин улучшает самочувствие и усиливает половое влечение (Arlt et al., 1999). | ||
| Строка 9: | Строка 9: | ||
== Физиологическое и фармакологическое действие == | == Физиологическое и фармакологическое действие == | ||
| − | Эффекты кортикостероидов многочисленны и разнообразны. Они влияют на углеводный, белковый и липидный обмен, поддерживают водно-электролитный баланс и функции сердечно-сосудистой, иммунной, эндокринной и нервной систем, а также почек и скелетных мышц. Кроме того, каким-то не до конца выясненным путем глюкокортикоиды придают организму способность противостоять стрессу (например, при боли или резких изменениях окружающей среды). Без коры надпочечников выживание возможно лишь в специальных условиях: при достаточном и регулярном питании, потреблении относительно больших количеств поваренной соли и поддержании определенной температуры внешней среды. | + | Эффекты кортикостероидов многочисленны и разнообразны. Они влияют на углеводный, белковый и липидный обмен, поддерживают водно-электролитный баланс и функции [[Сердечно-сосудистая система|сердечно-сосудистой]], [[Иммунная система|иммунной]], [[Эндокриная система, спорт и двигательная активность|эндокринной]] и [[Центральная нервная система|нервной систем]], а также [[Почки|почек]] и [[Скелетные мышцы|скелетных мышц]]. Кроме того, каким-то не до конца выясненным путем глюкокортикоиды придают организму способность противостоять стрессу (например, при боли или резких изменениях окружающей среды). Без коры надпочечников выживание возможно лишь в специальных условиях: при достаточном и регулярном питании, потреблении относительно больших количеств [[Соль|поваренной соли]] и поддержании определенной температуры внешней среды. |
| − | До недавнего времени действие глюкокортикоидов разделяли на физиологическое (в нормальных физиологических концентрациях) и фармакологическое (в больших концентрациях). Согласно более поздним представлениям, основное фармакологическое действие глюкокортикоидов, а именно противовоспалительное и иммуносупрессивное, имеет место и в физиологических условиях. Многие медиаторы воспаления снижают сосудистый тонус и могли бы вызывать острую сердечно-сосудистую недостаточность, если бы не встречали противодействия со стороны эндогенных глюкокортикоидов. Эту гипотезу подтверждает резкое (по меньшей мере, десятикратное) возрастание суточной секреции глюкокортикоидов при выраженном стрессе. Кроме того, их фармакологические и многие физиологические эффекты опосредуются, по-видимому, одними и теми же рецепторами (см. ниже), поэтому побочное и лечебное действие различных глюкокортикоидов, назначаемых больному, | + | До недавнего времени действие глюкокортикоидов разделяли на физиологическое (в нормальных физиологических концентрациях) и фармакологическое (в больших концентрациях). Согласно более поздним представлениям, основное фармакологическое действие глюкокортикоидов, а именно противовоспалительное и иммуносупрессивное, имеет место и в физиологических условиях. Многие медиаторы воспаления снижают сосудистый тонус и могли бы вызывать острую сердечно-сосудистую недостаточность, если бы не встречали противодействия со стороны эндогенных глюкокортикоидов. Эту гипотезу подтверждает резкое (по меньшей мере, десятикратное) возрастание суточной секреции глюкокортикоидов при выраженном стрессе. Кроме того, их фармакологические и многие физиологические эффекты опосредуются, по-видимому, одними и теми же рецепторами (см. ниже), поэтому побочное и лечебное действие различных глюкокортикоидов, назначаемых больному, не разделимы. |
| − | Действие кортикостероидов сложным образом связано с действием других гормонов. Например, в отсутствие катехоламинов, обладающих липолитическим действием, кортизол почти не влияет на скорость липолиза | + | Действие кортикостероидов сложным образом связано с действием других гормонов. Например, в отсутствие [[Катехоламины|катехоламинов]], обладающих липолитическим действием, кортизол почти не влияет на скорость липолиза в липоцитах. И наоборот, в отсутствие глюкокортикоидов адреналин и норадреналин лишь очень слабо влияют на липолиз. Введение малой дозы глюкокортикоидов резко усиливает липолитическое действие катехоламинов. Это, скорее всего, связано с изменением синтеза белка под влиянием глюкокортикоидов. Такой эффект, облегчающий действие других гормонов, называют пермиссивным. |
| − | Кортикостероиды различаются по способности задерживать натрий в организме, влиянию на углеводный обмен (например, на отложение гликогена и глюконеогенез в печени) и противовоспалительному действию. В целом, жизнь животных, подвергнутых адреналэктомии, лучше поддерживают те кортикостероиды, которые активнее задерживают натрий (то есть кортикостероиды с высокой минералокортикоидной активностью). Влияние кортикостероидов на углеводный обмен (глюкокортикоидная активность) пропорционально их противовоспалительной активности. В то же время их минералокортикоидная активность не зависит от глюкокортикоидной и противовоспалительной активности. Как уже говорилось, минералокортикоидная и глюкокортикоидная (как и противовоспалительная) активность опосредованы разными рецепторами. Сравнительная активность глюкокортикоидов приведена в табл. 60.2.[[Image:Gmt60_2.jpg|250px|thumb|right|Таблица 60.2. Сравнительная активность и эквивалентные дозы некоторых кортикостероидов.]] Некоторые | + | Кортикостероиды различаются по способности задерживать натрий в организме, влиянию на углеводный обмен (например, на отложение гликогена и [[глюконеогенез]] в печени) и противовоспалительному действию. В целом, жизнь животных, подвергнутых адреналэктомии, лучше поддерживают те кортикостероиды, которые активнее задерживают натрий (то есть кортикостероиды с высокой минералокортикоидной активностью). Влияние кортикостероидов на углеводный обмен (глюкокортикоидная активность) пропорционально их противовоспалительной активности. В то же время их минералокортикоидная активность не зависит от глюкокортикоидной и противовоспалительной активности. Как уже говорилось, минералокортикоидная и глюкокортикоидная (как и противовоспалительная) активность опосредованы разными рецепторами. Сравнительная активность глюкокортикоидов приведена в табл. 60.2.[[Image:Gmt60_2.jpg|250px|thumb|right|Таблица 60.2. Сравнительная активность и эквивалентные дозы некоторых кортикостероидов.]] Некоторые глюкокортикоиды (например, кортизол и преднизон) проявляют и существенную минералокортикоидную активность. Однако при первичной надпочечниковой недостаточности заместительная терапия этими препаратами (см. ниже) не компенсирует отсутствия альдостерона, поэтому приходится одновременно вводить более активные минералокортикоиды. Напротив, активный минералокортикоид альдостерон слабо влияет на углеводный обмен. При физиологических концентрациях или в дозах, оказывающих максимальное действие на водноэлектролитный баланс, альдостерон почти не обладает глюкокортикоидной активностью, то есть является чистым минералокортикоидом. |
=== Общие механизмы действия кортикостероидов === | === Общие механизмы действия кортикостероидов === | ||
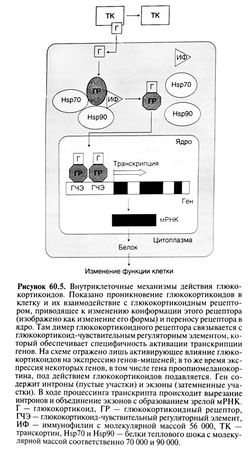
| − | Взаимодействуя с внутриклеточными рецепторами, кортикостероиды регулируют экспрессию генов-мишеней и тем | + | Взаимодействуя с внутриклеточными рецепторами, кортикостероиды регулируют экспрессию генов-мишеней и тем самым изменяют количество и спектр синтезируемых белков (рис. 60.5). Так как изменение в синтезе белка требует времени, большинство эффектов кортикостероидов проявляется не сразу, а лишь через несколько часов. Поэтому нельзя ожидать немедленного эффекта от введения глюкокортикоидов. Хотя под действием кортикостероидов экспрессия большинства генов-мишеней усиливается, описано и подавление экспрессии некоторых генов (см. ниже). В отличие от действия, опосредованного изменением экспрессии генов-мишеней, некоторые эффекты кортикостероидов возникают немедленно и связаны с влиянием этих гормонов на мембранные рецепторы (Christ et al., 1999). |
| − | Структура кортикостероидных рецепторов была выяснена с помощью молекулярного клонирования. Эти рецепторы принадлежат к суперсемейству белков, опосредующих эффекты ряда небольших гидрофобных молекул, включая стероидные и тиреоидные гормоны, кальцитриол и ретиноиды (Mangelsdorf et al., 1995). Все эти белки содержат два консервативных домена: один из них, состоящий примерно из 70 аминокислотных остатков, имеет два участка связывания цинка (цинковые пальцы) и необходим для взаимодействия рецептора с определенными последовательностями ДНК, а второй, расположенный на С-конце молекулы, связывает гормон.[[Image:Gm60_5.jpg|250px|thumb|right|Рисунок 60.5. Внутриклеточные механизмы действия глюкокортикоидов.]] | + | Структура кортикостероидных рецепторов была выяснена с помощью молекулярного клонирования. Эти рецепторы принадлежат к суперсемейству белков, опосредующих эффекты ряда небольших гидрофобных молекул, включая стероидные и [[тиреоидные гормоны]], кальцитриол и [[ретиноиды]] (Mangelsdorf et al., 1995). Все эти белки содержат два консервативных домена: один из них, состоящий примерно из 70 аминокислотных остатков, имеет два участка связывания цинка (цинковые пальцы) и необходим для взаимодействия рецептора с определенными последовательностями ДНК, а второй, расположенный на С-конце молекулы, связывает гормон.[[Image:Gm60_5.jpg|250px|thumb|right|Рисунок 60.5. Внутриклеточные механизмы действия глюкокортикоидов.]] |
==== Глюкокортикоидный рецептор ==== | ==== Глюкокортикоидный рецептор ==== | ||
| − | Как показано на рис. 60.5, глюкокортикоидные рецепторы до взаимодействия с гормоном не активны и расположены преимущественно в цитоплазме. Связывание гормона активирует рецептор и вызывает его перемещение в ядро клетки. Неактивный рецептор находится в комплексе с другими белками, включая белок теплового шока Hsp-90 (один из индуцируемых стрессом белков), белок теплового шока Hsp-70 и иммунофилин с молекулярной массой 56 000 -один из внутриклеточных белков, связывающих иммунодепрессанты циклоспорин и такролимус | + | Как показано на рис. 60.5, глюкокортикоидные рецепторы до взаимодействия с гормоном не активны и расположены преимущественно в цитоплазме. Связывание гормона активирует рецептор и вызывает его перемещение в ядро клетки. Неактивный рецептор находится в комплексе с другими белками, включая белок теплового шока Hsp-90 (один из индуцируемых стрессом белков), белок теплового шока Hsp-70 и иммунофилин с молекулярной массой 56 000 -один из внутриклеточных белков, связывающих иммунодепрессанты циклоспорин и такролимус. Считается, что, взаимодействуя с гормонсвязывающим доменом глюкокортикоидного рецептора, белок теплового шока Hsp-90 способствует приобретению рецептором той конформации, которая необходима для связывания гормона. |
==== Регуляция экспрессии генов глюкокортикоидами ==== | ==== Регуляция экспрессии генов глюкокортикоидами ==== | ||
| Строка 31: | Строка 31: | ||
После связывания гормона глюкокортикоидный рецептор освобождается от других белков, образует димер и перемещается в клеточное ядро, где и взаимодействует с определенными последовательностями ДНК на регуляторных участках генов-мишеней. Короткие последовательности ДНК, распознаваемые активированным рецептором, носят название глюкокортикоид-чувствительных регуляторных элементов и обеспечивают специфичность влияния глюкокортикоидов на экспрессию генов. Основу таких элементов составляет устойчивая последовательность, несовершенный палиндром ГГТАЦАХХХТТТЦТ (X — любой нуклеотид), с которым и связывается димер глюкокортикоидного рецептора. Сложные механизмы активирующего влияния рецептора на транскрипцию генов выяснены не полностью, но, по-видимому, включают его взаимодействие с кофакторами и белками, формирующими основу транскрипционного аппарата. Установлены также гены, транскрипция которых подавляется глюкокортикоидами (Webster and Cidlowski, 1999). Один из них — ген [[Проопиомеланокортин|проопиомеланокортина]], подавление транскрипции которого в кортикотропных клетках гипофиза — существенное звено в регуляции [[Гипоталамо-гипофизарно-надпочечниковая система|гипоталамо-гипофизарно-надпочечниковой системы]]. В этом случае глюкокортикоидные рецепторы взаимодействуют с особым глюкокортикоид-чувствительным регуляторным элементом в промоторе гена проопиомеланокортина. | После связывания гормона глюкокортикоидный рецептор освобождается от других белков, образует димер и перемещается в клеточное ядро, где и взаимодействует с определенными последовательностями ДНК на регуляторных участках генов-мишеней. Короткие последовательности ДНК, распознаваемые активированным рецептором, носят название глюкокортикоид-чувствительных регуляторных элементов и обеспечивают специфичность влияния глюкокортикоидов на экспрессию генов. Основу таких элементов составляет устойчивая последовательность, несовершенный палиндром ГГТАЦАХХХТТТЦТ (X — любой нуклеотид), с которым и связывается димер глюкокортикоидного рецептора. Сложные механизмы активирующего влияния рецептора на транскрипцию генов выяснены не полностью, но, по-видимому, включают его взаимодействие с кофакторами и белками, формирующими основу транскрипционного аппарата. Установлены также гены, транскрипция которых подавляется глюкокортикоидами (Webster and Cidlowski, 1999). Один из них — ген [[Проопиомеланокортин|проопиомеланокортина]], подавление транскрипции которого в кортикотропных клетках гипофиза — существенное звено в регуляции [[Гипоталамо-гипофизарно-надпочечниковая система|гипоталамо-гипофизарно-надпочечниковой системы]]. В этом случае глюкокортикоидные рецепторы взаимодействуют с особым глюкокортикоид-чувствительным регуляторным элементом в промоторе гена проопиомеланокортина. | ||
| − | Без глюкокортикоидов и, вероятно, их рецепторов жизнь невозможна, но взаимодействие рецепторов с глюкокортикоид- | + | Без глюкокортикоидов и, вероятно, их рецепторов жизнь невозможна, но взаимодействие рецепторов с глюкокортикоид-чувствительными регуляторными элементами ДНК не столь необходимо. Это подтверждается данными о том, что трансгенные мыши, полностью лишенные глюкокортикоидных рецепторов, погибают сразу же после рождения, тогда как мыши, у которых дефекты рецепторов препятствуют их связыванию с ДНК. выживают (Reichardt et al., 1998). Отсюда следует, что важность глюкокортикоидных рецепторов определяется их взаимодействием с другими белковыми факторами транскрипции (Xu et al., 1999). Действительно, обнаружены белок-белковые взаимодействия этих рецепторов с факторами транскрипции NFkB и АР-1, которые регулируют экспрессию многих белков иммунной системы (McKay and Cidlowski, 1999). В результате подавляется экспрессия генов, кодирующих ряд цитокинов (регуляторных молекул, играющих ведущую роль в иммунных и воспалительных реакциях), и таких ферментов, как коллагеназа и стромелизины (предположительно играющих основную роль в деструкции суставов при артрите). Таким образом, противовоспалительная и иммуносупрессивная активность глюкокортикоидов во многом связана с подавлением экспрессии ряда генов. |
==== Регуляция экспрессии генов минералокортикоидами ==== | ==== Регуляция экспрессии генов минералокортикоидами ==== | ||
| − | Минералокортикоидные рецепторы также представляют собой лиганд-чувствительные регуляторы транскрипции, которые связываются с аналогичными (если не теми же) гормон-чувствительными регуляторными элементами ДНК. что и | + | Минералокортикоидные рецепторы также представляют собой лиганд-чувствительные регуляторы транскрипции, которые связываются с аналогичными (если не теми же) гормон-чувствительными регуляторными элементами ДНК. что и глюкокортикоидные рецепторы. Действие минералокортикоилных рецепторов изучено хуже, чем глюкокортикоидных, но основные принципы, по-видимому, в обоих случаях одинаковы: минералокортикоидные рецепторы также связываются с белком теплового шока Hsp-90 и также активируют транскрипцию определенных генов-мишеней. Различия в ДНК-связывающих доменах глюко-и минералокортикоидных рецепторов, которые могли бы объяснить разницу в активации генов-мишеней, пока не обнаружены. Эти рецепторы различаются по способности подавлять активирующее действие факторов транскрипции АР-1 на экспрессию генов (Pearce and Yamamoto, 1993). Таким образом, причина различного влияния этих рецепторов на клетки может заключаться в их неодинаковом взаимодействии с другими факторами транскрипции. Кроме того, минералокортикоидные рецепторы, в отличие от глюкокортикоидных, имеются лишь в некоторых тканях — в основном в почках (в дистальных извитых канальцах и корковом отделе собирательных трубочек), толстой кишке, слюнных и потовых железах, гиппокампе. |
| − | Альдостерон изменяет обмен натрия и калия преимущественно за счет влияния на главные клетки дистальных канальцев и собирательных трубочек, тогда как действие на секрецию Н+ осуществляется в основном через вставочные клетки. Недавние исследования позволили выяснить некоторые механизмы действия альдостерона на транспорт воды и электролитов. Связываясь с минералокортикоидными рецепторами в клетках-мишенях, альдостерон запускает цепь реакций, включающую быструю индукцию киназы, которая регулируется факторами сыворотки и глюкокортикоидами. Эта киназа фосфорилирует и активирует чувствительные к амилориду натриевые каналы в апикальной мембране эпителиальных клеток (Chen et al., 1999). Усиленный вход натрия стимулирует | + | Альдостерон изменяет обмен натрия и калия преимущественно за счет влияния на главные клетки дистальных канальцев и собирательных трубочек, тогда как действие на секрецию Н+ осуществляется в основном через вставочные клетки. Недавние исследования позволили выяснить некоторые механизмы действия альдостерона на транспорт воды и электролитов. Связываясь с минералокортикоидными рецепторами в клетках-мишенях, альдостерон запускает цепь реакций, включающую быструю индукцию киназы, которая регулируется факторами сыворотки и глюкокортикоидами. Эта киназа фосфорилирует и активирует чувствительные к амилориду натриевые каналы в апикальной мембране эпителиальных клеток (Chen et al., 1999). Усиленный вход натрия стимулирует Na+,К+-АТФазу в базолатеральной мембране. Помимо такого быстрого действия альдостерон усиливает и синтез отдельных компонентов этих мембранных белков. |
| − | Дальнейшему выяснению роли минералокортикоидных рецепторов и их генов-мишеней в регуляции водно- | + | Дальнейшему выяснению роли минералокортикоидных рецепторов и их генов-мишеней в регуляции водно-электролитного баланса способствовало обследование больных с такими редкими генетическими нарушениями, как псевдогипоапьдостеронизм и синдром Лиддла. При псевдогипоальдосгеронизме, несмотря на повышенный уровень минералокортикоидов, наблюдаются симптомы дефицита минералокортикоидов (например, гиповолемия, артериальная гипотония, гиперкалиемия и метаболический ацидоз). Молекулярно-генетические исследования позволили выделить разные группы больных с этим заболеванием. У одних заболевание наследуется аутосомно-рецессивно и обусловлено инактивирующими мутациями генов, кодирующих субъединицы чувствительных к амилориду натриевых каналов эпителиальных клеток. У других имеется аутосомно-доминантная форма псевдогипоальдостеронизма, вызванная инактивирующими мутациями гена минералокортикоидного рецептора (Geller et al., 1998). Синдром Лиддла, наследуемый аутосомно-доминантно, обусловлен активирующими мутациями генов чувствительных к амилориду натриевых каналов (Shimketsetal., 1994). Постоянная активация этих каналов приводит к артериальной гипертонии, гипокалиемии и метаболическому алкалозу, несмотря на низкие уровни ренина и альдостерона в плазме. |
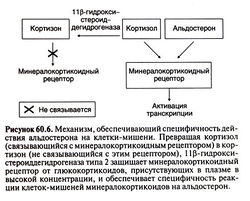
| − | Специфичность действия кортикостероидов, не зависящая от рецепторов. Клонирование генов глюкокортикоидного и минера-локортикоидного рецепторов позволило обнаружить, что альдостерон (классический минералокортикоид) и кортизол (преимущественно глюкокортикоид) связываются с | + | Специфичность действия кортикостероидов, не зависящая от рецепторов. Клонирование генов глюкокортикоидного и минера-локортикоидного рецепторов позволило обнаружить, что альдостерон (классический минералокортикоид) и кортизол (преимущественно глюкокортикоид) связываются с минералокортикоидным рецептором с равным сродством. Почему же минералокортикоидный рецептор взаимодействует именно с альдо-стероном, а не с глюкокортикоидами, уровень которых в крови гораздо выше? По крайней мере частичный ответ на этот вопрос дало открытие фермента 1 ip-гидроксистероиддегидрогеназы типа 2, от которого и зависит специфичность действия кортикостероидов, особенно в почках, толстой кишке и слюнных железах. Этот фермент превращает глюкокортикоиды (например, кортизол) в 11-кето-производные (например, кортизон), не взаимодействующие с минералокортикоидными рецепторами, и тем самым препятствует действию глюкокортикоидов в тканях, чувствительных к минералокортикоидам (рис. 60.6). Альдостерон же, находящийся в организме преимущественно в форме полуацеталя, устойчив к действию 1 ф-гидроксистеро-иддегидрогеназы. В отсутствие этого фермента (что характерно для наследственного заболевания — синдрома мнимого избытка минералокортикоидов) находящийся в избытке кортизол действует на минералокортикоидные рецепторы, что приводит к тяжелой гипокалиемии и артериальной гипертонии. Симптомы избытка минералокортикоидов (в частности, артериальная гипертония) возникают также при ингибировании 11 β-гидро-ксистероиддегидрогеназы глициризиновой кислотой, содержащейся в лакрице. |
=== Углеводный и белковый обмен === | === Углеводный и белковый обмен === | ||
| − | Глюкокортикоиды оказывают выраженное влияние на углеводный и белковый обмен. Можно считать, что они защищают глюкозозависимые ткани (такие, как головной мозг и сердце) от голодания. В печени | + | Глюкокортикоиды оказывают выраженное влияние на углеводный и белковый обмен. Можно считать, что они защищают глюкозозависимые ткани (такие, как головной мозг и сердце) от голодания. В печени глюкокортикоиды стимулируют глюконеогенез и накопление гликогена. В периферических тканях глюкокортикоиды подавляют утилизацию глюкозы, усиливают распад белка и активируют липолиз, что дает аминокислоты и глицерин, используемые для глюконеогенез а. Конечный результат сводится к повышению концентрации глюкозы в крови. Поэтому назначение глюкокортикоидов может усугубить нарушения углеводного обмена у больных сахарным диабетом и вызвать гипергликемию у лиц с предрасположенностью к этому заболеванию. |
| − | Механизм подавляющего действия глюкокортикоидов на утилизацию глюкозы периферическими тканями не совсем понятен. | + | Механизм подавляющего действия глюкокортикоидов на утилизацию глюкозы периферическими тканями не совсем понятен. глюкокортикоиды снижают поглощение глюкозы жировой тканью, кожей, фибробластами, тимоцитами и нейтрофилами. Считается, что это связано с перемещением переносчиков глюкозы из клеточной мембраны внутрь клеток. Уменьшение поглощения глюкозы периферическими тканями сопровождается усилением катаболизма, что приводит к атрофии лимфоидной ткани, снижению мышечной массы, отрицательному азотистому балансу и истончению кожи. |
| − | Механизмы стимулирующего действия глюкокортикоидов на | + | Механизмы стимулирующего действия глюкокортикоидов на глюконеогенез также не совсем ясны. Аминокислоты, выделяемые рядом тканей под влиянием глюкокортикоидов, поступают в печень, где используются для глюконеогенеза и образования гликогена. В печени глюкокортикоиды усиливают синтез многих ферментов глюконеогенеза и метаболизма аминокислот, включая фосфоенолпируваткарбоксикиназу, глюкозо-6-фосфа-тазу и фруктозо-2,6-дифосфатазу. В регуляции экспрессии гена фосфоенолпируваткарбоксикиназы принимают участие не только глюкокортикоиды, но и инсулин, глюкагон и катехоламины. Влияние всех этих гормонов на экспрессию гена фосфоенолпируваткарбоксикиназы отражает сложность регуляции глюконеогенеза в организме.[[Image:Gm60_6.jpg|250px|thumb|right|Рисунок 60.6. Механизм, обеспечивающий специфичность действия альдостерона на клетки-мишени.]] |
=== Липидный обмен === | === Липидный обмен === | ||
| Строка 59: | Строка 59: | ||
=== Водно-электролитный баланс === | === Водно-электролитный баланс === | ||
| − | По минералокортикоидной активности альдостерон намного превосходит все (остальные природные кортикостероиды. На это указывает сохранение водно-электролитного баланса у подвергнутых гипофизэктомии животных, у которых надпочечники не секретируют | + | По минералокортикоидной активности альдостерон намного превосходит все (остальные природные кортикостероиды. На это указывает сохранение водно-электролитного баланса у подвергнутых гипофизэктомии животных, у которых надпочечники не секретируют глюкокортикоиды. Минерало-кортикоиды усиливают реабсорбцию натрия, действуя на клетки дистальных канальцев и собирательных трубочек почек, и увеличивают экскрецию калия и Н+ с мочой. Можно считать, что альдостерон стимулирует обмен между ионами Na+ и К+ (или Н+), хотя молекулярный механизм перемещения этих ионов в почечных канальцах отличается от простого обмена одного катиона на другой. |
Это действие на транспорт электролитов в почках и в других тканях (толстой кишке, слюнных и потовых железах) определяет физиологические и фармакологические эффекты минералокортикоидов. Поэтому для гипераль-достеронизма характерны задержка натрия, сопровождающаяся увеличением объема внеклеточной жидкости, нормальная или слегка повышенная концентрация натрия в плазме, гипокалиемия и алкалоз. Напротив, дефицит альдостерона сопровождается потерей натрия и уменьшением объема внеклеточной жидкости на фоне гипо-натриемии, гиперкалиемии и ацидоза. При хроническом гиперальдостеронизме наблюдается артериальная гипертония, тогда как дефицит альдостерона обусловливает артериальную гипотонию и может приводить к острой сердечно-сосудистой недостаточности. Из-за выпадения влияния минералокортикоидов на обмен электролитов в потовых железах больные с надпочечниковой недостаточностью в жару особенно предрасположены к потере натрия и воды с потом. | Это действие на транспорт электролитов в почках и в других тканях (толстой кишке, слюнных и потовых железах) определяет физиологические и фармакологические эффекты минералокортикоидов. Поэтому для гипераль-достеронизма характерны задержка натрия, сопровождающаяся увеличением объема внеклеточной жидкости, нормальная или слегка повышенная концентрация натрия в плазме, гипокалиемия и алкалоз. Напротив, дефицит альдостерона сопровождается потерей натрия и уменьшением объема внеклеточной жидкости на фоне гипо-натриемии, гиперкалиемии и ацидоза. При хроническом гиперальдостеронизме наблюдается артериальная гипертония, тогда как дефицит альдостерона обусловливает артериальную гипотонию и может приводить к острой сердечно-сосудистой недостаточности. Из-за выпадения влияния минералокортикоидов на обмен электролитов в потовых железах больные с надпочечниковой недостаточностью в жару особенно предрасположены к потере натрия и воды с потом. | ||
| − | + | глюкокортикоиды также влияют на водно-электролитный баланс. Они необходимы для поддержания СКФ и функции почечных канальцев. глюкокортикоиды увеличивают почечную экскрецию воды; когда-то пробу с водной нагрузкой использовали для выявления надпочечниковой недостаточности. Задержка воды при первичной надпочечниковой недостаточности отчасти связана с повышенной секрецией АДГ, который стимулирует реабсорбцию воды в почках. | |
| − | Помимо действия на транспорт одновалентных катионов и воды | + | Помимо действия на транспорт одновалентных катионов и воды глюкокортикоиды влияют и на обмен кальция. Они каким-то образом препятствуют всасыванию кальция в кишечнике, одновременно усиливая его экскрецию почками. Сочетание этих эффектов приводит к снижению содержания кальция в организме. Сердечно-сосудистая система. Как уже отмечалось, действие кортикостероидов на сердечно-сосудистую систему связано прежде всего с изменением почечной экскреции натрия под влиянием минералокортикоидов. Это действие особенно ярко проявляется при первичном гиперальдостеронизме. Развивающаяся при этом расстройстве артериальная гипертония ведет к дальнейшему поражению сердечно-сосудистой системы, способствуя развитию атеросклероза, инсультов и гипертрофической кар-диомиопатии. Механизм артериальной гипертонии остается не совсем ясным, но низкосолевая диета может значительно снижать АД. |
| − | + | глюкокортикоиды повышают также чувствительность сосудов к другим вазоактивным веществам. При надпочечниковой недостаточности снижается реакция на нор-адреналин и ангиотензин 11. Это отчасти объясняют экспериментальные исследования, в которых показано, что глюкокортикоиды увеличивают число адренорецепторов в сосудистой стенке. Если надпочечниковая недостаточность обычно сопровождается артериальной гипотонией, то у больных с повышенной секрецией глюкокортикоидов (как при гипофизарном синдроме Кушинга) или у получающих синтетические глюкокортикоиды (даже почти лишенные минералокортикоидной активности) наблюдается артериальная гипертония. | |
Механизмы развития артериальной гипертонии под влиянием глюкокортикоидов не известны. Не ясно, в частности, связано ли повышение АД при синдроме Кушинга со стимуляцией глюкокортикоидных или минералокортикоидных рецепторов. При артериальной гипертонии на фоне избытка глюкокортикоидов низкосолевая диета обычно неэффективна (в отличие от артериальной гипертонии при гиперальдостеронизме). | Механизмы развития артериальной гипертонии под влиянием глюкокортикоидов не известны. Не ясно, в частности, связано ли повышение АД при синдроме Кушинга со стимуляцией глюкокортикоидных или минералокортикоидных рецепторов. При артериальной гипертонии на фоне избытка глюкокортикоидов низкосолевая диета обычно неэффективна (в отличие от артериальной гипертонии при гиперальдостеронизме). | ||
| − | Обнаружено и прямое действие альдостерона на сердце и сосуды. У крыс, которым вводили альдостерон, наблюдалась не только артериальная гипертония, но и кардиосклероз (Funderet al., 1997). Предполагается, что последний обусловлен не повышением АД, а прямым действием альдостерона на сердце, так как спиронолактон (блокатор минералокортикоидных рецепторов) предотвращал развитие кардиосклероза, не влияя на АД. Это объясняет (по крайней мере, частично) эффективность спи-ронолактона при сердечной недостаточности (Pitt et al., 1999). Скелетные мышцы. Пермиссивное действие кортикостероидов необходимо для нормальной работы скелетных мышц; снижение работоспособности — одно из основных проявлений надпочечниковой недостаточности. Первичная надпочечниковая недостаточность часто сопровождается мышечной слабостью и утомляемостью, которые, как считают, вызваны нарушением кровообращения. Однако работа мышц страдает и при избытке | + | Обнаружено и прямое действие альдостерона на сердце и сосуды. У крыс, которым вводили альдостерон, наблюдалась не только артериальная гипертония, но и кардиосклероз (Funderet al., 1997). Предполагается, что последний обусловлен не повышением АД, а прямым действием альдостерона на сердце, так как спиронолактон (блокатор минералокортикоидных рецепторов) предотвращал развитие кардиосклероза, не влияя на АД. Это объясняет (по крайней мере, частично) эффективность спи-ронолактона при сердечной недостаточности (Pitt et al., 1999). Скелетные мышцы. Пермиссивное действие кортикостероидов необходимо для нормальной работы скелетных мышц; снижение работоспособности — одно из основных проявлений надпочечниковой недостаточности. Первичная надпочечниковая недостаточность часто сопровождается мышечной слабостью и утомляемостью, которые, как считают, вызваны нарушением кровообращения. Однако работа мышц страдает и при избытке глюко-и минералокортикоидов. Мышечная слабость при первичном гиперальдостеронизме связана в основном с ги-покалиемией, а не с прямым влиянием минералокортикоидов на скелетные мышцы. В основе же атрофии скелетных мышц при хроническом избытке глюкокортикоидов (будь то вследствие глюкокортикоидной терапии или эндогенной гиперкортизолемии) лежат неизвестные механизмы. Этот эффект, получивший название стероидной миопатии, отчасти объясняет слабость и утомляемость, характерные для синдрома Кушинга (см. ниже). ЦНС. Многие влияния кортикостероидов на ЦНС опосредованы действием этих гормонов на АД, а также на уровень глюкозы и электролитов в плазме. Изучение распределения и функции рецепторов стероидных гормонов в головном мозге способствовало выявлению и прямого действия кортикостероидов в ЦНС, проявляющегося изменениями настроения, поведения и возбудимости головного мозга. |
| − | При первичной надпочечниковой недостаточности иногда наблюдаются различные изменения психики, в том числе апатия, депрессия и раздражительность, порой развивается явный психоз. Заместительная глюкокортикоидная терапия приводит к исчезновению этих симптомов. Существенное клиническое значение имеют и реакции ЦНС на введение глюкокортикоидов. У большинства больных при этом улучшается настроение, что дает ощущение благополучия, несмотря на продолжающуюся болезнь. Иногда возникают более глубокие изменения поведения, включая эйфорию, бессонницу, беспокойство и психомоторное возбуждение. У меньшего, но все же значительного числа больных, получающих | + | При первичной надпочечниковой недостаточности иногда наблюдаются различные изменения психики, в том числе апатия, депрессия и раздражительность, порой развивается явный психоз. Заместительная глюкокортикоидная терапия приводит к исчезновению этих симптомов. Существенное клиническое значение имеют и реакции ЦНС на введение глюкокортикоидов. У большинства больных при этом улучшается настроение, что дает ощущение благополучия, несмотря на продолжающуюся болезнь. Иногда возникают более глубокие изменения поведения, включая эйфорию, бессонницу, беспокойство и психомоторное возбуждение. У меньшего, но все же значительного числа больных, получающих глюкокортикоиды, развиваются тревожное состояние, депрессия или даже явный психоз. При синдроме Кушинга неврозы и психозы довольно часты. После отмены глюкокортикоидов или излечения синдрома Кушинга эти нарушения обычно исчезают. |
| − | Механизмы влияния кортикостероидов на активность нейронов не известны, но важно подчеркнуть, что возбудимость нейронов может зависеть от местной продукции стероидов (называемых нейростероидами) в головном мозге (Baulieu, 1998). У грызунов | + | Механизмы влияния кортикостероидов на активность нейронов не известны, но важно подчеркнуть, что возбудимость нейронов может зависеть от местной продукции стероидов (называемых нейростероидами) в головном мозге (Baulieu, 1998). У грызунов глюкокортикоиды повреждают нейроны гиппокампа, приводя к ухудшению памяти (Lupien and McEwan, 1997). У человека также обнаружена связь между высоким базальным уровнем кортизола и атрофией гиппокампа с ухудшением памяти (Lupien et al., 1998). Если эти результаты удастся подтвердить, они будут иметь важное значение для профилактики возрастного ослабления памяти и оправдают применение средств, уменьшающих влияние глюкокортикоидов на нейроны гиппокампа при старении. |
=== Кроветворение === | === Кроветворение === | ||
| − | Судя по тому, что при синдроме Кушинга часто наблюдается эритроцитоз, а при первичной надпочечниковой недостаточности — нормоцитарная нормо-хромная анемия, | + | Судя по тому, что при синдроме Кушинга часто наблюдается эритроцитоз, а при первичной надпочечниковой недостаточности — нормоцитарная нормо-хромная анемия, глюкокортикоиды как-то влияют на содержание гемоглобина и эритроцитов в крови. Более четко эффекты глюкокортикоидов проявляются при аутоиммунной гемолитической анемии, когда их иммуносу-прессивное действие ослабляет процесс разрушения эритроцитов. |
| − | + | глюкокортикоиды влияют и на лейкоциты. При первичной надпочечниковой недостаточности, как отмечал еще Аддисон, наблюдается увеличение массы лимфоидной ткани и числа лимфоцитов в крови. Напротив, для синдрома Кушинга характерны лимфопения и уменьшение массы лимфоидной ткани. Введение глюкокортикоидов приводит к снижению общего числа лимфоцитов, эозинофилов, моноцитов и базофилов. После однократного введения гидрокортизона снижение числа этих клеток в крови происходит через 4—6 ч и сохраняется в течение суток. Этот эффект связан в основном с перераспределением клеток, а не с их разрушением. Число же нейтрофилов под влиянием глюкокортикоидов возрастает: ускоряется их выход из костного мозга, замедляется исчезновение из крови и уменьшается краевое стояние. глюкокортикоиды эффективны при некоторых лимфомах, что может быть связано со способностью этих гормонов индуцировать апоптоз клеток лимфоидного ряда. | |
=== Противовоспалительное и иммуносупрессивное действие === | === Противовоспалительное и иммуносупрессивное действие === | ||
| − | + | глюкокортикоиды изменяют не только число, но и активность лимфоцитов. Это одна из важнейших сторон противовоспалительного и иммуносупрессивного действия глюкокортикоидов. Они предотвращают или подавляют воспалительную реакцию, развивающуюся в ответ на механические, химические, инфекционные воздействия, на введение антигенов и на облучение. Хотя причина болезни при этом не устраняется, подавление воспалительной реакции имеет огромное клиническое значение; именно поэтому глюкокортикоиды относятся к числу наиболее часто назначаемых средств. Им принадлежит неоценимая роль в лечении и тех заболеваний, в основе которых лежат нежелательные иммунные реакции, будь то гуморальные (например, крапивница, гл. 65) или клеточные (например, отторжение трансплантата, гл. 53). Иммуносупрессивный и противовоспалительный эффекты глюкокортикоидов трудно разделить, вероятно потому, что оба они связаны с подавлением функции лейкоцитов (Chrousos, 1995). | |
В основе противовоспалительного действия глюкокортикоидов лежат различные механизмы. Эти вещества подавляют продукцию различных факторов, участвующих в развитии воспаления. Уменьшается выделение вазоактивных веществ и хемоат-трактантов, секреция липаз и протеаз, перемещение лейкоцитов из сосудов в очаги повреждения и, наконец, фиброз. Все это значительно подавляет воспаление. Некоторые клетки и факторы, на которые действуют глюкокортикоиды, перечислены в табл. 60.3.[[Image:Gmt60_3.jpg|250px|thumb|right| Таблица 60.3. Влияние глюкокортикоидов на различные факторы, участвующие в ввоспалении и иммунных реакциях]] | В основе противовоспалительного действия глюкокортикоидов лежат различные механизмы. Эти вещества подавляют продукцию различных факторов, участвующих в развитии воспаления. Уменьшается выделение вазоактивных веществ и хемоат-трактантов, секреция липаз и протеаз, перемещение лейкоцитов из сосудов в очаги повреждения и, наконец, фиброз. Все это значительно подавляет воспаление. Некоторые клетки и факторы, на которые действуют глюкокортикоиды, перечислены в табл. 60.3.[[Image:Gmt60_3.jpg|250px|thumb|right| Таблица 60.3. Влияние глюкокортикоидов на различные факторы, участвующие в ввоспалении и иммунных реакциях]] | ||
| Строка 91: | Строка 91: | ||
Влияние стресса на иммунитет, равно как и участие в этом гипоталамо-гипофизарно-надпочечниковой системы, надежно установлено (Sapolsky et al., 2000). Отсюда понятно, что глюко-кортикоиды являются важнейшими физиологическими регуляторами иммунной системы, защищающими организм от опасных последствий неконтролируемого воспаления. | Влияние стресса на иммунитет, равно как и участие в этом гипоталамо-гипофизарно-надпочечниковой системы, надежно установлено (Sapolsky et al., 2000). Отсюда понятно, что глюко-кортикоиды являются важнейшими физиологическими регуляторами иммунной системы, защищающими организм от опасных последствий неконтролируемого воспаления. | ||
| − | Такие воздействия, как травмы, инфекции и болезни, сопровождаются усилением продукции цитокинов — сигнальных молекул, обеспечивающих взаимодействие моноцитов, макрофагов, Т- и В-лимфоцитов в иммунном ответе. К цитокинам относятся ИЛ-1, ИЛ-6 и ФНОа, которые стимулируют гипотала-мо-гипофизарно-надпочечниковую систему. Наиболее широким спектром действия обладает ИЛ-1. Он стимулирует выделение кортиколиберина гипоталамическими нейронами, непосредственно усиливает секрецию АКТГ гипофизом и может повышать продукцию глюкокортикоидов надпочечниками (Turnbull and Rivier, 1999). Как отмечалось выше, | + | Такие воздействия, как травмы, инфекции и болезни, сопровождаются усилением продукции цитокинов — сигнальных молекул, обеспечивающих взаимодействие моноцитов, макрофагов, Т- и В-лимфоцитов в иммунном ответе. К цитокинам относятся ИЛ-1, ИЛ-6 и ФНОа, которые стимулируют гипотала-мо-гипофизарно-надпочечниковую систему. Наиболее широким спектром действия обладает ИЛ-1. Он стимулирует выделение кортиколиберина гипоталамическими нейронами, непосредственно усиливает секрецию АКТГ гипофизом и может повышать продукцию глюкокортикоидов надпочечниками (Turnbull and Rivier, 1999). Как отмечалось выше, глюкокортикоиды, в свою очередь, подавляют иммунную систему, препятствуя секреции цитокинов, в том числе интерферона у, ГМ-КСФ, интерлейкинов (ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-8, ИЛ-12) и ФНОа. Таким образом, гипоталамо-гипофизарно-надпочечниковая и иммунная системы при стрессе взаимодействуют, что, по-видимому, играет важную физиологическую роль. |
| − | Хотя | + | Хотя глюкокортикоиды традиционно считаются иммунодепрессантами, ряд данных свидетельствует, что, угнетая клеточный иммунитет, они усиливают выработку антител, то есть стимулируют гуморальный иммунитет (Elenkov and Chrousos, 1999). Механизмы такого действия глюкокортикоидов не ясны; возможно, глюкокортикоиды подавляют активность Т-хелперов типа 1, но активируют Т-хелперы типа 2 (гл. 53). |
== Фармакокинетика == | == Фармакокинетика == | ||
| Строка 101: | Строка 101: | ||
Гидрокортизон и его многочисленные аналоги, в том числе синтетические, эффективны при приеме внутрь. Некоторые водорастворимые эфиры гидрокортизона и сходные соединения вводят в/в, что приводит к быстрому возрастанию их концентрации во внеклеточной жидкости. Более длительные эффекты обеспечивает в/м введение суспензий гидрокортизона, его аналогов и эфиров. Небольшие изменения химической структуры могут заметно сказаться на скорости всасывания, быстроте и продолжительности действия препарата. | Гидрокортизон и его многочисленные аналоги, в том числе синтетические, эффективны при приеме внутрь. Некоторые водорастворимые эфиры гидрокортизона и сходные соединения вводят в/в, что приводит к быстрому возрастанию их концентрации во внеклеточной жидкости. Более длительные эффекты обеспечивает в/м введение суспензий гидрокортизона, его аналогов и эфиров. Небольшие изменения химической структуры могут заметно сказаться на скорости всасывания, быстроте и продолжительности действия препарата. | ||
| − | + | глюкокортикоиды поступают в кровь даже при местном их применении (введении в суставы, конъюнктивальный мешок, нанесении на кожу и вдыхании). Если препараты применяются длительно, наносятся на большие участки кожи или места их нанесения закрывают окклюзионной повязкой, то могут возникать и системные эффекты, в том числе угнетение гипоталамо-гипофизарно-надпочечниковой системы. | |
=== Транспорт и элиминация === | === Транспорт и элиминация === | ||
| Строка 116: | Строка 116: | ||
== Структурно-функциональная зависимость == | == Структурно-функциональная зависимость == | ||
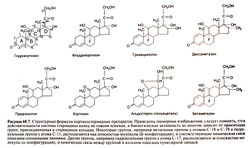
| − | Химические модификации молекулы кортизола позволили получить производные с более избирательной глюкокортикоид-ной или минерапокортикоидной активностью. Многие синтетические | + | Химические модификации молекулы кортизола позволили получить производные с более избирательной глюкокортикоид-ной или минерапокортикоидной активностью. Многие синтетические глюкокортикоиды, даже в максимальных дозах, почти не влияют на водно-электролитный баланс. Кроме того, удалось получить производные с большей активностью и более длительным действием. Сейчас существует множество глюкокортикоидных препаратов для приема внутрь, парентерального и местного применения. Некоторые из них перечислены в табл. 60.4. Поскольку противовоспалительное и метаболическое действие глюкокортикоидов опосредовано одними и теми же рецепторами, не удается создать препараты только с противовоспалительным действием, не влияющие на углеводный, белковый и жировой обмен или лишенные угнетающего влияния на гипоталамо-гипофизарно-надпочечниковую систему. |
'''Препараты кортикостероидов''' | '''Препараты кортикостероидов''' | ||
| Строка 223: | Строка 223: | ||
<p>Местно</p></td></tr> | <p>Местно</p></td></tr> | ||
<tr><td> | <tr><td> | ||
| − | <p>Дексаметазон</p></td><td> | + | <p>[[Дексаметазон]]</p></td><td> |
<p>Внутрь, местно</p></td><td> | <p>Внутрь, местно</p></td><td> | ||
<p>Флунизолид</p></td><td> | <p>Флунизолид</p></td><td> | ||
| Строка 250: | Строка 250: | ||
</table> | </table> | ||
| − | Структура гидрокортизона (кортизола) и некоторых его важнейших производных показана на рис. 60.7.[[Image:Gm60_7.jpg|250px|thumb|right|Рисунок 60.7. Структурные формулы кортикостероидных препаратов]] Химическая модификация может сказаться на специфичности и активности препарата (из-за изменения сродства и прочности связывания с рецепторами), на его всасывании, взаимодействии с белками, скорости метаболических превращений и экскреции, а также на способности проникать через клеточные мембраны. Влияние различных замещений на глюко- и минералокортикоидную активность и продолжительность действия стероидов видно из табл. 60.2. Для проявления как глюко-, так и минералокортико-идной активности необходимы двойная связь между атомами С-4 и С-5, а также кетогруппа в положении 3 кольца А. Глюкокортикоидная (но не минералокортикоидная) активность зависит от I ip-гидроксильной группы в кольце С. Все природные кортикостероиды и большинство их активных синтетических аналогов содержат гидроксильную группу у атома С-21, которая, по-видимому, совершенно необходима для проявления ми-нералокортикоидной (но не | + | Структура гидрокортизона (кортизола) и некоторых его важнейших производных показана на рис. 60.7.[[Image:Gm60_7.jpg|250px|thumb|right|Рисунок 60.7. Структурные формулы кортикостероидных препаратов]] Химическая модификация может сказаться на специфичности и активности препарата (из-за изменения сродства и прочности связывания с рецепторами), на его всасывании, взаимодействии с белками, скорости метаболических превращений и экскреции, а также на способности проникать через клеточные мембраны. Влияние различных замещений на глюко- и минералокортикоидную активность и продолжительность действия стероидов видно из табл. 60.2. Для проявления как глюко-, так и минералокортико-идной активности необходимы двойная связь между атомами С-4 и С-5, а также кетогруппа в положении 3 кольца А. Глюкокортикоидная (но не минералокортикоидная) активность зависит от I ip-гидроксильной группы в кольце С. Все природные кортикостероиды и большинство их активных синтетических аналогов содержат гидроксильную группу у атома С-21, которая, по-видимому, совершенно необходима для проявления ми-нералокортикоидной (но не глюкокортикоидной) активности. В кольце D кортизола и всех используемых в настоящее время синтетических глюкокортикоидов присутствует 17а-гидрокси-льная группа. Лишенные ее стероиды (например, кортикосте-рон) обладают меньшей глюкокортикоидной активностью. |
Дополнительная двойная связь между атомами С-1 и С-2 кольца А (как в молекулах преднизалона или преднизона) избирательно повышает глюкокортикоидную активность (примерно в 4 раза по сравнению с гидрокортизоном). Соединения, имеющие эту двойную связь, метаболизируются медленнее, чем гидрокортизон. | Дополнительная двойная связь между атомами С-1 и С-2 кольца А (как в молекулах преднизалона или преднизона) избирательно повышает глюкокортикоидную активность (примерно в 4 раза по сравнению с гидрокортизоном). Соединения, имеющие эту двойную связь, метаболизируются медленнее, чем гидрокортизон. | ||
| Строка 299: | Строка 299: | ||
</table> | </table> | ||
| − | Замещения в положении 6а кольца В дают не всегда предсказуемый результат. Так, 6а-метилкортизол обладает большей | + | Замещения в положении 6а кольца В дают не всегда предсказуемый результат. Так, 6а-метилкортизол обладает большей глюкокортикоидной и минералокортикоидной активностью, тогда как 6а-метилпреднизолон по сравнению с преднизалоном проявляет несколько большую глюкокортикоидную и меньшую минералокортикоидную активность. Некоторые модификации усиливают местное действие глюкокортикоидов в ущерб системному. Этого можно достичь двумя способами: 1) увеличить липофильность молекулы (например, путем введения ацетонида между гидроксильными группами у атомов С-16 и С-17, этерификации гидроксильной группы у атома С-17 валериановой кислотой, этерификации гидроксильных групп у атомов С-17 и С-21 пропионовой кислотой или замещения гидроксильной группы у атома С-21 хлором) и 2) ускорить инактивацию препаратов после всасывания (например, карбоксилатный или карботионатный эфиры у атома С-21 глюкокортикоидов быстро превращаются в организме в неактивные метаболиты с 21-карбоксильной группой). |
| + | |||
| + | == Читайте также == | ||
| + | |||
| + | *[[Надпочечники]] | ||
| + | *[[Кортикостероиды - побочные эффекты]] | ||
| + | *[[Кортикостероиды - показания к применению]] | ||
| + | *[[Ингибиторы синтеза (блокаторы) кортикостероидов]] | ||
| + | *[[Глюкокортикоиды]] | ||
| + | *[[Глюкокортикоиды (местные и системные препараты)]] | ||
| + | *[[Глюкокортикостероиды и спорт]] | ||
Текущая версия на 15:56, 23 апреля 2015
Источник:
Клиническая фармакология по Гудману и Гилману, том 4.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
- 1 Гормоны коры надпочечников
- 2 Физиологическое и фармакологическое действие
- 3 Фармакокинетика
- 4 Структурно-функциональная зависимость
- 5 Читайте также
Гормоны коры надпочечников[править | править код]
Кора надпочечников синтезирует стероидные гормоны двух классов: кортикостероиды, относящиеся по химической структуре к С21-стероидам, и андрогены, относящиеся к С19-стероидам (рис. 60.3)
. Традиционное деление кортикостероидов на глюкокортикоиды и минералокортикоиды отражает их преобладающее физиологическое действие соответственно на углеводный обмен и водно-электролитный баланс. У человека основной глюкокортикоид — кортизол, а основной минералокортикоид — альдостерон. Величины суточной секреции у человека наиболее важных кортикостероидов — кортизола и альдестерона — и их нормальные сывороточные концентрации указаны в табл. 60.1.
Раньше считали, что в сутки образуется 20 мг кортизола, но, как показали более поздние исследования, эта величина ближе к 10 мг (Esteban et al., 1991).
У женщин кора надпочечников служит также важным источником андрогенов, но при надпочечниковой недостаточности введение одних лишь глюко- и минералокортикоидов увеличивает среднюю продолжительность жизни до нормальной. Иными словами, надпочечниковые андрогены не являются жизненно необходимыми. Однако уровень дегидроэпиандростерона (главного надпочечникового андрогена) изменяется с возрастом, достигая максимума на третьем десятилетии жизни, а затем постепенно снижаясь. Кроме того, при многих хронических заболеваниях концентрация дегидроэпиандростерона в плазме крайне низка. На основании этого было выдвинуто предположение, что прием дегидроэпиандростерона может хотя бы отчасти смягчить симптомы старения. Обсуждалась необходимость применения дегидроэпиандростерона при первичной и вторичной надпочечниковой недостаточности. По данным одного исследования, добавление дегидроэпиандростерона (50 мг внутрь один раз в сутки утром) к стандартной схеме заместительной терапии надпочечниковой недостаточности у женщин улучшает самочувствие и усиливает половое влечение (Arlt et al., 1999).
Физиологическое и фармакологическое действие[править | править код]
Эффекты кортикостероидов многочисленны и разнообразны. Они влияют на углеводный, белковый и липидный обмен, поддерживают водно-электролитный баланс и функции сердечно-сосудистой, иммунной, эндокринной и нервной систем, а также почек и скелетных мышц. Кроме того, каким-то не до конца выясненным путем глюкокортикоиды придают организму способность противостоять стрессу (например, при боли или резких изменениях окружающей среды). Без коры надпочечников выживание возможно лишь в специальных условиях: при достаточном и регулярном питании, потреблении относительно больших количеств поваренной соли и поддержании определенной температуры внешней среды.
До недавнего времени действие глюкокортикоидов разделяли на физиологическое (в нормальных физиологических концентрациях) и фармакологическое (в больших концентрациях). Согласно более поздним представлениям, основное фармакологическое действие глюкокортикоидов, а именно противовоспалительное и иммуносупрессивное, имеет место и в физиологических условиях. Многие медиаторы воспаления снижают сосудистый тонус и могли бы вызывать острую сердечно-сосудистую недостаточность, если бы не встречали противодействия со стороны эндогенных глюкокортикоидов. Эту гипотезу подтверждает резкое (по меньшей мере, десятикратное) возрастание суточной секреции глюкокортикоидов при выраженном стрессе. Кроме того, их фармакологические и многие физиологические эффекты опосредуются, по-видимому, одними и теми же рецепторами (см. ниже), поэтому побочное и лечебное действие различных глюкокортикоидов, назначаемых больному, не разделимы.
Действие кортикостероидов сложным образом связано с действием других гормонов. Например, в отсутствие катехоламинов, обладающих липолитическим действием, кортизол почти не влияет на скорость липолиза в липоцитах. И наоборот, в отсутствие глюкокортикоидов адреналин и норадреналин лишь очень слабо влияют на липолиз. Введение малой дозы глюкокортикоидов резко усиливает липолитическое действие катехоламинов. Это, скорее всего, связано с изменением синтеза белка под влиянием глюкокортикоидов. Такой эффект, облегчающий действие других гормонов, называют пермиссивным.
Кортикостероиды различаются по способности задерживать натрий в организме, влиянию на углеводный обмен (например, на отложение гликогена и глюконеогенез в печени) и противовоспалительному действию. В целом, жизнь животных, подвергнутых адреналэктомии, лучше поддерживают те кортикостероиды, которые активнее задерживают натрий (то есть кортикостероиды с высокой минералокортикоидной активностью). Влияние кортикостероидов на углеводный обмен (глюкокортикоидная активность) пропорционально их противовоспалительной активности. В то же время их минералокортикоидная активность не зависит от глюкокортикоидной и противовоспалительной активности. Как уже говорилось, минералокортикоидная и глюкокортикоидная (как и противовоспалительная) активность опосредованы разными рецепторами. Сравнительная активность глюкокортикоидов приведена в табл. 60.2.
Некоторые глюкокортикоиды (например, кортизол и преднизон) проявляют и существенную минералокортикоидную активность. Однако при первичной надпочечниковой недостаточности заместительная терапия этими препаратами (см. ниже) не компенсирует отсутствия альдостерона, поэтому приходится одновременно вводить более активные минералокортикоиды. Напротив, активный минералокортикоид альдостерон слабо влияет на углеводный обмен. При физиологических концентрациях или в дозах, оказывающих максимальное действие на водноэлектролитный баланс, альдостерон почти не обладает глюкокортикоидной активностью, то есть является чистым минералокортикоидом.
Общие механизмы действия кортикостероидов[править | править код]
Взаимодействуя с внутриклеточными рецепторами, кортикостероиды регулируют экспрессию генов-мишеней и тем самым изменяют количество и спектр синтезируемых белков (рис. 60.5). Так как изменение в синтезе белка требует времени, большинство эффектов кортикостероидов проявляется не сразу, а лишь через несколько часов. Поэтому нельзя ожидать немедленного эффекта от введения глюкокортикоидов. Хотя под действием кортикостероидов экспрессия большинства генов-мишеней усиливается, описано и подавление экспрессии некоторых генов (см. ниже). В отличие от действия, опосредованного изменением экспрессии генов-мишеней, некоторые эффекты кортикостероидов возникают немедленно и связаны с влиянием этих гормонов на мембранные рецепторы (Christ et al., 1999).
Структура кортикостероидных рецепторов была выяснена с помощью молекулярного клонирования. Эти рецепторы принадлежат к суперсемейству белков, опосредующих эффекты ряда небольших гидрофобных молекул, включая стероидные и тиреоидные гормоны, кальцитриол и ретиноиды (Mangelsdorf et al., 1995). Все эти белки содержат два консервативных домена: один из них, состоящий примерно из 70 аминокислотных остатков, имеет два участка связывания цинка (цинковые пальцы) и необходим для взаимодействия рецептора с определенными последовательностями ДНК, а второй, расположенный на С-конце молекулы, связывает гормон.
Глюкокортикоидный рецептор[править | править код]
Как показано на рис. 60.5, глюкокортикоидные рецепторы до взаимодействия с гормоном не активны и расположены преимущественно в цитоплазме. Связывание гормона активирует рецептор и вызывает его перемещение в ядро клетки. Неактивный рецептор находится в комплексе с другими белками, включая белок теплового шока Hsp-90 (один из индуцируемых стрессом белков), белок теплового шока Hsp-70 и иммунофилин с молекулярной массой 56 000 -один из внутриклеточных белков, связывающих иммунодепрессанты циклоспорин и такролимус. Считается, что, взаимодействуя с гормонсвязывающим доменом глюкокортикоидного рецептора, белок теплового шока Hsp-90 способствует приобретению рецептором той конформации, которая необходима для связывания гормона.
Регуляция экспрессии генов глюкокортикоидами[править | править код]
После связывания гормона глюкокортикоидный рецептор освобождается от других белков, образует димер и перемещается в клеточное ядро, где и взаимодействует с определенными последовательностями ДНК на регуляторных участках генов-мишеней. Короткие последовательности ДНК, распознаваемые активированным рецептором, носят название глюкокортикоид-чувствительных регуляторных элементов и обеспечивают специфичность влияния глюкокортикоидов на экспрессию генов. Основу таких элементов составляет устойчивая последовательность, несовершенный палиндром ГГТАЦАХХХТТТЦТ (X — любой нуклеотид), с которым и связывается димер глюкокортикоидного рецептора. Сложные механизмы активирующего влияния рецептора на транскрипцию генов выяснены не полностью, но, по-видимому, включают его взаимодействие с кофакторами и белками, формирующими основу транскрипционного аппарата. Установлены также гены, транскрипция которых подавляется глюкокортикоидами (Webster and Cidlowski, 1999). Один из них — ген проопиомеланокортина, подавление транскрипции которого в кортикотропных клетках гипофиза — существенное звено в регуляции гипоталамо-гипофизарно-надпочечниковой системы. В этом случае глюкокортикоидные рецепторы взаимодействуют с особым глюкокортикоид-чувствительным регуляторным элементом в промоторе гена проопиомеланокортина.
Без глюкокортикоидов и, вероятно, их рецепторов жизнь невозможна, но взаимодействие рецепторов с глюкокортикоид-чувствительными регуляторными элементами ДНК не столь необходимо. Это подтверждается данными о том, что трансгенные мыши, полностью лишенные глюкокортикоидных рецепторов, погибают сразу же после рождения, тогда как мыши, у которых дефекты рецепторов препятствуют их связыванию с ДНК. выживают (Reichardt et al., 1998). Отсюда следует, что важность глюкокортикоидных рецепторов определяется их взаимодействием с другими белковыми факторами транскрипции (Xu et al., 1999). Действительно, обнаружены белок-белковые взаимодействия этих рецепторов с факторами транскрипции NFkB и АР-1, которые регулируют экспрессию многих белков иммунной системы (McKay and Cidlowski, 1999). В результате подавляется экспрессия генов, кодирующих ряд цитокинов (регуляторных молекул, играющих ведущую роль в иммунных и воспалительных реакциях), и таких ферментов, как коллагеназа и стромелизины (предположительно играющих основную роль в деструкции суставов при артрите). Таким образом, противовоспалительная и иммуносупрессивная активность глюкокортикоидов во многом связана с подавлением экспрессии ряда генов.
Регуляция экспрессии генов минералокортикоидами[править | править код]
Минералокортикоидные рецепторы также представляют собой лиганд-чувствительные регуляторы транскрипции, которые связываются с аналогичными (если не теми же) гормон-чувствительными регуляторными элементами ДНК. что и глюкокортикоидные рецепторы. Действие минералокортикоилных рецепторов изучено хуже, чем глюкокортикоидных, но основные принципы, по-видимому, в обоих случаях одинаковы: минералокортикоидные рецепторы также связываются с белком теплового шока Hsp-90 и также активируют транскрипцию определенных генов-мишеней. Различия в ДНК-связывающих доменах глюко-и минералокортикоидных рецепторов, которые могли бы объяснить разницу в активации генов-мишеней, пока не обнаружены. Эти рецепторы различаются по способности подавлять активирующее действие факторов транскрипции АР-1 на экспрессию генов (Pearce and Yamamoto, 1993). Таким образом, причина различного влияния этих рецепторов на клетки может заключаться в их неодинаковом взаимодействии с другими факторами транскрипции. Кроме того, минералокортикоидные рецепторы, в отличие от глюкокортикоидных, имеются лишь в некоторых тканях — в основном в почках (в дистальных извитых канальцах и корковом отделе собирательных трубочек), толстой кишке, слюнных и потовых железах, гиппокампе.
Альдостерон изменяет обмен натрия и калия преимущественно за счет влияния на главные клетки дистальных канальцев и собирательных трубочек, тогда как действие на секрецию Н+ осуществляется в основном через вставочные клетки. Недавние исследования позволили выяснить некоторые механизмы действия альдостерона на транспорт воды и электролитов. Связываясь с минералокортикоидными рецепторами в клетках-мишенях, альдостерон запускает цепь реакций, включающую быструю индукцию киназы, которая регулируется факторами сыворотки и глюкокортикоидами. Эта киназа фосфорилирует и активирует чувствительные к амилориду натриевые каналы в апикальной мембране эпителиальных клеток (Chen et al., 1999). Усиленный вход натрия стимулирует Na+,К+-АТФазу в базолатеральной мембране. Помимо такого быстрого действия альдостерон усиливает и синтез отдельных компонентов этих мембранных белков.
Дальнейшему выяснению роли минералокортикоидных рецепторов и их генов-мишеней в регуляции водно-электролитного баланса способствовало обследование больных с такими редкими генетическими нарушениями, как псевдогипоапьдостеронизм и синдром Лиддла. При псевдогипоальдосгеронизме, несмотря на повышенный уровень минералокортикоидов, наблюдаются симптомы дефицита минералокортикоидов (например, гиповолемия, артериальная гипотония, гиперкалиемия и метаболический ацидоз). Молекулярно-генетические исследования позволили выделить разные группы больных с этим заболеванием. У одних заболевание наследуется аутосомно-рецессивно и обусловлено инактивирующими мутациями генов, кодирующих субъединицы чувствительных к амилориду натриевых каналов эпителиальных клеток. У других имеется аутосомно-доминантная форма псевдогипоальдостеронизма, вызванная инактивирующими мутациями гена минералокортикоидного рецептора (Geller et al., 1998). Синдром Лиддла, наследуемый аутосомно-доминантно, обусловлен активирующими мутациями генов чувствительных к амилориду натриевых каналов (Shimketsetal., 1994). Постоянная активация этих каналов приводит к артериальной гипертонии, гипокалиемии и метаболическому алкалозу, несмотря на низкие уровни ренина и альдостерона в плазме.
Специфичность действия кортикостероидов, не зависящая от рецепторов. Клонирование генов глюкокортикоидного и минера-локортикоидного рецепторов позволило обнаружить, что альдостерон (классический минералокортикоид) и кортизол (преимущественно глюкокортикоид) связываются с минералокортикоидным рецептором с равным сродством. Почему же минералокортикоидный рецептор взаимодействует именно с альдо-стероном, а не с глюкокортикоидами, уровень которых в крови гораздо выше? По крайней мере частичный ответ на этот вопрос дало открытие фермента 1 ip-гидроксистероиддегидрогеназы типа 2, от которого и зависит специфичность действия кортикостероидов, особенно в почках, толстой кишке и слюнных железах. Этот фермент превращает глюкокортикоиды (например, кортизол) в 11-кето-производные (например, кортизон), не взаимодействующие с минералокортикоидными рецепторами, и тем самым препятствует действию глюкокортикоидов в тканях, чувствительных к минералокортикоидам (рис. 60.6). Альдостерон же, находящийся в организме преимущественно в форме полуацеталя, устойчив к действию 1 ф-гидроксистеро-иддегидрогеназы. В отсутствие этого фермента (что характерно для наследственного заболевания — синдрома мнимого избытка минералокортикоидов) находящийся в избытке кортизол действует на минералокортикоидные рецепторы, что приводит к тяжелой гипокалиемии и артериальной гипертонии. Симптомы избытка минералокортикоидов (в частности, артериальная гипертония) возникают также при ингибировании 11 β-гидро-ксистероиддегидрогеназы глициризиновой кислотой, содержащейся в лакрице.
Углеводный и белковый обмен[править | править код]
Глюкокортикоиды оказывают выраженное влияние на углеводный и белковый обмен. Можно считать, что они защищают глюкозозависимые ткани (такие, как головной мозг и сердце) от голодания. В печени глюкокортикоиды стимулируют глюконеогенез и накопление гликогена. В периферических тканях глюкокортикоиды подавляют утилизацию глюкозы, усиливают распад белка и активируют липолиз, что дает аминокислоты и глицерин, используемые для глюконеогенез а. Конечный результат сводится к повышению концентрации глюкозы в крови. Поэтому назначение глюкокортикоидов может усугубить нарушения углеводного обмена у больных сахарным диабетом и вызвать гипергликемию у лиц с предрасположенностью к этому заболеванию.
Механизм подавляющего действия глюкокортикоидов на утилизацию глюкозы периферическими тканями не совсем понятен. глюкокортикоиды снижают поглощение глюкозы жировой тканью, кожей, фибробластами, тимоцитами и нейтрофилами. Считается, что это связано с перемещением переносчиков глюкозы из клеточной мембраны внутрь клеток. Уменьшение поглощения глюкозы периферическими тканями сопровождается усилением катаболизма, что приводит к атрофии лимфоидной ткани, снижению мышечной массы, отрицательному азотистому балансу и истончению кожи.
Механизмы стимулирующего действия глюкокортикоидов на глюконеогенез также не совсем ясны. Аминокислоты, выделяемые рядом тканей под влиянием глюкокортикоидов, поступают в печень, где используются для глюконеогенеза и образования гликогена. В печени глюкокортикоиды усиливают синтез многих ферментов глюконеогенеза и метаболизма аминокислот, включая фосфоенолпируваткарбоксикиназу, глюкозо-6-фосфа-тазу и фруктозо-2,6-дифосфатазу. В регуляции экспрессии гена фосфоенолпируваткарбоксикиназы принимают участие не только глюкокортикоиды, но и инсулин, глюкагон и катехоламины. Влияние всех этих гормонов на экспрессию гена фосфоенолпируваткарбоксикиназы отражает сложность регуляции глюконеогенеза в организме.
Липидный обмен[править | править код]
Точно установлены два эффекта глюкокортикоидов на липидный обмен. Один из них — резкое перераспределение жира, наблюдающееся при гиперкортизолемии, характерной для синдрома Кушинга. Другой — усиление липолитического действия других факторов, например СТГ и β-адреностимуляторов, на липоциты (пермиссивное действие), что приводит к повышению уровня свободных жирных кислот. Перераспределение жира проявляется увеличением жировых отложений на шее (жировой горбик), лице (лунообразное лицо) и в надключичной области одновременно с потерей жира в конечностях.
Согласно одной из гипотез, липоциты туловища и конечностей различаются по чувствительности к инсулину и пермис-сивному действию глюкокортикоидов. Липоциты туловища особенно чувствительны к гиперинсулинемии, которая возникает в ответ на вызываемую глюкокортикоидами гипергликемию, тогда как липоциты конечностей менее чувствительны к инсулину, и в них под действием глюкокортикоидов и других гормонов усиливается липолиз.
Водно-электролитный баланс[править | править код]
По минералокортикоидной активности альдостерон намного превосходит все (остальные природные кортикостероиды. На это указывает сохранение водно-электролитного баланса у подвергнутых гипофизэктомии животных, у которых надпочечники не секретируют глюкокортикоиды. Минерало-кортикоиды усиливают реабсорбцию натрия, действуя на клетки дистальных канальцев и собирательных трубочек почек, и увеличивают экскрецию калия и Н+ с мочой. Можно считать, что альдостерон стимулирует обмен между ионами Na+ и К+ (или Н+), хотя молекулярный механизм перемещения этих ионов в почечных канальцах отличается от простого обмена одного катиона на другой.
Это действие на транспорт электролитов в почках и в других тканях (толстой кишке, слюнных и потовых железах) определяет физиологические и фармакологические эффекты минералокортикоидов. Поэтому для гипераль-достеронизма характерны задержка натрия, сопровождающаяся увеличением объема внеклеточной жидкости, нормальная или слегка повышенная концентрация натрия в плазме, гипокалиемия и алкалоз. Напротив, дефицит альдостерона сопровождается потерей натрия и уменьшением объема внеклеточной жидкости на фоне гипо-натриемии, гиперкалиемии и ацидоза. При хроническом гиперальдостеронизме наблюдается артериальная гипертония, тогда как дефицит альдостерона обусловливает артериальную гипотонию и может приводить к острой сердечно-сосудистой недостаточности. Из-за выпадения влияния минералокортикоидов на обмен электролитов в потовых железах больные с надпочечниковой недостаточностью в жару особенно предрасположены к потере натрия и воды с потом.
глюкокортикоиды также влияют на водно-электролитный баланс. Они необходимы для поддержания СКФ и функции почечных канальцев. глюкокортикоиды увеличивают почечную экскрецию воды; когда-то пробу с водной нагрузкой использовали для выявления надпочечниковой недостаточности. Задержка воды при первичной надпочечниковой недостаточности отчасти связана с повышенной секрецией АДГ, который стимулирует реабсорбцию воды в почках.
Помимо действия на транспорт одновалентных катионов и воды глюкокортикоиды влияют и на обмен кальция. Они каким-то образом препятствуют всасыванию кальция в кишечнике, одновременно усиливая его экскрецию почками. Сочетание этих эффектов приводит к снижению содержания кальция в организме. Сердечно-сосудистая система. Как уже отмечалось, действие кортикостероидов на сердечно-сосудистую систему связано прежде всего с изменением почечной экскреции натрия под влиянием минералокортикоидов. Это действие особенно ярко проявляется при первичном гиперальдостеронизме. Развивающаяся при этом расстройстве артериальная гипертония ведет к дальнейшему поражению сердечно-сосудистой системы, способствуя развитию атеросклероза, инсультов и гипертрофической кар-диомиопатии. Механизм артериальной гипертонии остается не совсем ясным, но низкосолевая диета может значительно снижать АД.
глюкокортикоиды повышают также чувствительность сосудов к другим вазоактивным веществам. При надпочечниковой недостаточности снижается реакция на нор-адреналин и ангиотензин 11. Это отчасти объясняют экспериментальные исследования, в которых показано, что глюкокортикоиды увеличивают число адренорецепторов в сосудистой стенке. Если надпочечниковая недостаточность обычно сопровождается артериальной гипотонией, то у больных с повышенной секрецией глюкокортикоидов (как при гипофизарном синдроме Кушинга) или у получающих синтетические глюкокортикоиды (даже почти лишенные минералокортикоидной активности) наблюдается артериальная гипертония.
Механизмы развития артериальной гипертонии под влиянием глюкокортикоидов не известны. Не ясно, в частности, связано ли повышение АД при синдроме Кушинга со стимуляцией глюкокортикоидных или минералокортикоидных рецепторов. При артериальной гипертонии на фоне избытка глюкокортикоидов низкосолевая диета обычно неэффективна (в отличие от артериальной гипертонии при гиперальдостеронизме).
Обнаружено и прямое действие альдостерона на сердце и сосуды. У крыс, которым вводили альдостерон, наблюдалась не только артериальная гипертония, но и кардиосклероз (Funderet al., 1997). Предполагается, что последний обусловлен не повышением АД, а прямым действием альдостерона на сердце, так как спиронолактон (блокатор минералокортикоидных рецепторов) предотвращал развитие кардиосклероза, не влияя на АД. Это объясняет (по крайней мере, частично) эффективность спи-ронолактона при сердечной недостаточности (Pitt et al., 1999). Скелетные мышцы. Пермиссивное действие кортикостероидов необходимо для нормальной работы скелетных мышц; снижение работоспособности — одно из основных проявлений надпочечниковой недостаточности. Первичная надпочечниковая недостаточность часто сопровождается мышечной слабостью и утомляемостью, которые, как считают, вызваны нарушением кровообращения. Однако работа мышц страдает и при избытке глюко-и минералокортикоидов. Мышечная слабость при первичном гиперальдостеронизме связана в основном с ги-покалиемией, а не с прямым влиянием минералокортикоидов на скелетные мышцы. В основе же атрофии скелетных мышц при хроническом избытке глюкокортикоидов (будь то вследствие глюкокортикоидной терапии или эндогенной гиперкортизолемии) лежат неизвестные механизмы. Этот эффект, получивший название стероидной миопатии, отчасти объясняет слабость и утомляемость, характерные для синдрома Кушинга (см. ниже). ЦНС. Многие влияния кортикостероидов на ЦНС опосредованы действием этих гормонов на АД, а также на уровень глюкозы и электролитов в плазме. Изучение распределения и функции рецепторов стероидных гормонов в головном мозге способствовало выявлению и прямого действия кортикостероидов в ЦНС, проявляющегося изменениями настроения, поведения и возбудимости головного мозга.
При первичной надпочечниковой недостаточности иногда наблюдаются различные изменения психики, в том числе апатия, депрессия и раздражительность, порой развивается явный психоз. Заместительная глюкокортикоидная терапия приводит к исчезновению этих симптомов. Существенное клиническое значение имеют и реакции ЦНС на введение глюкокортикоидов. У большинства больных при этом улучшается настроение, что дает ощущение благополучия, несмотря на продолжающуюся болезнь. Иногда возникают более глубокие изменения поведения, включая эйфорию, бессонницу, беспокойство и психомоторное возбуждение. У меньшего, но все же значительного числа больных, получающих глюкокортикоиды, развиваются тревожное состояние, депрессия или даже явный психоз. При синдроме Кушинга неврозы и психозы довольно часты. После отмены глюкокортикоидов или излечения синдрома Кушинга эти нарушения обычно исчезают.
Механизмы влияния кортикостероидов на активность нейронов не известны, но важно подчеркнуть, что возбудимость нейронов может зависеть от местной продукции стероидов (называемых нейростероидами) в головном мозге (Baulieu, 1998). У грызунов глюкокортикоиды повреждают нейроны гиппокампа, приводя к ухудшению памяти (Lupien and McEwan, 1997). У человека также обнаружена связь между высоким базальным уровнем кортизола и атрофией гиппокампа с ухудшением памяти (Lupien et al., 1998). Если эти результаты удастся подтвердить, они будут иметь важное значение для профилактики возрастного ослабления памяти и оправдают применение средств, уменьшающих влияние глюкокортикоидов на нейроны гиппокампа при старении.
Кроветворение[править | править код]
Судя по тому, что при синдроме Кушинга часто наблюдается эритроцитоз, а при первичной надпочечниковой недостаточности — нормоцитарная нормо-хромная анемия, глюкокортикоиды как-то влияют на содержание гемоглобина и эритроцитов в крови. Более четко эффекты глюкокортикоидов проявляются при аутоиммунной гемолитической анемии, когда их иммуносу-прессивное действие ослабляет процесс разрушения эритроцитов.
глюкокортикоиды влияют и на лейкоциты. При первичной надпочечниковой недостаточности, как отмечал еще Аддисон, наблюдается увеличение массы лимфоидной ткани и числа лимфоцитов в крови. Напротив, для синдрома Кушинга характерны лимфопения и уменьшение массы лимфоидной ткани. Введение глюкокортикоидов приводит к снижению общего числа лимфоцитов, эозинофилов, моноцитов и базофилов. После однократного введения гидрокортизона снижение числа этих клеток в крови происходит через 4—6 ч и сохраняется в течение суток. Этот эффект связан в основном с перераспределением клеток, а не с их разрушением. Число же нейтрофилов под влиянием глюкокортикоидов возрастает: ускоряется их выход из костного мозга, замедляется исчезновение из крови и уменьшается краевое стояние. глюкокортикоиды эффективны при некоторых лимфомах, что может быть связано со способностью этих гормонов индуцировать апоптоз клеток лимфоидного ряда.
Противовоспалительное и иммуносупрессивное действие[править | править код]
глюкокортикоиды изменяют не только число, но и активность лимфоцитов. Это одна из важнейших сторон противовоспалительного и иммуносупрессивного действия глюкокортикоидов. Они предотвращают или подавляют воспалительную реакцию, развивающуюся в ответ на механические, химические, инфекционные воздействия, на введение антигенов и на облучение. Хотя причина болезни при этом не устраняется, подавление воспалительной реакции имеет огромное клиническое значение; именно поэтому глюкокортикоиды относятся к числу наиболее часто назначаемых средств. Им принадлежит неоценимая роль в лечении и тех заболеваний, в основе которых лежат нежелательные иммунные реакции, будь то гуморальные (например, крапивница, гл. 65) или клеточные (например, отторжение трансплантата, гл. 53). Иммуносупрессивный и противовоспалительный эффекты глюкокортикоидов трудно разделить, вероятно потому, что оба они связаны с подавлением функции лейкоцитов (Chrousos, 1995).
В основе противовоспалительного действия глюкокортикоидов лежат различные механизмы. Эти вещества подавляют продукцию различных факторов, участвующих в развитии воспаления. Уменьшается выделение вазоактивных веществ и хемоат-трактантов, секреция липаз и протеаз, перемещение лейкоцитов из сосудов в очаги повреждения и, наконец, фиброз. Все это значительно подавляет воспаление. Некоторые клетки и факторы, на которые действуют глюкокортикоиды, перечислены в табл. 60.3.
Влияние стресса на иммунитет, равно как и участие в этом гипоталамо-гипофизарно-надпочечниковой системы, надежно установлено (Sapolsky et al., 2000). Отсюда понятно, что глюко-кортикоиды являются важнейшими физиологическими регуляторами иммунной системы, защищающими организм от опасных последствий неконтролируемого воспаления.
Такие воздействия, как травмы, инфекции и болезни, сопровождаются усилением продукции цитокинов — сигнальных молекул, обеспечивающих взаимодействие моноцитов, макрофагов, Т- и В-лимфоцитов в иммунном ответе. К цитокинам относятся ИЛ-1, ИЛ-6 и ФНОа, которые стимулируют гипотала-мо-гипофизарно-надпочечниковую систему. Наиболее широким спектром действия обладает ИЛ-1. Он стимулирует выделение кортиколиберина гипоталамическими нейронами, непосредственно усиливает секрецию АКТГ гипофизом и может повышать продукцию глюкокортикоидов надпочечниками (Turnbull and Rivier, 1999). Как отмечалось выше, глюкокортикоиды, в свою очередь, подавляют иммунную систему, препятствуя секреции цитокинов, в том числе интерферона у, ГМ-КСФ, интерлейкинов (ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-8, ИЛ-12) и ФНОа. Таким образом, гипоталамо-гипофизарно-надпочечниковая и иммунная системы при стрессе взаимодействуют, что, по-видимому, играет важную физиологическую роль.
Хотя глюкокортикоиды традиционно считаются иммунодепрессантами, ряд данных свидетельствует, что, угнетая клеточный иммунитет, они усиливают выработку антител, то есть стимулируют гуморальный иммунитет (Elenkov and Chrousos, 1999). Механизмы такого действия глюкокортикоидов не ясны; возможно, глюкокортикоиды подавляют активность Т-хелперов типа 1, но активируют Т-хелперы типа 2 (гл. 53).
Фармакокинетика[править | править код]
Всасывание[править | править код]
Гидрокортизон и его многочисленные аналоги, в том числе синтетические, эффективны при приеме внутрь. Некоторые водорастворимые эфиры гидрокортизона и сходные соединения вводят в/в, что приводит к быстрому возрастанию их концентрации во внеклеточной жидкости. Более длительные эффекты обеспечивает в/м введение суспензий гидрокортизона, его аналогов и эфиров. Небольшие изменения химической структуры могут заметно сказаться на скорости всасывания, быстроте и продолжительности действия препарата.
глюкокортикоиды поступают в кровь даже при местном их применении (введении в суставы, конъюнктивальный мешок, нанесении на кожу и вдыхании). Если препараты применяются длительно, наносятся на большие участки кожи или места их нанесения закрывают окклюзионной повязкой, то могут возникать и системные эффекты, в том числе угнетение гипоталамо-гипофизарно-надпочечниковой системы.
Транспорт и элиминация[править | править код]
В норме более 90% гидрокортизона, попавшего в кровь, обратимо связывается с белками плазмы. Лишь свободный препарат проникает в клетки и оказывает действие. Кортикостероиды связываются в основном с двумя белками — транскортином и альбумином. Секретируемый печенью транскортин представляет собой а,-глобулин, обладающий высоким сродством к стероидам, но относительно малой емкостью. Альбумин также продуцируемый печенью, обладает малым сродством, но высокой емкостью. При нормальных или низких концентрациях кортикостероидов большая их часть связана с белками. Однако с ростом концентрации участки связывания насыщаются, и концентрация свободных кортикостероидов значительно увеличивается. Кортикостероиды конкурируют друг с другом за участки связывания на транскортине, сродство которого к кортизолу и большинству его синтетических производных выше, чем к альдостерону и метаболитам стероидов, конъюгированным с глюкуроновой кислотой. Поэтому у последней группы соединений свободная фракция выше.
Таблица 60.3. Влияние глюкокортикоидов на различные факторы, участвующие в воспалении и иммунных реакциях
При беременности или приеме эстрогенов сывороточная концентрация транскортина, а также общего и свободного кортизола многократно возрастает. Физиологическое значение этих сдвигов остается неясным.
Все биологически активные кортикостероиды и их синтетические аналоги содержат двойную связь мелщу атомами С-4 и С-5 и кетогруппу в положении 3. Метаболизм стероидных гормонов, как правило, протекает путем последовательного присоединения к их молекулам атомов кислорода или водорода и затем конъюгирования с образованием водорастворимых производных. Восстановление двойной связи между атомами С-4 и С-5, приводящее к потере гормональной активности, происходит как в печени, так и вне ее, но последующее восстановление кетогруппы в положении 3 до гидроксильной группы с образованием тетрагидрокортизола — только в печени. В ферментативных реакциях, протекающих в печени и в меньшей степени — в почках, гидроксильная группа большинства таких восстановленных стероидов взаимодействует с глюкуроновой кислотой или сульфатом. Образующиеся водорастворимые конъюгаты (сульфаты и глюкурониды) — основные формы стероидов, экскрети-руемые с мочой. У человека экскреция стероидов с желчью и калом весьма незначительна.
Синтетические стероиды с кетогруппой в положении II (такие, как кортизон и преднизон) приобретают биологическую активность только после ферментативного восстановления в соответствующие 11 p-гидроксип роизводные. Эту реакцию катализирует в печени 11 β-гидроксистероидцегидро-геназа типа 1. При недостаточности этого фермента (например, при тяжелой печеночной недостаточности или в редких случаях наследственного отсутствия фермента) следует использовать стероиды, не требующие ферментативной активации, то есть гидрокортизон и преднизолон вместо кортизона или преднизона.
Структурно-функциональная зависимость[править | править код]
Химические модификации молекулы кортизола позволили получить производные с более избирательной глюкокортикоид-ной или минерапокортикоидной активностью. Многие синтетические глюкокортикоиды, даже в максимальных дозах, почти не влияют на водно-электролитный баланс. Кроме того, удалось получить производные с большей активностью и более длительным действием. Сейчас существует множество глюкокортикоидных препаратов для приема внутрь, парентерального и местного применения. Некоторые из них перечислены в табл. 60.4. Поскольку противовоспалительное и метаболическое действие глюкокортикоидов опосредовано одними и теми же рецепторами, не удается создать препараты только с противовоспалительным действием, не влияющие на углеводный, белковый и жировой обмен или лишенные угнетающего влияния на гипоталамо-гипофизарно-надпочечниковую систему.
Препараты кортикостероидов
|
Препарат |
Пути введения |
Препарат |
Пути введения |
|
Алклометазон |
Местно |
Дифлоразон |
Местно |
|
Амцинонид |
Местно |
Клобетазол |
Местно |
|
Беклометазон |
Ингаляционно |
Клокортолон |
Местно |
|
Бетаметазон |
Внутрь |
Кортизон |
Внутрь, парентерально |
|
Бетаметазона валерат |
Местно |
Медризон |
В глаза |
|
Бетаметазона дипропионат |
Местно |
Метилпреднизолон |
Внутрь |
|
Бетаметазона натрия фосфат |
Парентерально |
Метилпреднизолона ацетат |
Местно, парентерально |
|
Бетаметазона натрия фосфат и ацетат |
Парентерально |
Метилпреднизолона натрия сукцинат |
Парентерально |
|
Будесонид |
Ингаляционно |
Мометазон |
Местно |
|
Галцинонид |
Местно |
Преднизолон |
Внутрь |
|
Гидрокортизон |
Местно, в виде ушных капель, в клизмах, внутрь, парентерально |
Преднизолона ацетат |
В глаза, парентерально |
|
Преднизолона натрия фосфат |
Внутрь, в глаза, парентерально | ||
|
Гидрокортизона ацетат |
Местно, в виде свечей, в виде ректальной пены, парентерально |
Преднизолона тебутат Преднизон |
Парентерально Внутрь |
|
Гидрокортизона бутират |
Местно |
Триамцинолон |
Внутрь |
|
Гидрокортизона валерат |
Местно |
Триамцинолона ацетонид |
Местно, ингаляционно, парентерально |
|
Гидрокортизона натрия сукцинат |
Парентерально |
Триамцинолона гексацетонид |
Парентерально |
|
Гидрокортизона натрия фосфат |
Парентерально |
Триамцинолона диацетат |
Внутрь, парентерально |
|
Гидрокортизона ципионат |
Внутрь |
Флудрокортизон |
Внутрь |
|
Дезоксиметазон |
Местно |
Флудроксикортид |
Местно |
|
Внутрь, местно |
Флунизолид |
Ингаляционно | |
|
Дексаметазона ацетат |
Парентерально |
Флуорометолон |
В глаза |
|
Дексаметазона натрия фосфат |
Местно, в глаза, в виде ушных капель, парентерально |
Флуорометолона ацетат |
В глаза |
|
Флуоцинолон |
Местно | ||
|
Десонид |
Местно |
Флуоцинонид |
Местно |
|
Флудрокортизон применяется в качестве минералокортикоида. Средства для местного применения наносятся на кожу или слизистые в вше кремов, растворов, мазей, гелей, паст (при поражении полости рта) и аэрозолей; к офтальмологическим средствам относятся растворы, суспензии и мази; ингаляционное применение подразумевает вдыхание распыленного препарата через нос или рот. | |||
Структура гидрокортизона (кортизола) и некоторых его важнейших производных показана на рис. 60.7.
Химическая модификация может сказаться на специфичности и активности препарата (из-за изменения сродства и прочности связывания с рецепторами), на его всасывании, взаимодействии с белками, скорости метаболических превращений и экскреции, а также на способности проникать через клеточные мембраны. Влияние различных замещений на глюко- и минералокортикоидную активность и продолжительность действия стероидов видно из табл. 60.2. Для проявления как глюко-, так и минералокортико-идной активности необходимы двойная связь между атомами С-4 и С-5, а также кетогруппа в положении 3 кольца А. Глюкокортикоидная (но не минералокортикоидная) активность зависит от I ip-гидроксильной группы в кольце С. Все природные кортикостероиды и большинство их активных синтетических аналогов содержат гидроксильную группу у атома С-21, которая, по-видимому, совершенно необходима для проявления ми-нералокортикоидной (но не глюкокортикоидной) активности. В кольце D кортизола и всех используемых в настоящее время синтетических глюкокортикоидов присутствует 17а-гидрокси-льная группа. Лишенные ее стероиды (например, кортикосте-рон) обладают меньшей глюкокортикоидной активностью.
Дополнительная двойная связь между атомами С-1 и С-2 кольца А (как в молекулах преднизалона или преднизона) избирательно повышает глюкокортикоидную активность (примерно в 4 раза по сравнению с гидрокортизоном). Соединения, имеющие эту двойную связь, метаболизируются медленнее, чем гидрокортизон.
Фторирование (в положении 9а) кольца В усиливает как глюко-, так и минералокортикоидную активность, что связано, вероятно, со смещением электронной плотности от близко расположенной 1 ф-гидроксильной группы. Флудрокортизон (9а-фторкортизол) действует на глюкокортикоидные рецепторы в 10 раз, а на минералокортикоидные рецепторы — в 125 раз активнее кортизола. Его применяют для заместительной минера-локортикоидной терапии (см. ниже). При приеме в дозах 0,05— 0,2 мг/сут флудрокортизон не оказывает заметного глюкокортикоидного действия. При наличии двойной связи между атомами С-1 и С-2 кольца А и дополнительных радикалов у атома С-16 кольца D (рис. 60.7) 9а-фторпроизводные (например, триамцино-лон, дексаметазон, бетаметазон) обладают выраженной глюкокортикоидной активностью, причем замещения у атома С-16 почти лишают препарат минерапокортикоидной активности.
|
Клетки |
Вещества |
Примечания |
|
Макрофаги и моноциты |
Арахидоновая кислота и ее производные (простагландины и лейкотриены) |
Подавление секреции, отчасти за счет индукции белка (липокортина), ингибирующего фосфолипазу А, |
|
Цитокины, включая ИЛ-1, ИЛ-6 и ФНОа |
Подавление синтеза и секреции. Цитокины влияют на многие звенья воспаления (например, активируют Т-лимфоциты, стимулируют пролиферацию фибробластов) | |
|
Белки острой фазы воспаления |
Включая компонент комплемента СЗ | |
|
Эндотелиальные клетки |
Молекулы адгезии ELAM-I и ICAM-1 |
ELAM-1 и ICAM-1 необходимы для удержания лейкоцитов в очаге воспаления. |
|
Белки острой фазы воспаления |
То же, что для макрофагов и моноцитов | |
|
Цитокины |
То же, что для макрофагов и моноцитов | |
|
Производные арахидоновой кислоты |
То же, что для макрофагов и моноцитов | |
|
Базофилы |
Гистамин, лейкотриен С4 |
Подавление IgE-зависимой секреции |
|
Фибробласты |
Производные арахидоновой кислоты |
То же, что для макрофагов и моноцитов. Глюкокортикоиды подавляют также синтез ДНК и пролиферацию фибробластов, индуцируемые факторами роста |
|
Тимфоциты |
Цитокины (ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-6, ФНОа, ГМ-КСФ, интерферон у) |
То же, что для макрофагов и моноцитов |
Замещения в положении 6а кольца В дают не всегда предсказуемый результат. Так, 6а-метилкортизол обладает большей глюкокортикоидной и минералокортикоидной активностью, тогда как 6а-метилпреднизолон по сравнению с преднизалоном проявляет несколько большую глюкокортикоидную и меньшую минералокортикоидную активность. Некоторые модификации усиливают местное действие глюкокортикоидов в ущерб системному. Этого можно достичь двумя способами: 1) увеличить липофильность молекулы (например, путем введения ацетонида между гидроксильными группами у атомов С-16 и С-17, этерификации гидроксильной группы у атома С-17 валериановой кислотой, этерификации гидроксильных групп у атомов С-17 и С-21 пропионовой кислотой или замещения гидроксильной группы у атома С-21 хлором) и 2) ускорить инактивацию препаратов после всасывания (например, карбоксилатный или карботионатный эфиры у атома С-21 глюкокортикоидов быстро превращаются в организме в неактивные метаболиты с 21-карбоксильной группой).