Инсектициды — различия между версиями
Zabava (обсуждение | вклад) (→Хлорзамещенные циклодиены) |
Dormiz (обсуждение | вклад) (→Читайте также) |
||
| (не показаны 3 промежуточные версии 1 участника) | |||
| Строка 14: | Строка 14: | ||
=== ДДТ === | === ДДТ === | ||
| − | ДДТ, называемый также хлорфенотаном, известен более других хлорзамещенных производных этана. До введения во многих странах ограничений на применение ДДТ он был самым популярным, дешевым и эффективным синтетическим инсектицидом. Его широкое использование началось с середины 1940-х гг. | + | ДДТ, называемый также хлорфенотаном, известен более других хлорзамещенных производных этана. До введения во многих странах ограничений на применение ДДТ он был самым популярным, дешевым и эффективным синтетическим инсектицидом. Его широкое использование началось с середины 1940-х гг.[[Image:Gm1450.jpg|250px|thumb|right|Структурная формула ДДТ (хлорфенотана)]] |
ДДТ хорошо растворяется в жирах и почти не растворяется в воде. В виде сухого порошка или водной суспензии ДДТ всасывается медленно, а в виде масляного раствора, раствора в жире или органическом растворителе — очень быстро. В организме ДДТ накапливается в жировой ткани, что играет защитную роль, так как в результате уменьшается его токсическое действие на головной мозг. ДДТ проникает через плаценту, и его концентрация в пуповинной крови такая же, как в материнской (Saxenaetal., 1981). | ДДТ хорошо растворяется в жирах и почти не растворяется в воде. В виде сухого порошка или водной суспензии ДДТ всасывается медленно, а в виде масляного раствора, раствора в жире или органическом растворителе — очень быстро. В организме ДДТ накапливается в жировой ткани, что играет защитную роль, так как в результате уменьшается его токсическое действие на головной мозг. ДДТ проникает через плаценту, и его концентрация в пуповинной крови такая же, как в материнской (Saxenaetal., 1981). | ||
| Строка 54: | Строка 54: | ||
Гексахлорциклогексан представляет собой смесь восьми стереоизомеров. Гамма-изомер, получивший название линдан, обладает наибольшей токсичностью и обеспечивает почти всю инсектицидную активность гексахлорциклогексана. Линдан применяют как средство против эктопаразитов (см. ниже). Отравление им во многом напоминает отравление Д ДТ и проявляется тремором, атаксией, судорогами и слабостью. При тяжелом остром отравлении тонические и клонические судороги бывают выражены особенно сильно. В то время как а- и у-изомеры гексахлорциклогексана стимулируют ЦНС, 0- и 8-изомеры угнетают ее. Стимулирующее действие на ЦНС обусловлено, по-видимому, подавлением ГАМКергаческой передачи (Matsumura, Ghiasuddin, 1979). Линдан индуцирует микросомальные ферменты печени. Считается, что линдан и другие изомеры гексахлорциклогексана вызывают апластическую анемию (Rugman and Cosstick, 1990). Однако анализ 60 случаев апластической анемии не выявил связи между развитием заболевания и наличием профессионального контакта с этими пестицидами (Wang and Grufferman, 1981). Некоторые изомеры гексахлорциклогексана, включая линдан, вызывают печеночноклеточный рак у грызунов (Cueto, 1980). | Гексахлорциклогексан представляет собой смесь восьми стереоизомеров. Гамма-изомер, получивший название линдан, обладает наибольшей токсичностью и обеспечивает почти всю инсектицидную активность гексахлорциклогексана. Линдан применяют как средство против эктопаразитов (см. ниже). Отравление им во многом напоминает отравление Д ДТ и проявляется тремором, атаксией, судорогами и слабостью. При тяжелом остром отравлении тонические и клонические судороги бывают выражены особенно сильно. В то время как а- и у-изомеры гексахлорциклогексана стимулируют ЦНС, 0- и 8-изомеры угнетают ее. Стимулирующее действие на ЦНС обусловлено, по-видимому, подавлением ГАМКергаческой передачи (Matsumura, Ghiasuddin, 1979). Линдан индуцирует микросомальные ферменты печени. Считается, что линдан и другие изомеры гексахлорциклогексана вызывают апластическую анемию (Rugman and Cosstick, 1990). Однако анализ 60 случаев апластической анемии не выявил связи между развитием заболевания и наличием профессионального контакта с этими пестицидами (Wang and Grufferman, 1981). Некоторые изомеры гексахлорциклогексана, включая линдан, вызывают печеночноклеточный рак у грызунов (Cueto, 1980). | ||
| − | Гексахлорциклогексан метаболизируется с образованием хлорфенолов. По сравнению с ДДТ он относительно недолго сохраняется в окружающей среде. | + | Гексахлорциклогексан метаболизируется с образованием хлорфенолов. По сравнению с ДДТ он относительно недолго сохраняется в окружающей среде.[[Image:Gm1451.jpg|250px|thumb|right|Структурная формула гексахлорциклогексан ]] |
| − | Токсафен — это смесь более чем 175 полихлорзамещенных углеводородов С1(), из которых известны только 20, например гептахлорборнан (Saleh, 1991). Токсичность токсафена, как и других хлорзамещенных углеводородов, проявляется в основном стимуляцией ЦНС. Метаболизируется токсафен довольно быстро, поэтому его Т1/2 короче, чем у большинства других хлорзамещенных углеводородов. У мышей токсафен вызывает опухоли печени и обладает мутагенным действием (Hooper et al., 1979). На основе этих данных применение токсафена было значительно сокращено. | + | Токсафен — это смесь более чем 175 полихлорзамещенных углеводородов С1(), из которых известны только 20, например гептахлорборнан (Saleh, 1991). Токсичность токсафена, как и других хлорзамещенных углеводородов, проявляется в основном стимуляцией ЦНС. Метаболизируется токсафен довольно быстро, поэтому его Т1/2 короче, чем у большинства других хлорзамещенных углеводородов. У мышей токсафен вызывает опухоли печени и обладает мутагенным действием (Hooper et al., 1979). На основе этих данных применение токсафена было значительно сокращено.[[Image:Gm1451_1.jpg|250px|thumb|right|Структурные формулы мирекса и кепона]] |
Мирекс и кепон сохраняются в окружающей среде очень долго. Для них характерно биоконцентрирование, увеличивающее их содержание в организме в тысячи раз (Waters et al., 1977). Структурные формулы этих соединений следующие: | Мирекс и кепон сохраняются в окружающей среде очень долго. Для них характерно биоконцентрирование, увеличивающее их содержание в организме в тысячи раз (Waters et al., 1977). Структурные формулы этих соединений следующие: | ||
| Строка 70: | Строка 70: | ||
=== Инсектициды растительного происхождения === | === Инсектициды растительного происхождения === | ||
| − | К ним относятся, в частности, пиретрины, выпускаемые в виде неочищенного экстракта из цветков ромашки Chrysanthemum (Руrethrum) cinerariaefolium и частично очищенного препарата, представляющего собой смесь шести пиретринов, среди которых самым сильным инсектицидом является пиретрин I. Структурная формула последнего следующая: | + | К ним относятся, в частности, пиретрины, выпускаемые в виде неочищенного экстракта из цветков ромашки Chrysanthemum (Руrethrum) cinerariaefolium и частично очищенного препарата, представляющего собой смесь шести пиретринов, среди которых самым сильным инсектицидом является пиретрин I. Структурная формула последнего следующая:[[Image:Gm1452.jpg|250px|thumb|right|Структурная формула пиретрина I ]] |
Пиретроиды (синтетические производные пиретринов) и пиретрины благодаря своему быстродействию входят в состав многих бытовых инсектицидов. Механизм их действия заключается в удлинении и увеличении следовой деполяризации мембран нейронов (за счет поддержания натриевых каналов в открытом состоянии и длительного поступления натрия в клетки), которая, достигая порогового значения мембранного потенциала, приводит к возникновению повторных спонтанных потенциалов действия (Narahashietal., 1998). В связи с видовыми особенностями строения натриевых каналов эти инсектициды гораздо более токсичны для насекомых, чем для млекопитающих. Низкая токсичность пиретринов и пиретроидов делает их самыми безопасными инсектицидами. Это обусловлено также их быстрым метаболизмом путем гидролиза эфирных связей и гидроксилирования (Aldridge, 1983). У насекомых пиретрины и пиретроиды метаболизируются медленно. При этом пиперонила бутоксид (ингибитор микросомальных ферментов печени), входящий вместе с пиретринами в состав комбинированного препарата, еще больше подавляет их метаболизм и повышает эффективность. Высокой чувствительностью к токсическому действию этих инсектицидов обладают также рыбы (Khan, 1983). | Пиретроиды (синтетические производные пиретринов) и пиретрины благодаря своему быстродействию входят в состав многих бытовых инсектицидов. Механизм их действия заключается в удлинении и увеличении следовой деполяризации мембран нейронов (за счет поддержания натриевых каналов в открытом состоянии и длительного поступления натрия в клетки), которая, достигая порогового значения мембранного потенциала, приводит к возникновению повторных спонтанных потенциалов действия (Narahashietal., 1998). В связи с видовыми особенностями строения натриевых каналов эти инсектициды гораздо более токсичны для насекомых, чем для млекопитающих. Низкая токсичность пиретринов и пиретроидов делает их самыми безопасными инсектицидами. Это обусловлено также их быстрым метаболизмом путем гидролиза эфирных связей и гидроксилирования (Aldridge, 1983). У насекомых пиретрины и пиретроиды метаболизируются медленно. При этом пиперонила бутоксид (ингибитор микросомальных ферментов печени), входящий вместе с пиретринами в состав комбинированного препарата, еще больше подавляет их метаболизм и повышает эффективность. Высокой чувствительностью к токсическому действию этих инсектицидов обладают также рыбы (Khan, 1983). | ||
| Строка 76: | Строка 76: | ||
По сравнению с другими пестицидами пиретрины — более сильные аллергены. Они часто вызывают контактный дерматит и бронхиальную астму. Риск аллергических реакций на пиретрины особенно высок у лиц с аллергией к амброзии. При этом очищенные пиретрины и пиретроиды гораздо менее аллергенны, чем порошок из высушенных цветков ромашки. | По сравнению с другими пестицидами пиретрины — более сильные аллергены. Они часто вызывают контактный дерматит и бронхиальную астму. Риск аллергических реакций на пиретрины особенно высок у лиц с аллергией к амброзии. При этом очищенные пиретрины и пиретроиды гораздо менее аллергенны, чем порошок из высушенных цветков ромашки. | ||
| − | Ротенон получают из корней растений Derris elliptica и Lonc-hocarpus spp. Первоначально его использовали как яд для рыб (ихтиоцид), а сейчас — как инсектицид. Структурная формула ротенона следующая: | + | Ротенон получают из корней растений Derris elliptica и Lonc-hocarpus spp. Первоначально его использовали как яд для рыб (ихтиоцид), а сейчас — как инсектицид. Структурная формула ротенона следующая:[[Image:Gm1452_2.jpg|250px|thumb|right|Структурная формула ротенона ]] |
Ротенон редко вызывает отравление у людей. Его применяют для уничтожения головных вшей, чесоточных клещей и других эктопаразитов. Местные побочные эффекты ротенона включают конъюнктивит, дерматит, фарингит и ринит. Употребление внутрь вызывает раздражение слизистой ЖКТ, тошноту и рвоту. Наиболее опасно вдыхание ротенона, которое вначале вызывает активацию дыхательного центра, а затем — его угнетение и судороги. Ротенон тормозит окисление НАДН до НАД и, следовательно, окисление глутаминовой, а-кетоглутаровой и виноградной кислот. | Ротенон редко вызывает отравление у людей. Его применяют для уничтожения головных вшей, чесоточных клещей и других эктопаразитов. Местные побочные эффекты ротенона включают конъюнктивит, дерматит, фарингит и ринит. Употребление внутрь вызывает раздражение слизистой ЖКТ, тошноту и рвоту. Наиболее опасно вдыхание ротенона, которое вначале вызывает активацию дыхательного центра, а затем — его угнетение и судороги. Ротенон тормозит окисление НАДН до НАД и, следовательно, окисление глутаминовой, а-кетоглутаровой и виноградной кислот. | ||
| Строка 107: | Строка 107: | ||
*[[Родентициды]] | *[[Родентициды]] | ||
*[[Фунгициды]] | *[[Фунгициды]] | ||
| + | *[[Растительные препараты]] | ||
Текущая версия на 20:51, 9 ноября 2014
Источник:
Клиническая фармакология по Гудману и Гилману, том 4.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Пестициды[править | править код]
Пестициды — это целая группа веществ, в которую входят инсектициды, родентициды, фунгициды, гербициды и фумиганты. Пестициды играют важную роль в сельском хозяйстве, других отраслях экономики и медицине. Они позволяют увеличить урожай, снизить трудовые затраты на производство пищевых продуктов и уменьшить распространенность таких заболеваний, как малярия, желтая лихорадка и бубонная чума.
После окончания Второй мировой войны использование пестицидов значительно возросло. Однако в сельском хозяйстве оно в течение последних 15 лет оставалось неизменным, а сейчас в связи с широким внедрением генетически модифицированных культур стало снижаться . В США ежегодно продается более 0,5 млн тонн, а во всем мире — около 2,3 млн тонн пестицидов.
Поскольку пестициды служат для уничтожения тех или иных живых организмов, в идеале они должны обладать строго избирательной токсичностью. Однако на самом деле все они оказываются токсичными и для человека.
Инсектициды[править | править код]
Хотя главный потребитель инсектицидов — сельское хозяйство, они активно используются и на других производствах, а также в быту для обработки помещений и прилегающих к ним территорий. Небольшое количество инсектицидов часто остается на продуктах и вместе с пищей попадает в организм. Нередки случаи острого отравления пищевыми продуктами, обработанными во время их хранения или транспортировки высокими дозами инсектицидов. Использование инсектицидов дома и в саду бывает причиной случайного отравления у детей. Хлорорганические инсектициды включают хлорзамещенные производные этана (самый известный — ДДТ), циклодиены (хлордан, альдрин, диэльдрин, гептахлор и эндрин), гексахлорциклогексан (линдан), токсафен, мирекс, кепон и другие углеводороды. С середины 1940-х до середины 1960-х гг. эти инсектициды широко использовали в сельском хозяйстве и для борьбы с гмалярией.
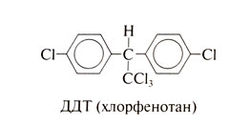
ДДТ[править | править код]
ДДТ, называемый также хлорфенотаном, известен более других хлорзамещенных производных этана. До введения во многих странах ограничений на применение ДДТ он был самым популярным, дешевым и эффективным синтетическим инсектицидом. Его широкое использование началось с середины 1940-х гг.
ДДТ хорошо растворяется в жирах и почти не растворяется в воде. В виде сухого порошка или водной суспензии ДДТ всасывается медленно, а в виде масляного раствора, раствора в жире или органическом растворителе — очень быстро. В организме ДДТ накапливается в жировой ткани, что играет защитную роль, так как в результате уменьшается его токсическое действие на головной мозг. ДДТ проникает через плаценту, и его концентрация в пуповинной крови такая же, как в материнской (Saxenaetal., 1981).
Медленное разрушение ДДТ и его способность долго сохраняться в жировой ткани животных приводит к биоконцентрированию ДДТ, то есть к накоплению в каждом последующем звене пищевой цепи во все возрастающей концентрации. В результате биоконцентрирования максимальному токсическому действию ДДТ подвергаются виды животных, составляющие высшее звено пищевой цепи. Так, вследствие попадания ДДТ и других хлорзамещенных инсектицидов в воду сокращается численность птиц, питающихся рыбой; считается, что ДЦТ приводит к уменьшению толщины яичной скорлупы.
ДДТ распространен повсеместно, поэтому все люди, родившиеся после 1945 г., в течение всей своей жизни подвергаются воздействию этого инсектицида и накапливают его в жировой ткани. При поступлении в организм постоянного количества ДДТ его концентрация в жировой ткани в конце концов стабилизируется. Если же поступление ДДТ уменьшается, он начинает медленно выводиться из организма. Подсчитано, что за сутки из организма выводится около 1% общего запаса ДДТ. Выводится он в виде метаболитов, которые медленно образуются при отщеплении хлора и окислении ДДТ под действием микросомальных ферментов печени. Один из главных метаболитов — бис-транс-хлорфенил-уксусная кислота.
Порог токсического действия ДДТ довольно высок, поэтому достоверных сообщений о смертельных отравлениях нет, несмотря на широкую распространенность и доступность ДДТ. Те немногочисленные смертельные отравления, которые якобы были вызваны высокими дозами Д ДТ, на самом деле могли быть обусловлены керосином, используемым в качестве его растворителя. Острое отравление ДДТ проявляется в основном возбуждением ЦНС.
Симптомы отравления высокими дозами ДДТ включают парестезию лица, губ и языка, беспокойство, возбудимость, раздражительность, дурноту, тремор, тонические и клонические судороги (Ecobichon, 2001). Механизмы действия ДДТ на ЦНС до конца не изучены. Известно, однако, что он нарушает транспорт натрия и калия через мембрану аксонов, приводя к увеличению следовой деполяризации, удлинению потенциала действия, повторным разрядам в ответ на одиночное раздражение и множественным спонтанным потенциалам действия (Narahashi, 1983).
В/в введение ДДТ животным приводит к фибрилляции желудочков и смерти. Развитие фибрилляции желудочков обусловлено, по-видимому, тем, что ДДТ, с одной стороны, повышает чувствительность миокарда к аритмогенному действию катехоламинов (как и другие хлорзамещенные углеводороды), с другой, действуя на ЦНС и мозговое вещество надпочечников, — вызывает адренергическую стимуляцию сердца.
В относительно низких дозах ДДТ индуцирует микросомальные ферменты печени. Повышение их активности отмечается у сотрудников санитарно-эпидемиологической службы, проводящих дератизацию (Kolmodin et al., 1969), и лиц, занятых на производстве ДДТ (Poland et al., 1970). В результате изменяется метаболизм многих лекарственных средств, других экзогенных веществ и стероидных гормонов. ДДТ представляет опасность для некоторых видов птиц, поскольку он снижает прочность яичной скорлупы (Radcliffe, 1967). Ускорение метаболизма эстрогенов у самок птиц, обусловленное повышением активности микросомальных ферментов печени, может приводить к нарушению метаболизма кальция и повреждению скорлупы во время откладывания и высиживания яиц. В результате может уменьшаться общая плодовитость популяции и выживаемость птенцов (Lundholm, 1987). Кроме того, сам ДДТ обладает эстрогенным действием (Kupfer, Bulger, 1982) и ингибирует Са +-АТФазу, участвующую в кальцификации скорлупы (Miller et al., 1976).
На добровольцах показано, что ежедневное употребление 35 мг ДДТ (что примерное 1000 раз превышает его среднее суточное потребление) в течение 25 сут не приводит к каким-либо последствиям (Hayes, 1963). Тем не менее не исключено, что ДЦТ, попадая в организм длительное время в малых дозах, все же обладает канцерогенным действием (IARC, 1974а). Широкое использование ДДТ в индустриальных странах никак не отразилось на заболеваемости раком печени. Однако в исследовании, проведенном среди 3800 сотрудников санитарно-эпидемиологической службы, было зарегистрировано увеличение смертности от лейкозов (особенно от миелоидных), опухолей головного мозга и рака легкого без значительного повышения общего уровня стандартизованной смертности (Blair et al., 1983).
Начиная с 1972 г. в США был введен запрет на широкое использование ДДТ; это вещество разрешено применять только в некоторых случаях угрозы здоровью населения и для борьбы с вредителями сельскохозяйственных растений в отсутствие эффективной замены. Поводом к такому ограничению послужило предположение о вреде, который наносит окружающей среде и здоровью человека длительное использование ДДТ, а также появление насекомых, устойчивых к его действию. Наряду с США решение о запрете ДДТ приняли и некоторые другие страны. Однако в ряде тропических стран ДДТ и сейчас используют очень широко для борьбы с малярией. Следует отметить, что многие пестициды, пришедшие на смену ДДТ, оказались гораздо токсичнее.
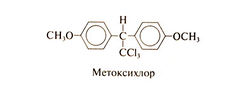
Метоксихлор[править | править код]
Метоксихлор представляет собой хлорзамещенное производное этана. Его структурная формула следующая:
Метоксихлор, все чаще используемый вместо ДДТ, гораздо менее токсичен для млекопитающих (LD50 метоксихлора составляет 6000 мг/кг, а ДДТ — 250 мг/кг), не является канцерогеном и не задерживается в организме. Метоксихлор накапливается в жировой ткани в количестве, составляющем всего 0,2% количества откладывающегося там ДДТ, и его Т1/2 У крыс составляет всего 2 нед по сравнению с 6 мес для ДДТ (Ecobichon, 2001). Высокая скорость элиминации метоксихлора обусловлена его быстрым метаболизмом посредством 0-деметилирования (Kapoor et al., 1970) с последующей конъюгацией и выведением с мочой. Однако метоксихлор обладает эстрогенным действием, поэтому существует опасение, что он может повышать риск рака молочной железы и угнетать сперматогенез.
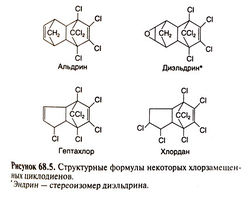
Хлорзамещенные циклодиены[править | править код]
Структурные формулы наиболее широко используемых соединений этой группы приведены на рис. 68.5. Эти соединения обладают возбуждающим действием на ЦНС и приводят к отравлению, напоминающему отравление ДДТ. Однако механизмы нейротоксического действия хлорзамещенных циклодиенов и ДДТ неодинаковы. Хлорзамещенные циклодиены действуют как блокаторы рецепторов ГАМК, подавляя транспорт хлора в клетку, что затрудняет реполяризацию нейронов и приводит к их продолжительному возбуждению. Первым и наиболее тяжелым симптомом отравления часто бывают судороги, другие симптомы включают головную боль, тошноту, рвоту, дурноту и легкие клонические подергивания (Hayes, 1963). В отличие от ДДТ, хлорзамещенные циклодиены могут вызывать смертельное отравление.
Хлорзамещенные циклодиены отличаются от ДДТ еще и тем, что они быстро всасываются через неповрежденную кожу. Как и в случае с ДДТ, попадание небольшого их количества вместе с пищей внутрь, по-видимому, не представляет большой угрозы для здоровья населения, однако контакт с концентрированными растворами может быть опасен.
Подобно ДДТ, хлорзамещенные циклодиены жирорастворимы, задерживаются в жировой ткани, индуцируют микросомальные ферменты печени, медленно метаболизируются, долго сохраняются в окружающей среде и подвергаются биоконцентрированию. Они вызывают дозозависимое повышение риска печеночноклеточного рака у мышей и являются самыми сильными канцерогенами среди всех инсектицидов. В связи с этим в США в 1974 г. был введен запрет на применение апьдрина и диэльдрина, а начиная с 1976 г. наложены ограничения и на использование в сельском хозяйстве хлордана и гептахлора.
Другие хлорзамещенные углеводороды — линдан, токсафен, мирекс и кепон, — хотя и имеют много общего с ДДТ, в отличие от него, не нарушают проведения нервного импульса в аксонах, а действуют на уровне пресинаптических окончаний и усиливают высвобождение медиаторов (Shankland, 1982).
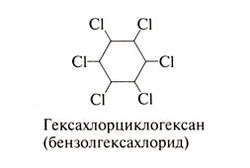
Гексахлорциклогексан (бензолгексахлорид)[править | править код]
Гексахлорциклогексан представляет собой смесь восьми стереоизомеров. Гамма-изомер, получивший название линдан, обладает наибольшей токсичностью и обеспечивает почти всю инсектицидную активность гексахлорциклогексана. Линдан применяют как средство против эктопаразитов (см. ниже). Отравление им во многом напоминает отравление Д ДТ и проявляется тремором, атаксией, судорогами и слабостью. При тяжелом остром отравлении тонические и клонические судороги бывают выражены особенно сильно. В то время как а- и у-изомеры гексахлорциклогексана стимулируют ЦНС, 0- и 8-изомеры угнетают ее. Стимулирующее действие на ЦНС обусловлено, по-видимому, подавлением ГАМКергаческой передачи (Matsumura, Ghiasuddin, 1979). Линдан индуцирует микросомальные ферменты печени. Считается, что линдан и другие изомеры гексахлорциклогексана вызывают апластическую анемию (Rugman and Cosstick, 1990). Однако анализ 60 случаев апластической анемии не выявил связи между развитием заболевания и наличием профессионального контакта с этими пестицидами (Wang and Grufferman, 1981). Некоторые изомеры гексахлорциклогексана, включая линдан, вызывают печеночноклеточный рак у грызунов (Cueto, 1980).
Гексахлорциклогексан метаболизируется с образованием хлорфенолов. По сравнению с ДДТ он относительно недолго сохраняется в окружающей среде.
Токсафен — это смесь более чем 175 полихлорзамещенных углеводородов С1(), из которых известны только 20, например гептахлорборнан (Saleh, 1991). Токсичность токсафена, как и других хлорзамещенных углеводородов, проявляется в основном стимуляцией ЦНС. Метаболизируется токсафен довольно быстро, поэтому его Т1/2 короче, чем у большинства других хлорзамещенных углеводородов. У мышей токсафен вызывает опухоли печени и обладает мутагенным действием (Hooper et al., 1979). На основе этих данных применение токсафена было значительно сокращено.
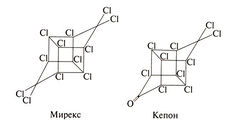
Мирекс и кепон сохраняются в окружающей среде очень долго. Для них характерно биоконцентрирование, увеличивающее их содержание в организме в тысячи раз (Waters et al., 1977). Структурные формулы этих соединений следующие:
Как и остальные хлорзамещенные углеводороды, мирекс и кепон стимулируют ЦНС, обладают гепатотоксическим действием и индуцируют микросомальные ферменты печени. Кепон вызывает атрофию яичек и угнетает сперматогенез, что, по-видимому, обусловлено его прямым эстрогенным действием (Eroschenko, 1981). На животных показано, что и мирекс, и кепон обладают канцерогенным действием (Cueto et al., 1976; Waters et al., 1977).
В Хопвелле (штат Виргиния, США) было зафиксировано отравление 76 из 148 работников предприятия по производству кепона, обусловленное грубым нарушением гигиены труда (Taylor et al., 1978). У пострадавших отмечались тремор, опсоклонус, гепатоспленомегалия, сыпь, нарушение походки (широко расставленные ноги) и психические нарушения. Лабораторные исследования выявили олигозооспермию и уменьшение подвижности сперматозоидов. Вследствие загрязнения территории вокруг этого предприятия пришлось резко ограничить ловлю рыбы и моллюсков в реке Джеймс и прилегающей части Чесапикского залива.
Мирекс, по-видимому, метаболизируется до кепона (Carlson et al., 1976), а последний — до хлордеконового спирта, который в виде конъюгата с глюкуроновой кислотой попадает в желчь (Guzelian, 1982). Выводится кепон в основном с калом. Холе-стирамин (гл. 36), которым лечат отравление кепоном, в 3—118 раз увеличивает экскрецию последнего с калом, уменьшает его Т1/2 со 140 до 80 сут и ускоряет выздоровление (Cohn et al., 1978). Кепон может выводиться не только с желчью, но и за счет жскреции через кишечник (Guzelian, 1982). У человека всего 1—10% кепона, поступившего в желчь, выводится с калом, а ос-ральное всасывается обратно (Cohn et al., 1978), причем сама Ьселчь и стимулирует его всасывание (Boylan et al., 1979). Ускорение экскреции кепона с калом под действием холестирамина объясняется способностью последнего связывать желчные кислоты в кишечнике. Кепон выявляется в женском, коровьем и крысином молоке. Таким образом, кепон может попадать в организм человека с коровьим молоком.
Фосфорорганические инсектициды сейчас широко используют вместо хлорзамещенных углеводородов. Фосфорорганические инсектициды не сохраняются подолгу в окружающей среде и не обладают выраженным канцерогенным действием, но при этом очень токсичны и вызывают острое отравление. Так, относящийся к этой группе паратион вызывает смертельное отравление чаще, чем остальные пестициды. Фармакологические и токсические свойства этих соединений приведены в гл. 8. Карбаматные инсектициды во многом напоминают фосфорорганические. Карбарил — наиболее распространенный из карба-матных инсектицидов. Поскольку эти соединения ингибируют АХЭ, они обсуждаются в гл. 8.
Инсектициды растительного происхождения[править | править код]
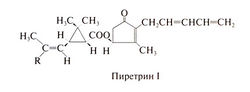
К ним относятся, в частности, пиретрины, выпускаемые в виде неочищенного экстракта из цветков ромашки Chrysanthemum (Руrethrum) cinerariaefolium и частично очищенного препарата, представляющего собой смесь шести пиретринов, среди которых самым сильным инсектицидом является пиретрин I. Структурная формула последнего следующая:
Пиретроиды (синтетические производные пиретринов) и пиретрины благодаря своему быстродействию входят в состав многих бытовых инсектицидов. Механизм их действия заключается в удлинении и увеличении следовой деполяризации мембран нейронов (за счет поддержания натриевых каналов в открытом состоянии и длительного поступления натрия в клетки), которая, достигая порогового значения мембранного потенциала, приводит к возникновению повторных спонтанных потенциалов действия (Narahashietal., 1998). В связи с видовыми особенностями строения натриевых каналов эти инсектициды гораздо более токсичны для насекомых, чем для млекопитающих. Низкая токсичность пиретринов и пиретроидов делает их самыми безопасными инсектицидами. Это обусловлено также их быстрым метаболизмом путем гидролиза эфирных связей и гидроксилирования (Aldridge, 1983). У насекомых пиретрины и пиретроиды метаболизируются медленно. При этом пиперонила бутоксид (ингибитор микросомальных ферментов печени), входящий вместе с пиретринами в состав комбинированного препарата, еще больше подавляет их метаболизм и повышает эффективность. Высокой чувствительностью к токсическому действию этих инсектицидов обладают также рыбы (Khan, 1983).
По сравнению с другими пестицидами пиретрины — более сильные аллергены. Они часто вызывают контактный дерматит и бронхиальную астму. Риск аллергических реакций на пиретрины особенно высок у лиц с аллергией к амброзии. При этом очищенные пиретрины и пиретроиды гораздо менее аллергенны, чем порошок из высушенных цветков ромашки.
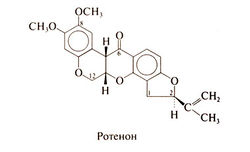
Ротенон получают из корней растений Derris elliptica и Lonc-hocarpus spp. Первоначально его использовали как яд для рыб (ихтиоцид), а сейчас — как инсектицид. Структурная формула ротенона следующая:
Ротенон редко вызывает отравление у людей. Его применяют для уничтожения головных вшей, чесоточных клещей и других эктопаразитов. Местные побочные эффекты ротенона включают конъюнктивит, дерматит, фарингит и ринит. Употребление внутрь вызывает раздражение слизистой ЖКТ, тошноту и рвоту. Наиболее опасно вдыхание ротенона, которое вначале вызывает активацию дыхательного центра, а затем — его угнетение и судороги. Ротенон тормозит окисление НАДН до НАД и, следовательно, окисление глутаминовой, а-кетоглутаровой и виноградной кислот.
Никотин — один из наиболее токсичных инсектицидов (гл. 9). Отравление им проявляется слюнотечением, рвотой (из-за стимуляции вегетативных ганглиев), мышечной слабостью (из-за угнетения нервно-мышечной передачи, сменяющего ее стимуляцию) и в конце концов приводит к клоническим судорогам и остановке дыхания (из-за действия на ЦНС).
Авермектины вырабатываются обитающими в почве актиномицетами Streptomyces avermitilis. Синтетический аналог природных авермектинов, ивермектин, применяют в качестве инсектицида, активного в отношении многих насекомых и паразитов. Фармакологические и токсические свойства ивермектина приведены в гл. 42.
Инсектициды, используемые в качестве антипаразитарных средств[править | править код]
Основные эктопаразиты человека — этот головная вошь и чесоточный клещ.
Линдан в виде 1% крема, лосьона или шампуня используют для лечения чесотки. Крем (для взрослых его требуется 30 г) наносят на кожу от шеи до ступней и оставляют на 8—12 ч. Обычно в течение 24 ч зуд исчезает и повторного применения крема не требуется. При необходимости лечение можно повторить один или два раза с интервалом 1 нед. Линдан эффективен также для лечения педикулеза (вызванного как головной, так и платяной вошью) и фтириаза. Для уничтожения вшей обычно хватает однократного применения 1 % крема, лосьона или шампуня.
Малатион относится к фосфорорганическим инсектицидам. Общая фармакология фосфорорганических ингибиторов АХЭ обсуждается в гл. 8. В виде 0,003 и 0,06% раствора в ацетоне он в течение 3 с полностью уничтожает соответственно вшей и гнид.
В продажу препарат поступает в виде раствора, содержащего 19% изопропанола. Малатион наносят на сухие волосы и оставляют на 8—12 ч, после чего волосы промывают с шампунем и расчесывают. При необходимости процедуру повторяют через 7-9 сут.
Бензилбензоат в высоких концентрациях токсичен для клеша Sarcoptesscabiei и относительно безопасен для человека. Препарат широко применяют при чесотке, эффективен он и при педикулезе. Для лечения чесотки бензилбензоат используют в виде 25—30% лосьона, которым обрабатывают всю кожу (перед этим тщательно вымытую) от шеи до ступней. После того как нанесенный лосьон высыхает, кожу обрабатывают еще раз. Лосьон смывают через 24 ч.
Кротамитон (N-этилкротоно-о-толуидид) — эффективное средство для лечения чесотки. Кротамитон — препарат для местного применения. Иногда он вызывает раздражение кожи, особенно при нанесении на длительный срок и при наличии воспаления, возможны также аллергические реакции. С другой стороны, кротамитон обладает противозудным действием.
Эмульсию, содержащую тетрагидронафталин и олеат меди, предлагали для лечения педикулеза, однако ее эффективность пока не доказана.
Тиабендазол используют местно для лечения кожной формы синдрома larva migrans (гл. 42). За пределами США его применяют и для лечения чесотки. Кроме того, он обладает слабой фунгицидной активностью.