Противотуберкулезные средства (антимикобактериальные) — различия между версиями
Febor (обсуждение | вклад) |
|||
| (не показано 7 промежуточных версий 3 участников) | |||
| Строка 1: | Строка 1: | ||
| + | {{Клинфарм3}} | ||
== Антимикобактериальные средства == | == Антимикобактериальные средства == | ||
| − | |||
| − | |||
| − | + | В этой статье обсуждаются фармакологические свойства и клиническое применение антимикобактериальных средств, то есть препаратов, применяемых при туберкулёзе, проказе и инфекции, вызванной Mycobacterium avium-intracellulaге. В мире туберкулёз по-прежнему занимает первое место среди причин смерти от инфекционных заболеваний, хотя в США рост числа случаев туберкулёза среди ВИЧ-инфицированных удалось приостановить. Хроническое течение болезни и большая длительность противотуберкулёзной терапии создают дополнительные трудности, связанные с несоблюдением назначений врача, побочными эффектами и лекарственной устойчивостью. Здесь рассматриваются противотуберкулёзные средства первого и второго ряда, а также их применение в условиях распространения устойчивых штаммов микобактерий туберкулёза. Обсуждается также профилактика и лечение инфекции, вызванной Mycobacterium avium-intracellulare, у ВИЧ-инфицированных. Кроме того, даётся представление о клинических формах проказы и средствах, используемых при их лечении. | |
| + | |||
| + | Противотуберкулёзные средства подразделяют на препараты первого и второго ряда (табл. 48.1). К препаратам первого ряда относятся наиболее эффективные и относительно нетоксичные [[изониазид]], [[рифампицин]], [[этамбутол]], [[стрептомицин]] и [[пиразинамид]]. Их с успехом применяют у подавляющего большинства больных туберкулёзом. Хорошие результаты даёт 6-месячный курс лечения изониазидом, рифампицином и пиразинамидом (при условии, что возбудитель чувствителен к ним): первые 2 мес используют изониазид, рифампицин и пиразинамид, в следующие 4 мес — изониазид и рифампицин. Эффективен и 9-месячный курс лечения изониазидом и рифампицином; его можно назначать при всех формах туберкулёза, вызванного чувствительными к этим препаратам штаммами (Bass et al., 1994). В районах, где распространена первичная устойчивость к изониазиду, до получения результатов бактериологического исследования в дополнение к рифампицину, изониазиду и пиразинамиду назначают этамбутол или стрептомицин. Если микобактерии устойчивы к препаратам первого ряда, в схему лечения включают препараты второго ряда, так что в целом комбинация состоит из 5—6 противотуберкулёзных средств. К препаратам второго ряда относятся офлоксацин, ципрофлоксацин, этионамид, аминосалициловая кислота, циклосерин, амикацин, канамицин и капреомицин (Iseman, 1993). При лечении ВИЧ-инфицированных нужно помнить о взаимодействии рифамицинов (рифампицин, рифапентин, рифабутин) с ингибиторами протеазы ВИЧ и ненуклеозидными ингибиторами обратной транскриптазы. Приём противотуберкулёзных средств под непосредственным наблюдением медицинского работника улучшает результаты лечения (Havlir and Barnes, 1999). | ||
На Mycobacterium leprae и Mycobacterium avium-intracellulare изониазид не действует. Полимикобактериальную проказу (лепроматозную, погранично-лепроматозную и пограничную) лечат дапсоном, клофазимином и рифампицином не менее 2 лет, олигомикобактериальную (туберкулоидную, погранично-туберкулоидную и неопределенную) — дапсоном и рифампицином в течение 6 мес. | На Mycobacterium leprae и Mycobacterium avium-intracellulare изониазид не действует. Полимикобактериальную проказу (лепроматозную, погранично-лепроматозную и пограничную) лечат дапсоном, клофазимином и рифампицином не менее 2 лет, олигомикобактериальную (туберкулоидную, погранично-туберкулоидную и неопределенную) — дапсоном и рифампицином в течение 6 мес. | ||
| Строка 42: | Строка 43: | ||
<p>Миноциклин; офлоксацин; кларитромицин; этионамид</p></td></tr> | <p>Миноциклин; офлоксацин; кларитромицин; этионамид</p></td></tr> | ||
</table> | </table> | ||
| + | |||
| + | == Антимикробные средства, действующие на Mycobacterium avium-intracellulare == | ||
| + | |||
| + | В настоящее время распространённость инфекции, вызванной Mycobacterium avium-intracellulare, среди ВИЧ-инфицированных значительно снизилась (Benson, 1997—1998). До широкого внедрения высокоактивной антиретровирусной терапии и медикаментозной профилактики инфекции, вызванной Mycobacterium avium-intracellulare, диссеминированная форма этой инфекции наблюдалась у 15—40% ВИЧ-инфицированных. Как правило, болезнь развивается на поздних стадиях ВИЧ-инфекции, когда число лимфоцитов CD4 падает ниже 100 мкл-1; появляются лихорадка, потливость по ночам, снижение веса, анемия (Masuret al., 1993). В отсутствие ВИЧ-инфекции Mycobacterium avium-intracellulare обычно поражает только лёгкие: больные жалуются на постоянный кашель с мокротой; на рентгенограмме грудной клетки обнаруживают диффузные или очаговые инфильтраты, иногда с образованием каверн (Havlir and Ellner, 2000). Обычные антимикобактериальные средства малоэффективны. Недавно появились новые препараты, активные в отношении Mycobacterium avium-intracellulare. Их применяют для профилактики и лечения этого заболевания у ВИЧ-инфицированных. | ||
| + | |||
| + | === Рифабутин === | ||
| + | |||
| + | Рифабутин — производное рифамицина S. Рифабутин действует так же, как и рифампицин (ингибирует бактериальную РНК-полимеразу), но in vitro и при экспериментальном туберкулёзе у мышей он эффективнее рифампицина. | ||
| + | |||
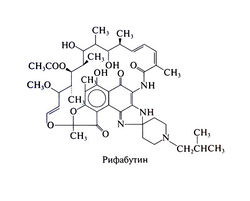
| + | '''Химические свойства'''. Рифабутин растворим в органических растворителях, а в низких концентрациях (0,19 мг/мл) — в воде. Его структурная формула следующая:[[Image:Gm990.jpg|250px|thumb|right|Структурная формула рифабутина]] | ||
| + | |||
| + | '''Антимикробная активность'''. В отношении Mycobacterium avium-intracellulare рифабутин активнее рифампицина. In vitro рифабутин действует как на Mycobacterium avium (основной возбудитель у ВИЧ-инфицированных), так и на Mycobacterium intracellulare, которую выделяют у 40% больных без ВИЧ-инфекции. МПКдля большинства штаммов Mycobacterium avium-intracellulare составляет 0,25—1 мкг/мл, МПК для многих штаммов Mycobacterium tuberculosis не превышает 0,125 мкг/мл. | ||
| + | |||
| + | '''Устойчивость'''. И у Mycobacterium tuberculosis, и у Mycobacterium avium-intracellulare иногда встречается перекрёстная устойчивость к рифампицину и рифабутину. Так, из 225 штаммов Муcobacterium avium-intracellulare, устойчивых к рифампицину в концентрации 10 мкг/мл, 20% были устойчивы к рифабутину в г концентрации 1 мкг/мл (Heifetsetal., 1985). Фармакокинетика. После приёма рифабутина внутрь в дозе 300 мг максимальная сывороточная концентрация достигается через 2—3 ч и составляет 0,4 мкг/мл. Рифабутин элиминируется в две фазы; конечный Т1/2 составляет в среднем 45 ч (16—96 ч). Благодаря своей липофильности препарат накапливается в тканях (его концентрация там в 5—10 раз превышает сывороточную). Выводится рифабутин с мочой и желчью. При почечной недостаточности дозу не снижают. | ||
| + | |||
| + | '''Применение'''. Рифабутин используют для профилактики инфекции, вызванной Mycobacterium avium-intracellulare, у ВИЧ-инфицированных. При приёме в дозе 300 мг/сут вероятность бактериемии снижается на 50% (Nightingale et al., 1993). Однако азитромицин и кларитромицин эффективнее рифабутина и, в отличие от него, не взаимодействуют с антиретровирусными препаратами. В сочетании с кларитромицином и этамбутолом рифабутин применяют для лечения инфекции, вызванной Mycobacterium avium-intracellulare (Shafran etal., 1996). Кроме того, рифабутин часто назначают ВИЧ-инфицированным больным туберкулёзом вместо рифампицина, так как последний в большей степени усиливает метаболизм антиретровирусных средств (Haas, 2000). | ||
| + | |||
| + | '''Побочные эффекты'''. Как правило, ВИЧ-инфицированные хорошо переносят рифабутин. Основные причины отмены препарата — сыпь (4%), желудочно-кишечные нарушения (3%) и нейтропения (2%; Nightingale et al., 1993). На поздних стадиях ВИЧ-инфекции нейтропения возникает в 25% случаев. При приёме рифабутина в д03е более 450 мг/сут в сочетании с кларитромицином или флуконазолом наблюдались увеит и артралгия. Больных предупреждают, что при появлении симптомов поражения глаз (боль в глазах, нечёткость зрения) приём рифабутина следует прекратить. Как и рифампицин, рифабутин окрашивает кожу, мочу, кал, слюну и слёзы в оранжевый цвет. Возможно окрашивание контактных линз К редким побочным эффектам относятся тромбоцитопения, гриппоподобный синдром, гемолиз, миозит, боль в груди и гепатит. | ||
| + | |||
| + | Рифабутин, как и рифампицин, индуцирует микросомальные ферменты печени, ускоряя метаболизм ряда лекарственных средств, в том числе зидовудина, преднизона, дигитоксина, хинидина, кетоконазола, пропранолола, фенитоина, производных сульфанилмочевины, вар-фарина. По сравнению с рифампицином рифабутин в меньшей степени снижает сывороточную концентрацию индинавира и нелфинавира. | ||
| + | |||
| + | === Макролиды === | ||
| + | |||
| + | Фармакологические свойства [[Макролиды (эритромицин, кларитромицин, азитромицин)|макролидов]] и их клиническое применение подробно рассматриваются в гл. 47. Здесь обсуждается только роль этих препаратов в лечении инфекции, вызванной Mycobacterium avium-intracellulare. | ||
| + | |||
| + | '''Антимикробная активность'''. In vitro в отношении Mycobacterium avium-intracellulare кларитромицин примерно в 4 раза активнее азитромицина. Однако in vivo эти различия не столь заметны, поскольку азитромицин очень хорошо проникает внутрь клеток и его концентрации в тканях превышают сывороточную на два порядка. На большинство других атипичных микобактерий (за исключением Mycobacterium simiae) кларитромицин действует в концентрации не более 4 мкг/мл. | ||
| + | |||
| + | '''Устойчивость'''. Длительная монотерапия кларитромицином или азитромицином приводит к появлению устойчивых штаммов Mycobacterium avium-intracellulare, поэтому макролиды назначают только в комбинации с другими антимикобактериальными средствами. | ||
| + | |||
| + | '''Применение'''. Кларитромицин (500 мг 2 раза в сутки) или азитромицин (500 мг 1 раз в сутки) в сочетании с этамбутолом используют для лечения инфекции, вызванной Mycobacterium avium-intracellulare, у ВИЧ-инфицированных; в некоторых случаях дополнительно назначают рифабутин (Shafran etal., 1996; Masur et al., 1993). Лечение продолжают пожизненно (USPHS, 1999). Побочные эффекты. В высоких дозах, которые необходимы для лечения инфекции, вызванной Mycobacterium avium-intracellulare, макролиды иногда вызывают шум в ушах, головокружение и обратимое снижение слуха. | ||
| + | |||
| + | === Фторхинолоны === | ||
| + | |||
| + | Фармакологические свойства фторхинолонов и их клиническое применение подробно рассматриваются в [[Хинолоны и мочевые антисептики|Хинолоны]]. Здесь обсуждается роль этих препаратов в лечении инфекций, вызванных только Mycobacterium avium-intracellulare. | ||
| + | |||
| + | '''Антимикробная активность'''. In vitro фторхинолоны (левофлок-сацин, ципрофлоксацин, офлоксацин, флероксацин и cnapj флоксацин) подавляют рост Mycobacterium tuberculosis (МПК: £ 1,3 мкг/мл) и Mycobacterium avium-intracellulare (МПК £1(Ь 100 мкг/мл). МПКдля Mycobacterium fortuitum и Mycobacteri um kansasii не превышает 3 мкг/мл. | ||
| + | |||
| + | '''Устойчивость'''. При монотерапии ципрофлоксацином инфекции, вызванной Mycobacterium fortuitum, к нему развивается устойчивость. | ||
| + | |||
| + | '''Применение'''. Ципрофлоксацин (750 мг 2 раза в сутки или 500 мг 3 раза в сутки) в сочетании с кларитромицином, рифабутином и амикацином применяют для лечения инфекции, вызванной Mycobacterium avium-intracellulare, у ВИЧ-инфицированных (Havlir and Ellner, 2000). Офлоксацин (300—800 мг/сут) в комбинации с противотуберкулёзными препаратами второго ряда назначают при полирезистентном туберкулёзе. | ||
| + | |||
| + | === Клофазимин === | ||
| + | |||
| + | In vitro клофазимин подавляет рост большинства штаммов Mycobacterium avium-intracellulare в концентрации 1,6—2 мкг/мл, однако результаты его клинического применения в сочетании с другими антимикобактериальными средствами неутешительны. Более подробные сведения о клофазимине приведены в разделе, посвящённом противолепрозным средствам. | ||
| + | |||
| + | === Амикацин === | ||
| + | |||
| + | Фармакологические свойства амикацина рассмотрены в гл. 46. Дмикацин входит в схему комбинированной терапии инфекции, вызванной Mycobacterium avium-intracellulare, в качестве третьего или четвёртого препарата. МПК для большинства штаммов Mycobacterium avium-intracellulare составляет 8—32 мкг/мл. | ||
| + | |||
| + | === Медикаментозное лечение инфекции, вызванной Mycobacterium avium-intracellulare === | ||
| + | |||
| + | Надежда на успешное лечение инфекции, вызванной Mycobacterium avium-intracellulare, появилась благодаря кларитромицину и азитромицину. Оба препарата высокоактивны в отношении многих штаммов этих микобактерий. Даже при монотерапии устраняется бактериемия или уменьшается число микобактерий в крови, исчезают лихорадка и ночная потливость. Однако монотерапия сопровождается развитием лекарственной устойчивости, поэтому большинство врачей в настоящее время комбинируют кларитромицин или азитромицин с этамбутолом (Haas, 2000; Shafran et al., 1996). Иногда к этой схеме добавляют рифабутин, клофазимин или фторхинолоны, хотя преимущества такого лечения не доказаны. Чем больше препаратов назначают одновременно, тем выше риск лекарственных взаимодействий и побочных эффектов. По данным одного исследования, у 46% больных, получавших комбинацию из 4 препаратов, лечение пришлось прекратить (Kemper et al., 1992). Улучшение обычно наступает через 1—2 мес после начала терапии, а посевы становятся отрицательными через 3 мес (Masur et al., 1993). ВИЧ-инфицированным лечение проводят пожизненно (USPHS, 1999). Изониазид и пиразинамид на Mycobacterium avium-intracellulare не действуют. | ||
| + | |||
| + | Профилактика инфекции, вызванной Mycobacterium avium-intracellulare, показана всем ВИЧ-инфицированным с числом лимфоцитов CD4 менее 50 мкл-1. Кларитромицин и азитромицин снижают риск развития этой инфекции и хорошо переносятся. Если на фоне высокоактивной антиретровирусной терапии наблюдается стойкое улучшение — число лимфоцитов CD4 стабилизируется на уровне выше 100 мкгГ1, а концентрация вирусной РНК снижается, — профилактическое лечение можно прекратить (USPHS, 1999). | ||
== Перспективы == | == Перспективы == | ||
| − | Перспективное направление в лечении микобактериальных инфекций — применение фторхинолонов. Расширение системы контролируемой амбулаторной терапии | + | Перспективное направление в лечении микобактериальных инфекций — применение фторхинолонов. Расширение системы контролируемой амбулаторной терапии туберкулёза и успехи высокоактивной антиретровирусной терапии позволяют надеяться на дальнейшее снижение распространенности туберкулёза среди ВИЧ-инфицированных. Расшифровка механизмов устойчивости микобактерий к антимикробным средствам поможет более эффективно бороться с устойчивыми микроорганизмами. Ещё одно важное новое направление в антимикобактериальной терапии — использование иммуномодуляторов (например, интерферона у), стимулирующих фагоцитоз микобактерий макрофагами. |
== Читайте также == | == Читайте также == | ||
| Строка 55: | Строка 110: | ||
*[[Пиразинамид]] | *[[Пиразинамид]] | ||
*[[Прочие противотуберкулезные препараты]] | *[[Прочие противотуберкулезные препараты]] | ||
| + | |||
| + | *[[Антибиотики (антимикробные средства)]] | ||
| + | **[[Выбор антибиотика]] | ||
| + | **[[Комбинированная антибиотикотерапия]] | ||
| + | **[[Профилактическая антибиотикотерапия]] | ||
| + | **[[Механизмы действия антибиотиков]] | ||
| + | *[[Антибактериальные средства]] | ||
Текущая версия на 10:36, 19 марта 2017
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Антимикобактериальные средства[править | править код]
В этой статье обсуждаются фармакологические свойства и клиническое применение антимикобактериальных средств, то есть препаратов, применяемых при туберкулёзе, проказе и инфекции, вызванной Mycobacterium avium-intracellulaге. В мире туберкулёз по-прежнему занимает первое место среди причин смерти от инфекционных заболеваний, хотя в США рост числа случаев туберкулёза среди ВИЧ-инфицированных удалось приостановить. Хроническое течение болезни и большая длительность противотуберкулёзной терапии создают дополнительные трудности, связанные с несоблюдением назначений врача, побочными эффектами и лекарственной устойчивостью. Здесь рассматриваются противотуберкулёзные средства первого и второго ряда, а также их применение в условиях распространения устойчивых штаммов микобактерий туберкулёза. Обсуждается также профилактика и лечение инфекции, вызванной Mycobacterium avium-intracellulare, у ВИЧ-инфицированных. Кроме того, даётся представление о клинических формах проказы и средствах, используемых при их лечении.
Противотуберкулёзные средства подразделяют на препараты первого и второго ряда (табл. 48.1). К препаратам первого ряда относятся наиболее эффективные и относительно нетоксичные изониазид, рифампицин, этамбутол, стрептомицин и пиразинамид. Их с успехом применяют у подавляющего большинства больных туберкулёзом. Хорошие результаты даёт 6-месячный курс лечения изониазидом, рифампицином и пиразинамидом (при условии, что возбудитель чувствителен к ним): первые 2 мес используют изониазид, рифампицин и пиразинамид, в следующие 4 мес — изониазид и рифампицин. Эффективен и 9-месячный курс лечения изониазидом и рифампицином; его можно назначать при всех формах туберкулёза, вызванного чувствительными к этим препаратам штаммами (Bass et al., 1994). В районах, где распространена первичная устойчивость к изониазиду, до получения результатов бактериологического исследования в дополнение к рифампицину, изониазиду и пиразинамиду назначают этамбутол или стрептомицин. Если микобактерии устойчивы к препаратам первого ряда, в схему лечения включают препараты второго ряда, так что в целом комбинация состоит из 5—6 противотуберкулёзных средств. К препаратам второго ряда относятся офлоксацин, ципрофлоксацин, этионамид, аминосалициловая кислота, циклосерин, амикацин, канамицин и капреомицин (Iseman, 1993). При лечении ВИЧ-инфицированных нужно помнить о взаимодействии рифамицинов (рифампицин, рифапентин, рифабутин) с ингибиторами протеазы ВИЧ и ненуклеозидными ингибиторами обратной транскриптазы. Приём противотуберкулёзных средств под непосредственным наблюдением медицинского работника улучшает результаты лечения (Havlir and Barnes, 1999).
На Mycobacterium leprae и Mycobacterium avium-intracellulare изониазид не действует. Полимикобактериальную проказу (лепроматозную, погранично-лепроматозную и пограничную) лечат дапсоном, клофазимином и рифампицином не менее 2 лет, олигомикобактериальную (туберкулоидную, погранично-туберкулоидную и неопределенную) — дапсоном и рифампицином в течение 6 мес.
В отношении Mycobacterium avium-intracellulare активны рифабутин, кларитромицин, азитромицин и фторхинолоны. Азитромицин и кларитромицин — более эффективные средства профилактики инфекции, вызванной Mycobacterium avium-intracellulare, чем рифабутин. В сочетании с этамбутолом азитромицин и кларитромицин применяют для лечения этой инфекции у ВИЧ-инфицированных.
Таблица 48.1. Антимикобактериальные средства
|
Микроорганизм |
Препараты первого ряда |
Препараты второго ряда |
|
Mycobacterium tuberculosis |
Изониазид + рифампицин + пиразинамид + этамбутол или стрептомицин |
Ципрофлоксацин или офлоксацин; циклосерин; капреомицин; канамицин; амикацин; этионамид; клофазимин; аминосалициловая кислота |
|
Mycobacterium avium-intracellulare |
Кларитромицин или азитромицин + этамбутол ± рифабутин |
Рифабутин; рифампицин; этионамид; циклосерин; спарфлоксацин; офлоксацин; левофлоксацин |
|
Mycobacterium kansasii |
Изониазид + рифампицин* + этамбутол |
Этионамид; циклосерин; кларитромицин; амикацин; стрептомицин; левофлоксацин |
|
Mycobacterium fortuitum, Mycobacterium chelonae и Mycobacterium abscessus |
Амикацин + доксициклин |
Цефокситин; рифампицин; сульфаниламиды; ципрофлоксацин; офлоксацин; кларитромицин; триметоприм/сульфаметоксазол; имипенем |
|
Mycobacterium marinum |
Рифампицин + этамбутол |
Триметоприм/сульфаметоксазол; кларитромицин; миноциклин; доксициклин |
|
Mycobacterium leprae |
Дапсон + рифампицин ± клофазимин |
Миноциклин; офлоксацин; кларитромицин; этионамид |
Антимикробные средства, действующие на Mycobacterium avium-intracellulare[править | править код]
В настоящее время распространённость инфекции, вызванной Mycobacterium avium-intracellulare, среди ВИЧ-инфицированных значительно снизилась (Benson, 1997—1998). До широкого внедрения высокоактивной антиретровирусной терапии и медикаментозной профилактики инфекции, вызванной Mycobacterium avium-intracellulare, диссеминированная форма этой инфекции наблюдалась у 15—40% ВИЧ-инфицированных. Как правило, болезнь развивается на поздних стадиях ВИЧ-инфекции, когда число лимфоцитов CD4 падает ниже 100 мкл-1; появляются лихорадка, потливость по ночам, снижение веса, анемия (Masuret al., 1993). В отсутствие ВИЧ-инфекции Mycobacterium avium-intracellulare обычно поражает только лёгкие: больные жалуются на постоянный кашель с мокротой; на рентгенограмме грудной клетки обнаруживают диффузные или очаговые инфильтраты, иногда с образованием каверн (Havlir and Ellner, 2000). Обычные антимикобактериальные средства малоэффективны. Недавно появились новые препараты, активные в отношении Mycobacterium avium-intracellulare. Их применяют для профилактики и лечения этого заболевания у ВИЧ-инфицированных.
Рифабутин[править | править код]
Рифабутин — производное рифамицина S. Рифабутин действует так же, как и рифампицин (ингибирует бактериальную РНК-полимеразу), но in vitro и при экспериментальном туберкулёзе у мышей он эффективнее рифампицина.
Химические свойства. Рифабутин растворим в органических растворителях, а в низких концентрациях (0,19 мг/мл) — в воде. Его структурная формула следующая:
Антимикробная активность. В отношении Mycobacterium avium-intracellulare рифабутин активнее рифампицина. In vitro рифабутин действует как на Mycobacterium avium (основной возбудитель у ВИЧ-инфицированных), так и на Mycobacterium intracellulare, которую выделяют у 40% больных без ВИЧ-инфекции. МПКдля большинства штаммов Mycobacterium avium-intracellulare составляет 0,25—1 мкг/мл, МПК для многих штаммов Mycobacterium tuberculosis не превышает 0,125 мкг/мл.
Устойчивость. И у Mycobacterium tuberculosis, и у Mycobacterium avium-intracellulare иногда встречается перекрёстная устойчивость к рифампицину и рифабутину. Так, из 225 штаммов Муcobacterium avium-intracellulare, устойчивых к рифампицину в концентрации 10 мкг/мл, 20% были устойчивы к рифабутину в г концентрации 1 мкг/мл (Heifetsetal., 1985). Фармакокинетика. После приёма рифабутина внутрь в дозе 300 мг максимальная сывороточная концентрация достигается через 2—3 ч и составляет 0,4 мкг/мл. Рифабутин элиминируется в две фазы; конечный Т1/2 составляет в среднем 45 ч (16—96 ч). Благодаря своей липофильности препарат накапливается в тканях (его концентрация там в 5—10 раз превышает сывороточную). Выводится рифабутин с мочой и желчью. При почечной недостаточности дозу не снижают.
Применение. Рифабутин используют для профилактики инфекции, вызванной Mycobacterium avium-intracellulare, у ВИЧ-инфицированных. При приёме в дозе 300 мг/сут вероятность бактериемии снижается на 50% (Nightingale et al., 1993). Однако азитромицин и кларитромицин эффективнее рифабутина и, в отличие от него, не взаимодействуют с антиретровирусными препаратами. В сочетании с кларитромицином и этамбутолом рифабутин применяют для лечения инфекции, вызванной Mycobacterium avium-intracellulare (Shafran etal., 1996). Кроме того, рифабутин часто назначают ВИЧ-инфицированным больным туберкулёзом вместо рифампицина, так как последний в большей степени усиливает метаболизм антиретровирусных средств (Haas, 2000).
Побочные эффекты. Как правило, ВИЧ-инфицированные хорошо переносят рифабутин. Основные причины отмены препарата — сыпь (4%), желудочно-кишечные нарушения (3%) и нейтропения (2%; Nightingale et al., 1993). На поздних стадиях ВИЧ-инфекции нейтропения возникает в 25% случаев. При приёме рифабутина в д03е более 450 мг/сут в сочетании с кларитромицином или флуконазолом наблюдались увеит и артралгия. Больных предупреждают, что при появлении симптомов поражения глаз (боль в глазах, нечёткость зрения) приём рифабутина следует прекратить. Как и рифампицин, рифабутин окрашивает кожу, мочу, кал, слюну и слёзы в оранжевый цвет. Возможно окрашивание контактных линз К редким побочным эффектам относятся тромбоцитопения, гриппоподобный синдром, гемолиз, миозит, боль в груди и гепатит.
Рифабутин, как и рифампицин, индуцирует микросомальные ферменты печени, ускоряя метаболизм ряда лекарственных средств, в том числе зидовудина, преднизона, дигитоксина, хинидина, кетоконазола, пропранолола, фенитоина, производных сульфанилмочевины, вар-фарина. По сравнению с рифампицином рифабутин в меньшей степени снижает сывороточную концентрацию индинавира и нелфинавира.
Макролиды[править | править код]
Фармакологические свойства макролидов и их клиническое применение подробно рассматриваются в гл. 47. Здесь обсуждается только роль этих препаратов в лечении инфекции, вызванной Mycobacterium avium-intracellulare.
Антимикробная активность. In vitro в отношении Mycobacterium avium-intracellulare кларитромицин примерно в 4 раза активнее азитромицина. Однако in vivo эти различия не столь заметны, поскольку азитромицин очень хорошо проникает внутрь клеток и его концентрации в тканях превышают сывороточную на два порядка. На большинство других атипичных микобактерий (за исключением Mycobacterium simiae) кларитромицин действует в концентрации не более 4 мкг/мл.
Устойчивость. Длительная монотерапия кларитромицином или азитромицином приводит к появлению устойчивых штаммов Mycobacterium avium-intracellulare, поэтому макролиды назначают только в комбинации с другими антимикобактериальными средствами.
Применение. Кларитромицин (500 мг 2 раза в сутки) или азитромицин (500 мг 1 раз в сутки) в сочетании с этамбутолом используют для лечения инфекции, вызванной Mycobacterium avium-intracellulare, у ВИЧ-инфицированных; в некоторых случаях дополнительно назначают рифабутин (Shafran etal., 1996; Masur et al., 1993). Лечение продолжают пожизненно (USPHS, 1999). Побочные эффекты. В высоких дозах, которые необходимы для лечения инфекции, вызванной Mycobacterium avium-intracellulare, макролиды иногда вызывают шум в ушах, головокружение и обратимое снижение слуха.
Фторхинолоны[править | править код]
Фармакологические свойства фторхинолонов и их клиническое применение подробно рассматриваются в Хинолоны. Здесь обсуждается роль этих препаратов в лечении инфекций, вызванных только Mycobacterium avium-intracellulare.
Антимикробная активность. In vitro фторхинолоны (левофлок-сацин, ципрофлоксацин, офлоксацин, флероксацин и cnapj флоксацин) подавляют рост Mycobacterium tuberculosis (МПК: £ 1,3 мкг/мл) и Mycobacterium avium-intracellulare (МПК £1(Ь 100 мкг/мл). МПКдля Mycobacterium fortuitum и Mycobacteri um kansasii не превышает 3 мкг/мл.
Устойчивость. При монотерапии ципрофлоксацином инфекции, вызванной Mycobacterium fortuitum, к нему развивается устойчивость.
Применение. Ципрофлоксацин (750 мг 2 раза в сутки или 500 мг 3 раза в сутки) в сочетании с кларитромицином, рифабутином и амикацином применяют для лечения инфекции, вызванной Mycobacterium avium-intracellulare, у ВИЧ-инфицированных (Havlir and Ellner, 2000). Офлоксацин (300—800 мг/сут) в комбинации с противотуберкулёзными препаратами второго ряда назначают при полирезистентном туберкулёзе.
Клофазимин[править | править код]
In vitro клофазимин подавляет рост большинства штаммов Mycobacterium avium-intracellulare в концентрации 1,6—2 мкг/мл, однако результаты его клинического применения в сочетании с другими антимикобактериальными средствами неутешительны. Более подробные сведения о клофазимине приведены в разделе, посвящённом противолепрозным средствам.
Амикацин[править | править код]
Фармакологические свойства амикацина рассмотрены в гл. 46. Дмикацин входит в схему комбинированной терапии инфекции, вызванной Mycobacterium avium-intracellulare, в качестве третьего или четвёртого препарата. МПК для большинства штаммов Mycobacterium avium-intracellulare составляет 8—32 мкг/мл.
Медикаментозное лечение инфекции, вызванной Mycobacterium avium-intracellulare[править | править код]
Надежда на успешное лечение инфекции, вызванной Mycobacterium avium-intracellulare, появилась благодаря кларитромицину и азитромицину. Оба препарата высокоактивны в отношении многих штаммов этих микобактерий. Даже при монотерапии устраняется бактериемия или уменьшается число микобактерий в крови, исчезают лихорадка и ночная потливость. Однако монотерапия сопровождается развитием лекарственной устойчивости, поэтому большинство врачей в настоящее время комбинируют кларитромицин или азитромицин с этамбутолом (Haas, 2000; Shafran et al., 1996). Иногда к этой схеме добавляют рифабутин, клофазимин или фторхинолоны, хотя преимущества такого лечения не доказаны. Чем больше препаратов назначают одновременно, тем выше риск лекарственных взаимодействий и побочных эффектов. По данным одного исследования, у 46% больных, получавших комбинацию из 4 препаратов, лечение пришлось прекратить (Kemper et al., 1992). Улучшение обычно наступает через 1—2 мес после начала терапии, а посевы становятся отрицательными через 3 мес (Masur et al., 1993). ВИЧ-инфицированным лечение проводят пожизненно (USPHS, 1999). Изониазид и пиразинамид на Mycobacterium avium-intracellulare не действуют.
Профилактика инфекции, вызванной Mycobacterium avium-intracellulare, показана всем ВИЧ-инфицированным с числом лимфоцитов CD4 менее 50 мкл-1. Кларитромицин и азитромицин снижают риск развития этой инфекции и хорошо переносятся. Если на фоне высокоактивной антиретровирусной терапии наблюдается стойкое улучшение — число лимфоцитов CD4 стабилизируется на уровне выше 100 мкгГ1, а концентрация вирусной РНК снижается, — профилактическое лечение можно прекратить (USPHS, 1999).
Перспективы[править | править код]
Перспективное направление в лечении микобактериальных инфекций — применение фторхинолонов. Расширение системы контролируемой амбулаторной терапии туберкулёза и успехи высокоактивной антиретровирусной терапии позволяют надеяться на дальнейшее снижение распространенности туберкулёза среди ВИЧ-инфицированных. Расшифровка механизмов устойчивости микобактерий к антимикробным средствам поможет более эффективно бороться с устойчивыми микроорганизмами. Ещё одно важное новое направление в антимикобактериальной терапии — использование иммуномодуляторов (например, интерферона у), стимулирующих фагоцитоз микобактерий макрофагами.