Противогрибковые средства (препараты) — различия между версиями
Zabava (обсуждение | вклад) (→Флуконазол) |
Zabava (обсуждение | вклад) (→Гризеофульвин) |
||
| Строка 248: | Строка 248: | ||
=== Химические свойства === | === Химические свойства === | ||
| − | Структурная формула гризеофульвина следующая: | + | Структурная формула гризеофульвина следующая:[[Image:Gm1005.jpg|250px|thumb|right|Структурная формула гризеофульвина]] |
Препарат практически нерастворим в воде. | Препарат практически нерастворим в воде. | ||
Версия 21:44, 4 сентября 2013
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Противогрибковые средства
Грибковые инфекции бывают поверхностными и глубокими. Соответственно, рассматриваемые в данной статье противогрибковые средства разделены на две группы — препараты для местного и системного применения, хотя это деление достаточно условно. Так, триазолы, имидазолы и полиеновые антибиотики назначают и системно, и местно. С другой стороны, при многих поверхностных грибковых инфекциях используют препараты как для местного, так и для системного применения. Подробнее всего рассмотрены амфотерицин В, флуконазол и итраконазол. Хотя Pneumocystis carinii сегодня относят к грибам, а не к простейшим, этот микроорганизм чувствителен к антибактериальным и антипротозойным, а не к противогрибковым средствам. Поэтому лечение пневмоцистной пневмонии — угрожающей жизни инфекции, возникающей на фоне иммунодефицита, — обсуждается в других главах.
Уже около трех десятилетий ведущее место среди противогрибковых средств (как применяемых в клинической практике, так и вновь разрабатываемых) занимают азолы. Все азолы характеризуются широким спектром действия, высокой биодоступностью при приеме внутрь и низкой токсичностью, хотя по противогрибковой активности, физическим и фармакологическим свойствам разные препараты отличаются друг от друга. Новые азолы все еще появляются, но прогресс в этой области уже 1не столь заметен. Кроме того, в последнее время среди микроорганизмов, традиционно чувствительных к азолам, постепенно растет число устойчивых штаммов. В частности, это относится к Candida albicans.
Помимо новых азолов важным достижением в области разработки новых противогрибковых средств стали липидные препараты амфотерицина В. По сравнению с обычным амфотерицином В для в/в введения (в комплексе с дезоксихолатом натрия) эти препараты гораздо менее нефротоксичны, но на частоту лихорадки и озноба влияют по-разному. Как ни странно, в проспективных исследованиях их эффективность при грибковых инфекциях не изучалась. Липидные препараты разрешено применять в качестве резервных средств при неэффективности или непереносимости обычного амфотерицина В. В клинических испытаниях их эмпирически назначали больным с нейтропенией, однако оценить результаты такого лечения оказалось крайне трудно. Пока не ясно, превосходят ли липидные препараты по эффективности обычный амфотерицин В в максимально допустимой дозе; вероятно, ответ на этот вопрос отрицателен.
Сывороточные концентрации противогрибковых средств обычно определяют только в рамках научных исследований. Исключение составляет фторцитозин: его побочное действие зависит от дозы, а при почечной недостаточности сывороточная концентрация препарата в крови быстро достигает токсического уровня. Эффективность и побочное действие азолов и амфотерицина В напрямую не зависят от их сывороточной концентрации.
Широкое распространение противогрибковых средств для системного применения заставляет изучать их эффективность, безопасность и взаимодействие с другими препаратами. Средства для местного применения, в том числе новые азолы, отпускаемые без рецепта, настолько разнообразны, что сделать выбор трудно и врачу, и больному.
В табл. 49.1 приведены препараты выбора для лечения наиболее распространенных грибковых инфекций.
Историческая справка
Амфотерицин В впервые получен в 1956 г. Голдом с сотрудниками, изучавшими штамм аэробного актиномицета Streptomyces nodosus, выделенный из почвы в долине реки Ориноко в Венесуэле.
Химические свойства
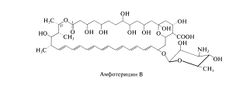
Амфотерицин В относится к группе полиеновых антибиотиков, насчитывающей около 200 препаратов. Все они представляют собой внутренние циклические эфиры и имеют от 4 до 7 сопряженных двойных связей. Кроме того, все полиеновые антибиотики плохо растворимы в воде, достаточно токсичны при парентеральном введении и обладают общим механизмом действия. Амфотерицин В (гептаеновый макролид) содержит семь сопряженных двойных связей в транс-конфигурации; к его макроциклическому лактонному кольцу гликозидной связью присоединена 3-амино-3,6-дидезоксиманноза — микозамин (см. ниже). Амфотерные свойства, за которые препарат и получил свое название, обусловлены карбоксильной группой макроциклического кольца и первичной аминогруппой микозамина; эти группы обеспечивают растворимость амфотерицина В в воде при крайних значениях pH. По данным рентгеноструктурного анализа, молекула амфотерицина В имеет жесткую вытянутую структуру; вдоль одного края располагаются гидроксильные группы макроциклического кольца, а вдоль другого — сопряженные двойные связи. Таким образом, один край молекулы оказывается гидрофильным, а другой — гидрофобным.
Лекарственные формы
Амфотерицин В нерастворим в воде, поэтому для в/в введения его выпускают в комплексе с дезоксихолатом натрия. Лекарственная форма представляет собой лиофилизированный порошок, содержащий 50 мг амфотерицина В, 41 мгдезоксихолата натрия и небольшое количество фосфатного буфера. При разведении порошка водой образуется коллоидный раствор, в котором диаметр большинства частиц меньше 0,4 мкм. Инфузионные системы с фильтрами, не пропускающими частицы диаметром более 0,22 мкм, задерживают значительную часть препарата. При добавлении солевых растворов происходит агрегация частиц, и коллоидный раствор мутнеет. Вводить помутневший раствор не следует, поскольку сывороточная концентрация амфотерицина В при этом очень низка.
N- и О-ацилированные производные амфотерицина В образуют растворимые в воде соли, но эти препараты пока находятся в стадии разработки. Благодаря амфифильности амфотерицина В были созданы несколько липидных препаратов для в/в введения. В США продаются три таких препарата (Wong-Berin-ger et al., 1998). Первый из них —коллоидная взвесь амфотерицина В — содержит эквимолярные количества амфотерицина В и сульфата холестерина. Как и обычный амфотерицин В, при разведении водой она образует коллоидный раствор. Коллоидные частицы имеют форму диска толщиной 4 нм и диаметром 115 нм. И у мышей, и у человека сывороточная концентрация амфотерицина В при введении коллоидной взвеси намного ниже, чем при введении обычного амфотерицина В. У мышей, получавших коллоидную взвесь амфотерицина В в течение 2 нед, от 41 до 80% введенного препарата обнаруживают в печени. В двойном слепом клиническом испытании коллоидная взвесь амфотерицина В в дозе 4 мг/кг/сут чаще вызывала озноб и гипоксию (соответственно в 79,8 и 12% случаев), чем обычный амфотерицин В в дозе 0,8 мг/кг/сут (соответственно в 65,4 и 2,9% случаев); первый препарат пришлось отменить у 4,6% больных, а второй — только у 0,9% (White et al., 1998). Гипоксия возникала на фоне сильной пирогенной реакции. Во избежание пирогенных реакций рекомендуемую дозу коллоидной взвеси (3—4 мг) следует вводить в течение 3—4 ч и проводить премедикацию. особенно при первых инфузиях. Нефротоксичность коллоидной взвеси меньше, чем у обычного амфотерицина В, и снижать по этой причине дозу приходится редко даже у больных, перенесших трансплантацию костного мозга (Noskin et al., 1999). Достоверно оценить эффективность коллоидной взвеси I амфотерицина В ни в одном из проведенных на сегодняшний I день испытаний не удалось. Ее разрешено использовать только у больных инвазивным аспергиллезом при неэффективности или непереносимости обычного амфотерицина В, однако эти рекомендации основаны на результатах неслепых испытаний, в которых сравнения с другими препаратами не проводилось.
Другой липидный препарат — липосомный амфотерицин В — содержит 50 мг амфотерицина В и 350 мг липидов (в молярном отношении примерно 1:10). Липидная часть препарата включает гидрогенизированный соевый лецитин (фосфатидилхолин), холестерин и дистеароилфосфатидилглицерол в малярном отношении 10:5:4. Липосомный амфотерицин В выпускают в виде лиофилизированного порошка. Перед применением порошок разводят стерильной водой для инъекций, после чего необходимую дозу растворяют в 5% глюкозе. В полученном таким образом растворе диаметр частиц составляет около 80 нм. Биодоступность липосомного амфотерицина В примерно такая же, как и у обычного амфотерицина В, но первый можно вводить в более высоких дозах, так как он лучше переносится. В печени и селезенке липосомный препарат накапливается в большей степени, чем обычный амфотерицин В (de Marie et al., 1994). У 23 больных, получавших липосомный амфотерицин В в дозе 3 мг/кг/сут в течение 27 сут, уровень креатинина сыворотки увеличился в среднем лишь на 34%; снизить дозу из-за нефро-токсического действия пришлось только у одного больного (Coker et al., 1993). Липосомный препарат реже, чем обычный амфотерицин В и липидный комплекс амфотерицина В (см. ниже), вызывает поражение почек, гипокалиемию и реакции на введение — лихорадку, озноб, гипоксию, артериальную гипо- и гипертонию (Walsh et al., 1999). В отдельных случаях, обычно при введении первых нескольких доз, возникают боль в спине, животе или груди (Johnson et al., 1998). Сообщалось об анафилактическом шоке. За некоторыми исключениями (Walsh et al., 1999; Prentice et al., 1997; Kelsey et al., 1999), данные об эффективности липосомного амфотерицина В получены в неслепых испытаниях, в которых его не сравнивали с другими препарата-ми. Сравнение липосомного и обычного амфотерицина В проводили в двух слепых испытаниях у больных с нейтропенией и лихорадкой (Walsh et al., 1999; Prentice et al., 1997). Результаты лечения в обеих группах оказались примерно одинаковыми Полученные данные позволяют сравнить безопасность липосомного и обычного амфотерицина В. Однако сделать выводов их сравнительной эффективности невозможно, поскольку не удалось количественно оценить эффективность препаратов. Грибковые инфекции в этих испытаниях возникали столь редко, что использовать их частоту как показатель эффективности лечения оказалось невозможно; кроме того, дозы обычного амфотерицина В часто были ниже стандартных. Липосомный амфотерицин В в дозе 3 мг/кг/сут разрешено применять в качестве эмпирической терапии у больных с нейтропенией и лихорадкой при неэффективности антибактериальных средств, а также в качестве резервного средства при аспергиллезе, криптококкозе и кандидозе (в дозе 3—5 мг/кг/сут). Кроме того, этот препарат эффективен при висцеральном лейшманиозе (в дозе 3-~4 мг/кг/сут). Первые инфузии должны продолжаться не менее 2 ч. При хорошей переносимости время введения можно сократить до 1 ч. Отдельные больные переносят дозы до 10 мг/кг, однако у собак препарат оказался высокотоксичным в дозе 8 мг/кг (Bekerskyetal., 1999).
Еще один липидный препарат — липидный комплекс амфотерицина В — содержит димиристоилфосфатидилхолин и ди-миристоилфосфатидилглицерол в соотношении 7:3. Отношение молярных концентраций амфотерицина В и липидов составляет примерно 35%. Липиды и амфотерицин В образуют лентовидные комплексы размером от 1,6 до 11 мкм. Биодоступность липидного комплекса намного ниже, чем у обычного амфотерицина В. Согласно неопубликованным данным, для достижения равных сывороточных концентраций доза липидного комплекса амфотерицина В должна быть в 5 раз выше дозы обычного препарата. По данным неслепых испытаний, в которых липидный комплекс амфотерицина В не сравнивали с другими препаратами, он эффективен при многих грибковых инфекциях, за исключением, пожалуй, криптококкового менингита (Walsh etal., 1998; Wingard, 1997; Sharkey et al., 1996). По частоте нефротоксического действия и реакций на введение (лихорадка, озноб, гипоксия, артериальная гипер- и гипотония) липидный комплекс амфотерицина В занимает промежуточное место между липосомным амфотерицином В и обычным амфо-терицином В (в комплексе с дезоксихолатом натрия). Липидный комплекс амфотерицина В назначают в дозе 5 мг/кг в/в 1 раз в сутки. Препарат вводят в 5% глюкозе в течение 2 ч. Липидный комплекс амфотерицина В применяют в качестве резервного средства при глубоких микозах.
Обычный амфотерицин В (в комплексе с дезоксихолатом натрия) можно смешивать с 20% жировой эмульсией. Что происходит при этом — агрегация комплексов или связывание амфотерицина В с липидами эмульсии, — не известно. При введении в дозе I мг/кг нефротоксичность смеси ниже, чем у чистого амфотерицина В в комплексе с дезоксихолатом натрия, однако есть мнение, что сывороточная концентрация амфотерицина В и эффективность лечения при этом тоже оказываются ниже (Chavanet et al., 1992). В/в введение амфотерицина В в смеси с жировой эмульсией не одобрено ФДА.
Применение липидных препаратов амфотерицина В сопряжено с рядом проблем, как финансовых, так и медицинских. Стоят эти лекарственные формы в 20—50 раз дороже обычного амфотерицина В, что сводит на нет экономическую выгодность лечения. В то же время вопрос об их относительной эффективности остается открытым. Выбирая лекарственную форму амфотерицина В, необходимо взвесить, что важнее: подтвержденная эффективность обычного амфотерицина В или низкая нефротоксичность липидных препаратов. Следует помнить, что в некоторых случаях амфотерицин В может спровоцировать тяжелую почечную недостаточность, что не только утяжеляет состояние больного, но и значительно удорожает медицинскую помошь (Wingard et al., 1999).
=== Противогрибковая активность === Амфотерицин В эффективен при инфекциях, вызванных Candida spp., Cryptococcus neoformans, Blastomyces dermatitidis, Histoplasma capsulatum, Sporothrixschen-ckii, Coccidioides immitis, Paracoccidioides brasiliensis, Aspergillus spp-, Penicillium marneffei и возбудителями мукороза. Некоторые штаммы Candida lusitaniae умеренно устойчивы к этому препарату.
Кроме того, амфотерицин В обладает некоторой активностью в отношении простейших — Leishmania braziliensis и Naegleria fowleri. На бактерии препарат не действует.
Механизм действия
Противогрибковое действие амфотерицина В, по крайней мере отчасти, обусловлено связыванием препарата со стеролами клеточной мембраны гриба, в основном с эргостерином. При этом проницаемость мембраны сильно повышается: образуются поры, через которые происходит утечка мелких молекул. Кроме того, in vitro амфотерицин В повреждает клетки гриба за счет свободнорадикального окисления. Устойчивость к амфотерицину В. У полученных in vitro мутантов, устойчивых к нистатину и амфотерицину В, эргостерин замешен другими стеролами, его предшественниками. В ходе лечения устойчивость к амфотерицину В развивается редко, поэтому остается неясным, сохраняют ли такие мутанты жизнеспособность in vivo. В некоторых случаях устойчивость, возможно, обусловлена низкой проницаемостью клеточной стенки грибов для амфотерицина В; косвенным подтверждением тому служит более высокая чувствительность к нему протопластов, фармакокинетика. Все препараты амфотерицина В почти не всасываются в ЖКТ. При ежедневном в/в введении обычного амфотерицина В в дозе 0,5 мг/кг/сут сывороточная концентрация препарата сразу после инфузии составляет 1 — 1,5 мкг/мл, а через 24 ч падает до 0,5— 1 мкг/мл. В крови амфотерицин В освобождается из комплекса с дезоксихолатом натрия, после чего на 90% связывается с белками плазмы, в основном с апопротеинами ЛПНП. При ежедневном введении примерно 2—5% каждой дозы выделяются с мочой. У больных с отсутствующими почками и у больных, находящихся на гемодиализе, динамика элиминации амфотерицина В не меняется. О влиянии заболеваний печени и желчных путей на метаболизм препарата ничего не известно. При экстракции амфотерицина В метанолом из тканей (на аутопсии) получают не менее трети введенной за время лечения дозы; больше всего препарата содержится в печени и селезенке, несколько меньше — в почках и легких. При введении обычного амфотерицина В уровни препарата в плевральном и перитонеальном выпоте, синовиальной жидкости и водянистой влаге составляют окало двух третей от минимальной сывороточной концентрации. В СМЖ, стекловидное тело и, в норме, в околоплодные воды амфотерицин В проникает плохо. За счет значительного накопления в тканях препарат элиминируется в две фазы с конечным Т1/2 около 15 сут.
Применение
Стандартная доза обычного амфотерицина В составляет 0,5—0,6 мг/кг/сут. Препарат вводят в 5% глюкозе в течение 4ч. При кандидозном эзофагите эффективны дозы 0,15— 0,2 мг/кг/сут. При быстропрогрессирующем мукорозе и инвазивном аспергиллезе назначают 1 —1,2 мг/кг/сут до тех пор, пока развитие болезни не удастся приостановить. Введение двойных доз через день удобнее, но не безопаснее и потому используется редко. От прежних рекомендаций защищать флакон от света сейчас отказались. Продолжительность инфузии можно сократить до 1 ч, однако при этом в первые 5—7 сут лечения повышается риск пирогенных реакций.
При кокцидиоидозном менингите амфотерицин В в комплексе с дезоксихолатом натрия вводят интратекально (эндолюмбально, в мозжечково-мозговую цистерну или в боковые желудочки). Начинают с дозы 0,05—0,1 мг 3 раза в неделю; с учетом переносимости дозу постепенно наращивают до 0,5 мг, после чего переходят на введение 2 раза в неделю. Распространенные побочные эффекты — лихорадка и головная боль; для их уменьшения интратекально вводят 10—15 мг гидрокортизона. Возможны и более тяжелые, хотя и не столь частые, осложнения; их природа зависит от места введения. При внутрисуставном введении и добавлении в диализирующий раствор амфотерицин В обычно вызывает местное раздражение и боль. При грибковом эндофтальмите эффективны внутриглазные инъекции, которые проводят после витреоэктомии с доступом через плоскую часть ресничного тела.
При мукорозе, инвазивном аспергиллезе, висцеральном споротрихозе, криптококкозе, а также при глубоких микозах, вызванных Fusariumspp., Altemariaspp., Trichosporonbeigelii и Penicillium marneffei, в/в введение амфотерицина В — метод выбора. При североамериканском бластомикозе, гистоплазмозе, кок-цидиоидозе и паракокцидиоидозе эффективны триазолы и ими-дазолы, но при быстропрогрессирующих инфекциях, ослабленном иммунитете или вовлечении ЦНС предпочтение отдают амфотерицину В. Кроме того, амфотерицин В (обычный или липосомный) применяют у больных с тяжелой нейтропенией и лихорадкой при неэффективности антибиотиков широкого спектра действия. Больным СПИДом амфотерицин В (1 раз в неделю) назначают для профилактики рецидивов криптококкоза и гистоплазмоза.
При кандидозном цистите мочевой пузырь орошают раствором амфотерицина В (50 мкг/мл) в стерильной воде. Однако если мочевой катетер не извлечен или велик объем остаточной мочи, часто возникают рецидивы. Ингаляции амфотерицина В (при грибковом поражении легких) и закапывание препарата в нос (для профилактики аспергиллеза при нейтропении) неэффективны. Местно амфотерицин В используют только при кандидозе кожи (см. ниже).
Побочные эффекты
При в/в введении обычного амфотерицина В часто возникают лихорадка и озноб. Возможны гипервентиляция, стридор и умеренная артериальная гипотония; бронхоспазм и анафилактические реакции редки. Так как пирогенная реакция сопровождается возрастанием метаболических потребностей, при заболеваниях сердца и легких могут развиться гипоксия и артериальная гипотония. Поэтому при сердечной и дыхательной недостаточности сначала вводят пробную дозу (1 мг), после чего не менее 2 ч наблюдают за больным и лишь затем вводят терапевтическую дозу. Пирогенная реакция обычно проходит самостоятельно в течение 30—45 мин, для ее сокращения можно назначить петидин. Премедикация парацетамолом или введение в начале инфузии гидрокортизона гемисукцината в дозе 0,7 мг/кг в/в ослабляют лихорадку и озноб. При последующих введениях пирогенная реакция уменьшается. У больных, получающих глюкокортикоиды, и детей она возникает реже.
У 80% больных, которым амфотерицин В назначают по поводу глубоких микозов, развивается азотемия (Carlson and Condon, 1994). Степень поражения почек зависит от дозы и усиливается при назначении других нефротоксичных препаратов. На гистологическом уровне стойкие изменения в почечных канальцах возникают даже при коротком курсе лечения, однако в отсутствие болезней почек необратимая почечная недостаточность развивается редко, если общая доза не превышает 3—4 г (для взрослых). Во время терапии и в течение нескольких недель после нее могут наблюдаться почечный канальцевый ацидоз и потери калия и магния с мочой. При длительном лечении треть больных нуждается в препаратах калия. У крыс в основе нефротоксического действия амфотерицина В лежит увеличение сопротивления почечных сосудов (Tolins and Raji, 1988). У человека и экспериментальных животных введение раствора хлорида натрия снижает нефротоксичность амфотерицина В; этот эффект развивается даже при достаточном потреблении жидкости и соли, а следовательно, не обусловлен компенсацией дефицита натрия и воды. В тот день, когда планируется введение амфотерицина В, рекомендуется назначать 1 л физиологического раствора, если больной не получает этот объем в составе других инфузионных растворов и хорошо переносит солевую нагрузку (Branch, 1988).
Довольно часто амфотерицин В вызывает нормоцитарную гипохромную анемию; в одном исследовании гематокрит снизился в среднем до 27%. Возможно, анемия обусловлена угнетением синтеза эритропоэтина. При низком уровне этого вещества в крови эффективен рекомбинантный эритропоэтин. После отмены амфотерицина В анемия постепенно исчезает. Другие распространенные побочные эффекты — головная боль, тошнота, рвота, недомогание, снижение веса, флебит (при введении в периферическую вену). Есть данные о вызванной амфотерицином В энцефалопатии (Balmaceda and Walker, 1994). Изредка наблюдаются тромбоцитопения и незначительная лейкопения. Гепатотоксичность препарата не доказана.
Фторцитозин
Химические свойства
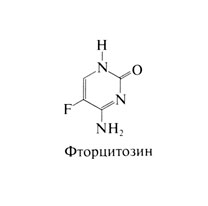
Фторцитозин - фторированный пиримидин. близкий по строению к фторурацилу и фторуридину. Структурная формула фторцитозина следующая:
Противогрибковая активность
Фторцитозин активен в отношении Cryptococcus neoformans, Candida spp. и возбудителей хромомикоза. Чувствительность этих грибов in vitro сильно зависит от метода ее определения и не коррелирует с результатами лечения.
Механизм действия
Все чувствительные к фторцитозину грибы способны дезаминировать его до 5-фторурацила, представляющего собой мощный антиметаболит (рис. 49.1). Фторурацил при участии урацилфосфорибозилтрансферазы превращается в 5-фтор-УМФ. Последний фосфорилируется до 5-фтор-УТф (и далее встраивается в РНК) или же превращается в 5-фтордезокси-УМФ, который, будучи мощным ингибитором тимидилат-синтазы, нарушает синтез ДНК. Избирательность действия фтор, цитозина на клетки грибов объясняется тем, что клетки млекопитающих не способны превращать препарат во фторурацил Устойчивость. При криптококкозе и кандидозе монотерапия фторцитозином часто оказывается безуспешной из-за развития устойчивости. Рецидив хромомикоза после первоначально успешного лечения тоже говорит о приобретении возбудителем устойчивости к препарату. Для устойчивых штаммов Cryptococcus neoformans и Candida spp. МПК увеличивается с менее чем 2,5 до более чем 360 мкг/мл. В основе устойчивости может лежать утрата белка, обеспечивающего трансмембранный перенос цитозина, снижение активности урацилфосфорибозилтрансферазы или цитозиндезаминазы (рис. 49.1). У Candidaal-bicans при гетерозиготной форме недостаточности урацилфосфорибозилтрансферазы наблюдается умеренная устойчивость к фторцитозину, клиническое значение которой не ясно. Фармакокинетика. Фторцитозин быстро и хорошо всасывается в ЖКТ. Препарат проникает во все ткани; его объем распределения приближается к общему содержанию воды в организме. С белками плазмы он связывается незначительно. При нормальной функции почек после приема фторцитозина в дозе 37,5 мг/кг его максимальная сывороточная концентрация достигается через 1—2 ч и составляет 70—80 мкг/мл. Около 80% принятой дозы выводится с мочой в неизмененном виде; при этом концентрация фторцитозина в моче достигает 200—500 мкг/мл. Т)/2 составляет 3—6 ч, но при почечной недостаточности может увеличиваться до 200 ч. Клиренс фторцитозина приближается к клиренсу креатинина (то есть СКФ). Поскольку препарат выводится в основном почками, при почечной недостаточности его дозу нужно снижать и следить за сывороточной концентрацией. Максимальная сывороточная концентрация должна лежать в интервале от 50 до 100 мкг/мл. Фторцитозин выводится при гемодиализе и перитонеальном диализе. Больным, находящимся на гемодиализе, сразу после процедуры следует принять дополнительную дозу препарата — 37,5 мг/кг.
Концентрация фторцитозина в СМЖ достигает 65-90% сывороточной. Кроме того, препарат, видимо, проникает в водянистую влагу.
Применение
Фторцитозин назначают в дозе 100—150 мг/кг/сут внутрь в 4 приема. При почечной недостаточности дозу снижают. Как правило, препарат используют в комбинации с амфотерицином В. При добавлении фторцитозина к амфотерицину В, назначаемому в дозе 0,7 мг/кг/сут, несколько улучшаются результаты лечения криптококкового менингита у больных СПИДом, хотя это улучшение статистически незначимо; риск побочных эффектов при этом не возрастает (van der Horst et al., 1997). Для лечения криптококкоза у больных СПИДом предлагалось также использовать фторцитозин в сочетании с флуко-назолом (оба препарата назначают внутрь), однако при такой схеме часто возникают желудочно-кишечные нарушения, а польза от добавления фторцитозина не доказана. При криптококковом менингите в отсутствие ВИЧ-инфекции, когда цель лечения — не подавить инфекцию, а полностью уничтожить возбудителя, эффективность фторцитозина сомнительна. У таких больных добавление фторцитозина к амфотерицину В, назначаемому в дозе 0,3 мг/кг, позволяет сократить сроки до получения отрицательных результатов посева, однако если амфотерицин В применяют в обычной дозе — 0,7 мг/кг, такого эффекта не наблюдается. При длительном лечении амфотерицином В (6 нед и более) в сочетании с фторцитозином по мере развития вызванной амфотерицином В азотемии дозу фторцитозина нужно снижать, иначе возрастает риск угнетения кроветворения и колита. При глубоком кандидозе фторцитозин больше не используют из-за токсичности, отсутствия лекарственной формы для в/в введения и доступности других противогрибковых средств.
Побочные эффекты
Фторцитозин угнетает кроветворение, вызывая лейкопению и тромбоцитопению. Чаще всего это происходит при сопутствующих заболеваниях крови, атакже на фоне лучевой терапии или лечения другими миелотоксичными препаратами (в том числе и в анамнезе). Среди других побочных эффектов встречаются сыпь, тошнота, рвота, понос и тяжелый энтероколит. Примерно у 5% больных во время лечения обратимо повышается активность печеночных ферментов. Риск побочного действия выше у больных СПИДом, при азотемии (в том числе вызванной приемом амфотерицина В), а также в тех случаях, когда сывороточная концентрация фторцитозина превышает 100 мкг/мл (Stamm etal., 1987). Токсичность препарата, возможно, обусловлена превращением его под действием кишечной микрофлоры в 5-фторурацил.
Имидазолы и триазолы
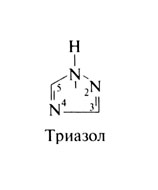
Азолы включают две большие группы препаратов — имидазолы и триазолы. Все азолы обладают одинаковым механизмом действия и спектром противогрибковой активности. Триазолы метаболизируются медленнее, чем имидазолы, и слабее влияют на синтез стеролов в клетках человека. Поэтому поиск новых препаратов сейчас ведется главным образом среди триазолов. Из имидазолов на фармацевтическом рынке США имеются клотримазол, миконазол, кетоконазол, эконазол, бутоконазол, ок-сиконазол и сулконазол, а из триазолов — терконазол, итраконазол, флуконазол и некоторые новые препараты, проходящие клинические испытания. Местное применение азолов описано во второй части этой главы. Структурная формула триазола следующая:
Триазол
Противогрибковая активность
Результаты лечения азолами мало зависят от чувствительности возбудителя in vitro. Хотя по спектру действия отдельные препараты несколько различаются, в целом все они эффективны при инфекциях, вызванных Candida albicans, Candida tropica-lis, Candida glabrata, Cryptococcus neoformans, Blastomyces dermatitidis, Histoplasma capsulatum, Coccidioides im-mitis, Paracoccidioides brasiliensis и дерматофитами. Candida krusei и возбудители мукороза, по-видимому, устойчивы к азолам; Aspergillus spp. и Sporothrix schenckii умеренно устойчивы. На бактерии и простейших эти препараты не действуют, за исключением, быть может, Leishmania major.
Механизм действия
В концентрациях, достижимых при системном применении, азолы подавляют рост грибов, ингибируя стерол-14-деметилазу, изофермент цитохрома Р450. При этом нарушается синтез эргостерина, участвующего в построении мембран грибов. Накапливающиеся в результате 14-а-метилстеролы нарушают плотную упаковку углеводородных цепей фосфолипидов, необходимую для нормального функционирования мембранных белков, в том числе АТФаз и ферментов дыхательной цепи.
Некоторые азолы, например клотримазол, непосредственно повышают проницаемость клеточной мембраны гриба, но в таких концентрациях, которые достигаются только при местном применении.
При длительном применении к азолам постепенно развивается устойчивость, поэтому лечение кандидозного стоматита и эзофагита на поздних стадиях ВИЧ-инфекции со временем становится неэффективным. Основной механизм устойчивости у Candida albicans — накопление мутаций гена ERG11, кодирующего стерол-14-деметилазу (Marichal et al., 1999). В результате этих мутаций гем цитохрома перестает связываться с азолами, но остается доступным для естественного субстрата — ланостерола. Перекрестная устойчивость развивается ко всем азолам. Кроме того, у Candida albicans и Candida glabrata устойчивость к азолам может быть обусловлена выведением препарата из клетки с помощью переносчиков, в том числе АТФ-зависимых. Еще один возможный механизм устойчивости — усиление синтеза стерол- 14-деметилазы.
Кетоконазол
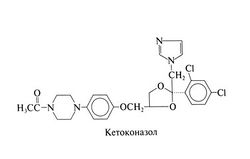
Вместо кетоконазола для приема внутрь теперь назначают итраконазол (за исключением тех случаев, когда низкая стоимость кетоконазола перевешивает его недостатки). По фармакологическим свойствам препараты очень похожи, зато итраконазол не оказывает гепатотоксиче-ского действия, не нарушает синтез стероидных гормонов и обладает более широким противогрибковым спектром. С появлением новых триазолов кетоконазол, вероятно, будет применяться еще реже. Структурная формула кетоконазола следующая:
Фармакокинетика
Всасывание кетоконазола в ЖКТ подвержено индивидуальным колебаниям. Поскольку препарат растворяется в кислой среде, при приеме Н2-блокаторов (например, циметидина), ингибиторов Н+,К+-АТФазы и антацидных средств оно значительно снижается. Всасывание кетоконазола нарушает и диданозин (антиретровирусное средство), поскольку в состав препарата обычно входят буферные компоненты, снижающие кислотность желудочного содержимого и препятствующие разрушению диданозина. Прием пищи не оказывает заметного влияния на максимальную сывороточную концентрацию кетоконазола. После приема в дозе 200,400 и 800 мг она составляет соответственно около 4, 8 и 20 мкг/мл. Т1/2 возрастает с увеличением дозы и при приеме 800 мг препарата может достигать 7—8 ч. Кетоконазол в значительной степени метаболизируется, а его метаболиты выводятся с калом. В моче концентрация неизмененного препарата очень мала. В крови 84% кетоконазола связано с белками плазмы, в основном с альбумином, 15% — с эритроцитами и только 1% присутствует в свободном виде. Почечная недостаточность, гемодиализ и перитонеальный диализ не влияют на метаболизм препарата. При умеренной печеночной недостаточности сывороточная концентрация кетоконазола не меняется.
Кетоконазол хорошо проникает в кератиноциты. Во влагалищном отделяемом его концентрация приближается к сывороточной, а в СМЖ при грибковом менингите составляет всего 1% последней.
Рифампицин, изониазид и, возможно, фенитоин усиливают метаболизм кетоконазола за счет индукции микросомальных ферментов печени. При этом концентрация кетоконазола может снижаться более чем в 2 раза. Кетоконазол увеличивает сывороточные концентрации циклоспорина, мидазолама, триазолама, индинавира и фенитоина, поскольку все эти препараты метаболизируются изоферментом IIIA4 цитохрома Р450. Кроме того, кетоконазол может усиливать антикоагулянтное действие варфарина.
Применение
Кетоконазол эффективен при североамериканском бластомикозе, гистоплазмозе, кокцидиоидозе, аллешери-озе, паракокцидиоидозе, дерматофитиях, отрубевидном лишае, хроническом генерализованном гранулематозном кандидозе, а также при кандидозном вульвовагините, стоматите и эзофагите. При ослабленном иммунитете и при менингите эффективность препарата невелика. Взрослым назначают 400 мг 1 раз в сутки, детям — 3,3—6,6 мг/кг/сут. Продолжительность лечения при кандидозном вульвовагините составляет 5 сут, при кандидозном эзофагите — 2 нед, при глубоких микозах — 6—12 мес. Кетоконазол начинает действовать не сразу, поэтому при тяжелых или быстропрогрессирующих инфекциях он не годится. I Если больной способен оплатить более дорогое лечение, во всех перечисленных случаях предпочтение отдается итраконазолу.
Побочные эффекты
Самые распространенные побочные эффекты — тошнота, рвота и снижение аппетита. Они зависят от дозы и при приеме 400 мг/сут наблюдаются примерно у 20% больных. При назначении кетоконазола с едой, на ночь или в несколько приемов переносимость препарата улучшается. Приблизительно у 4% больных возникает аллергическая сыпь, а у 2% — зуд без сыпи. Сообщалось также о выпадении волос.
Кетоконазол ингибирует изоферменты цитохрома Р450 не только у грибов, но и у человека. В результате подавляется сте-роидогенез, что может привести к гормональным расстройствам. Примерно у 10% женщин нарушается менструальный цикл, у некоторых мужчин развивается гинекомастия, снижаются половое влечение и потенция. В высоких дозах кетоконазол вызывает обратимую азооспермию. В обычных дозах (400 мг/сут) наблюдается преходящее снижение сывороточной концентрации свободного тестостерона и эстрадиола и снижение реакции на АКТГ. Этот побочный эффект используют в терапевтических целях. В дозе 800— 1200 мг/сут препарат назначают для подавления секреции кортизола при синдроме Кушинга. В тех же дозах кетоконазол пытались использовать при раке предстательной железы. Кроме того, кетоконазол применяют для подавления синтеза андрогенов при синдроме поликистозных яичников. Из других побочных эффектов встречаются артериальная гипертония и задержка жидкости, обусловленные повышением уровней 11-дезоксикортикостерона, кортикостерона и 11-дез-оксикортизола. Данные о первичной надпочечниковой недостаточности, вызванной кетоконазолом, неубедительны; тем не менее препарат целесообразно отменять перед большими операциями и не использовать его при серьезных травмах, ожогах и других тяжелых состояниях.
У 5—10% больных наблюдается незначительное бессимптомное повышение активности печеночных ферментов, которое проходит самостоятельно. Гепатит возникает редко, но представляет угрозу для жизни. Он может развиться как через несколько дней после начала лечения, так и спустя много месяцев. Первые симптомы — снижение аппетита, недомогание, тошнота и рвота, иногда — тупая боль в животе. Биохимическая картина обычно напоминает вирусный гепатит, иногда — холестаз; в некоторых случаях имеются признаки и того, и другого. Больных следует предупредить, что при появлении перечисленных симптомов необходимо определить активность печеночных ферментов. Кетоконазол не рекомендуется назначать беременным и кормящим, поскольку он оказывает тератогенное действие у животных (вызывает синдактилию у крыс) и проникает в молоко.
Итраконазол
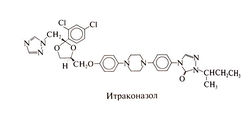
Этот синтетический триазол представляет собой рацемическую смесь четырех диастереомеров (двух пар оптических изомеров) в равном соотношении. В его молекуле имеется три хиральных центра. По химическому строению итраконазол близок к кетоконазолу. Структурная формула итраконазола следующая:
Фармакокинетика
Итраконазол выпускают в виде капсул, раствора для приема внутрь и раствора для в/в введения. В капсулах препарат лучше всасывается после еды, а в растворе для приема внутрь — натощак. В последнем случае максимальная сывороточная концентрация в 1,5 раза выше, чем при приеме капсул. Оба раствора, для приема внутрь и для в/в введения, содержат итраконазол и гидроксипропил-р-циклодекстрин в соотношении 40:1, так что на 200 мг препарата приходится 8 г наполнителя. Итраконазол метаболизируется влечение участием изофермента 1IIA4 цитохрома Р450 и, следовательно, подавляет метаболизм других препаратов, мета-болизируемыхэтим изоферментом. В крови в равных количествах с итраконазолом присутствует его активный метаболит — гидроксиитраконазол. Поэтому при определении биологическими методами сывороточная концентрация итраконазола может быть выше, чем по данным высокоэффективной жидкостной хроматографии. В зависимости от чувствительности эталонного штамма к гидроксиитраконазолу эта разница может достигать 3,3 раза. В некоторых лабораториях методом высокоэффективной жидкостной хроматографии определяют как итраконазол, так и гидроксиитраконазол, так что концентрации обоих противогрибковых веществ можно сложить. И сам итраконазол, и его активный метаболит связываются с белками плазмы соответственно на 99,8 и 99,5%. В мочу и в СМЖ оба вещества не поступают. итраконазола — 30—40 ч. Стационарной сывороточной концентрации итраконазол достигает более чем за 4 сут, а гидроксиитраконазол — более чем за 7 сут, поэтому при глубоких микозах рекомендуется назначать насыщающие дозы. При тяжелой печеночной недостаточности сывороточная концентрация итраконазола повышается; почечная недостаточность и гемодиализ не влияют на элиминацию препарата. Гидроксипропил-Р-циклодек-стрин, входящий в состав раствора для в/в введения, на 80—90% выводится с мочой. При почечной недостаточности это вещество накапливается, поэтому больным с СКФ менее 30 мл/мин в/в введение итраконазола противопоказано. Итраконазол не канцерогенен, но у крыс оказывает тератогенное действие, поэтому он относится к категории С по классификации ФДА и во время беременности противопоказан. Гидроксипропил-Р-цикло-декстрин вызывает рак поджелудочной железы у крыс, но не у мышей; клиническое значение этого факта не выяснено.
Лекарственные взаимодействия
В табл. перечислены препараты, с которыми взаимодействует итраконазол, причем этот список продолжает пополняться.
Таблица 49.2. Взаимодействие итраконазола с другими лекарственными средствами
- Препараты, концентрация которых при лечении итраконазолом увеличивается
- Алпразолам
- Алфентанил
- Астемизол
- Аторвастатин
- Бромперидол
- Буспирон
- Варфарин
- Верапамил
- Винбластин
- Винкристин
- Делавирдин
- Диазепам
- Дигидропиридиновые антагонисты кальция
- Дигоксин
- Доцетаксел
- Индинавир
- Ловастатин
- Лоратадин
- Мидазолам
- Нисолдипин
- Пимозид
- Производные сульфанилмочевины (глибенкламид и др.)
- Ритонавир
- Саквинавир
- Силденафил
- Симвастатин
- Сиролимус
- Такролимус
- Триазолам
- Фелодипин
- Фенитоин
- Хинидин
- Церивастатин
- Цизаприд
- Циклоспорин
- Препараты, уменьшающие концентрацию итраконазола
- Препараты, снижающие кислотность желудочного содержимого
- Антациды
- Диданозин (с щелочным буфером)
- Ингибиторы Н+,К+-АТФазы H2-блокаторы
- Изониазид
- Карбамазепин
- Невирапин
- Рифампицин, рифабутин
- Фенитоин
- Фенобарбитал
- Препараты, увеличивающие концентрацию итраконазола
- Индинавир
- Кларитромицин
- Ритонавир
В результате этих взаимодействий одни препараты могут вызывать тяжелые побочные эффекты (например, цизаприд, хинидин и астемизол — угрожающие жизни аритмии), а другие — снижать сывороточную концентрацию итраконазола ниже терапевтического уровня.
Применение
Итраконазол в капсулах — препарат выбора при непрогрессирующих инфекциях без вовлечения ЦНС, вызванных Blastomyces dermatitidis, Histoplasma capsulatum, Paracoccidioides brasiliensis и Coccidioides immitis. Кроме того, эту лекарственную форму используют при медленно прогрессирующем инвазивном аспергиллезе; препарат назначают сразу или после того, как состояние больного стабилизируется на фоне лечения амфотерицином В. Итраконазол в/в назначают при североамериканском бластомикозе, гистоплазмозе и медленно прогрессирующем аспергиллезе в первые 2 нед лечения. В/в введение предпочтительно при непереносимости лекарственных форм для приема внутрь или при нарушении их всасывания вследствие низкой кислотности желудочного содержимого. При дистально-латеральном подногтевом онихомикозе эффективность итраконазола составляет примерно 50% (Evans and Sigurgeirsson, 1999). Помимо официальных показаний итраконазол часто оказывается лучшим средством при аллешериозе (эта инфекция почти не поддается лечению амфотерицином В), а также при кожном и висцеральном споротрихозе, дерматофитии туловища и распространенном отрубевидном лишае. Поддерживающая терапия итраконазолом снижает частоту рецидивов диссеминированного гистоплазмоза и инфекции, вызванной Penicillium marneffei, у больных СПИДом (Wheat et al., 1993; Supparatpinyo et al., 1998). Пока не ясно, нужно ли продолжать прием итраконазола в тех случаях, когда под влиянием высокоактивной антиретровирусной терапии восстановилась функция иммунной системы (гл. 51). Профилактика рецидивов криптококкового менингита у больных СПИДом с помощью итраконазола неэффективна. Профилактический прием итраконазола на поздних стадиях ВИЧ-инфекции снижает заболеваемость криптококкозом и гистоплазмозом, но не влияет на частоту кандидоза слизистых (McKinsey etal., 1999). Однако эти данные получены до широкого внедрения высокоактивной антиретровирусной терапии; в настоящее время с целью первичной профилактики итраконазол не назначают. При аллергическом бронхолегочном аспергиллезе в отсутствие ВИЧ-инфекции длительный прием итраконазола позволяет снизить дозу глюко-кортикоидов и уменьшить частоту приступов бронхиальной астмы (Salez et al., 1999).
Раствор итраконазола для приема внутрь разрешено применять для лечения кандидозного стоматита и эзофагита. Этот препарат чаще, чем флуконазол в таблетках, вызывает желудочно-кишечные нарушения и потому обычно используется только при неэффективности флуконазола (Saag et al., 1999). К сожалению, такие больные часто получают ингибиторы протеазы ВИЧ и другие препараты, при лечении которыми итраконазол противопоказан. Биодоступность итраконазола в капсулах и в растворе для приема внутрь разная, что надо учитывать при замене одной лекарственной формы на другую.
Дозы
При глубоких микозах итраконазол назначают в дозе 200 мг (2 капсулы) внутрь 2 раза в сутки во время еды. Считается, что при дробном приеме ПФК (гл. 1) выше, чем при приеме 1 раз в сутки, хотя Титраконазола — около 30 ч. При угрожающих жизни инфекциях в первые 3 сут дают насыщающую дозу — 200 мг 3 раза в сутки, затем переходят на прием в поддерживающей дозе. При диссеминированном гистоплазмозе у больных СПИДом последняя составляет 200 мг 1 раз в сутки. При онихомикозах итраконазол принимают ежедневно в дозе 200 мг/сут в течение 12 нед либо в режиме пульс-терапии — 200 мг 2 раза в сутки в течение недели каждый месяц в течение 3 мес (Evans and Sigurgeirsson, 1999). Эффективность пульс-терапии обусловлена накоплением препарата в кератине ногтей. При инфекциях, плохо поддающихся лечению, некоторые авторы предпочитают постоянный прием итраконазола, однако стоимость такого лечения в 2 раза выше. Тербинафин в дозе 250 мг 1 раз в сутки в течение 3 мес (см. ниже) немного эффективнее пульс-терапии итраконазолом. Раствор итраконазола принимают натошак в дозе 100 мг (10 мл раствора) 1 раз в сутки; перед проглатыванием тщательно прополаскивают раствором рот, чтобы усилить местное действие препарата. При кандидозном стоматите и эзофагите, устойчивых к флуконазолу, раствор итраконазола назначают в дозе 100 мг внутрь 2 раза в сутки в течение 2—4 нед. В/в итраконазол вводят при тяжелых инфекциях; в первые 2 сут — 200 мг 2 раза в сутки, а в последующие 12 сут — 200 мг 1 раз в сутки. Продолжительность инфузии — 1 ч. Эффективность и безопасность более длительных курсов лечения итраконазолом в/в не изучена.
Побочные эффекты
Побочное действие итраконазола может быть обусловлено лекарственными взаимодействиями (см. ниже). В остальных случаях итраконазол в капсулах в дозе 200 мг/сут обычно переносится хорошо. При приеме в дозе 400 мг/сут иногда возникают желудочно-кишечные нарушения. По данным одного исследования, побочные эффекты наблюдались у 39% из 189 больных, получавших итраконазол в дозе от 50 до 400 мг/сут: тошнота и рвота — у 10%, гипертриглице-ридемия — у 9%, гипокалиемия —у 6%, повышение активности печеночных ферментов — у 5%, сыпь — у 2%. Большинство побочных эффектов уменьшается при снижении дозы; гепатоток-сическое действие и лекарственная сыпь иногда заставляют отменить препарат. У больных, получающих итраконазол в дозе 600 мг/сут и выше (Sharkey et al., 1991), а также у тех, кто недавно длительно лечился амфотерицином В, возникает выраженная гипокалиемия. В дозе 300 мг 2 раза в сутки итраконазол может вызвать надпочечниковую недостаточность, отеки ног, артериальную гипертонию и даже рабдомиолиз (Sharkey et al., 1991). Длительное лечение дозами, превышающими 400 мг/сут, не рекомендуется.
При в/в введении побочное действие ограничивается флебитом в месте введения. Итраконазол необходимо вводить через отдельный катетер. Если через катетер все же вводят другие лекарственные средства, его необходимо тщательно промывать физиологическим раствором. Несмотря на небольшой объем инфузии (25 мл раствора итраконазола и 50 мл физиологического раствора), ее длительность должна составлять не менее 1 ч. Так как безопасность гидроксипропил-р-циклодекстрина в высоких концентрациях не доказана, до выяснения этого вопроса больным с СКФ менее 30 мл/мин в/в введение итраконазола противопоказано.
Раствор для приема внутрь переносится достаточно хорошо, но вызывает те же побочные эффекты, что и итраконазол в капсулах. Изредка возникают анафилактический шок и другие тяжелые аллергические реакции, включая синдром Стивенса—Джонсона. Некоторым больным не нравится вкус раствора, у многих возникают желудочно-кишечные нарушения, но никто, как правило, не отказывается от приема препарата. Понос, схваткообразная боль в животе, снижение аппетита и тошнота возникают чаще, чем при приеме капсул.
Флуконазол
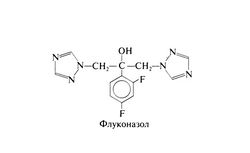
Флуконазол представляет собой фторированный бис-триазол со следующей структурой:
Фармакокинетика
Флуконазол практически полностью всасывается в ЖКТ. Сывороточные концентрации при приеме внутрь и в/в введении почти одинаковы; биодоступность не зависит от приема пищи и кислотности желудочного содержимого. Максимальная сывороточная концентрация при дозе 100 мг составляет 4—8 мкг/мл. Примерно на 11—12% флуконазол связывается с белками плазмы. С мочой выводится до 90% препарата; Т1/2 составляет 25—30 ч. Флуконазол быстро проникает в биологические жидкости, в том числе в мокроту и слюну. Концентрация препарата в СМЖ составляет 50—90% сывороточной. При СКФ от 21 до 40 мл/мин интервал между дозами увеличивают с 24 до 48 ч, а при СКФ от 10 до 20 мл/мин — до 72 ч. Больным, находящимся на гемодиализе, сразу после сеанса вводят 100—200 мг препарата.
Лекарственные взаимодействия
Флуконазол значительно увеличивает сывороточные концентрации астемизола, цизаприда циклоспорина, рифампицина, рифабутина, производных суль-фанилмочевины (глипизид, толбутамид и пр.), теофиллина,такролимуса и варфарина. При высокой сывороточной концентрации флуконазола (дозы более 400 мг/сут, почечная недостаточность) возможны другие лекарственные взаимодействия. Рифампицин уменьшает ПФК флуконазола на 25%, но клинического значения это обычно не имеет. Средства, снижающие кислотность желудочного содержимого, не влияют на всасывание флуконазола.
Применение
Кандидоз. При кандидозном стоматите в первые сутки назначают 200 мг, а затем — 100 мг/сут в течение 2 нед или дольше. При кандидозном эзофагите доза составляет 100-200 мг/сут. В той же дозе флуконазол эффективен при кандиду-рии у тяжелых больных (Sobel et al., 2000). При кандидозном вульвовагините достаточно однократного приема 150 мг препарата. В дозе 400 мг/сут флуконазол снижает риск глубокого канди-доза у больных, перенесших аллотрансплантацию костного мозга. В такой же дозе препарат назначают при фунгемии, вызванной Candida spp., у больных с нормальным иммунитетом. Эффективность флуконазола при глубоком кандидозе у больных с тяжелой нейтропенией не доказана. При инфекциях, вызванных Candida krusei, флуконазол вряд ли эффективен, так как in vitro этот гриб устойчив к флуконазолу и другим азолам. Криптококкоз. Флуконазол применяют у больных СПИДом при криптококковом менингите. Препарат назначают после стабилизации состояния на фоне в/в введения амфотерицина В. В первые 8 нед флуконазол дают в дозе 400 мг/сут, затем переходят на пожизненный прием в дозе 200 мг/сут. Остается неясным, следует ли продолжать прием флуконазола в тех случаях, когда под действием высокоактивной антиретровирусной терапии восстановилась функция иммунной системы. В отсутствие неблагоприятных прогностических признаков (нарушения сознания, ориентации и др.) лечение криптококкового менингита у больных СПИДом можно сразу начинать с флуконазола (400 мг/сут). Роль флуконазола в лечении криптококкозау больных без ВИЧ-инфекции не изучена.
Другие грибковые инфекции. Благодаря гораздо меньшей токсичности по сравнению с интратекальным введением амфотерицина В флуконазол стал препаратом выбора при кокцидиоидоз-ном менингите. При других формах кокцидиоидоза эффективность флуконазола примерно такая же, как и у итраконазола. Кроме того, флуконазол применяют при гистоплазмозе, североамериканском бластомикозе, споротрихозе и дерматофити-ях, хотя и с меньшим успехом, чем итраконазол в эквивалентных дозах. Для профилактики и лечения аспергиллеза флуконазол не годится. Кроме того, как и другие азолы, этот препарат бесполезен при мукорозе.
В США флуконазол выпускают в виде таблеток для приема внутрь по 50, 100 и 200 мг; порошка для приготовления суспензии для приема внутрь, содержащей 10 и 40 мг/мл флуконазола; растворов для в/в введения, содержащих помимо флуконазола (2 мг/мл) физиологический раствор или раствор глюкозы. Дозы составляют 50—400 мг 1 раз в сутки внутрь или в/в. Детям назначают 3—6 мг/кг 1 раз в сутки.
Побочные эффекты
При дозах выше 200 мг/сут возможны тошнота и рвота. Больным, получающим 800 мг/сут, могут понадобиться противорвотные средства. При неэффективности последних переходят на в/в введение, иначе снижается всасывание препарата. В инструкции изготовителя указано, что при приеме флуконазола дольше 7 сут, вне зависимости от дозы, возникают следующие побочные эффекты: тошнота — в 7,3% случаев, головная боль — в 1,9%, сыпь — в 1,8%, рвота — в 1,7 %, больвживоте —в 1,7%ипонос —в 1,5%.При длительном приеме в дозе 400 мг/сут иногда возникает обратимая алопеция. Сообщалось о редких смертельных исходах, обусловленных печеночной недостаточностью (Jacobson et al., 1994) и синдромом Стивенса—Джонсона. Хотя взаимосвязь между этими исходами и приемом флуконазола четко не установлена, следует бьггь внимательными и при появлении первых симптомов поражения печени или тяжелого поражения кожи отменять препарат. Флуконазол тератогенен у грызунов; имеются три сообщения о пороках сердца и пороках развития костей у детей, чьи матери во время беременности получали высокие дозы этого препарата (Pursley et al., 1996). Поэтому при беременности препарат не назначают.
Эхинокандины
Каспофунгин (МК-0991) представляет собой водорастворимое полусинтетическое липопептидное производное пневмокандина В0. Эхинокандины (известные также как пневмокандины) нарушают образование 1,3-р-D-глюкана в клеточной стенке грибов. Устойчивость к этим препаратам возникает в результате мутации гена FKS1, который кодирует большую субъединицу 1,3-Р-глюкансинтетазы. Штаммы Candida albicans, устойчивые к азолам, к каспофунгину чувствительны. В экспериментах на животных каспофунгин эффективен при инфекциях, вызванных Candida albicans, Aspergillus fumigatus, Pneumocystis carinii и Histoplasma capsulatum. В настоящее время проходят клинические испытания каспофунгина для в/в введения и близкого к нему липопептида микафунгина (FK463) при глубоком кандидозе, атакже у больных с нейтропенией и лихорадкой, не поддающимися лечению антибактериальными средствами.
Гризеофульвин
Химические свойства
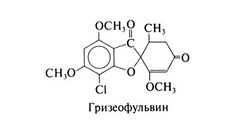
Структурная формула гризеофульвина следующая:
Препарат практически нерастворим в воде.
Противогрибковая активность
In vitro гризеофульвин действует фунгистатически на многие виды дерматофитов родов Microsporum, Epidermophyton и Trichophyton. На другие грибы и бактерии препарат не действует.
Устойчивость
При дерматофитиях гризеофульвин нередко бывает неэффективным, хотя in vitro возбудители, выделенные у таких больных, оказываются чувствительными к нему. Механизм действия. Гризеофульвин нарушает клеточное деление у грибов, что морфологически проявляется образованием многоядерных клеток. Более подробно действие препарата изучено на клетках млекопитающих. В высоких концентрациях он препятствует полимеризации микротрубочек, нарушая тем самым образование митотического веретена. Таким образом, по механизму действия гризеофульвин напоминает колхицин, винбластин и винкристин, но связывается с иными участками белков микротрубочек. По некоторым данным, гризеофульвин взаимодействует не только с тубулином, но и с белком, ассоциированным с микротрубочками.
Фармакокинетика
Сывороточная концентрация гризеофульвина подвержена значительным колебаниям. После приема препарата в дозе 0,5 г максимальная сывороточная концентрация составляет 1 мкг/мл и достигается через 4 ч. По некоторым данным, при приеме с жирной пищей всасывание гризеофульвина улучшается. Поскольку оно зависит от скорости растворения препарата, в настоящее время применяют в основном высокодисперсный и сверхвысокодисперсный гризеофульвин. Считается, что биодосгупносгь сверхвысокодисперсного гризеофульвина в полтора раза выше, чем высокодисперсного, но это не всегда так.
Т1/2 гризеофульвина в крови — около 24 ч; втечение 5 сут примерно половина дозы выводится с мочой, преимущественно в виде метаболитов. Основной метаболит — 6-метилгризеофульвин. Барбитураты снижают всасывание гризеофульвина в ЖКТ.
Гризеофульвин откладывается в молодых кератиноцитах. По мере их дифференцировки он прочно связывается с кератином, препятствуя грибковой инфекции. Таким образом, на вновь растущие волосы и ногти инфекция не распространяется. Выздоровление наступает по мере слущивания пораженных ороговевших кератиноцитов и замены их здоровыми. В роговом слое эпидермиса гризеофульвин определяется уже через 4—8 ч после приема внутрь. Важную роль в проникновении гризеофульвина в роговой слой играют потоотделение и транспорт воды через кожу. В другие ткани, а также в биологические жидкости попадает лишь очень незначительная часть препарата.
Применение
Гризеофульвин применяют при грибковых инфекциях кожи, волос и ногтей, вызванных Microsporum spp., Trichophyton spp. и Epidermophyton spp. Лучше всего лечению этим препаратом поддаются дерматофития волосистой части головы (Microsporum canis, Microsporum audouini, Trichophyton schoenleinii и Trichophyton verrucosum), дерматофития туловища, паховая дерматофития (Microsporum canis, Trichophyton rubrum, T richophyton verrucosum и Epidermophyton floccosum), дерматофития кистей (Trichophyton rubrum и Trichophyton mentag-rophytes) и дерматофития бороды и усов (Trichophyton spp.). Кроме того, гризеофульвин весьма эффективен при дермато-фитии стоп и онихомикозе стоп (дисгидротическая форма дерматофитии стоп обычно бывает вызвана Trichophyton mentagrophytes, а подошвенная — Trichophyton rubrum). При инфекциях, вызванных Trichophyton rubrum и Trichophyton mentag-rophytes, могут потребоваться более высокие дозы. В очень высоких дозах гризеофульвин тератогенен и канцерогенен у лабораторных животных, поэтому его не следует использовать при легких инфекциях, поддающихся местному лечению, таких, как дерматофития стоп (см. ниже).
Взрослым гризеофульвин назначают в дозе 500—1000 мг/сут, детям — 5—15 мг/кг/сут. При тяжелых инфекциях и распространенном поражении можно в течение короткого времени использовать более высокие дозы — 1,5—2 г/сут. Наиболее эффективен прием каждые 6 ч, но часто препарат назначают 2 раза в сутки. Лечение продолжают до полного замещения пораженных кожи, ногтей и волос здоровой тканью; при поражении волосистой части головы на это уходит 1 мес, при поражении ногтей на руках — 6—9 мес, при поражении ногтей на ногах — минимум 1 год. Онихомикозы предпочтительнее лечить итраконазолом или тербинафином. При поражении подкожной клетчатки и глубоких микозах гризеофульвин неэффективен. Побочные эффекты. Тяжелые осложнения возникают очень редко. Из незначительных побочных эффектов встречается головная боль, иногда достаточно сильная, но обычно проходящая без отмены лечения. Ее частота достигает 15%. Описаны и другие неврологические нарушения — нейропатии, сонливость, спутанность сознания, трудности при выполнении привычных действий, усталость, обмороки, головокружение, нечеткость зрения, преходящий отек желтого пятна, усиление действия алкоголя. Со стороны ЖКТ возможны тошнота, рвота, понос, изжога, метеоризм, сухость во рту и заеда. Отмечено гепатотоксическое действие. Из гематологических нарушений встречаются лейкопения, нейтропения, базофильная зернистость эритроцитов и моноцитоз. По крайней мере в течение первого месяца лечения необходимо не реже 1 раза в неделю делать общий анализ крови. Гематологические нарушения обычно исчезают без отмены препарата. Часто наблюдаются альбуминурия и цилин-друрия; почечная недостаточность не характерна. Возможно поражение кожи — холодовая и тепловая крапивница, фотосенсибилизация, гиперемия, сыпь, напоминающая красный плоский лишай и полиморфную экссудативную эритему, везикулярная и кореподобная сыпь. В редких случаях развивается сывороточная болезнь и тяжелый отек Квинке. У детей наблюдалось эстрогеноподобное действие. При длительном применении отмечено умеренное преходящее увеличение уровня протопорфиринов в кале.
Гризеофульвин индуцирует микросомальные ферменты печени, ускоряя метаболизм варфарина, поэтому дозу последнего иногда приходится увеличивать. По той же причине может снижаться эффективность некоторых пероральных контрацептивов.
Тербинафин
Тербинафин представляет собой синтетический аллиламин, имеющий структурное сходство с нафтифином — противогрибковым средством для местного применения. Структурная формула тербинафина следующая:
Тербинафин хорошо всасывается при приеме внутрь, но в значительной степени метаболизируется при первом прохождении через печень, поэтому его биодоступность составляет всего около 40%. Тербинафин на 99% связывается с белками плазмы. Препарат накапливается в коже, ногтях и жировой ткани. Начальный Т1/2 составляет 12 ч, но по достижении стационарного состояния увеличивается до 200—400 ч. После длительного лечения препарат определяется в крови еще в течение 4—8 нед (Balfour and Faulds, 1992). Тербинафин не рекомендуется при почечной и печеночной недостаточности, поскольку при этих состояниях его сывороточная концентрация может непредсказуемо увеличиваться. Рифампицин снижает сывороточную концентрацию тербинафина, а циметидин — повышает. В целом тербинафин переносится хорошо; иногда возникают желудочно-кишечные нарушения, головная боль и сыпь. Изредка поражается печень, развиваются тяжелая нейтропения, синдром Стивенса—Джонсона и синдром Лайелла. По классификации лекарственных средств, применяемых во время беременности (ФДА), тербинафин относится к категории В. Действие препарата, вероятно, обусловлено ингибированием грибковой скваленэпоксидазы — фермента, необходимого для синтеза эргостерина.
При онихомикозах прием тербинафина (250 мг I раз в сутки) по эффективности не уступает постоянному приему итраконазола (200 мг/сут) и слегка превосходит пульс-терапию итраконазолом —см. выше (Evans, 1999). Продолжительность лечения зависит от локализации поражения, но обычно составляет 3 мес. Кроме того, тербинафин в дозе 250 мг/сут эффективен при других дерматофитиях, хотя в официальные показания они не входят. Опыт применения препарата при дерматофитии волосистой части головы, которая часто встречается у детей, невелик, поскольку специальной лекарственной формы для них не сушествует. Местное применение тербинафина обсуждается в следующей части главы.
Йодид калия
Насыщенный раствор йодида калия (1 г/мл) применяют при кожном споротрихозе. Препарат принимают внутрь; он имеет горький вкус, вызывает тошноту, горькую отрыжку и слюнотечение. Переносимость улучшается, если начинать с небольших доз — 10 капель в небольшом количестве воды 3 раза в сутки. Чтобы уменьшить горький вкус, сразу после приема можно выпить воды или сока. Постепенно дозу увеличивают до 25—40 капель 3 раза в сутки у детей и 40—50 капель 3 раза в сутки у взрослых. Лечение продолжают до уплощения всех кожных очагов и заживления язв (минимальная длительность — 6 нед). Во время лечения часто наблюдается постепенное увеличение слюнных и слезных желез, а у взрослых S угреподобная сыпь на верхней части груди. Эти побочные эффекты не требуют отмены препарата и проходят после прекращения терапии. При аллергической сыпи переходят на итраконазол.
Прочие противогрибковые средства
Ундециленовая кислота. Это 10-ундеценовая кислота — ненасыщенная карбоновая кислота, содержащая 11 атомов углерода.
Она представляет собой желтую жидкость с характерным прогорклым запахом. Ундециленовая кислота оказывает преимущественно фунгистатическое действие, хотя при длительном применении в высоких концентрациях может давать фунгицидный эффект. Она активна в отношении многих грибов, в том числе дерматофитов. Ундециленовая кислота выпускается в виде пены, мази, крема, присыпки, аэрозоля, мыла и раствора. Унде-циленат цинка входит в состав комбинированных препаратов. Цинк оказывает вяжущее действие, ослабляя воспаление. В продаже имеется мазь, содержащая около 5% ундециленовой кислоты и около 20% ундецилената цинка. Ундециленат кальция выпускают в виде присыпки.
Ундециленовую кислоту применяют при разных грибковых инфекциях кожи, в первую очередь при дерматофитии стоп. В препаратах д ля нанесения на кожу обычно содержится до 10% ундециленовой кислоты и до 20% ундецилената цинка. Раздражение кожи и сенсибилизация не характерны. При дерматофитии стоп ундециленовая кислота препятствует росту возбудителя, однако даже активное лечение зачастую оказывается безуспешным. Клиническое излечение наблюдается в лучшем случае у 50% больных, то есть намного реже, чем при лечении имида-золами, галопрогином и толнафтатом. При дерматофитии волосистой части головы эффективность ундециленовой кислоты невелика, и с этой целью препарат уже не используют. Кроме того, ундециленовую кислоту разрешено применять при опрелостях, паховой дерматофитии и других незначительных поражениях кожи.
Бензойная и салициловая кислоты. Эти вещества входят в состав мази Уитфилда в соотношении 2:1 (как правило, 6 и 3% соответственно). Бензойная кислота оказывает фунгистатическое действие, а салициловая кислота — кератолитическое. Мазь Уитфилда применяют в основном при дерматофитии стоп. Поскольку бензойная кислота не уничтожает возбудителя, а лишь подавляет его рост, выздоровление наступает только после полного обновления пораженного рогового слоя, то есть через несколько недель или даже месяцев лечения. Салициловая кислота ускоряет слущивание эпителия. Иногда мазь Уитфилда используют и при дерматофитии волосистой части головы. В месте нанесения может возникать легкое раздражение.
Пропионовая и каприловая кислоты. Пропионовая кислота и пропионат натрия предназначены для лечения дерматофитий. Однако с учетом высокой стоимости и низкой эффективности этих препаратов их использование вряд ли можно считать целесообразным. Выпускают комбинированные препараты, содержащие помимо пропионовой кислоты и пропионата натрия ка-прилат натрия и другие лекарственные средства. Пропионат натрия обычно составляет 1—5%.